Caprelsa 100 Mg Comprimidos Recubiertos Con Pelicula
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Caprelsa 100 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 100 mg de vandetanib. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Comprimidos recubiertos con película redondos, biconvexos, blancos, impresos con “Z100” por un lado.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Caprelsa está indicado para el tratamiento del cáncer medular de tiroides (CMT) agresivo y sintomático en pacientes con enfermedad no resecable localmente avanzada o metastásica.
Para pacientes en los que la mutación del oncogén Reorganizado durante la Transfección (RET) no se conoce o es negativa, antes de la decisión individual de tratamiento se debe tener en cuenta un posible beneficio menor (ver información importante en secciones 4.4 y 5.1).
4.2 Posología y forma de administración
El tratamiento se debe iniciar y supervisar por un médico con experiencia en el tratamiento de CMT y en el empleo de medicamentos antineoplásicos, así como con experiencia en la evaluación del electrocardiograma (ECG).
Sólo se permite una entrega por prescripción. Se requiere una nueva prescripción para una entrega posterior.
Posología
La dosis recomendada es 300 mg una vez al día, tomada con o sin alimentos, aproximadamente a la misma hora cada día.
Si se olvida una dosis, se debe tomar tan pronto como el paciente se acuerde. Si hasta la siguiente dosis existe un periodo menor de 12 horas, el paciente no debe tomar la dosis olvidada. Los pacientes no deben tomar una dosis doble (dos dosis al mismo tiempo) para compensar una dosis olvidada.
Se debe entregar a los pacientes tratados con Caprelsa la tarjeta de información para el paciente y deben ser informados sobre los riesgos de este medicamento (ver también prospecto).
Duración
Vandetanib puede administrarse hasta que los pacientes con CMT no se beneficien más del tratamiento.
Ajustes de dosis
Se debe evaluar cuidadosamente el intervalo QTc antes del inicio del tratamiento. En el caso de criterios de terminología común para acontecimientos adversos (CTCAE) grado 3 o toxicidad mayor o prolongación del intervalo QTc del ECG, la dosis con vandetanib debe interrumpirse al menos temporalmente y reanudarse a una dosis reducida cuando la toxicidad se haya resuelto o haya mejorado a CTCAE grado 1 (ver sección 4.4). La dosis diaria de 300 mg puede reducirse a 200 mg (dos comprimidos de 100 mg), y después a 100 mg si fuese necesario. El paciente debe ser monitorizado apropiadamente. Debido a la semivida de 19 días, puede que las reacciones adversas incluyendo una prolongación del intervalo QTc no se resuelvan rápidamente (ver sección 4.4).
Poblaciones especiales de pacientes Población pediátrica
No se ha establecido la seguridad y eficacia en niños. Por lo tanto, vandetanib no está indicado para uso en pacientes pediátricos.
Pacientes de edad avanzada
No se requiere ajuste en la dosis inicial para pacientes de edad avanzada. Se dispone de datos clínicos limitados con vandetanib en pacientes mayores de 75 años con CMT.
Insuficiencia renal
Un estudio de farmacocinética en voluntarios con insuficiencia renal leve, moderada y grave muestra que la exposición a vandetanib tras una sola dosis se eleva hasta 1,5, 1,6 y 2 veces respectivamente en pacientes con insuficiencia renal leve, moderada (aclaramiento de creatinina > 30 a < 50 ml/min) y grave (aclaramiento por debajo de 30 ml/min) en el momento inicial (ver sección 5.2). Los datos clínicos sugieren que no se requiere un cambio en la dosis inicial en pacientes con insuficiencia renal leve. Los datos con 300 mg en pacientes con insuficiencia renal moderada son limitados: se necesita disminuir la dosis a 200 mg en 5 de cada 6 pacientes. La dosis inicial podría reducirse a 200 mg en pacientes con insuficiencia renal moderada; sin embargo no se ha establecido la seguridad y eficacia con esta dosis (ver sección 4.4). No se recomienda el uso de vandetanib en pacientes con insuficiencia renal grave, ya que los datos en estos pacientes son limitados, y no se ha establecido la seguridad y eficacia.
Insuficiencia hepática
Vandetanib no está recomendado para uso en pacientes con insuficiencia hepática (bilirrubina sérica mayor que 1,5 veces el límite superior normal), debido a que los datos en estos pacientes son limitados, y no se ha establecido la seguridad y eficacia (ver sección 4.4).
Los datos farmacocinéticos de voluntarios sugieren que no se requiere un cambio en la dosis inicial en pacientes con insuficiencia hepática leve, moderada o grave (ver sección 5.2).
Forma de administración
Para pacientes que presenten problemas para tragar, los comprimidos de vandetanib se pueden dispersar en medio vaso de agua no carbonatada. No deben usarse otros líquidos. Sin triturarlo, se echa el comprimido en el agua, se remueve hasta que se disperse (aproximadamente 10 minutos) y la dispersión resultante se bebe inmediatamente. Los restos que queden en el vaso se mezclan con medio vaso de agua, y se beben. El líquido también puede ser administrado a través de sonda nasogástrica o de gastrostomía.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Síndrome del QTc largo congénito.
• Pacientes con un intervalo QTc por encima de 480 ms.
• El uso concomitante de vandetanib con los siguientes medicamentos que se sabe que prolongan también el intervalo QTc y/o inducen “Torsades de pointes”: arsénico, cisaprida, eritromicina intravenosa (IV), toremifeno, mizolastina, moxifloxacino, antiarrítmicos Clase IA y III (ver sección 4.5).
• Lactancia (ver sección 4.6).
4.4 Advertencias y precauciones especiales de empleo
En vista de los riesgos asociados, es importante limitar el uso de vandetanib a pacientes que están en una necesidad real de tratamiento, es decir con un desarrollo sintomático-agresivo de la enfermedad. Tanto la enfermedad sintomática como la enfermedad progresiva sólo, no es suficiente para dar lugar a la necesidad de tratamiento con vandetanib. La tasa de cambio en niveles de biomarcadores tales como calcitonina (CTN) y/o antígeno carcinoembrionario (CEA), así como la tasa de cambio del volumen del tumor durante la espera en observación, podrían ayudar a identificar no sólo pacientes en necesidad de tratamiento sino también el momento óptimo para comenzar este tratamiento con vandetanib.
Prolongación del QTc y “Torsades de Pointes”
Vandetanib a una dosis de 300 mg está asociado a una prolongación en el QTc sustancial y dependiente de la concentración (media 28 ms, mediana 35 ms). Las primeras prolongaciones del QTc tuvieron lugar más frecuentemente en los 3 primeros meses de tratamiento, pero continuaron ocurriendo por primera vez tras este tiempo. La semivida de vandetanib (19 días) hace que esta prolongación en el intervalo QTc sea particularmente problemática (ver sección 4.8). A una dosis de 300 mg al día en el CMT, se observó una prolongación del QTc del ECG por encima de 500 ms en el 11% de los pacientes en un estudio fase III. La prolongación del QTc del ECG parece ser dosis dependiente. En pacientes a los que se ha administrado 300 mg diarios de vandetanib, se han comunicado con poca frecuencia “Torsades de pointes” y taquicardia ventricular. El riesgo de “Torsades” puede aumentar en pacientes con desequilibrio electrolítico (ver sección 4.8).
No se debe iniciar el tratamiento con vandetanib en pacientes cuyo intervalo QTc del ECG es mayor de 480 ms. No debe administrarse vandetanib a pacientes con historial de “Torsades de pointes” a menos que se hayan corregido todos los factores de riesgo que contribuyeron a este “Torsades”. No se ha estudiado vandetanib en pacientes con arritmias ventriculares o infarto de miocardio reciente.
Tras instaurar el tratamiento, se debe obtener un ECG, y los niveles séricos de potasio, calcio y magnesio y hormona estimulante del tiroides (TSH) al inicio, en las semanas 1, 3, 6 y 12 tras el inicio del tratamiento y después cada 3 meses durante un periodo de al menos un año. Este esquema debe aplicarse al periodo tras la reducción de la dosis debida a la prolongación del QTc y tras la interrupción de la dosis durante más de dos semanas. También deben obtenerse los ECGs y los análisis de sangre durante este periodo y posteriormente, según esté clínicamente indicado. Se debe continuar con la monitorización frecuente del intervalo QTc del ECG.
Se deben mantener el potasio sérico, el magnesio sérico y el calcio sérico dentro del rango normal para reducir el riesgo de prolongación del QTc del ECG. En el caso de diarrea, aumento de diarrea/deshidratación, desequilibrio electrolítico y/o función renal alterada, se requiere especialmente la monitorización adicional del QTc, electrolitos y función renal. Si el QTc aumenta notablemente pero permanece por debajo de 500 ms, se debe buscar asesoramiento del cardiólogo.
La administración de vandetanib con sustancias que se sabe que prolongan el intervalo QTc del ECG, está contraindicada o no se recomienda (ver secciones 4.3 y 4.5).
No se recomienda el uso concomitante de vandetanib con ondansetrón (ver sección 4.5).
Los pacientes que desarrollen un solo valor de un intervalo QTc de >500 ms deben interrumpir el tratamiento con vandetanib. Se puede reanudar la administración a una dosis reducida tras haber confirmado la recuperación del intervalo QTc del ECG al estado de pretratamiento y haber corregido el posible desequilibrio electrolítico._
Síndrome de encefalopatía posterior reversible, SEPR (Síndrome de leucoencefalopatía posterior reversible-SLPR)
SEPR es un síndrome de edema vasogénico subcortical diagnosticado mediante una RM cerebral, que se ha observado poco frecuentemente con el tratamiento de vandetanib en combinación con quimioterapia. También se ha observado SEPR en pacientes en tratamiento con vandetanib como monoterapia. Este síndrome debe tenerse en cuenta en cualquier paciente que presente ataques, cefalea, alteraciones visuales, confusión o función mental alterada. Se debe realizar una RM cerebral en cualquier paciente que presente ataques, confusión o estado mental alterado.
Estado del oncogén Reorganizado durante la Transfección (RET)
Los pacientes sin mutación del RET pueden obtener un beneficio menor del tratamiento con vandetanib y el balance beneficio/riesgo para este grupo de pacientes puede por lo tanto diferir de aquel del grupo con mutaciones del RET. Para pacientes cuyo estado mutacional del RET pudiera ser negativo, antes de decisiones individuales de tratamiento se debe tener en cuenta un posible beneficio menor y se debe considerar cuidadosamente el empleo de vandetanib debido a los riesgos relacionados con este tratamiento. Por ello, se recomienda la determinación de mutación del RET.
Al establecer el estado mutacional del RET, se debe obtener las muestras de tejido si es posible en el momento del inicio del tratamiento mejor que en el momento del diagnóstico (ver secciones 4.1
ym
Reacciones cutáneas
Se han observado rash y otras reacciones cutáneas incluyendo reacciones de fotosensibilidad y síndrome de eritrodisestesia palmo-plantar en pacientes que han recibido vandetanib. Las reacciones cutáneas leves a moderadas se pueden manejar con tratamiento sintomático, o mediante reducción o interrupción de la dosis. Para las reacciones cutáneas más graves (como el síndrome de Stevens-Johnson), se recomienda derivar al paciente a buscar asesoramiento médico urgente.
Se debe tener precaución con la exposición al sol empleando ropa protectora y/o pantalla solar debido al riesgo potencial de reacciones de fototoxicidad asociadas al tratamiento con vandetanib.
Diarrea
La diarrea es un síntoma relacionado con la enfermedad así como una reacción adversa conocida de vandetanib. Se recomiendan agentes antidiarreicos de rutina para su tratamiento. Se deben monitorizar más frecuentemente el QTc y los electrolitos séricos. Si se presenta diarrea grave (CTCAE grado 3-4), se debe interrumpir vandetanib hasta que la diarrea mejore. Tras la mejoría, se debe reanudar el tratamiento a una dosis reducida (ver secciones 4.2 y 4.8).
Hemorragia
Se debe tener precaución al administrar vandetanib a pacientes con metástasis cerebrales, ya que se ha notificado hemorragia intracraneal.
Insuficiencia cardiaca
Se ha observado insuficiencia cardiaca en pacientes tratados con vandetanib. Puede ser necesaria la interrupción temporal o permanente de la terapia en pacientes con insuficiencia cardiaca. Puede que no sea reversible tras la interrupción de vandetanib. Algunos casos han sido mortales.
Hipertensión
Se ha observado hipertensión, incluyendo crisis hipertensiva, en pacientes tratados con vandetanib. Se debe monitorizar la hipertensión de los pacientes y controlar apropiadamente. Si la presión arterial elevada no se puede controlar con tratamiento clínico, no se debe reanudar vandetanib hasta que dicha presión arterial esté controlada clínicamente. Puede ser necesaria una reducción de dosis (ver sección 4.8).
Pacientes con insuficiencia renal
No se recomienda el uso de vandetanib en pacientes con insuficiencia renal moderada o grave ya que los datos son limitados, y no se ha establecido la seguridad y eficacia (ver secciones 4.2, 5.1 y 5.2).
Pacientes con insuficiencia hepática
Vandetanib no está recomendado para uso en pacientes con insuficiencia hepática (bilirrubina sérica mayor que 1,5 veces el límite superior normal), debido a que los datos en estos pacientes son limitados, y no se ha establecido la seguridad y eficacia. Los datos farmacocinéticos de voluntarios sugieren que no se requiere un cambio en la dosis inicial en pacientes con insuficiencia hepática leve, moderada o grave (ver secciones 4.2 y 5.2).
Elevaciones de alanina aminotransferasa
Frecuentemente tienen lugar elevaciones de la alanina aminotransferasa en pacientes tratados con vandetanib. La mayoría de estos aumentos se resuelven mientras se continúa el tratamiento, otros se resuelven normalmente tras 1-2 semanas de interrupción de la terapia. Se recomienda la monitorización periódica de la alanina aminotransferasa.
Enfermedad pulmonar intersticial
Se ha observado Enfermedad Pulmonar Intersticial (EPI) en pacientes tratados con vandetanib y algunos casos han sido mortales. Si un paciente presenta síntomas respiratorios tales como disnea, tos y fiebre, se debe interrumpir vandetanib e iniciar una investigación inmediata. Si se confirma la EPI, vandetanib debe interrumpirse permanentemente y el paciente debe ser tratado de forma apropiada.
Inductores del CYP3A4
Se debe evitar el uso concomitante de vandetanib con inductores potentes del CYP3A4 (tales como rifampicina, Hierba de San Juan, carbamazepina, fenobarbital) (ver sección 4.5).
CTN menor que 500 pg/ml
No se ha determinado el beneficio de vandetanib en pacientes con CTN menor que 500 pg/ml, por lo que se debe considerar cuidadosamente su uso en dichos pacientes debido a los riesgos relacionados con el tratamiento con este fármaco.
Tarjeta de Información para el Paciente
Todos los prescriptores de Caprelsa deben estar familiarizados con la información del Médico y las Guías de Tratamiento. El prescriptor debe comentar con el paciente los riesgos de la terapia de Caprelsa. Se entregará al paciente la Tarjeta de Información para el Paciente con cada prescripción.
4.5 Interacción con otros medicamentos y otras formas de interacción
Interacciones farmacocinéticas
Efecto de vandetanib sobre otros medicamentos
En sujetos sanos, la exposición a midazolam (sustrato del CYP3A4) no se vio afectada cuando se administró junto con una dosis única de 800 mg de vandetanib.
Vandetanib es un inhibidor del transportador 2 de catión orgánico (OCT2). En sujetos sanos con OCT2 no mutado, el AUC(0-t) y la Cmax para metformina (sustrato del OCT2) aumentaron un 74% y 50% respectivamente y el CLR de metformina decreció un 52% cuando se administró junto con vandetanib. En los pacientes que reciben de manera concomitante metformina y vandetanib, se recomienda un seguimiento clínico y/o de laboratorio apropiado, ya que tales pacientes pueden requerir una dosis menor de metformina.
En sujetos sanos, el AUC(0-t) y la Cmax de digoxina (sustrato de la P-gp) aumentaron un 23% y 29% respectivamente, cuando se administraron conjuntamente, debido a la inhibición de la P-gp por vandetanib. Además, el efecto bradicárdico de digoxina puede aumentar el riesgo de prolongación del intervalo QTc y Torsade de Pointes de vandetanib. Por lo tanto, se recomienda un seguimiento clínico (ej: ECG) y/o de laboratorio apropiado en los pacientes que reciben de manera concomitante digoxina y vandetanib, tales pacientes pueden requerir una dosis menor de digoxina. (Para monitorización de vandetanib, ver sección 4.2 “Posología y forma de administración” y sección 4.4 “Advertencias y precauciones especiales de empleo”).
En cuanto a otros sustratos de la P-gp como dabigatran, se recomienda monitorización clínica cuando se administra en combinación con vandetanib.
Efecto de otros medicamentos sobre vandetanib
En sujetos sanos, no se ha mostrado una interacción clínicamente significativa entre vandetanib (una dosis única de 300 mg) y el potente inhibidor del CYP3A4, itraconazol (dosis repetidas de 200 mg una vez al día). En sujetos varones sanos la exposición a vandetanib se redujo en un 40% cuando se administró junto con el inductor potente del CYP3A4, rifampicina. La administración de vandetanib con inductores potentes del CYP3A4 se debe evitar.
En sujetos sanos, la Cmax para vandetanib disminuyó un 15% mientras el AUC(0-t) no se vio afectado cuando se administró con omeprazol. Ni la Cmax ni el AUC(0-t) para vandetanib se vieron afectados cuando se administró junto con ranitidina. Por lo tanto, no se requiere cambio en la dosis de vandetanib cuando se administra junto con omeprazol o ranitidina.
Interacciones farmacodinámicas
La excreción biliar de vandetanib inalterado es una de las vías de excreción para vandetanib. Vandetanib no es un sustrato de la proteína 2 multifármaco resistente (MRP2), la glicoproteína P (P-gp) o la proteína de resitencia al cancer de mama (BCRP).
Medicamentos que se conoce prolongan el intervalo QTc
Se ha mostrado que vandetanib prolonga el intervalo QTc del ECG; se han notificado “Torsades de pointes” poco frecuentemente. Por lo tanto, dependiendo de las terapias alternativas existentes, está contraindicado o no se recomienda el uso concomitante de vandetanib con medicamentos que se conoce prolongan también el intervalo QTc y/o inducen “Torsades de pointes”.
• Combinaciones contraindicadas (ver sección 4.3): cisaprida, eritromicina intravenosa (IV), toremifeno, mizolastina, moxifloxacino, arsénico, antiarrítmicos Clase IA y III.
• Combinaciones no recomendadas: metadona, haloperidol, amisulprida, clorpromazina, sulpirida, zuclopentixol, halofantrina, pentamidina y lumefantrina.
Si no existe una terapia alternativa apropiada, las combinaciones no recomendadas con vandetanib pueden realizarse con monitorización adicional del intervalo QTc del ECG, evaluación de electrolitos y un nuevo control al inicio o empeoramiento de la diarrea.
Los resultados de un estudio de interacción farmacodinámica y farmacocinética, indicaron que la co-administración con ondansetrón en pacientes sanos pareció tener poco efecto en la farmacocinética de vandetanib, pero tuvo un pequeño efecto aditivo de aproximadamente 10 ms en la prolongación del intervalo QTc. Por lo tanto, no se recomienda el uso concomitante de ondansetrón con vandetanib. Si se administra ondansetrón con vandetanib, se requiere una estrecha monitorización de los electrolitos séricos y los ECGs, y el manejo agresivo de cualquier anormalidad.
Antagonistas de la vitamina K
Debido al aumento del riesgo trombótico en pacientes con cáncer, es frecuente el uso de anticoagulación. Teniendo en cuenta la elevada variabilidad intra-individual de la respuesta a la anticoagulación, y la posibilidad de interacción entre los antagonistas de la vitamina K y la quimioterapia, se recomienda un aumento de la frecuencia de monitorización del INR (Ratio Internacional Normalizado), si se decide tratar al paciente con antagonistas de la vitamina K.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Las mujeres en edad fértil deben utilizar métodos anticonceptivos durante el tratamiento y al menos durante cuatro meses después de la última dosis.
Embarazo
Los datos sobre el uso de vandetanib durante el embarazo son limitados. Tal como se espera de sus acciones farmacológicas, vandetanib ha mostrado efectos significativos en todas las etapas de la reproducción de las hembras en ratas (ver sección 5.3).
Si se emplea vandetanib durante el embarazo o si la paciente se queda embarazada mientras recibe este fármaco, debe ser informada sobre la posibilidad de anormalidades fetales o pérdida del embarazo. Sólo se debe continuar el tratamiento en mujeres embarazadas si el beneficio potencial para la madre sobrepasa el riesgo para el feto.
Lactancia
No hay datos sobre el uso de vandetanib en mujeres en periodo de lactancia. Vandetanib y/o sus metabolitos se excretan en la leche de las ratas y se encontraron en el plasma de las crías tras su administración a las ratas en periodo de lactancia (ver sección 5.3).
La lactancia está contraindicada mientras se esté recibiendo terapia de vandetanib.
Fertilidad
En ratas, vandetanib no tuvo efecto sobre la fertilidad en machos pero alteró la fertilidad en hembras (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios que establezcan los efectos de vandetanib sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se han notificado fatiga y visión borrosa y aquellos pacientes que experimenten estos síntomas deben tener cuidado cuando conduzcan o utilicen máquinas.
4.8 Reacciones adversas
Resumen global de reacciones adversas al medicamento
Las reacciones adversas al medicamento notificadas más frecuentemente han sido diarrea, rash, náuseas, hipertensión y cefalea.
Reacciones adversas al medicamento durante los ensayos clínicos
En ensayos clínicos con pacientes que recibieron vandetanib como tratamiento para el CMT, se han identificado las siguientes reacciones adversas. Su frecuencia se presenta en la Tabla 1, reacciones adversas al medicamento empleando la “Council for International Organizations of Medical Sciences” (CIOMS III), enumeradas por el Sistema de Clasificación de Órganos (COS) MedDRA y en el nivel de término preferido, y luego por la clasificación de frecuencia. Las frecuencias de aparición de las reacciones adversas se definen como: muy frecuentes (> 1/10); frecuentes (> 1/100 a <1/10); poco frecuentes (> 1/1.000 a <1/100); raras (> 1/10.000 a <1/1.000); muy raras (< 1/10.000) y no conocidas (no puede estimarse a partir de los datos disponibles). Esta sección sólo incluye datos derivados de ensayos completados donde se conoce la exposición del paciente.
|
Tabla 1: Reacciones adversas al medicamento y sistema de clasificación de órganos | |||
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Trastornos de infecciones e infestaciones |
Nasofaringitis, bronquitis, infecciones del tracto respiratorio superior, infecciones del tracto urinario |
Neumonía, sepsis, gripe, cistitis, sinusitis, laringitis, foliculitis, forúnculo, infección fúngica, pielonefritis |
Apendicitis, infección estafilocócica, diverticulitis, celulitis, absceso de la pared abdominal |
|
Trastornos endocrinos |
Hipotiroidismo | ||
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetito, hipocalcemia |
Hipopotasemia, hipercalcemia, hiperglucemia, deshidratación, hiponatremia |
Malnutrición |
|
Trastornos psiquiátricos |
Insomnio, depresión |
Ansiedad | |
|
Trastornos del sistema nervioso |
Cefalea, parestesia, disestesia, mareo |
Temblor, letargia, pérdida de conciencia, desórdenes del equilibrio, disgeusia |
Convulsión, clonus, edema cerebral |
|
Trastornos oculares |
Visión borrosa, cambio estructural de la córnea (incluyendo depósitos corneales y opacidad corneal) |
Alteración visual, visión de halo, fotopsia, glaucoma, conjuntivitis, ojo seco, queratopatía |
Catarata, trastornos de la acomodación |
|
Trastornos cardiacos |
Prolongación del intervalo QTc del ECG (*) (**) |
Insuficiencia cardiaca, insuficiencia cardiaca aguda, trastornos de la frecuencia y ritmo, trastornos de la conducción cardiaca, arritmia ventricular y parada cardiaca | |
|
Trastornos vasculares |
Hipertensión |
Crisis hipertensiva, enfermedades cerebrovasculares isquémicas | |
|
Trastornos respiratorios, torácicos |
Epistaxis, hemoptisis, neumonitis |
Insuficiencia respiratoria, neumonía | |
|
y mediastínicos |
aspirativa | ||
|
Trastornos gastrointestinales |
Dolor abdominal, diarrea, náusea, vómitos, dispepsia |
Colitis, sequedad de boca, estomatitis, disfagia, estreñimiento, gastritis, hemorragia gastrointestinal |
Pancreatitis, peritonitis, íleo, perforación intestinal, incontinencia fecal |
|
Trastornos hepatobiliares |
Colelitiasis | ||
|
Trastornos de la piel y del tejido subcutáneo |
Reacciones de fotosensibilidad, rash y otras reacciones cutáneas (incluyendo acné, sequedad cutánea, dermatitis, prurito), trastornos en las uñas |
Síndrome de eritrodisestesia palmo-plantar, alopecia |
Dermatitis bullosa |
|
Trastornos renales y urinarios |
Proteinuria, nefrolitiasis |
Disuria, hematuria, insuficiencia renal, polaquiuria, urgencia miccional |
Cromaturia, anuria |
|
Trastornos generales y alteraciones en el lugar de administración |
Astenia, fatiga, dolor, edema |
Pirexia |
Problemas de cicatrización |
|
Exploraciones complementarias |
Prolongación del intervalo QTc del ECG |
Incremento de la ALT y AST séricas, disminución de peso, incremento de la creatinina en sangre |
Incremento de la hemoglobina, incremento de la amilasa sérica |
* 13,4% de los pacientes de vandetanib tuvieron QTc (de Bazett) > 500 ms comparado con 1,0% de los pacientes de placebo. La prolongación del QTcF fue > 20 ms en más del 91% de los pacientes, > 60 ms en el 35%, > 100 ms en el 1,7%. El ocho por ciento de los pacientes tuvieron una reducción de dosis debido a la prolongación del QTc.
** incluyendo dos muertes en pacientes con QTc > 550 ms (una debida a sepsis y una debida a insuficiencia cardiaca).
En pacientes tratados con vandetanib en monoterapia, han tenido lugar acontecimientos tales como “Torsades de pointes”, síndrome de Stevens-Johnson, eritema multiforme, enfermedad pulmonar intersticial (a veces mortal) y SEPR (SLPR). Es de esperar que éstas fueran reacciones adversas poco frecuentes en pacientes que reciben vandetanib para el CMT.
Acontecimientos oculares como visión borrosa, son frecuentes en pacientes que recibieron vandetanib para el CMT. Exámenes programados con lámpara de hendidura han puesto de manifiesto opacidades corneales (queratopatías en vórtex) en pacientes tratados; sin embargo, no se requieren exámenes de rutina con esta lámpara de hendidura en pacientes que reciben vandetanib.
A varias duraciones de exposición, la mediana de los niveles de hemoglobina en pacientes tratados con vandetanib aumentó en 0,5-1,5 g/dl comparado con el momento inicial.
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional de
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del notificación incluido en el Apéndice V.
4.9 Sobredosis
No hay tratamiento específico en el caso de una sobredosis con vandetanib y no se han establecido los posibles síntomas de sobredosis. En estudios con voluntarios sanos y en pacientes a dosis múltiples y por encima de 300 mg, se observó un aumento en la frecuencia y gravedad de algunas de las reacciones adversas, como rash, diarrea e hipertensión. Además, se debe tener en cuenta la posibilidad de prolongación del QTc y “Torsades de pointes”
Las reacciones adversas asociadas con la sobredosis deben ser tratadas sintomáticamente; en particular debe controlarse de forma adecuada la diarrea grave. En el caso de una sobredosis, se debe interrumpir la administración adicional de dosis, y se deben tomar medidas adecuadas para asegurar que no ha tenido lugar un acontecimiento adverso, por ejemplo un ECG en las 24 horas para determinar una prolongación del QTc. Las reacciones adversas asociadas con la sobredosis pueden prolongarse debido a la larga semivida de vandetanib (ver sección 5.2).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo Farmacoterapéutico: agente antineoplásico, inhibidor de la protein quinasa, código ATC: L01XE12 Mecanismo de acción y efectos farmacodinámicos
Vandetanib es un potente inhibidor de las tirosinas quinasas del receptor-2 del factor de crecimiento endotelial vascular (VEGFR-2, también conocido como receptor con dominio de inserción de quinasa [KDR]), del receptor del factor de crecimiento epidérmico (EGFR) y del RET. Vandetanib es también un inhibidor submicromolar de la tirosina quinasa del receptor-3 del endotelio vascular.
Vandetanib inhibe la migración, proliferación y supervivencia celular endotelial del VEGF estimulado y la formación de nuevos vasos sanguíneos en modelos in vitro de angiogénesis. Además, vandetanib inhibe la tirosina quinasa del receptor del factor de crecimiento epidérmico (EGFR) estimulado en células tumorales y células endoteliales. Vandetanib inhibe la proliferación celular EGFR dependiente y la supervivencia celular in vitro. Vandetanib también inhibe ambas formas activadas del RET, tipo salvaje y la mayoría de las mutadas, e inhibe significativamente la proliferación celular de las líneas celulares del CMT in vitro.
In vivo, la administración de vandetanib redujo la angiogénesis inducida por células tumorales, la permeabilidad de los vasos del tumor y la densidad de los microvasos del tumor, e inhibió el crecimiento tumoral de un rango de modelos de xenoinjertos tumorales humanos en ratones atímicos. Vandetanib también inhibió el crecimiento de xenoinjertos tumorales del CMT in vivo.
Se desconoce el mecanismo de acción preciso de vandetanib en el CMT localmente avanzado o metastásico.
Eficacia clínica y seguridad
Datos clínicos del CMT
Un estudio aleatorizado, doble ciego, controlado con placebo (Estudio 58) fue llevado a cabo para demostrar la seguridad y eficacia de vandetanib 300 mg versus placebo. Este estudio incluyó 331 pacientes con CMT no resecable localmente avanzado o metastásico. Sólo se incluyeron pacientes con CTN > 500 pg/ml (unidades convencionales) o > 146,3 pmol/l (unidades internacionales estándar). De los pacientes incluidos en el estudio, 10 pacientes con vandetanib y 4 con placebo (4% de todos los pacientes) tuvieron un resultado de estado funcional de la Organización Mundial de la Salud (WHO PS) de > 2, y 28 (12,1%) pacientes con vandetanib y 10 (10,1%) con placebo tuvieron alteración cardiaca. La alteración cardiaca se definió como pacientes con anormalidad cardiovascular previa.
El objetivo principal de este estudio fue demostrar una mejora en la supervivencia libre de progresión (SLP) con vandetanib comparado con placebo. Las variables secundarias fueron evaluación de la tasa de respuesta objetiva global (TRO), tasa de control de la enfermedad (TCE) definida como respuesta parcial (RP) o respuesta completa (RC) o enfermedad estable (EE) que dure al menos 24 semanas, duración del tiempo de respuesta (DTR), tiempo hasta el empeoramiento del dolor basado en la escala de peor dolor “Brief Pain Inventory (BPI)”, y supervivencia global (SG). La variable principal SLP, la TRO y la TCE se basaron en la revisión ciega independiente y centralizada de los datos de imagen. También se evaluó como variable secundaria la respuesta bioquímica con vandetanib comparada con placebo medida por CTN y CEA.
Los pacientes fueron tratados con vandetanib o placebo hasta la progresión objetiva de la enfermedad. En el momento de la progresión objetiva de la enfermedad basada en la evaluación del investigador, los pacientes interrumpieron el tratamiento ciego del estudio y tuvieron la opción de recibir vandetanib en abierto. Veintiocho de los 231 pacientes (12,1%) con vandetanib y 3 de los 99 (3,0%) con placebo interrumpieron el tratamiento debido a un acontecimiento adverso. Catorce de los 28 pacientes (50%) que interrumpieron vandetanib por un acontecimiento adverso lo hicieron sin reducción de dosis. Cinco de 6 pacientes (83%) con insuficiencia renal moderada que fueron tratados con vandetanib, tuvieron una reducción de dosis a 200 mg debido a reacción adversa; 1 paciente requirió una reducción adicional a 100 mg.
El resultado de un análisis primario de SLP mostró una mejora clínicamente significativa en dicha SLP para pacientes aleatorizados a vandetanib comparado con placebo (“Hazard Ratio” (HR)=0,46; Intervalo de Confianza (IC) al 95%=0,31-0,69; p=0,0001).
La mediana de la SLP para pacientes aleatorizados a vandetanib no se ha alcanzado; sin embargo, en base a modelos estadísticos de datos observados hasta el percentil 43°, se predice que la mediana de la SLP sea 30,5 meses con un intervalo de confianza al 95% de 25,5 a 36,5 meses. La mediana de la SLP para pacientes aleatorizados a placebo fue 19,3 meses. A los 12 meses, la proporción de pacientes vivos y libres de progresión fue 192 (83%) para pacientes aleatorizados a vandetanib y 63 (63%) para pacientes aleatorizados a placebo. En el brazo de vandetanib, progresaron un total de 73 (32%) pacientes; 64 (28%) por progresión según los criterios de evaluación de respuesta en tumores sólidos (RECIST) y 9 (4%) por muerte en ausencia de progresión. Los 158 pacientes restantes (68%) fueron censurados en el análisis de SLP. En el brazo de placebo, había progresado un total de 51 (51%) pacientes: 46 (46%) por progresión RECIST y 5 (5%) por fallecimiento en ausencia de progresión. Los 49 pacientes restantes (49%) fueron censurados en el análisis de la SLP.
Fig 1. Curva de Kaplan Meier de la SLP
|
meses |
0 |
6 |
12 |
18 |
24 |
30 |
36 |
|
n-vandetanib |
231 |
196 |
169 |
140 |
40 |
1 |
0 |
|
n-placebo |
100 |
71 |
57 |
45 |
13 |
0 |
0 |
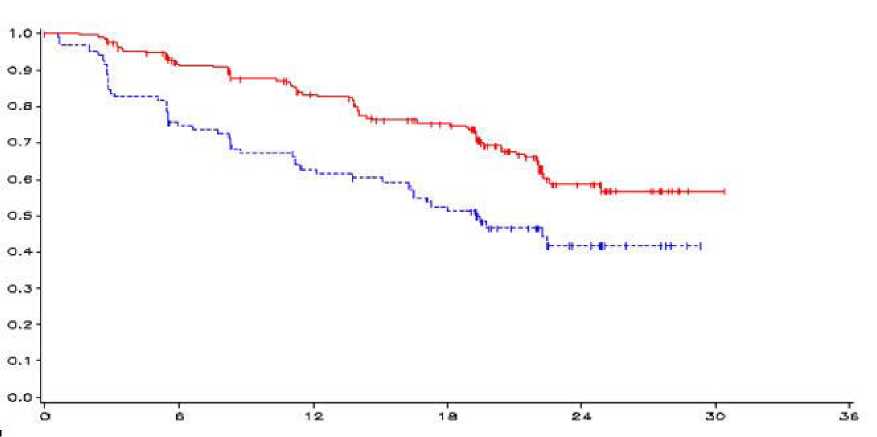
_vandetanib 300 mg,------placebo, eje-y=SLP, eje-x=tiempo en meses, n-vandetanib=número de pacientes a
riesgo-vandetanib, n-placebo=número de pacientes a riesgo-placebo
HR = 0,46, IC al 95% (0,31-0,69), p = 0,0001
|
SLP |
N |
Mediana SLP |
HR |
IC al 95% |
Valor de p |
|
Vandetanib 300 mg |
73/231 |
No alcanzada | |||
|
(32%) |
(prevista | ||||
|
30,5 meses) |
0,46 |
0,31, 0,69 |
0,0001 | ||
|
Placebo |
51/100 |
19,3 meses | |||
|
(51%) |
En el momento del análisis primario de SLP, 48 (15%) de los pacientes habían fallecido, y no había una diferencia significativa en la supervivencia global entre los grupos de tratamiento (HR = 0,89; IC al 99,98% 0,28-2,85; p = 0,712). En el momento de este análisis, 32 pacientes (14%) en el brazo de vandetanib y 16 pacientes (16%) en el brazo de placebo habían fallecido.
La mayoría (95% de los pacientes) tuvieron enfermedad metastásica. Catorce pacientes tratados con vandetanib, y 3 con placebo, tuvieron enfermedad no resecable localmente avanzada sólo. La experiencia clínica con vandetanib en pacientes con enfermedad no resecable localmente avanzada y sin metástasis es limitada.
Se observaron ventajas estadísticamente significativas para vandetanib en cuanto a las variables secundarias de tasa de respuesta, tasa de control de la enfermedad y respuesta bioquímica.
Tabla 2: Resumen de otros hallazgos de eficacia en el estudio 58_
TRGa N Tasa de ORb IC al 95% Valor de p
respuesta
|
Vandetanib 300 mg |
104/231 |
45% |
5,48 |
2,99, 10,79 |
<0,0001 |
|
Placebo |
13/100 |
13% | |||
|
TCEa |
N |
Tasa de respuesta |
ORb |
IC al 95% |
Valor de p |
|
Vandetanib 300 mg |
200/231 |
87% |
2,64 |
1,48, 4,69 |
0,001 |
|
Placebo |
71/100 |
71% | |||
|
Respuesta de CTN |
N |
Tasa de respuesta |
ORb |
IC al 95% |
Valor de p |
|
Vandetanib 300 mg |
160/231 |
69% |
72,9 |
26,2, 303,2 |
<0,0001 |
|
Placebo |
3/100 |
3% | |||
|
Respuesta de CEA |
N |
Tasa de respuesta |
ORb |
IC al 95% |
Valor de p |
|
Vandetanib 300 mg |
119/231 |
52% |
52,0 |
16,0, 320,3 |
<0,0001 |
|
Placebo |
2/100 |
2% |
a Tasa de respuesta global=respuestas parciales + completas. Tasa de control de la enfermedad=tasa de respuesta + enfermedad estable a 24 semanas. El análisis por intención de tratar (ITT) incluye pacientes que recibieron vandetanib en abierto antes de la progresión de acuerdo a la lectura central. b OR=“Odds Ratio”. Un valor > 1 favorece a vandetanib. El análisis se realizó empleando un modelo de regresión logística con el tratamiento como el único factor.
N=Número de acontecimientos/número de pacientes aleatorizados;
Se vio una ventaja estadísticamente significativa para vandetanib para la variable secundaria de tiempo hasta el empeoramiento del dolor (obtenido como una variable compuesta utilizando el valor de peor dolor de BPI y el uso de analgésicos opiáceos comunicado por el paciente) (vandetanib 49%, placebo 57%,
HR 0,61, IC al 97,5% 0,43-0,87, p<0,006: 8 vs. 3 meses). No hubo diferencias estadísticamente significativas para la variable exploratoria de diarrea (notificada como frecuencia de deposición).
Estado mutacional del RET en el Estudio 5 8
En el Estudio 58, se realizó la determinación de la mutación del RET mediante el uso de la reacción en cadena de la polimerasa (PCR) basada en el ensayo del Sistema de Amplificación Refractario a la Mutación (ARMS) para la mutación M918T, y la secuenciación directa del ADN para mutaciones en los exones 10, 11, 13, 14, 15 y 16 (lugar de la mutación M918T) en todos los pacientes esporádicos donde el ADN estaba disponible (297/298).
Sin embargo, el estado del RET no se pudo determinar en una gran proporción de pacientes (principalmente debido a la no disponibilidad de resultados para la secuenciación directa del ADN) y la tasa de respuesta fue de alguna manera menor en los pacientes con estado del RET desconocido comparado con el estado mutacional del RET positivo: 51,8% vs. 35,9% respectivamente. En la comparación ciega de vandetanib vs. placebo, sólo 2 pacientes que se conocía eran RET negativo en la totalidad de los 6 exones recibieron vandetanib y ninguno desmostró respuestas.
Se realizó un análisis de subgrupo post-hoc del estudio pivotal 58 del estado negativo del RET basado en la ausencia de mutación M918T. Se consideraba que un paciente tenía una mutación del RET si estaba presente en el tumor bien una mutación M918T mediante el ensayo ARMS, o bien una mutación del RET en cualquiera de los exones secuenciados. La realidad es que 79 pacientes fueron identificados por ausencia de una mutación M918T y no se identificó mutación del RET en ninguno de los otros 6 exones analizados, pero en 71 de dichos pacientes la secuenciación de los 6 exones fue incompleta. La mutación M918T es la mutación más frecuente observada en pacientes con CMT esporádico; sin embargo no se puede descartar que algunos pacientes con resultado RET negativo para mutación M918T puedan ser positivos para mutación de otros exones.
Los resultados de acuerdo al estado del RET (definición positiva, desconocida y mutación M918T negativa de RET) se presentan en la Tabla 3.
Tabla 3: Resumen de hallazgos de eficacia en un segmento de pacientes de acuerdo al estado mutacional del RET
|
Pacientes con |
Pacientes sin mutación | |
|
mutación RET |
M918T y otras | |
|
documentada |
mutaciones no | |
|
(n=187) |
analizadas o negativas (n=79)* | |
|
Tasa de respuesta objetiva (brazo de vandetanib) |
52% |
35% |
|
Variable de eficacia SLP HR intervalo de confianza (95%) |
0,45 (0,26, 0,78) |
0,57 (0,29, 1,13) |
*El estado mutacional del RET se obtuvo en el momento del diagnóstico en la mayoría de los pacientes y podría haber cambiado desde entonces.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con vandetanib en uno o más grupos de la población pediátrica en carcinoma medular de tiroides hereditario (ver sección 4.2 para consultar la información sobre uso en población pediátrica).
Este medicamento se ha autorizado con una “aprobación condicional”. Esta modalidad de aprobación significa que se espera obtener más información sobre este medicamento. La Agencia Europea de Medicamentos revisará la información nueva de este medicamento al menos una vez al año, y esta Ficha Técnica o Resumen de Características del Producto (RPC) se actualizará cuando sea necesario.
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración oral de vandetanib, la absorción es lenta y las concentraciones plasmáticas máximas se alcanzan generalmente a una mediana de 6 horas, un rango de 4-10 horas, después de dicha administración. Vandetanib se acumula aproximadamente 8 veces tras la administración múltiple, alcanzándose el estado estacionario a partir de aproximadamente 2 meses.
Distribución
Vandetanib se une a la albúmina sérica y a la glicoproteína ácida alfa-1 humanas, siendo la unión a proteínas in vitro aproximadamente 90%. En muestras de plasma ex vivo de pacientes con cáncer colorrectal, el porcentaje medio de unión a proteínas fue 93,7% (rango 92,2 a 95,7%) en el estado estacionario de exposición tras 300 mg una vez al día. La farmacocinética de vandetanib a la dosis de 300 mg en pacientes con CMT se caracteriza por un volumen de distribución de aproximadamente 7.450 l.
Biotransformación
Tras la administración oral de vandetanib-14C, se detectaron en plasma, orina y heces vandetanib inalterado y los metabolitos vandetanib-N-óxido y N-desmetil-vandetanib. Se observó un glucurónido conjugado como un metabolito menor sólo en excreta. N-desmetil-vandetanib se produce principalmente por el CYP3A4, y vandetanib-N-óxido por los enzimas monooxigenasas que contienen flavina (FMO1 y FMO3). N-desmetil-vandetanib y vandetanib-N-óxido circulan a concentraciones de aproximadamente 11% y 1,4% de las de vandetanib.
Eliminación
La farmacocinética de vandetanib a la dosis de 300 mg en pacientes con CMT se caracteriza por un aclaramiento de aproximadamente 13,2 l/h y una semivida plasmática de aproximadamente 19 días. En un periodo de recogida de 21 días tras una sola dosis de vandetanib-14C, se recuperó aproximadamente el 69% siendo el 44% en heces y el 25% en orina. La excreción de la dosis fue lenta y sería de esperar una excreción adicional más allá de los 21 días en base a la semivida plasmática.
Poblaciones especiales Insuficiencia renal
Un estudio de farmacocinética de dosis única en voluntarios indicó que la exposición a vandetanib está incrementada (hasta 1,5, 1,6 y 2 veces) en sujetos con insuficiencia renal leve, moderada y grave respectivamente en comparación a aquellos con una función renal normal (ver secciones 4.2, 4.4 y 4.5).
Insuficiencia hepática
Un estudio de farmacocinética de dosis única en voluntarios indicó que la insuficiencia hepática no afectó a la exposición a vandetanib. Se dispone de datos limitados en pacientes con insuficiencia hepática (bilirrubina sérica mayor que 1,5 veces el límite superior normal) (ver secciones 4.2 y 4.4).
Efecto de los alimentos
La exposición a vandetanib no está afectada por los alimentos.
5.3 Datos preclínicos sobre seguridad
Vandetanib no ha mostrado potencial mutagénico o clastogénico.
En estudios de toxicidad a dosis repetidas de hasta 9 meses de duración, los efectos incluyeron emesis, pérdida de peso corporal y diarrea en perros, y displasia fiseal en perros jóvenes y ratas con placas de crecimiento abiertas. En ratas, se observaron efectos en los dientes, riñón y piel. Estos hallazgos ocurrieron a concentraciones plasmáticas clínicamente relevantes, fueron ampliamente reversibles en 4 semanas tras la interrupción de la administración y se atribuyeron a la inhibición del receptor del factor de crecimiento endotelial vascular (VEGFR) o EGFR.
Los efectos observados en otros estudios incluyeron inhibición de la corriente del gen humano relacionado “ether-á-go-go” (hERG) y prolongación del intervalo QTc en perros. Se observó elevación de la presión arterial sistólica y diastólica en ratas y perros. En ratones, vandetanib demostró retrasar pero no impedir la cicatrización de heridas. Vandetanib mostró también evidencia de potencial fototóxico en un ensayo de citotoxicidad in vitro. En un modelo animal de cicatrización de heridas, los ratones a los que se administró vandetanib tuvieron una fuerza reducida a la rotura de piel en comparación con los controles. Esto sugiere que vandetanib enlentece pero no impide la cicatrización de heridas. No se ha determinado el intervalo apropiado entre la interrupción de vandetanib y la cirugía electiva posterior que se requiere para evitar los riesgos de alterar la cicatrización de heridas. En ensayos clínicos, un número pequeño de pacientes se sometió a cirugía mientras recibió vandetanib y no se comunicaron complicaciones de cicatrización de heridas.
Toxicología reproductiva
Vandetanib no tuvo efecto en la fertilidad de ratas macho. En un estudio de fertilidad en hembras, hubo una tendencia hacia el aumento de la irregularidad del ciclo estrogénico, una ligera reducción en la incidencia de embarazo y un aumento en la pérdida de la implantación. En un estudio de toxicidad a dosis repetidas en ratas, hubo un descenso en el número de cuerpos lúteos en los ovarios de ratas que recibieron vandetanib durante 1 mes.
En ratas, la toxicidad embriofetal se evidenció como pérdida fetal, retraso en el desarrollo fetal, anormalidades en los vasos del corazón y osificación precoz en algunos huesos del cráneo. En un estudio de desarrollo pre- y post-natal en ratas, a dosis que producen toxicidad materna durante la gestación y/o lactancia, vandetanib aumentó la pérdida pre-nacimiento y redujo el crecimiento post-natal de la cría. Vandetanib se excretó en la leche de las ratas y se encontró en el plasma de las crías tras su administración a ratas en periodo de lactancia.
Carcinogenicidad
No se han realizado estudios de carcinogenicidad con vandetanib.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido Hidrógeno fosfato de calcio dihidrato Celulosa microcristalina Crospovidona (tipo A)
Povidona (K 29-32)
Estearato de magnesio
Cubierta pelicular Hipromelosa Macrogol (300)
Dióxido de titanio (E171)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
4 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Blísters de PVC/PVDC/Alu, sellados con envoltorio de aluminio, que contienen 30 comprimidos recubiertos con película cada uno.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Genzyme Europe B.V., Gooimeer 10, NL-1411 DD, Naarden, Países Bajos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/749/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización 17/febrero/2012 Fecha de la última revalidación 15/enero/2015
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamento s http ://www.ema. europa.eu/.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Caprelsa 300 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 300 mg de vandetanib. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Comprimidos recubiertos con película ovalados, biconvexos, blancos, impresos con “Z300” por un lado.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Caprelsa está indicado para el tratamiento del cáncer medular de tiroides (CMT) agresivo y sintomático en pacientes con enfermedad no resecable localmente avanzada o metastásica.
Para pacientes en los que la mutación del oncogén Reorganizado durante la Transfección (RET) no se conoce o es negativa, antes de la decisión individual de tratamiento se debe tener en cuenta un posible beneficio menor (ver información importante en secciones 4.4 y 5.1).
4.2 Posología y forma de administración
El tratamiento se debe iniciar y supervisar por un médico con experiencia en el tratamiento de CMT y en el empleo de medicamentos antineoplásicos, así como con experiencia en la evaluación del electrocardiograma (ECG).
Sólo se permite una entrega por prescripción. Se requiere una nueva prescripción para una entrega posterior.
Posología
La dosis recomendada es 300 mg una vez al día, tomada con o sin alimentos, aproximadamente a la misma hora cada día.
Si se olvida una dosis, se debe tomar tan pronto como el paciente se acuerde. Si hasta la siguiente dosis existe un periodo menor de 12 horas, el paciente no debe tomar la dosis olvidada. Los pacientes no deben tomar una dosis doble (dos dosis al mismo tiempo) para compensar una dosis olvidada.
Se debe entregar a los pacientes tratados con Caprelsa la tarjeta de información para el paciente y deben ser informados sobre los riesgos de este medicamento (ver también prospecto).
Duración
Vandetanib puede administrarse hasta que los pacientes con CMT no se beneficien más del tratamiento.
Ajustes de dosis
Se debe evaluar cuidadosamente el intervalo QTc antes del inicio del tratamiento. En el caso de criterios de terminología común para acontecimientos adversos (CTCAE) grado 3 o toxicidad mayor o prolongación del intervalo QTc del ECG, la dosis con vandetanib debe interrumpirse al menos temporalmente y reanudarse a una dosis reducida cuando la toxicidad se haya resuelto o haya mejorado a CTCAE grado 1 (ver sección 4.4). La dosis diaria de 300 mg puede reducirse a 200 mg (dos comprimidos de 100 mg), y después a 100 mg si fuese necesario. El paciente debe ser monitorizado apropiadamente. Debido a la semivida de 19 días, puede que las reacciones adversas incluyendo una prolongación del intervalo QTc no se resuelvan rápidamente (ver sección 4.4).
Poblaciones especiales de pacientes Población pediátrica
No se ha establecido la seguridad y eficacia en niños. Por lo tanto, vandetanib no está indicado para uso en pacientes pediátricos.
Pacientes de edad avanzada
No se requiere ajuste en la dosis inicial para pacientes de edad avanzada. Se dispone de datos clínicos limitados con vandetanib en pacientes mayores de 75 años con CMT.
Insuficiencia renal
Un estudio de farmacocinética en voluntarios con insuficiencia renal leve, moderada y grave muestra que la exposición a vandetanib tras una sola dosis se eleva hasta 1,5, 1,6 y 2 veces respectivamente en pacientes con insuficiencia renal leve, moderada (aclaramiento de creatinina > 30 a < 50 ml/min) y grave (aclaramiento por debajo de 30 ml/min) en el momento inicial (ver sección 5.2). Los datos clínicos sugieren que no se requiere un cambio en la dosis inicial en pacientes con insuficiencia renal leve. Los datos con 300 mg en pacientes con insuficiencia renal moderada son limitados: se necesita disminuir la dosis a 200 mg en 5 de cada 6 pacientes. La dosis inicial podría reducirse a 200 mg en pacientes con insuficiencia renal moderada; sin embargo no se ha establecido la seguridad y eficacia con esta dosis (ver sección 4.4). No se recomienda el uso de vandetanib en pacientes con insuficiencia renal grave, ya que los datos en estos pacientes son limitados, y no se ha establecido la seguridad y eficacia.
Insuficiencia hepática
Vandetanib no está recomendado para uso en pacientes con insuficiencia hepática (bilirrubina sérica mayor que 1,5 veces el límite superior normal), debido a que los datos en estos pacientes son limitados, y no se ha establecido la seguridad y eficacia (ver sección 4.4).
Los datos farmacocinéticos de voluntarios sugieren que no se requiere un cambio en la dosis inicial en pacientes con insuficiencia hepática leve, moderada o grave (ver sección 5.2).
Forma de administración
Para pacientes que presenten problemas para tragar, los comprimidos de vandetanib se pueden dispersar en medio vaso de agua no carbonatada. No deben usarse otros líquidos. Sin triturarlo, se echa el comprimido en el agua, se remueve hasta que se disperse (aproximadamente 10 minutos) y la dispersión resultante se bebe inmediatamente. Los restos que queden en el vaso se mezclan con medio vaso de agua, y se beben. El líquido también puede ser administrado a través de sonda nasogástrica o de gastrostomía.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Síndrome del QTc largo congénito.
• Pacientes con un intervalo QTc por encima de 480 ms.
• El uso concomitante de vandetanib con los siguientes medicamentos que se sabe que prolongan también el intervalo QTc y/o inducen “Torsades de pointes”: arsénico, cisaprida, eritromicina intravenosa (IV), toremifeno, mizolastina, moxifloxacino, antiarrítmicos Clase IA y III (ver sección 4.5).
• Lactancia (ver sección 4.6).
4.4 Advertencias y precauciones especiales de empleo
En vista de los riesgos asociados, es importante limitar el uso de vandetanib a pacientes que están en una necesidad real de tratamiento, es decir con un desarrollo sintomático-agresivo de la enfermedad. Tanto la enfermedad sintomática como la enfermedad progresiva sólo, no es suficiente para dar lugar a la necesidad de tratamiento con vandetanib. La tasa de cambio en niveles de biomarcadores tales como calcitonina (CTN) y/o antígeno carcinoembrionario (CEA), así como la tasa de cambio del volumen del tumor durante la espera en observación, podrían ayudar a identificar no sólo pacientes en necesidad de tratamiento sino también el momento óptimo para comenzar este tratamiento con vandetanib.
Prolongación del QTc y “Torsades de Pointes”
Vandetanib a una dosis de 300 mg está asociado a una prolongación en el QTc sustancial y dependiente de la concentración (media 28 ms, mediana 35 ms). Las primeras prolongaciones del QTc tuvieron lugar más frecuentemente en los 3 primeros meses de tratamiento, pero continuaron ocurriendo por primera vez tras este tiempo. La semivida de vandetanib (19 días) hace que esta prolongación en el intervalo QTc sea particularmente problemática (ver sección 4.8). A una dosis de 300 mg al día en el CMT, se observó una prolongación del QTc del ECG por encima de 500 ms en el 11% de los pacientes en un estudio fase III. La prolongación del QTc del ECG parece ser dosis dependiente. En pacientes a los que se ha administrado 300 mg diarios de vandetanib, se han comunicado con poca frecuencia “Torsades de pointes” y taquicardia ventricular. El riesgo de “Torsades” puede aumentar en pacientes con desequilibrio electrolítico (ver sección 4.8).
No se debe iniciar el tratamiento con vandetanib en pacientes cuyo intervalo QTc del ECG es mayor de 480 ms. No debe administrarse vandetanib a pacientes con historial de “Torsades de pointes” a menos que se hayan corregido todos los factores de riesgo que contribuyeron a este “Torsades”. No se ha estudiado vandetanib en pacientes con arritmias ventriculares o infarto de miocardio reciente.
Tras instaurar el tratamiento, se debe obtener un ECG, y los niveles séricos de potasio, calcio y magnesio y hormona estimulante del tiroides (TSH) al inicio, en las semanas 1, 3, 6 y 12 tras el inicio del tratamiento y después cada 3 meses durante un periodo de al menos un año. Este esquema debe aplicarse al periodo tras la reducción de la dosis debida a la prolongación del QTc y tras la interrupción de la dosis durante más de dos semanas. También deben obtenerse los ECGs y los análisis de sangre durante este periodo y posteriormente, según esté clínicamente indicado. Se debe continuar con la monitorización frecuente del intervalo QTc del ECG.
Se deben mantener el potasio sérico, el magnesio sérico y el calcio sérico dentro del rango normal para reducir el riesgo de prolongación del QTc del ECG. En el caso de diarrea, aumento de diarrea/deshidratación, desequilibrio electrolítico y/o función renal alterada, se requiere especialmente la monitorización adicional del QTc, electrolitos y función renal. Si el QTc aumenta notablemente pero permanece por debajo de 500 ms, se debe buscar asesoramiento del cardiólogo.
La administración de vandetanib con sustancias que se sabe que prolongan el intervalo QTc del ECG, está contraindicada o no se recomienda (ver secciones 4.3 y 4.5).
No se recomienda el uso concomitante de vandetanib con ondansetrón (ver sección 4.5).
Los pacientes que desarrollen un solo valor de un intervalo QTc de >500 ms deben interrumpir el tratamiento con vandetanib. Se puede reanudar la administración a una dosis reducida tras haber confirmado la recuperación del intervalo QTc del ECG al estado de pretratamiento y haber corregido el posible desequilibrio electrolítico._
Síndrome de encefalopatía posterior reversible, SEPR (Síndrome de leucoencefalopatía posterior reversible-SLPR)
SEPR es un síndrome de edema vasogénico subcortical diagnosticado mediante una RM cerebral, que se ha observado poco frecuentemente con el tratamiento de vandetanib en combinación con quimioterapia. También se ha observado SEPR en pacientes en tratamiento con vandetanib como monoterapia. Este síndrome debe tenerse en cuenta en cualquier paciente que presente ataques, cefalea, alteraciones visuales, confusión o función mental alterada. Se debe realizar una RM cerebral en cualquier paciente que presente ataques, confusión o estado mental alterado.
Estado del oncogén Reorganizado durante la Transfección (RET)
Los pacientes sin mutación del RET pueden obtener un beneficio menor del tratamiento con vandetanib y el balance beneficio/riesgo para este grupo de pacientes puede por lo tanto diferir de aquel del grupo con mutaciones del RET. Para pacientes cuyo estado mutacional del RET pudiera ser negativo, antes de decisiones individuales de tratamiento se debe tener en cuenta un posible beneficio menor y se debe considerar cuidadosamente el empleo de vandetanib debido a los riesgos relacionados con este tratamiento. Por ello, se recomienda la determinación de mutación del RET.
Al establecer el estado mutacional del RET, se debe obtener las muestras de tejido si es posible en el momento del inicio del tratamiento mejor que en el momento del diagnóstico (ver secciones 4.1
ym
Reacciones cutáneas
Se han observado rash y otras reacciones cutáneas incluyendo reacciones de fotosensibilidad y síndrome de eritrodisestesia palmo-plantar en pacientes que han recibido vandetanib. Las reacciones cutáneas leves a moderadas se pueden manejar con tratamiento sintomático, o mediante reducción o interrupción de la dosis. Para las reacciones cutáneas más graves (como el síndrome de Stevens-Johnson), se recomienda derivar al paciente a buscar asesoramiento médico urgente.
Se debe tener precaución con la exposición al sol empleando ropa protectora y/o pantalla solar debido al riesgo potencial de reacciones de fototoxicidad asociadas al tratamiento con vandetanib.
Diarrea
La diarrea es un síntoma relacionado con la enfermedad así como una reacción adversa conocida de vandetanib. Se recomiendan agentes antidiarreicos de rutina para su tratamiento. Se deben monitorizar más frecuentemente el QTc y los electrolitos séricos. Si se presenta diarrea grave (CTCAE grado 3-4), se debe interrumpir vandetanib hasta que la diarrea mejore. Tras la mejoría, se debe reanudar el tratamiento a una dosis reducida (ver secciones 4.2 y 4.8).
Hemorragia
Se debe tener precaución al administrar vandetanib a pacientes con metástasis cerebrales, ya que se ha notificado hemorragia intracraneal.
Insuficiencia cardiaca
Se ha observado insuficiencia cardiaca en pacientes tratados con vandetanib. Puede ser necesaria la interrupción temporal o permanente de la terapia en pacientes con insuficiencia cardiaca. Puede que no sea reversible tras la interrupción de vandetanib. Algunos casos han sido mortales.
Hipertensión
Se ha observado hipertensión, incluyendo crisis hipertensiva, en pacientes tratados con vandetanib. Se debe monitorizar la hipertensión de los pacientes y controlar apropiadamente. Si la presión arterial elevada no se puede controlar con tratamiento clínico, no se debe reanudar vandetanib hasta que dicha presión arterial esté controlada clínicamente. Puede ser necesaria una reducción de dosis (ver sección 4.8).
Pacientes con insuficiencia renal
No se recomienda el uso de vandetanib en pacientes con insuficiencia renal moderada o grave ya que los datos son limitados, y no se ha establecido la seguridad y eficacia (ver secciones 4.2, 5.1 y 5.2).
Pacientes con insuficiencia hepática
Vandetanib no está recomendado para uso en pacientes con insuficiencia hepática (bilirrubina sérica mayor que 1,5 veces el límite superior normal), debido a que los datos en estos pacientes son limitados, y no se ha establecido la seguridad y eficacia. Los datos farmacocinéticos de voluntarios sugieren que no se requiere un cambio en la dosis inicial en pacientes con insuficiencia hepática leve, moderada o grave (ver secciones 4.2 y 5.2).
Elevaciones de alanina aminotransferasa
Frecuentemente tienen lugar elevaciones de la alanina aminotransferasa en pacientes tratados con vandetanib. La mayoría de estos aumentos se resuelven mientras se continúa el tratamiento, otros se resuelven normalmente tras 1-2 semanas de interrupción de la terapia. Se recomienda la monitorización periódica de la alanina aminotransferasa.
Enfermedad pulmonar intersticial
Se ha observado Enfermedad Pulmonar Intersticial (EPI) en pacientes tratados con vandetanib y algunos casos han sido mortales. Si un paciente presenta síntomas respiratorios tales como disnea, tos y fiebre, se debe interrumpir vandetanib e iniciar una investigación inmediata. Si se confirma la EPI, vandetanib debe interrumpirse permanentemente y el paciente debe ser tratado de forma apropiada.
Inductores del CYP3A4
Se debe evitar el uso concomitante de vandetanib con inductores potentes del CYP3A4 (tales como rifampicina, Hierba de San Juan, carbamazepina, fenobarbital) (ver sección 4.5).
CTN menor que 500 pg/ml
No se ha determinado el beneficio de vandetanib en pacientes con CTN menor que 500 pg/ml, por lo que se debe considerar cuidadosamente su uso en dichos pacientes debido a los riesgos relacionados con el tratamiento con este fármaco.
Tarjeta de Información para el Paciente
Todos los prescriptores de Caprelsa deben estar familiarizados con la información del Médico y las Guías de Tratamiento. El prescriptor debe comentar con el paciente los riesgos de la terapia de Caprelsa. Se entregará al paciente la Tarjeta de Información para el Paciente con cada prescripción.
4.5 Interacción con otros medicamentos y otras formas de interacción
Interacciones farmacocinéticas
Efecto de vandetanib sobre otros medicamentos
En sujetos sanos, la exposición a midazolam (sustrato del CYP3A4) no se vio afectada cuando se administró junto con una dosis única de 800 mg de vandetanib.
Vandetanib es un inhibidor del transportador 2 de catión orgánico (OCT2). En sujetos sanos con OCT2 no mutado, el AUC(0-t) y la Cmax para metformina (sustrato del OCT2) aumentaron un 74% y 50% respectivamente y el CLR de metformina decreció un 52% cuando se administró junto con vandetanib. En los pacientes que reciben de manera concomitante metformina y vandetanib, se recomienda un seguimiento clínico y/o de laboratorio apropiado, ya que tales pacientes pueden requerir una dosis menor de metformina.
En sujetos sanos, el AUC(0-t) y la Cmax de digoxina (sustrato de la P-gp) aumentaron un 23% y 29% respectivamente, cuando se administraron conjuntamente, debido a la inhibición de la P-gp por vandetanib. Además, el efecto bradicárdico de digoxina puede aumentar el riesgo de prolongación del intervalo QTc y Torsade de Pointes de vandetanib. Por lo tanto, se recomienda un seguimiento clínico (ej: ECG) y/o de laboratorio apropiado en los pacientes que reciben de manera concomitante digoxina y vandetanib, tales pacientes pueden requerir una dosis menor de digoxina. (Para monitorización de vandetanib, ver sección 4.2 “Posología y forma de administración” y sección 4.4 “Advertencias y precauciones especiales de empleo”).
En cuanto a otros sustratos de la P-gp como dabigatran, se recomienda monitorización clínica cuando se administra en combinación con vandetanib.
Efecto de otros medicamentos sobre vandetanib
En sujetos sanos, no se ha mostrado una interacción clínicamente significativa entre vandetanib (una dosis única de 300 mg) y el potente inhibidor del CYP3A4, itraconazol (dosis repetidas de 200 mg una vez al día). En sujetos varones sanos la exposición a vandetanib se redujo en un 40% cuando se administró junto con el inductor potente del CYP3A4, rifampicina. La administración de vandetanib con inductores potentes del CYP3A4 se debe evitar.
En sujetos sanos, la Cmax para vandetanib disminuyó un 15% mientras el AUC(0-t) no se vio afectado cuando se administró con omeprazol. Ni la Cmax ni el AUC(0-t) para vandetanib se vieron afectados cuando se administró junto con ranitidina. Por lo tanto, no se requiere cambio en la dosis de vandetanib cuando se administra junto con omeprazol o ranitidina.
Interacciones farmacodinámicas
La excreción biliar de vandetanib inalterado es una de las vías de excreción para vandetanib. Vandetanib no es un sustrato de la proteína 2 multifármaco resistente (MRP2), la glicoproteína P (P-gp) o la proteína de resitencia al cancer de mama (BCRP).
Medicamentos que se conoce prolongan el intervalo QTc
Se ha mostrado que vandetanib prolonga el intervalo QTc del ECG; se han notificado “Torsades de pointes” poco frecuentemente. Por lo tanto, dependiendo de las terapias alternativas existentes, está contraindicado o no se recomienda el uso concomitante de vandetanib con medicamentos que se conoce prolongan también el intervalo QTc y/o inducen “Torsades de pointes”.
• Combinaciones contraindicadas (ver sección 4.3): cisaprida, eritromicina intravenosa (IV), toremifeno, mizolastina, moxifloxacino, arsénico, antiarrítmicos Clase IA y III.
• Combinaciones no recomendadas: metadona, haloperidol, amisulprida, clorpromazina, sulpirida, zuclopentixol, halofantrina, pentamidina y lumefantrina.
Si no existe una terapia alternativa apropiada, las combinaciones no recomendadas con vandetanib pueden realizarse con monitorización adicional del intervalo QTc del ECG, evaluación de electrolitos y un nuevo control al inicio o empeoramiento de la diarrea.
Los resultados de un estudio de interacción farmacodinámica y farmacocinética, indicaron que la co-administración con ondansetrón en pacientes sanos pareció tener poco efecto en la farmacocinética de vandetanib, pero tuvo un pequeño efecto aditivo de aproximadamente 10 ms en la prolongación del intervalo QTc. Por lo tanto, no se recomienda el uso concomitante de ondansetrón con vandetanib. Si se administra ondansetrón con vandetanib, se requiere una estrecha monitorización de los electrolitos séricos y los ECGs, y el manejo agresivo de cualquier anormalidad.
Antagonistas de la vitamina K
Debido al aumento del riesgo trombótico en pacientes con cáncer, es frecuente el uso de anticoagulación. Teniendo en cuenta la elevada variabilidad intra-individual de la respuesta a la anticoagulación, y la posibilidad de interacción entre los antagonistas de la vitamina K y la quimioterapia, se recomienda un aumento de la frecuencia de monitorización del INR (Ratio Internacional Normalizado), si se decide tratar al paciente con antagonistas de la vitamina K.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Las mujeres en edad fértil deben utilizar métodos anticonceptivos durante el tratamiento y al menos durante cuatro meses después de la última dosis.
Embarazo
Los datos sobre el uso de vandetanib durante el embarazo son limitados. Tal como se espera de sus acciones farmacológicas, vandetanib ha mostrado efectos significativos en todas las etapas de la reproducción de las hembras en ratas (ver sección 5.3).
Si se emplea vandetanib durante el embarazo o si la paciente se queda embarazada mientras recibe este fármaco, debe ser informada sobre la posibilidad de anormalidades fetales o pérdida del embarazo. Sólo se debe continuar el tratamiento en mujeres embarazadas si el beneficio potencial para la madre sobrepasa el riesgo para el feto.
Lactancia
No hay datos sobre el uso de vandetanib en mujeres en periodo de lactancia. Vandetanib y/o sus metabolitos se excretan en la leche de las ratas y se encontraron en el plasma de las crías tras su administración a las ratas en periodo de lactancia (ver sección 5.3).
La lactancia está contraindicada mientras se esté recibiendo terapia de vandetanib.
Fertilidad
En ratas, vandetanib no tuvo efecto sobre la fertilidad en machos pero alteró la fertilidad en hembras (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios que establezcan los efectos de vandetanib sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se han notificado fatiga y visión borrosa y aquellos pacientes que experimenten estos síntomas deben tener cuidado cuando conduzcan o utilicen máquinas.
4.8 Reacciones adversas
Resumen global de reacciones adversas al medicamento
Las reacciones adversas al medicamento notificadas más frecuentemente han sido diarrea, rash, náuseas, hipertensión y cefalea.
Reacciones adversas al medicamento durante los ensayos clínicos
En ensayos clínicos con pacientes que recibieron vandetanib como tratamiento para el CMT, se han identificado las siguientes reacciones adversas. Su frecuencia se presenta en la Tabla 1, reacciones adversas al medicamento empleando la “Council for International Organizations of Medical Sciences” (CIOMS III), enumeradas por el Sistema de Clasificación de Órganos (COS) MedDRA y en el nivel de término preferido, y luego por la clasificación de frecuencia. Las frecuencias de aparición de las reacciones adversas se definen como: muy frecuentes (> 1/10); frecuentes (> 1/100 a <1/10); poco frecuentes (> 1/1.000 a <1/100); raras (> 1/10.000 a <1/1.000); muy raras (< 1/10.000) y no conocidas (no puede estimarse a partir de los datos disponibles). Esta sección sólo incluye datos derivados de ensayos completados donde se conoce la exposición del paciente.
|
Tabla 1: Reacciones adversas al medicamento y sistema de clasificación de órganos | |||
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Trastornos de infecciones e infestaciones |
Nasofaringitis, bronquitis, infecciones del tracto respiratorio superior, infecciones del tracto urinario |
Neumonía, sepsis, gripe, cistitis, sinusitis, laringitis, foliculitis, forúnculo, infección fúngica, pielonefritis |
Apendicitis, infección estafilocócica, diverticulitis, celulitis, absceso de la pared abdominal |
|
Trastornos endocrinos |
Hipotiroidismo | ||
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetito, hipocalcemia |
Hipopotasemia, hipercalcemia, hiperglucemia, deshidratación, hiponatremia |
Malnutrición |
|
Trastornos psiquiátricos |
Insomnio, depresión |
Ansiedad | |
|
Trastornos del sistema nervioso |
Cefalea, parestesia, disestesia, mareo |
Temblor, letargia, pérdida de conciencia, desórdenes del equilibrio, disgeusia |
Convulsión, clonus, edema cerebral |
|
Trastornos oculares |
Visión borrosa, cambio estructural de la córnea (incluyendo depósitos corneales y opacidad corneal) |
Alteración visual, visión de halo, fotopsia, glaucoma, conjuntivitis, ojo seco, queratopatía |
Catarata, trastornos de la acomodación |
|
Trastornos cardiacos |
Prolongación del intervalo QTc del ECG (*) (**) |
Insuficiencia cardiaca, insuficiencia cardiaca aguda, trastornos de la frecuencia y ritmo, trastornos de la conducción cardiaca, arritmia ventricular y parada cardiaca | |
|
Trastornos vasculares |
Hipertensión |
Crisis hipertensiva, enfermedades cerebrovasculares isquémicas | |
|
Trastornos respiratorios, torácicos |
Epistaxis, hemoptisis, neumonitis |
Insuficiencia respiratoria, neumonía | |
|
y mediastínicos |
aspirativa | ||
|
Trastornos gastrointestinales |
Dolor abdominal, diarrea, náusea, vómitos, dispepsia |
Colitis, sequedad de boca, estomatitis, disfagia, estreñimiento, gastritis, hemorragia gastrointestinal |
Pancreatitis, peritonitis, íleo, perforación intestinal, incontinencia fecal |
|
Trastornos hepatobiliares |
Colelitiasis | ||
|
Trastornos de la piel y del tejido subcutáneo |
Reacciones de fotosensibilidad, rash y otras reacciones cutáneas (incluyendo acné, sequedad cutánea, dermatitis, prurito), trastornos en las uñas |
Síndrome de eritrodisestesia palmo-plantar, alopecia |
Dermatitis bullosa |
|
Trastornos renales y urinarios |
Proteinuria, nefrolitiasis |
Disuria, hematuria, insuficiencia renal, polaquiuria, urgencia miccional |
Cromaturia, anuria |
|
Trastornos generales y alteraciones en el lugar de administración |
Astenia, fatiga, dolor, edema |
Pirexia |
Problemas de cicatrización |
|
Exploraciones complementarias |
Prolongación del intervalo QTc del ECG |
Incremento de la ALT y AST séricas, disminución de peso, incremento de la creatinina en sangre |
Incremento de la hemoglobina, incremento de la amilasa sérica |
* 13,4% de los pacientes de vandetanib tuvieron QTc (de Bazett) > 500 ms comparado con 1,0% de los pacientes de placebo. La prolongación del QTcF fue > 20 ms en más del 91% de los pacientes, > 60 ms en el 35%, > 100 ms en el 1,7%. El ocho por ciento de los pacientes tuvieron una reducción de dosis debido a la prolongación del QTc.
** incluyendo dos muertes en pacientes con QTc > 550 ms (una debida a sepsis y una debida a insuficiencia cardiaca).
En pacientes tratados con vandetanib en monoterapia, han tenido lugar acontecimientos tales como “Torsades de pointes”, síndrome de Stevens-Johnson, eritema multiforme, enfermedad pulmonar intersticial (a veces mortal) y SEPR (SLPR). Es de esperar que éstas fueran reacciones adversas poco frecuentes en pacientes que reciben vandetanib para el CMT.
Acontecimientos oculares como visión borrosa, son frecuentes en pacientes que recibieron vandetanib para el CMT. Exámenes programados con lámpara de hendidura han puesto de manifiesto opacidades corneales (queratopatías en vórtex) en pacientes tratados; sin embargo, no se requieren exámenes de rutina con esta lámpara de hendidura en pacientes que reciben vandetanib.
A varias duraciones de exposición, la mediana de los niveles de hemoglobina en pacientes tratados con vandetanib aumentó en 0,5-1,5 g/dl comparado con el momento inicial.
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional de
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del notificación incluido en el Apéndice V.
4.9 Sobredosis
No hay tratamiento específico en el caso de una sobredosis con vandetanib y no se han establecido los posibles síntomas de sobredosis. En estudios con voluntarios sanos y en pacientes a dosis múltiples y por encima de 300 mg, se observó un aumento en la frecuencia y gravedad de algunas de las reacciones adversas, como rash, diarrea e hipertensión. Además, se debe tener en cuenta la posibilidad de prolongación del QTc y “Torsades de pointes”
Las reacciones adversas asociadas con la sobredosis deben ser tratadas sintomáticamente; en particular debe controlarse de forma adecuada la diarrea grave. En el caso de una sobredosis, se debe interrumpir la administración adicional de dosis, y se deben tomar medidas adecuadas para asegurar que no ha tenido lugar un acontecimiento adverso, por ejemplo un ECG en las 24 horas para determinar una prolongación del QTc. Las reacciones adversas asociadas con la sobredosis pueden prolongarse debido a la larga semivida de vandetanib (ver sección 5.2).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo Farmacoterapéutico: agente antineoplásico, inhibidor de la protein quinasa, código ATC: L01XE12 Mecanismo de acción y efectos farmacodinámicos
Vandetanib es un potente inhibidor de las tirosinas quinasas del receptor-2 del factor de crecimiento endotelial vascular (VEGFR-2, también conocido como receptor con dominio de inserción de quinasa [KDR]), del receptor del factor de crecimiento epidérmico (EGFR) y del RET. Vandetanib es también un inhibidor submicromolar de la tirosina quinasa del receptor-3 del endotelio vascular.
Vandetanib inhibe la migración, proliferación y supervivencia celular endotelial del VEGF estimulado y la formación de nuevos vasos sanguíneos en modelos in vitro de angiogénesis. Además, vandetanib inhibe la tirosina quinasa del receptor del factor de crecimiento epidérmico (EGFR) estimulado en células tumorales y células endoteliales. Vandetanib inhibe la proliferación celular EGFR dependiente y la supervivencia celular in vitro. Vandetanib también inhibe ambas formas activadas del RET, tipo salvaje y la mayoría de las mutadas, e inhibe significativamente la proliferación celular de las líneas celulares del CMT in vitro.
In vivo, la administración de vandetanib redujo la angiogénesis inducida por células tumorales, la permeabilidad de los vasos del tumor y la densidad de los microvasos del tumor, e inhibió el crecimiento tumoral de un rango de modelos de xenoinjertos tumorales humanos en ratones atímicos. Vandetanib también inhibió el crecimiento de xenoinjertos tumorales del CMT in vivo.
Se desconoce el mecanismo de acción preciso de vandetanib en el CMT localmente avanzado o metastásico.
Eficacia clínica y seguridad
Datos clínicos del CMT
Un estudio aleatorizado, doble ciego, controlado con placebo (Estudio 58) fue llevado a cabo para demostrar la seguridad y eficacia de vandetanib 300 mg versus placebo. Este estudio incluyó 331 pacientes con CMT no resecable localmente avanzado o metastásico. Sólo se incluyeron pacientes con CTN > 500 pg/ml (unidades convencionales) o > 146,3 pmol/l (unidades internacionales estándar). De los pacientes incluidos en el estudio, 10 pacientes con vandetanib y 4 con placebo (4% de todos los pacientes) tuvieron un resultado de estado funcional de la Organización Mundial de la Salud (WHO PS) de > 2, y 28 (12,1%) pacientes con vandetanib y 10 (10,1%) con placebo tuvieron alteración cardiaca. La alteración cardiaca se definió como pacientes con anormalidad cardiovascular previa.
El objetivo principal de este estudio fue demostrar una mejora en la supervivencia libre de progresión (SLP) con vandetanib comparado con placebo. Las variables secundarias fueron evaluación de la tasa de respuesta objetiva global (TRO), tasa de control de la enfermedad (TCE) definida como respuesta parcial (RP) o respuesta completa (RC) o enfermedad estable (EE) que dure al menos 24 semanas, duración del tiempo de respuesta (DTR), tiempo hasta el empeoramiento del dolor basado en la escala de peor dolor “Brief Pain Inventory (BPI)”, y supervivencia global (SG). La variable principal SLP, la TRO y la TCE se basaron en la revisión ciega independiente y centralizada de los datos de imagen. También se evaluó como variable secundaria la respuesta bioquímica con vandetanib comparada con placebo medida por CTN y CEA.
Los pacientes fueron tratados con vandetanib o placebo hasta la progresión objetiva de la enfermedad. En el momento de la progresión objetiva de la enfermedad basada en la evaluación del investigador, los pacientes interrumpieron el tratamiento ciego del estudio y tuvieron la opción de recibir vandetanib en abierto. Veintiocho de los 231 pacientes (12,1%) con vandetanib y 3 de los 99 (3,0%) con placebo interrumpieron el tratamiento debido a un acontecimiento adverso. Catorce de los 28 pacientes (50%) que interrumpieron vandetanib por un acontecimiento adverso lo hicieron sin reducción de dosis. Cinco de 6 pacientes (83%) con insuficiencia renal moderada que fueron tratados con vandetanib, tuvieron una reducción de dosis a 200 mg debido a reacción adversa; 1 paciente requirió una reducción adicional a 100 mg.
El resultado de un análisis primario de SLP mostró una mejora clínicamente significativa en dicha SLP para pacientes aleatorizados a vandetanib comparado con placebo (“Hazard Ratio” (HR)=0,46; Intervalo de Confianza (IC) al 95%=0,31-0,69; p=0,0001).
La mediana de la SLP para pacientes aleatorizados a vandetanib no se ha alcanzado; sin embargo, en base a modelos estadísticos de datos observados hasta el percentil 43°, se predice que la mediana de la SLP sea
30,5 meses con un intervalo de confianza al 95% de 25,5 a 36,5 meses. La mediana de la SLP para pacientes aleatorizados a placebo fue 19,3 meses. A los 12 meses, la proporción de pacientes vivos y libres de progresión fue 192 (83%) para pacientes aleatorizados a vandetanib y 63 (63%) para pacientes aleatorizados a placebo. En el brazo de vandetanib, progresaron un total de 73 (32%) pacientes; 64 (28%) por progresión según los criterios de evaluación de respuesta en tumores sólidos (RECIST) y 9 (4%) por muerte en ausencia de progresión. Los 158 pacientes restantes (68%) fueron censurados en el análisis de SLP. En el brazo de placebo, había progresado un total de 51 (51%) pacientes: 46 (46%) por progresión RECIST y 5 (5%) por fallecimiento en ausencia de progresión. Los 49 pacientes restantes (49%) fueron censurados en el análisis de la SLP.
Fig 1. Curva de Kaplan Meier de la SLP
|
meses |
0 |
6 |
12 |
18 |
24 |
30 |
36 |
|
n-vandetanib |
231 |
196 |
169 |
140 |
40 |
1 |
0 |
|
n-placebo |
100 |
71 |
57 |
45 |
13 |
0 |
0 |
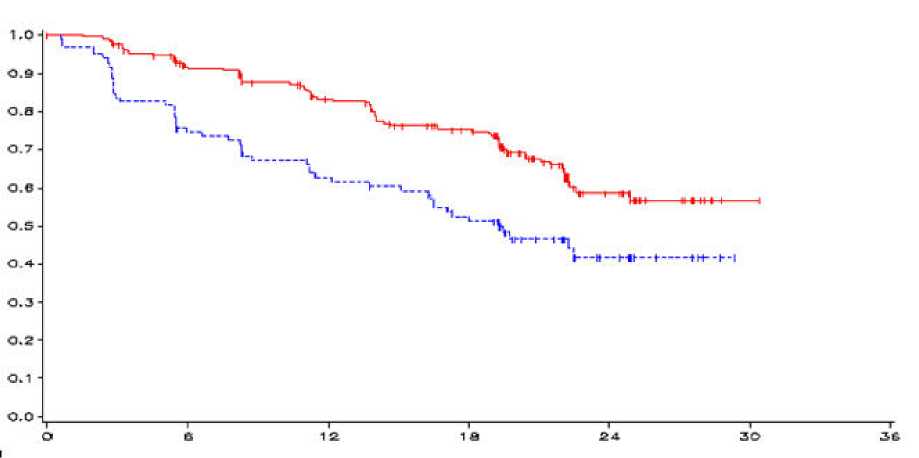
_vandetanib 300 mg,------placebo, eje-y=SLP, eje-x=tiempo en meses, n-vandetanib=número de pacientes a
riesgo-vandetanib, n-placebo=número de pacientes a riesgo-placebo
HR = 0,46, IC al 95% (0,31-0,69), p = 0,0001
|
SLP |
N |
Mediana SLP |
HR |
IC al 95% |
Valor de p |
|
Vandetanib 300 mg |
73/231 |
No alcanzada | |||
|
(32%) |
(prevista | ||||
|
30,5 meses) |
0,46 |
0,31, 0,69 |
0,0001 | ||
|
Placebo |
51/100 |
19,3 meses | |||
|
(51%) |
En el momento del análisis primario de SLP, 48 (15%) de los pacientes habían fallecido, y no había una diferencia significativa en la supervivencia global entre los grupos de tratamiento (HR = 0,89; IC al 99,98% 0,28-2,85; p = 0,712). En el momento de este análisis, 32 pacientes (14%) en el brazo de vandetanib y 16 pacientes (16%) en el brazo de placebo habían fallecido.
La mayoría (95% de los pacientes) tuvieron enfermedad metastásica. Catorce pacientes tratados con vandetanib, y 3 con placebo, tuvieron enfermedad no resecable localmente avanzada sólo. La experiencia clínica con vandetanib en pacientes con enfermedad no resecable localmente avanzada y sin metástasis es limitada.
Se observaron ventajas estadísticamente significativas para vandetanib en cuanto a las variables secundarias de tasa de respuesta, tasa de control de la enfermedad y respuesta bioquímica.
Tabla 2: Resumen de otros hallazgos de eficacia en el estudio 58_
TRGa N Tasa de ORb IC al 95% Valor de p
respuesta
Vandetanib 300 mg 104/231 45% 5,48 2,99, 10,79 <0,0001
|
Placebo |
13/100 |
13% | |||
|
TCEa |
N |
Tasa de respuesta |
ORb |
IC al 95% |
Valor de p |
|
Vandetanib 300 mg |
200/231 |
87% |
2,64 |
1,48, 4,69 |
0,001 |
|
Placebo |
71/100 |
71% | |||
|
Respuesta de CTN |
N |
Tasa de respuesta |
ORb |
IC al 95% |
Valor de p |
|
Vandetanib 300 mg |
160/231 |
69% |
72,9 |
26,2, 303,2 |
<0,0001 |
|
Placebo |
3/100 |
3% | |||
|
Respuesta de CEA |
N |
Tasa de respuesta |
ORb |
IC al 95% |
Valor de p |
|
Vandetanib 300 mg |
119/231 |
52% |
52,0 |
16,0, 320,3 |
<0,0001 |
|
Placebo |
2/100 |
2% |
a Tasa de respuesta global=respuestas parciales + completas. Tasa de control de la enfermedad=tasa de respuesta + enfermedad estable a 24 semanas. El análisis por intención de tratar (ITT) incluye pacientes que recibieron vandetanib en abierto antes de la progresión de acuerdo a la lectura central. b OR=“Odds Ratio”. Un valor > 1 favorece a vandetanib. El análisis se realizó empleando un modelo de regresión logística con el tratamiento como el único factor.
N=Número de acontecimientos/número de pacientes aleatorizados;
Se vio una ventaja estadísticamente significativa para vandetanib para la variable secundaria de tiempo hasta el empeoramiento del dolor (obtenido como una variable compuesta utilizando el valor de peor dolor de BPI y el uso de analgésicos opiáceos comunicado por el paciente) (vandetanib 49%, placebo 57%,
HR 0,61, IC al 97,5% 0,43-0,87, p<0,006: 8 vs. 3 meses). No hubo diferencias estadísticamente significativas para la variable exploratoria de diarrea (notificada como frecuencia de deposición).
Estado mutacional del RET en el Estudio 5 8
En el Estudio 58, se realizó la determinación de la mutación del RET mediante el uso de la reacción en cadena de la polimerasa (PCR) basada en el ensayo del Sistema de Amplificación Refractario a la Mutación (ARMS) para la mutación M918T, y la secuenciación directa del ADN para mutaciones en los exones 10, 11, 13, 14, 15 y 16 (lugar de la mutación M918T) en todos los pacientes esporádicos donde el ADN estaba disponible (297/298).
Sin embargo, el estado del RET no se pudo determinar en una gran proporción de pacientes (principalmente debido a la no disponibilidad de resultados para la secuenciación directa del ADN) y la tasa de respuesta fue de alguna manera menor en los pacientes con estado del RET desconocido comparado con el estado mutacional del RET positivo: 51,8% vs. 35,9% respectivamente. En la comparación ciega de vandetanib vs. placebo, sólo 2 pacientes que se conocía eran RET negativo en la totalidad de los 6 exones recibieron vandetanib y ninguno desmostró respuestas.
Se realizó un análisis de subgrupo post-hoc del estudio pivotal 58 del estado negativo del RET basado en la ausencia de mutación M918T. Se consideraba que un paciente tenía una mutación del RET si estaba presente en el tumor bien una mutación M918T mediante el ensayo ARMS, o bien una mutación del RET en cualquiera de los exones secuenciados. La realidad es que 79 pacientes fueron identificados por ausencia de una mutación M918T y no se identificó mutación del RET en ninguno de los otros 6 exones analizados, pero en 71 de dichos pacientes la secuenciación de los 6 exones fue incompleta. La mutación M918T es la mutación más frecuente observada en pacientes con CMT esporádico; sin embargo no se
puede descartar que algunos pacientes con resultado RET negativo para mutación M918T puedan ser positivos para mutación de otros exones.
Los resultados de acuerdo al estado del RET (definición positiva, desconocida y mutación M918T negativa de RET) se presentan en la Tabla 3.
Tabla 3: Resumen de hallazgos de eficacia en un segmento de pacientes de acuerdo al estado mutacional del RET
|
Pacientes con |
Pacientes sin mutación | |
|
mutación RET |
M918T y otras | |
|
documentada |
mutaciones no | |
|
(n=187) |
analizadas o negativas (n=79)* | |
|
Tasa de respuesta objetiva (brazo de vandetanib) |
52% |
35% |
|
Variable de eficacia SLP HR intervalo de confianza (95%) |
0,45 (0,26, 0,78) |
0,57 (0,29, 1,13) |
*El estado mutacional del RET se obtuvo en el momento del diagnóstico en la mayoría de los pacientes y podría haber cambiado desde entonces.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con vandetanib en uno o más grupos de la población pediátrica en carcinoma medular de tiroides hereditario (ver sección 4.2 para consultar la información sobre uso en población pediátrica).
Este medicamento se ha autorizado con una “aprobación condicional”. Esta modalidad de aprobación significa que se espera obtener más información sobre este medicamento. La Agencia Europea de Medicamentos revisará la información nueva de este medicamento al menos una vez al año, y esta Ficha Técnica o Resumen de Características del Producto (RPC) se actualizará cuando sea necesario.
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración oral de vandetanib, la absorción es lenta y las concentraciones plasmáticas máximas se alcanzan generalmente a una mediana de 6 horas, un rango de 4-10 horas, después de dicha administración. Vandetanib se acumula aproximadamente 8 veces tras la administración múltiple, alcanzándose el estado estacionario a partir de aproximadamente 2 meses.
Distribución
Vandetanib se une a la albúmina sérica y a la glicoproteína ácida alfa-1 humanas, siendo la unión a proteínas in vitro aproximadamente 90%. En muestras de plasma ex vivo de pacientes con cáncer colorrectal, el porcentaje medio de unión a proteínas fue 93,7% (rango 92,2 a 95,7%) en el estado estacionario de exposición tras 300 mg una vez al día. La farmacocinética de vandetanib a la dosis de 300 mg en pacientes con CMT se caracteriza por un volumen de distribución de aproximadamente 7.450 l.
Biotransformación
Tras la administración oral de vandetanib-14C, se detectaron en plasma, orina y heces vandetanib inalterado y los metabolitos vandetanib-N-óxido y N-desmetil-vandetanib. Se observó un glucurónido
conjugado como un metabolito menor sólo en excreta. N-desmetil-vandetanib se produce principalmente por el CYP3A4, y vandetanib-N-óxido por los enzimas monooxigenasas que contienen flavina (FMO1 y FMO3). N-desmetil-vandetanib y vandetanib-N-óxido circulan a concentraciones de aproximadamente 11% y 1,4% de las de vandetanib.
Eliminación
La farmacocinética de vandetanib a la dosis de 300 mg en pacientes con CMT se caracteriza por un aclaramiento de aproximadamente 13,2 l/h y una semivida plasmática de aproximadamente 19 días. En un periodo de recogida de 21 días tras una sola dosis de vandetanib-14C, se recuperó aproximadamente el 69% siendo el 44% en heces y el 25% en orina. La excreción de la dosis fue lenta y sería de esperar una excreción adicional más allá de los 21 días en base a la semivida plasmática.
Poblaciones especiales Insuficiencia renal
Un estudio de farmacocinética de dosis única en voluntarios indicó que la exposición a vandetanib está incrementada (hasta 1,5, 1,6 y 2 veces) en sujetos con insuficiencia renal leve, moderada y grave respectivamente en comparación a aquellos con una función renal normal (ver secciones 4.2, 4.4 y 4.5).
Insuficiencia hepática
Un estudio de farmacocinética de dosis única en voluntarios indicó que la insuficiencia hepática no afectó a la exposición a vandetanib. Se dispone de datos limitados en pacientes con insuficiencia hepática (bilirrubina sérica mayor que 1,5 veces el límite superior normal) (ver secciones 4.2 y 4.4).
Efecto de los alimentos
La exposición a vandetanib no está afectada por los alimentos.
5.3 Datos preclínicos sobre seguridad
Vandetanib no ha mostrado potencial mutagénico o clastogénico.
En estudios de toxicidad a dosis repetidas de hasta 9 meses de duración, los efectos incluyeron emesis, pérdida de peso corporal y diarrea en perros, y displasia fiseal en perros jóvenes y ratas con placas de crecimiento abiertas. En ratas, se observaron efectos en los dientes, riñón y piel. Estos hallazgos ocurrieron a concentraciones plasmáticas clínicamente relevantes, fueron ampliamente reversibles en 4 semanas tras la interrupción de la administración y se atribuyeron a la inhibición del receptor del factor de crecimiento endotelial vascular (VEGFR) o EGFR.
Los efectos observados en otros estudios incluyeron inhibición de la corriente del gen humano relacionado “ether-á-go-go” (hERG) y prolongación del intervalo QTc en perros. Se observó elevación de la presión arterial sistólica y diastólica en ratas y perros. En ratones, vandetanib demostró retrasar pero no impedir la cicatrización de heridas. Vandetanib mostró también evidencia de potencial fototóxico en un ensayo de citotoxicidad in vitro. En un modelo animal de cicatrización de heridas, los ratones a los que se administró vandetanib tuvieron una fuerza reducida a la rotura de piel en comparación con los controles. Esto sugiere que vandetanib enlentece pero no impide la cicatrización de heridas. No se ha determinado el intervalo apropiado entre la interrupción de vandetanib y la cirugía electiva posterior que se requiere para evitar los riesgos de alterar la cicatrización de heridas. En ensayos clínicos, un número pequeño de pacientes se sometió a cirugía mientras recibió vandetanib y no se comunicaron complicaciones de cicatrización de heridas.
Toxicología reproductiva
Vandetanib no tuvo efecto en la fertilidad de ratas macho. En un estudio de fertilidad en hembras, hubo una tendencia hacia el aumento de la irregularidad del ciclo estrogénico, una ligera reducción en la incidencia de embarazo y un aumento en la pérdida de la implantación. En un estudio de toxicidad a dosis repetidas en ratas, hubo un descenso en el número de cuerpos lúteos en los ovarios de ratas que recibieron vandetanib durante 1 mes.
En ratas, la toxicidad embriofetal se evidenció como pérdida fetal, retraso en el desarrollo fetal, anormalidades en los vasos del corazón y osificación precoz en algunos huesos del cráneo. En un estudio de desarrollo pre- y post-natal en ratas, a dosis que producen toxicidad materna durante la gestación y/o lactancia, vandetanib aumentó la pérdida pre-nacimiento y redujo el crecimiento post-natal de la cría. Vandetanib se excretó en la leche de las ratas y se encontró en el plasma de las crías tras su administración a ratas en periodo de lactancia.
Carcinogenicidad
No se han realizado estudios de carcinogenicidad con vandetanib.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido Hidrógeno fosfato de calcio dihidrato Celulosa microcristalina Crospovidona (tipo A)
Povidona (K 29-32)
Estearato de magnesio
Cubierta pelicular Hipromelosa Macrogol (300)
Dióxido de titanio (E171)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
4 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Blísters de PVC/PVDC/Alu, sellados con envoltorio de aluminio, que contienen 30 comprimidos recubiertos con película cada uno.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Genzyme Europe B.V., Gooimeer 10, NL-1411 DD, Naarden, Países Bajos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/749/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización 17/febrero/2012 Fecha de la última revalidación 15/enero/2015
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamento s http ://www.ema. europa.eu/.
ANEXO II
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
E. OBLIGACIÓN ESPECÍFICA DE LLEVAR A CABO MEDIDAS POST-AUTORIZACIÓN EN RELACIÓN CON UNA AUTORIZACIÓN DE COMERCIALIZACIÓN CONDICIONAL
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
AstraZeneca UK Ltd.
Silk Road Business Park Macclesfield, Cheshire SK10 2NA Reino Unido
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
Se debe presentar un PGR actualizado anualmente hasta la revalidación.
• Medidas adicionales de minimización de riesgos
Antes del lanzamiento del producto en cada Estado Miembro, el Titular de la Autorización de
Comercialización acordará el contenido y formato del material educativo con las Autoridades Nacionales
Competentes.
El Titular de la Autorización de Comercialización (TAC) debe asegurar que, en el lanzamiento y después,
se proporcione a todos los Profesionales Sanitarios que se espera van a utilizar y/o prescribir Caprelsa un
Kit educativo.
El kit educativo debe contener lo siguiente:
• Ficha Técnica y Prospecto
• Material Educativo para Profesional Sanitario
• Tarjetas de Información para el Paciente (texto según lo acordado por el CHMP)
El material educativo para los Profesionales Sanitarios debe contener los siguientes elementos clave:
• Vandetanib prolonga el intervalo QTc y puede causar “Torsades de pointes” y muerte súbita.
• El tratamiento con vandetanib no debe iniciarse en pacientes:
o Cuyo intervalo del QTc del ECG es mayor que 480 ms o Que tienen síndrome del QTc largo congénito
o Que tienen un historial de “Torsades de pointes” a menos que todos los factores de riesgo que contribuyeron a este “Torsades” hayan sido corregidos.
• La necesidad de un ECG, y los niveles séricos de potasio, calcio y magnesio y hormona estimulante del tiroides (TSH) y los tiempos y situaciones en los que deben realizarse.
• Los pacientes que desarrollen un solo valor del intervalo QTc del ECG de por lo menos 500 ms deben dejar de tomar vandetanib. Se puede reanudar la administración a una dosis reducida tras haber confirmado la recuperación del intervalo QTc del ECG al estado de pretratamiento y haber corregido el posible desequilibrio electrolítico.
• Si el QTc aumenta notablemente pero permanece por debajo de 500 ms, se debe buscar asesoramiento del cardiólogo.
• Detalles de los medicamentos en los que la co-administración de vandetanib está bien contraindicada o bien no recomendada.
• Que vandetanib puede causar Síndrome de encefalopatía posterior reversible (SEPR) también conocido como Síndrome de leucoencefalopatía posterior reversible (SLPR).
• El SEPR debe tenerse en cuenta en cualquier paciente que presente ataques, cefalea, alteraciones visuales, confusión o función mental alterada. Debe realizarse una RM cerebral si cualquier paciente presenta ataques, confusión o estado mental alterado.
• La necesidad de asesorar a los pacientes sobre el riesgo del QTc prolongado y el SEPR e informarles de qué síntomas y signos deben estar pendientes y qué acciones tomar.
• El papel y uso de la Tarjeta de Información para el Paciente.
E. OBLIGACIÓN ESPECÍFICA DE LLEVAR A CABO MEDIDAS POST-AUTORIZACIÓN EN RELACIÓN CON UNA AUTORIZACIÓN DE COMERCIALIZACIÓN CONDICIONAL
Al ser ésta una autorización de comercialización condicional y según lo que establece el artículo 14(7) del Reglamento (CE) 726/2004, el TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Un ensayo abierto basado en un protocolo aprobado por el CHMP, comparando |
3T 2020 |
pacientes RET negativo y RET positivo con cáncer medular de tiroides esporádico tratados con vandetanib. El estudio incluirá aproximadamente un 60% de pacientes que reciban vandetanib en la UE.
Criterios de inclusión: cumplir los criterios basados en la indicación de la Ficha Técnica. Además, se permitirá la inclusión y el seguimiento de los pacientes sin mutación del RET que no reciban vandetanib debido al estado del RET o por contraindicación.
Criterios de exclusión: se limitan a las contraindicaciones establecidas en la sección 4.3 de la Ficha Técnica.
Datos a recoger en el estudio:
• Historial y examen físico
• Estado mutacional del RET
• No se requiere que los pacientes dispongan de una biopsia de tejido para determinar el estado del RET para la inclusión
Estado mutacional del RET:
No se requerirá que los pacientes dispongan de una biopsia de tejido fresco para determinar el estado del RET antes de la inclusión. Sin embargo, el investigador debe solicitar firmemente la obtención de una muestra reciente para la determinación del estado del RET tan frecuentemente como sea posible, incluso en pacientes en los que se ha analizado previamente en un estadio más temprano de su enfermedad. La determinación del estado del RET debe hacerse preferiblemente justo antes del inicio del tratamiento. Se debe recoger el tipo de tejido empleado para el ensayo, la fecha de la biopsia del tejido, el tipo de ensayo y la definición empleada para la mutación del RET positiva y negativa. Se permitirá la inclusión de los pacientes sin mutación del RET que no reciban vandetanib debido al estado del RET o por contraindicación, se realizará el seguimiento.
El estado mutacional del RET debe evaluarse de acuerdo al análisis mutacional predefinido, donde el tipo de prueba y los exones a ser analizados estén predefinidos por protocolo.
• Evaluaciones de Seguridad en cada visita incluyendo información sobre la prolongación del QT.
• Respuestas objetivas del tumor / duración de la respuesta / progresión
• Evaluación de acuerdo a la práctica médica habitual de los médicos del estudio En un centro los pacientes serán evaluados en tiempos predefinidos para la eficacia de manera coherente, independientemente de su estado RET
• Método empleado para la evaluación (por ejemplo TAC, RM)
El estado de la enfermedad en cada visita de eficacia: respuesta objetiva, enfermedad estable o progresión de la enfermedad.
• El análisis final se realizará cuando al menos 40 pacientes identificados con mutación del RET y 40 pacientes identificados sin evidencia de mutación del RET hayan sido incluidos en el estudio y recibido vandetanib durante 14 meses. Se espera que la duración total del estudio sea de 38 meses.
Análisis:
• El estudio durará 2 años y los datos serán recogidos y analizados en tiempos pre-especificados (por ejemplo 12 meses y 24 meses)
• Tasa de respuesta objetiva, estado de progresión y TCE en la población global,
pacientes con mutación del RET negativa y mutación del RET positiva • Análisis de seguridad en la población global, pacientes con mutación del RET negativa y mutación del RET positiva
ANEXO III
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Caprelsa 100 mg comprimidos recubiertos con película vandetanib
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 100 mg de vandetanib.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Genzyme Europe B.V., Gooimeer 10, NL-1411 DD, Naarden, Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/749/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Caprelsa 100 mg
BLÍSTER DE CAPRELSA 100 MG
|
1. |
NOMBRE DEL MEDICAMENTO |
Caprelsa 100 mg comprimidos vandetanib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Genzyme Europe B.V.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Caprelsa 300 mg comprimidos recubiertos con película vandetanib
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 300 mg de vandetanib.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Genzyme Europe B.V., Gooimeer 10, NL-1411 DD, Naarden, Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/749/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Caprelsa 300 mg
BLÍSTER DE CAPRELSA 300 MG
|
1. |
NOMBRE DEL MEDICAMENTO |
Caprelsa 300 mg comprimidos vandetanib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Genzyme Europe B.V.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
B. PROSPECTO
Prospecto: información para el paciente Caprelsa 100 mg comprimidos recubiertos con película
vandetanib
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Además de este prospecto, se le proporcionará la Tarjeta de Información para el Paciente, que contiene información importante sobre seguridad que usted necesita conocer antes de que le entreguen Caprelsa y durante el tratamiento con dicho fármaco.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto y la tarjeta de información para el paciente, ya que puede tener que volver a leerlos.
- Es importante que mantenga la Tarjeta de Información consigo durante el tratamiento.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Caprelsa y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Caprelsa
3. Cómo tomar Caprelsa
4. Posibles efectos adversos
5. Conservación de Caprelsa
6. Contenido del envase e información adicional
1. Qué es Caprelsa y para qué se utiliza
Caprelsa se emplea para tratar el cáncer medular de tiroides que no puede ser eliminado mediante cirugía o que se ha extendido a otras partes del cuerpo.
Caprelsa actúa disminuyendo la velocidad de crecimiento de nuevos vasos sanguíneos en tumores (cánceres). Esto interrumpe el aporte de alimento y oxígeno al tumor. Caprelsa puede también actuar directamente en las células cancerígenas destruyéndolas o enlenteciendo su crecimiento.
2. Qué necesita saber antes de empezar a tomar Caprelsa No tome Caprelsa:
- si es alérgico (hipersensible) a vandetanib o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si tiene algún problema de corazón de nacimiento llamado “síndrome del QTc largo congénito”. Esto se observa en un electrocardiograma (ECG).
- si está en periodo de lactancia.
- si está tomando alguno de los siguientes medicamentos: arsénico, cisaprida (empleado para el ardor de estómago), eritromicina intravenosa y moxifloxacino (empleado para tratar una infección), toremifeno (empleado para tratar el cáncer de mama), mizolastina (empleado para tratar alergias), antiarrítmicos Clase IA y III (empleados para controlar el ritmo cardiaco).
Si alguno de los casos anteriores es aplicable a usted, no tome Caprelsa. Si no está seguro, consulte a su médico.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Caprelsa si es sensible al sol. Algunas personas que toman Caprelsa se vuelven más sensibles al sol. Esto puede provocar quemaduras solares. Mientras tome Caprelsa, protéjase cuando salga al exterior empleando siempre pantalla solar y llevando ropa para evitar la exposición al sol.
Monitorización de la sangre y el corazón:
Su médico o enfermera deben realizar análisis para comprobar los niveles de potasio, calcio, magnesio y hormona estimulante del tiroides (TSH) en sangre, así como la actividad eléctrica del corazón con una prueba llamada electrocardiograma (ECG). Se le deben llevar a cabo estas pruebas:
• Antes de comenzar a tomar Caprelsa
• Regularmente durante el tratamiento con Caprelsa
• 1, 3 y 6 semanas tras comenzar Caprelsa
• 12 semanas tras comenzar Caprelsa
• Tras esto, cada 3 meses
• Si su médico o farmacéutico cambian su dosis de Caprelsa
• Si comienza a tomar medicamentos que afecten al corazón
• Tal como le indique su médico o farmacéutico
Toma de Caprelsa con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento, incluso los adquiridos sin receta y plantas medicinales. Esto es porque Caprelsa puede afectar a la forma de actuar de algunos medicamentos y algunos medicamentos pueden tener efecto sobre Caprelsa.
Informe a su médico o farmacéutico si está tomando cualquiera de los siguientes medicamentos:
• itraconazol, ketoconazol, ritonavir, claritromicina, rifampicina y moxifloxacino (medicamentos utilizados para tratar infecciones)
• carbamazepina y fenobarbital (utilizados para controlar los ataques)
• ondansetrón (utilizado para tratar las náuseas y vómitos)
• cisaprida (utilizado para tratar la acidez de estómago), pimozida (utilizado para tratar los movimientos incontrolados y repetidos del cuerpo y los arrebatos verbales) y halofantrina y lumefantrina (utilizados para tratar la malaria)
• metadona (utilizado para tratar adicciones), haloperidol, clorpromazina, sulpirida, amisulprida y zuclopentixol (utilizados para tratar enfermedades mentales)
• pentamidina (utilizado para tratar una infección)
• antagonistas de la vitamina K y dabigatrán, frecuentemente llamados “anticoagulantes”
• ciclosporina y tacrolimus (utilizados para tratar los rechazos en los trasplantes), digoxina (utilizado para tratar el ritmo cardiaco irregular) y metformina (utilizado para controlar el azúcar en sangre)
• inhibidores de la bomba de protones (utilizados para tratar el ardor de estómago)
También encontrará esta información en la Tarjeta de Información para el Paciente que le ha entregado su médico. Es importante que guarde esta Tarjeta de Información y se la muestre a su pareja o cuidadores.
Embarazo y lactancia
Consulte a su médico antes de tomar Caprelsa si está embarazada, o planea estarlo. Esto se debe a que Caprelsa puede dañar al bebé. Su médico hablará con usted sobre los beneficios y riesgos de tomar Caprelsa durante este periodo.
• Si pudiera quedarse embarazada debe utilizar un método anticonceptivo eficaz cuando esté tomando Caprelsa y durante al menos cuatro meses tras la última dosis de Caprelsa.
Para la seguridad de su bebé, no debe dar el pecho durante el tratamiento con Caprelsa.
Conducción y uso de máquinas
Tenga precaución antes de conducir o usar máquinas. Tenga en cuenta que Caprelsa puede hacerle sentir cansado, débil o causar visión borrosa.
3. Cómo tomar Caprelsa
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
• La dosis recomendada es 300 mg al día.
• Tome Caprelsa aproximadamente a la misma hora cada día.
• Caprelsa puede tomarse con o sin alimentos.
Si tiene problemas para tragar el comprimido
Si tiene problemas para tragar el comprimido, puede mezclarlo con agua de la siguiente manera:
• Coja medio vaso de agua (sin gas). Utilice sólo agua, no use ningún otro líquido.
• Coloque el comprimido en el agua.
• Remueva el comprimido hasta que se haya disuelto en el agua. Esto puede tardar unos 10 minutos.
• Bébalo entonces inmediatamente.
Para asegurar que no queda medicamento, rellene el vaso con agua hasta la mitad y bébaselo.
Si presenta efectos adversos
Si presenta efectos adversos avise siempre a su médico. Éste puede decirle que tome Caprelsa a una dosis menor (como dos comprimidos de 100 mg o un comprimido de 100 mg). Su médico puede también prescribirle otros medicamentos que ayuden a controlar los efectos adversos. Los efectos adversos de Caprelsa están recogidos en la sección 4.
Si toma más Caprelsa del que debe
Si ha tomado más Caprelsa de lo prescrito, consulte con un médico o vaya a un hospital inmediatamente. Si olvidó tomar Caprelsa
Lo que debe hacer si olvida tomar un comprimido depende de cuánto tiempo falta hasta su próxima dosis:
• Si quedan 12 horas o más hasta su próxima dosis: Tome el comprimido olvidado tan pronto como se acuerde. Luego tome la siguiente dosis a la hora habitual.
• Si quedan menos de 12 horas hasta su próxima dosis: No tome la dosis olvidada. Luego tome la siguiente dosis a la hora habitual.
No tome una dosis doble (dos dosis a la vez) para compensar las dosis olvidadas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Si presenta efectos adversos, su médico puede decirle que tome Caprelsa a una dosis menor. Su médico también puede prescribirle otros medicamentos que ayuden a controlar los efectos adversos.
Informe inmediatamente a su médico si nota alguno de los siguientes efectos adversos - puede necesitar tratamiento médico urgente:
• Debilidad, mareo o cambios en el ritmo cardiaco. Estos pueden ser signos de un cambio en la actividad eléctrica del corazón. Se aprecian en el 8% de las personas que toman Caprelsa para el cáncer medular de tiroides. Su médico puede recomendarle que tome Caprelsa a una dosis más baja o que deje de tomarlo. Caprelsa se ha asociado poco frecuentemente a cambios en el ritmo cardiaco que sean un riesgo para la vida.
• Reacciones cutáneas graves que afectan a zonas extensas del cuerpo. Los signos pueden incluir enrojecimiento, dolor, úlceras, ampollas, y descamación de la piel. También puede afectar a los labios, nariz, ojos y genitales. Estas reacciones pueden ser frecuentes (afectan a menos de 1 de cada 10 personas) o poco frecuentes (afectan a menos de 1 de cada 100 personas) dependiendo del tipo de reacción cutánea.
• Diarrea grave.
• Dificultad grave para respirar, o empeoramiento repentino de la dificultad para respirar, posiblemente con tos o temperatura elevada (fiebre). Esto puede significar que tiene una inflamación de los pulmones denominada “enfermedad pulmonar intersticial”. Esto es poco frecuente (afecta a menos de 1 de cada 100 personas) pero puede amenazar a la vida.
• Ataques, dolor de cabeza, confusión o dificultad para concentrarse. Estos pueden ser signos de una enfermedad llamada SLPR (Síndrome de Leucoencefalopatía Posterior Reversible). Estos normalmente cesan cuando se interrumpe Caprelsa. El SLPR es poco frecuente (afecta a menos de 1 de cada 100 personas).
Informe a su médico inmediatamente si aprecia cualquiera de los efectos adversos anteriores.
Otros efectos adversos incluyen:
Muy frecuentes (que afectan a más de 1 de cada 10 personas):
• Diarrea. Su médico puede prescribirle un medicamento para tratarla. Si se agrava, informe a su médico inmediatamente.
• Dolor abdominal.
• Erupción cutánea o acné.
• Depresión.
• Cansancio.
• Náuseas.
• Malestar de estómago (dispepsia).
• Alteración de las uñas.
• Vómitos.
• Pérdida de apetito (anorexia).
• Debilidad (astenia).
• Presión arterial alta. Su médico puede prescribirle un medicamento para tratarla.
• Dolor de cabeza.
• Fatiga.
• Problemas para dormir (insomnio).
• Inflamación de los conductos nasales.
• Inflamación de los principales conductos de aire a los pulmones.
• Infecciones del tracto respiratorio superior.
• Infecciones del tracto urinario.
• Insensibilidad u hormigueo de la piel.
• Sensación anormal de la piel.
• Mareo.
• Dolor.
• Hinchazón causada por el exceso de fluido (edema).
• Cálculos o depósitos de calcio en el tracto urinario (nefrolitiasis).
• Visión borrosa, incluyendo cambios leves en el ojo que pueden dar lugar a visión borrosa (opacidad corneal).
• Sensibilidad de la piel a la luz solar. Mientras tome Caprelsa, protéjase cuando salga al exterior utilizando siempre crema solar y llevando ropa para evitar la exposición al sol.
Frecuentes (que afectan a menos de 1 de cada 10 personas):
• Deshidratación.
• Presión arterial alta grave.
• Pérdida de peso.
• Ictus u otras enfermedades en las que el cerebro puede no recibir suficiente sangre.
• Un tipo de erupción que afecta las manos y pies (síndrome de mano-pie).
• Irritación de la boca (estomatitis).
• Sequedad de boca.
• Neumonía.
• Toxinas en la sangre como una complicación de infección.
• Gripe.
• Inflamación de la vejiga urinaria.
• Inflamación de los senos.
• Inflamación de la caja de voz (laringe).
• Inflamación de un folículo, especialmente un folículo de pelo.
• Forúnculo.
• Infección fúngica.
• Infección del riñón.
• Pérdida de fluido corporal (deshidratación).
• Ansiedad.
• Temblor.
• Adormecimiento.
• Desvanecimiento.
• Sensación de inestabilidad.
• Aumento de la presión en el ojo (glaucoma).
• Toser sangre.
• Inflamación del tejido pulmonar.
• Dificultad para tragar.
• Estreñimiento.
• Inflamación del revestimiento del estómago (gastritis).
• Hemorragia gastrointestinal.
• Cálculos biliares (colelitiasis).
• Dolor al orinar.
• Insuficiencia renal.
• Orinar frecuentemente.
• Deseo urgente de orinar.
• Fiebre.
• Hemorragia nasal (epistaxis).
• Sequedad ocular.
• Irritación de los ojos (conjuntivitis).
• Alteración visual.
• Visión de halo.
• Ver destellos de luz (fotopsia).
• Alteración de la córnea ocular (queratopatía).
• Un tipo de diarrea (colitis).
• Pérdida de pelo de la cabeza o cuerpo (alopecia).
• Cambios en el gusto de los alimentos (disgeusia).
Poco frecuentes (que afectan a menos de 1 de cada 100 personas):
• Insuficiencia cardiaca.
• Inflamación del apéndice (apendicitis).
• Infección bacteriana.
• Inflamación de los divertículos (pequeñas bolsas protuberantes que se pueden formar en el sistema digestivo).
• Infección bacteriana de la piel.
• Abcesos en la pared abdominal.
• Malnutrición.
• Contracción muscular involuntaria (convulsiones).
• Contracción y relajación muscular alterna rápida (clonus).
• Hinchazón del cerebro.
• Enturbiamiento de la lente del ojo.
• Alteraciones de la frecuencia y ritmo cardiaco.
• Pérdida de la función cardiaca.
• Fallo de los pulmones para funcionar normalmente.
• Neumonía que ocurre cuando inspira materia extraña en los pulmones.
• Obstrucción intestinal.
• Perforación intestinal.
• Incapacidad para controlar los movimientos intestinales.
• Color anormal de la orina.
• Ausencia de orina.
• Incapacidad para cicatrizar apropiadamente.
• Inflamación del páncreas (pancreatitis).
• Formación de ampollas en la piel (dermatitis bullosa).
Se pueden observar los siguientes efectos adversos en los análisis que puede llevar a cabo su médico:
• Proteínas o sangre en la orina (se comprueba en un análisis de orina).
• Cambios en el ritmo cardiaco (se comprueban en un ECG). Su médico puede pedirle que deje de
tomar Caprelsa o que lo tome a dosis más bajas.
• Anomalías en el hígado o páncreas (se comprueban en análisis de sangre). Esto normalmente no provoca síntomas pero puede que su médico quiera controlarlos.
• Niveles de calcio en sangre disminuidos. Puede que su médico necesite prescribir o cambiar su tratamiento de la hormona tiroidea.
• Niveles de potasio en sangre disminuidos.
• Niveles de calcio en sangre aumentados.
• Niveles de glucosa en sangre aumentados.
• Niveles de sodio en sangre disminuidos.
• Disminución de la función tiroidea.
• Niveles de glóbulos rojos en sangre aumentados.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico inmediatamente.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Caprelsa
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el blíster y en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Caprelsa
• El principio activo es vandetanib. Cada comprimido contiene 100 mg de vandetanib.
• Los demás componentes son hidrógeno fosfato de calcio dihidrato, celulosa microcristalina, crospovidona (tipo A), povidona (K29-32), estearato de magnesio, hipromelosa, macrogol y dióxido de titanio (E171).
Aspecto del producto y contenido del envase
Caprelsa 100 mg es un comprimido recubierto con película redondo, blanco, marcado con “Z100” por un lado.
Caprelsa se presenta en envases blíster de 30 comprimidos.
Titular de la autorización de comercialización
Genzyme Europe B.V., Gooimeer 10, NL-1411 DD, Naarden, Países Bajos Responsable de la fabricación
AstraZeneca UK Limited, Macclesfield, Cheshire, SK10 2NA, Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
sanofi-aventis Bulgaria EOOD Ten: +359 2 9705300 |
Sanofi Malta Ltd Tel: +356 21493022 |
|
Ceská republika sanofi-aventis, s.r.o. Tel: +420 233 086 111 |
Nederland Genzyme Europe B.V. Tel: +31 35 699 1200 |
|
Danmark sanofi-aventis Denmark A/S Tlf: +45 45 16 70 00 |
Norge sanofi-aventis Norge AS Tlf: + 47 67 10 71 00 |
|
Deutschland Genzyme GmbH Tel: +49 (0)6102 3674 0 |
Osterreich sanofi-aventis GmbH Tel: + 43 1 80 185 - 0 |
|
Eesti sanofi-aventis Estonia OÜ Tel. +372 6 273 488 |
Polska sanofi-aventis Sp. z o.o. Tel.: +48 22 280 00 00 |
|
EHáSa/Kúnpoq sanofi-aventis AEBE (EHáSa) Tr|k: +30 210 900 1600 |
Portugal Sanofi - Produtos Farmacéuticos, Lda. Tel: +351 21 422 0100 |
|
España Genzyme, S.L.U. Tel: +34 93 485 94 00 sanofi-aventis, S.A. Tel: +34 93 485 94 00 |
Románia Sanofi Romania SRL Tel: +40 (0) 21 317 31 36 |
|
France Genzyme S.A.S. Information médicale: tél:+33(0) 800 100 499 |
Slovenija sanofi-aventis d.o.o. Tel: +386 1 560 4800 |
|
Hrvatska sanofi-aventis Croatia d.o.o. Tel: +385 1 600 34 00 |
Slovenská republika sanofi-aventis Pharma Slovakia s.r.o. Tel.: +421 2 33 100 100 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Suomi/Finland Sanofi Oy Puh/Tel: + 358 201 200 300 |
|
Italia Genzyme Srl Tel: +39 059 349 811 |
Sverige Sanofi AB Tel: +46 (0)8 634 50 00 |
|
Latvija sanofi-aventis Latvia SIA Tel: +371 67 33 24 51 Lietuva UAB „SANOFI-AVENTIS LIETUVA“ Tel. +370 5 275 5224 |
United Kingdom/Ireland Genzyme Therapeutics Ltd. (United Kingdom) Tel: +44 (0) 1865 405200 |
|
57 |
Fecha de la última revisión de este prospecto:
Este medicamento se ha autorizado con una «aprobación condicional».
Esta modalidad de aprobación significa que se espera obtener más información de este medicamento.
La Agencia Europea de Medicamentos revisará la información nueva de este medicamento al menos una vez al año y este prospecto se actualizará cuando sea necesario.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Prospecto: información para el paciente Caprelsa 300 mg comprimidos recubiertos con película
Vandetanib
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Además de este prospecto, se le proporcionará la Tarjeta de Información para el Paciente, que contiene información importante sobre seguridad que usted necesita conocer antes de que le entreguen Caprelsa y durante el tratamiento con dicho fármaco.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto y la tarjeta de información para el paciente, ya que puede tener que volver a leerlos.
- Es importante que mantenga la Tarjeta de Información consigo durante el tratamiento.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Caprelsa y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Caprelsa
3. Cómo tomar Caprelsa
4. Posibles efectos adversos
5. Conservación de Caprelsa
6. Contenido del envase e información adicional
1. Qué es Caprelsa y para qué se utiliza
Caprelsa se emplea para tratar el cáncer medular de tiroides que no puede ser eliminado mediante cirugía o que se ha extendido a otras partes del cuerpo.
Caprelsa actúa disminuyendo la velocidad de crecimiento de nuevos vasos sanguíneos en tumores (cánceres). Esto interrumpe el aporte de alimento y oxígeno al tumor. Caprelsa puede también actuar directamente en las células cancerígenas destruyéndolas o enlenteciendo su crecimiento.
2. Qué necesita saber antes de empezar a tomar Caprelsa No tome Caprelsa:
- si es alérgico (hipersensible) a vandetanib o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si tiene algún problema de corazón de nacimiento llamado “síndrome del QTc largo congénito”. Esto se observa en un electrocardiograma (ECG).
- si está en periodo de lactancia.
- si está tomando alguno de los siguientes medicamentos: arsénico, cisaprida (empleado para el ardor de estómago), eritromicina intravenosa y moxifloxacino (empleado para tratar una infección), toremifeno (empleado para tratar el cáncer de mama), mizolastina (empleado para tratar alergias), antiarrítmicos Clase IA y III (empleados para controlar el ritmo cardiaco).
Si alguno de los casos anteriores es aplicable a usted, no tome Caprelsa. Si no está seguro, consulte a su médico.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Caprelsa si es sensible al sol. Algunas personas que toman Caprelsa se vuelven más sensibles al sol. Esto puede provocar quemaduras solares. Mientras tome Caprelsa, protéjase cuando salga al exterior empleando siempre pantalla solar y llevando ropa para evitar la exposición al sol.
Monitorización de la sangre y el corazón:
Su médico o enfermera deben realizar análisis para comprobar los niveles de potasio, calcio, magnesio y hormona estimulante del tiroides (TSH) en sangre, así como la actividad eléctrica del corazón con una prueba llamada electrocardiograma (ECG). Se le deben llevar a cabo estas pruebas:
• Antes de comenzar a tomar Caprelsa
• Regularmente durante el tratamiento con Caprelsa
• 1, 3 y 6 semanas tras comenzar Caprelsa
• 12 semanas tras comenzar Caprelsa
• Tras esto, cada 3 meses
• Si su médico o farmacéutico cambian su dosis de Caprelsa
• Si comienza a tomar medicamentos que afecten al corazón
• Tal como le indique su médico o farmacéutico
Toma de Caprelsa con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento, incluso los adquiridos sin receta y plantas medicinales. Esto es porque Caprelsa puede afectar a la forma de actuar de algunos medicamentos y algunos medicamentos pueden tener efecto sobre Caprelsa.
Informe a su médico o farmacéutico si está tomando cualquiera de los siguientes medicamentos:
• itraconazol, ketoconazol, ritonavir, claritromicina, rifampicina y moxifloxacino (medicamentos utilizados para tratar infecciones)
• carbamazepina y fenobarbital (utilizados para controlar los ataques)
• ondansetrón (utilizado para tratar las náuseas y vómitos)
• cisaprida (utilizado para tratar la acidez de estómago), pimozida (utilizado para tratar los movimientos incontrolados y repetidos del cuerpo y los arrebatos verbales) y halofantrina y lumefantrina (utilizados para tratar la malaria)
• metadona (utilizado para tratar adicciones), haloperidol, clorpromazina, sulpirida, amisulprida y zuclopentixol (utilizados para tratar enfermedades mentales)
• pentamidina (utilizado para tratar una infección)
• antagonistas de la vitamina K y dabigatrán, frecuentemente llamados “anticoagulantes”
• ciclosporina y tacrolimus (utilizados para tratar los rechazos en los trasplantes), digoxina (utilizado para tratar el ritmo cardiaco irregular) y metformina (utilizado para controlar el azúcar en sangre)
• inhibidores de la bomba de protones (utilizados para tratar el ardor de estómago)
También encontrará esta información en la Tarjeta de Información para el Paciente que le ha entregado su médico. Es importante que guarde esta Tarjeta de Información y se la muestre a su pareja o cuidadores.
Embarazo y lactancia
Consulte a su médico antes de tomar Caprelsa si está embarazada, o planea estarlo. Esto se debe a que Caprelsa puede dañar al bebé. Su médico hablará con usted sobre los beneficios y riesgos de tomar Caprelsa durante este periodo.
• Si pudiera quedarse embarazada debe utilizar un método anticonceptivo eficaz cuando esté tomando Caprelsa y durante al menos cuatro meses tras la última dosis de Caprelsa.
Para la seguridad de su bebé, no debe dar el pecho durante el tratamiento con Caprelsa.
Conducción y uso de máquinas
Tenga precaución antes de conducir o usar máquinas. Tenga en cuenta que Caprelsa puede hacerle sentir cansado, débil o causar visión borrosa.
3. Cómo tomar Caprelsa
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
• La dosis recomendada es 300 mg al día.
• Tome Caprelsa aproximadamente a la misma hora cada día.
• Caprelsa puede tomarse con o sin alimentos.
Si tiene problemas para tragar el comprimido
Si tiene problemas para tragar el comprimido, puede mezclarlo con agua de la siguiente manera:
• Coja medio vaso de agua (sin gas). Utilice sólo agua, no use ningún otro líquido.
• Coloque el comprimido en el agua.
• Remueva el comprimido hasta que se haya disuelto en el agua. Esto puede tardar unos 10 minutos.
• Bébalo entonces inmediatamente.
Para asegurar que no queda medicamento, rellene el vaso con agua hasta la mitad y bébaselo.
Si presenta efectos adversos
Si presenta efectos adversos avise siempre a su médico. Éste puede decirle que tome Caprelsa a una dosis menor (como dos comprimidos de 100 mg o un comprimido de 100 mg). Su médico puede también prescribirle otros medicamentos que ayuden a controlar los efectos adversos. Los efectos adversos de Caprelsa están recogidos en la sección 4.
Si toma más Caprelsa del que debe
Si ha tomado más Caprelsa de lo prescrito, consulte con un médico o vaya a un hospital inmediatamente. Si olvidó tomar Caprelsa
Lo que debe hacer si olvida tomar un comprimido depende de cuánto tiempo falta hasta su próxima dosis:
• Si quedan 12 horas o más hasta su próxima dosis: Tome el comprimido olvidado tan pronto como se acuerde. Luego tome la siguiente dosis a la hora habitual.
• Si quedan menos de 12 horas hasta su próxima dosis: No tome la dosis olvidada. Luego tome la siguiente dosis a la hora habitual.
No tome una dosis doble (dos dosis a la vez) para compensar las dosis olvidadas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Si presenta efectos adversos, su médico puede decirle que tome Caprelsa a una dosis menor. Su médico también puede prescribirle otros medicamentos que ayuden a controlar los efectos adversos.
Informe inmediatamente a su médico si nota alguno de los siguientes efectos adversos - puede necesitar tratamiento médico urgente:
• Debilidad, mareo o cambios en el ritmo cardiaco. Estos pueden ser signos de un cambio en la actividad eléctrica del corazón. Se aprecian en el 8% de las personas que toman Caprelsa para el cáncer medular de tiroides. Su médico puede recomendarle que tome Caprelsa a una dosis más baja o que deje de tomarlo. Caprelsa se ha asociado poco frecuentemente a cambios en el ritmo cardiaco que sean un riesgo para la vida.
• Reacciones cutáneas graves que afectan a zonas extensas del cuerpo. Los signos pueden incluir enrojecimiento, dolor, úlceras, ampollas, y descamación de la piel. También puede afectar a los labios, nariz, ojos y genitales. Estas reacciones pueden ser frecuentes (afectan a menos de 1 de cada 10 personas) o poco frecuentes (afectan a menos de 1 de cada 100 personas) dependiendo del tipo de reacción cutánea.
• Diarrea grave.
• Dificultad grave para respirar, o empeoramiento repentino de la dificultad para respirar, posiblemente con tos o temperatura elevada (fiebre). Esto puede significar que tiene una inflamación de los pulmones denominada “enfermedad pulmonar intersticial”. Esto es poco frecuente (afecta a menos de 1 de cada 100 personas) pero puede amenazar a la vida.
• Ataques, dolor de cabeza, confusión o dificultad para concentrarse. Estos pueden ser signos de una enfermedad llamada SLPR (Síndrome de Leucoencefalopatía Posterior Reversible). Estos normalmente cesan cuando se interrumpe Caprelsa. El SLPR es poco frecuente (afecta a menos de 1 de cada 100 personas).
Informe a su médico inmediatamente si aprecia cualquiera de los efectos adversos anteriores.
Otros efectos adversos incluyen:
Muy frecuentes (que afectan a más de 1 de cada 10 personas):
• Diarrea. Su médico puede prescribirle un medicamento para tratarla. Si se agrava, informe a su médico inmediatamente.
• Dolor abdominal.
• Erupción cutánea o acné.
• Depresión.
• Cansancio.
• Náuseas.
• Malestar de estómago (dispepsia).
• Alteración de las uñas.
• Vómitos.
• Pérdida de apetito (anorexia).
• Debilidad (astenia).
• Presión arterial alta. Su médico puede prescribirle un medicamento para tratarla.
• Dolor de cabeza.
• Fatiga.
• Problemas para dormir (insomnio).
• Inflamación de los conductos nasales.
• Inflamación de los principales conductos de aire a los pulmones.
• Infecciones del tracto respiratorio superior.
• Infecciones del tracto urinario.
• Insensibilidad u hormigueo de la piel.
• Sensación anormal de la piel.
• Mareo.
• Dolor.
• Hinchazón causada por el exceso de fluido (edema).
• Cálculos o depósitos de calcio en el tracto urinario (nefrolitiasis).
• Visión borrosa, incluyendo cambios leves en el ojo que pueden dar lugar a visión borrosa (opacidad corneal).
• Sensibilidad de la piel a la luz solar. Mientras tome Caprelsa, protéjase cuando salga al exterior utilizando siempre crema solar y llevando ropa para evitar la exposición al sol.
Frecuentes (que afectan a menos de 1 de cada 10 personas):
• Deshidratación.
• Presión arterial alta grave.
• Pérdida de peso.
• Ictus u otras enfermedades en las que el cerebro puede no recibir suficiente sangre.
• Un tipo de erupción que afecta las manos y pies (síndrome de mano-pie).
• Irritación de la boca (estomatitis).
• Sequedad de boca.
• Neumonía.
• Toxinas en la sangre como una complicación de infección.
• Gripe.
• Inflamación de la vejiga urinaria.
• Inflamación de los senos.
• Inflamación de la caja de voz (laringe).
• Inflamación de un folículo, especialmente un folículo de pelo.
• Forúnculo.
• Infección fúngica.
• Infección del riñón.
• Pérdida de fluido corporal (deshidratación).
• Ansiedad.
• Temblor.
• Adormecimiento.
• Desvanecimiento.
• Sensación de inestabilidad.
• Aumento de la presión en el ojo (glaucoma).
• Toser sangre.
• Inflamación del tejido pulmonar.
• Dificultad para tragar.
• Estreñimiento.
• Inflamación del revestimiento del estómago (gastritis).
• Hemorragia gastrointestinal.
• Cálculos biliares (colelitiasis).
• Dolor al orinar.
• Insuficiencia renal.
• Orinar frecuentemente.
• Deseo urgente de orinar.
• Fiebre.
• Hemorragia nasal (epistaxis).
• Sequedad ocular.
• Irritación de los ojos (conjuntivitis).
• Alteración visual.
• Visión de halo.
• Ver destellos de luz (fotopsia).
• Alteración de la córnea ocular (queratopatía).
• Un tipo de diarrea (colitis).
• Pérdida de pelo de la cabeza o cuerpo (alopecia).
• Cambios en el gusto de los alimentos (disgeusia).
Poco frecuentes (que afectan a menos de 1 de cada 100 personas):
• Insuficiencia cardiaca.
• Inflamación del apéndice (apendicitis).
• Infección bacteriana.
• Inflamación de los divertículos (pequeñas bolsas protuberantes que se pueden formar en el sistema digestivo).
• Infección bacteriana de la piel.
• Abcesos en la pared abdominal.
• Malnutrición.
• Contracción muscular involuntaria (convulsiones).
• Contracción y relajación muscular alterna rápida (clonus).
• Hinchazón del cerebro.
• Enturbiamiento de la lente del ojo.
• Alteraciones de la frecuencia y ritmo cardiaco.
• Pérdida de la función cardiaca.
• Fallo de los pulmones para funcionar normalmente.
• Neumonía que ocurre cuando inspira materia extraña en los pulmones.
• Obstrucción intestinal.
• Perforación intestinal.
• Incapacidad para controlar los movimientos intestinales.
• Color anormal de la orina.
• Ausencia de orina.
• Incapacidad para cicatrizar apropiadamente.
• Inflamación del páncreas (pancreatitis).
• Formación de ampollas en la piel (dermatitis bullosa).
Se pueden observar los siguientes efectos adversos en los análisis que puede llevar a cabo su médico:
• Proteínas o sangre en la orina (se comprueba en un análisis de orina).
• Cambios en el ritmo cardiaco (se comprueban en un ECG). Su médico puede pedirle que deje de
tomar Caprelsa o que lo tome a dosis más bajas.
• Anomalías en el hígado o páncreas (se comprueban en análisis de sangre). Esto normalmente no provoca síntomas pero puede que su médico quiera controlarlos.
• Niveles de calcio en sangre disminuidos. Puede que su médico necesite prescribir o cambiar su tratamiento de la hormona tiroidea.
• Niveles de potasio en sangre disminuidos.
• Niveles de calcio en sangre aumentados.
• Niveles de glucosa en sangre aumentados.
• Niveles de sodio en sangre disminuidos.
• Disminución de la función tiroidea.
• Niveles de glóbulos rojos en sangre aumentados.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico inmediatamente.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Caprelsa
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el blíster y en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Caprelsa
• El principio activo es vandetanib. Cada comprimido contiene 300 mg de vandetanib.
• Los demás componentes son hidrógeno fosfato de calcio dihidrato, celulosa microcristalina, crospovidona (tipo A), povidona (K29-32), estearato de magnesio, hipromelosa, macrogol y dióxido de titanio (E171).
Aspecto del producto y contenido del envase
Caprelsa 300 mg es un comprimido recubierto con película ovalado, blanco, marcado con “Z300” por un lado.
Caprelsa se presenta en envases blíster de 30 comprimidos.
Titular de la autorización de comercialización
Genzyme Europe B.V., Gooimeer 10, NL-1411 DD, Naarden, Países Bajos Responsable de la fabricación
AstraZeneca UK Limited, Macclesfield, Cheshire, SK10 2NA, Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
sanofi-aventis Bulgaria EOOD Ten: +359 2 9705300 |
Sanofi Malta Ltd Tel: +356 21493022 |
|
Ceská republika sanofi-aventis, s.r.o. Tel: +420 233 086 111 |
Nederland Genzyme Europe B.V. Tel: +31 35 699 1200 |
|
Danmark sanofi-aventis Denmark A/S Tlf: +45 45 16 70 00 |
Norge sanofi-aventis Norge AS Tlf: + 47 67 10 71 00 |
|
Deutschland Genzyme GmbH Tel: +49 (0)6102 3674 0 |
Osterreich sanofi-aventis GmbH Tel: + 43 1 80 185 - 0 |
|
Eesti sanofi-aventis Estonia OÜ Tel. +372 6 273 488 |
Polska sanofi-aventis Sp. z o.o. Tel.: +48 22 280 00 00 |
|
EHáSa/Kúnpoq sanofi-aventis AEBE (EHáSa) Tr|k: +30 210 900 1600 |
Portugal Sanofi - Produtos Farmacéuticos, Lda. Tel: +351 21 422 0100 |
|
España Genzyme, S.L.U. Tel: +34 93 485 94 00 sanofi-aventis, S.A. Tel: +34 93 485 94 00 |
Románia Sanofi Romania SRL Tel: +40 (0) 21 317 31 36 |
|
France Genzyme S.A.S. Information médicale: tél:+33(0) 800 100 499 |
Slovenija sanofi-aventis d.o.o. Tel: +386 1 560 4800 |
|
Hrvatska sanofi-aventis Croatia d.o.o. Tel: +385 1 600 34 00 |
Slovenská republika sanofi-aventis Pharma Slovakia s.r.o. Tel.: +421 2 33 100 100 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Suomi/Finland Sanofi Oy Puh/Tel: + 358 201 200 300 |
|
Italia Genzyme Srl Tel: +39 059 349 811 |
Sverige Sanofi AB Tel: +46 (0)8 634 50 00 |
|
Latvija sanofi-aventis Latvia SIA Tel: +371 67 33 24 51 Lietuva UAB „SANOFI-AVENTIS LIETUVA“ Tel. +370 5 275 5224 |
United Kingdom/Ireland Genzyme Therapeutics Ltd. (United Kingdom) Tel: +44 (0) 1865 405200 |
|
66 |
Fecha de la última revisión de este prospecto:
Este medicamento se ha autorizado con una «aprobación condicional».
Esta modalidad de aprobación significa que se espera obtener más información de este medicamento.
La Agencia Europea de Medicamentos revisará la información nueva de este medicamento al menos una vez al año y este prospecto se actualizará cuando sea necesario.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
67