Byetta 10 Microgramos Solucion Inyectable, Pluma Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Byetta 5 microgramos solución inyectable en pluma precargada Byetta 10 microgramos solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada dosis contiene 5 microgramos (pg) de exenatida en 20 microlitros (pl), (0,25 mg de exenatida por ml).
Cada dosis contiene 10 microgramos (pg) de exenatida en 40 microlitros (pl), (0,25 mg de exenatida por ml).
Excipiente con efecto conocido:
Byetta 5 mcg: Cada dosis contiene 44 pg de metacresol.
Byetta 10 mcg: Cada dosis contiene 88 pg de metacresol.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyección). Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Byetta está indicado para el tratamiento de diabetes mellitus tipo 2 en combinación con:
- metformina
- sulfonilureas
- tiazolidindionas
- metformina y una sulfonilurea
- metformina y una tiazolidindiona
en adultos que no hayan alcanzado un control glucémico adecuado con las dosis máximas toleradas de estos tratamientos orales.
Byetta está también indicado como tratamiento coadyuvante a insulina basal con o sin metformina y/o pioglitazona en adultos que no hayan alcanzado un adecuado control glucémico con estos medicamentos.
4.2 Posología y forma de administración
Posología
El tratamiento con exenatida de liberación inmediata (Byetta) debe ser iniciado con una dosis de 5 pg de exenatida administrada dos veces al día durante al menos un mes con el objeto de mejorar la tolerabilidad. La dosis de exenatida puede luego aumentarse a 10 pg dos veces al día para mejorar de forma adicional el control glucémico. Las dosis superiores a 10 pg dos veces al día no están recomendadas.
Exenatida de liberación inmediata está disponible en pluma precargada con dosis de 5 pg ó 10 pg de exenatida.
Exenatida de liberación inmediata puede ser administrada en cualquier momento dentro de un período de 60 minutos antes del desayuno y cena (o de las dos comidas principales del día, separadas por aproximadamente 6 horas o más). Exenatida de liberación inmediata no debe ser administrada después de la comida. Si se olvida una inyección, el tratamiento debe continuar con la siguiente dosis pautada.
El uso de exenatida de liberación inmediata está recomendado en pacientes con diabetes mellitus tipo 2 que ya estén recibiendo metformina, una sulfonilurea, pioglitazona y/o una insulina basal. Se puede continuar utilizando exenatida de liberación inmediata cuando se añade al tratamiento una insulina basal. Cuando se añade exenatida de liberación inmediata al tratamiento con metformina y/o pioglitazona, se puede continuar con la dosis de metformina y/o pioglitazona ya que no se prevé un aumento del riesgo de hipoglucemia, comparado con metformina o pioglitazona solas. Cuando se añade exenatida de liberación inmediata al tratamiento con una sulfonilurea, se debe considerar una reducción de la dosis de sulfonilurea para reducir el riesgo de hipoglucemia (ver sección 4.4). Cuando se utiliza exenatida de liberación inmediata en combinación con insulina basal, se debe revisar la dosis de insulina basal. En pacientes con un mayor riesgo de hipoglucemia, se debe considerar una reducción de la dosis de insulina basal (ver sección 4.8).
La dosis de exenatida de liberación inmediata no necesita ser ajustada diariamente en base al autocontrol de los niveles de glucosa. Sin embargo, el autocontrol de los niveles de glucosa puede ser necesario para ajustar la dosis de sulfonilureas o la dosis de insulina basal.
Poblaciones especiales
Edad avanzada
Exenatida de liberación inmediata debe ser utilizada con precaución en pacientes mayores de 70 años y se debe proceder cuidadosamente en el escalado de la dosis de 5 pg a 10 pg. La experiencia clínica en pacientes mayores de 75 años es muy limitada.
Insuficiencia renal
No es necesario un ajuste de la dosis en pacientes con insuficiencia renal leve (aclaramiento de creatinina entre 50-80 ml/min).
En pacientes con insuficiencia renal moderada (aclaramiento de creatinina entre 30-50 ml/min), se debe proceder cuidadosamente en el escalado de la dosis de 5 pg a 10 pg (ver sección 5.2).
El uso de exenatida no está recomendado en pacientes con insuficiencia renal terminal o grave (aclaramiento de creatinina < 30 ml/min) (ver sección 4.4).
Insuficiencia hepática
No es necesario un ajuste de dosis en pacientes con insuficiencia hepática (ver sección 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de exenatida en niños y adolescentes menores de 18 años de edad (ver sección 5.2).
Los datos actualmente disponibles se incluyen en la sección 5.2, sin embargo no se puede hacer una recomendación posológica.
Forma de administración
Cada dosis debe ser administrada mediante inyección subcutánea en el muslo, abdomen o en la parte superior del brazo.
Exenatida de liberación inmediata e insulina basal se deben administrar en dos inyecciones por separado.
Para consultar las instrucciones de uso de la pluma, ver sección 6.6 y el manual del usuario incluidas en el prospecto.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Exenatida no debe ser utilizada en pacientes con diabetes mellitus tipo 1 o para el tratamiento de la cetoacidosis diabética.
Exenatida de liberación inmediata no debe ser administrada mediante inyección intravenosa o intramuscular.
Insuficiencia renal
En pacientes con insuficiencia renal terminal en tratamiento de diálisis, dosis únicas de exenatida de liberación inmediata 5 pg aumentaron la frecuencia y la gravedad de las reacciones adversas gastrointestinales. Exenatida no está recomendada para el uso en pacientes con insuficiencia renal terminal o insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min). La experiencia clínica en pacientes con insuficiencia renal moderada es muy limitada (ver sección 4.2).
Se han notificado de forma espontánea casos poco frecuentes de alteración de la función renal, incluyendo aumento de la creatinina sérica, disfunción renal, empeoramiento de la insuficiencia renal crónica e insuficiencia renal aguda, requiriendo algunas veces hemodiálisis. Algunos de estos casos ocurrieron en pacientes que experimentaron acontecimientos que podían afectar la hidratación, incluyendo náuseas, vómitos y/o diarrea y/o estaban recibiendo medicamentos conocidos por afectar a la función renal/estado de hidratación. Los medicamentos concomitantes incluyeron inhibidores de enzima convertidora de la angiotensina, antagonistas de la angiotensina-II, medicamentos antiinflamatorios no esteroideos y diuréticos. Se ha observado reversibilidad de la función renal con tratamiento de apoyo y suspensión de los medicamentos causantes potenciales, incluyendo exenatida.
Pancreatitis aguda
Se ha asociado el uso de agonistas del receptor de GLP-1 al riesgo de desarrollar pancreatitis aguda.
Se han notificado de forma espontánea casos de pancreatitis aguda con exenatida. Se ha observado la resolución de la pancreatitis con tratamiento de apoyo pero se han notificado casos muy raros de pancreatitis necrotizante o hemorrágica y/o muerte. Se debe informar a los pacientes del síntoma característico de la pancreatitis aguda: dolor abdominal grave y persistente. Si hay sospecha de pancreatitis, se debe interrumpir el tratamiento con exenatida; si se confirma pancreatitis aguda, el tratamiento con exenatida no se debe reiniciar. Se debe tener precaución en pacientes con antecedentes de pancreatitis.
Enfermedad gastrointestinal grave
Exenatida no ha sido estudiada en pacientes con enfermedad gastrointestinal grave, incluyendo gastroparesia. Su uso está comúnmente asociado con reacciones adversas gastrointestinales, incluyendo náuseas, vómitos y diarrea. Por lo tanto, no está recomendado el uso de exenatida en pacientes con enfermedad gastrointestinal grave.
Hipoglucemia
Cuando se utilizó exenatida de liberación inmediata en combinación con una sulfonilurea, aumentó la incidencia de hipoglucemia respecto a la de placebo en combinación con una sulfonilurea. Durante los ensayos clínicos se observó un aumento de la incidencia de hipoglucemia en los pacientes con insuficiencia renal leve que recibían una combinación con sulfonilurea, en comparación con los pacientes con función renal normal. Para reducir el riesgo de hipoglucemia asociada al uso de una sulfonilurea, se debe considerar la reducción de la dosis de sulfonilurea.
Pérdida de peso rápida
Se ha observado una pérdida de peso mayor a 1,5 kg a la semana, en aproximadamente un 5 % de los pacientes de ensayos clínicos tratados con exenatida. Una pérdida de peso tan rápida puede tener
consecuencias perjudiciales. Se debe monitorizar los signos y síntomas de colelitiasis en los pacientes con una pérdida de peso tan rápida.
Medicamentos concomitantes
El efecto de enlentecimiento del vaciado gástrico que produce exenatida de liberación inmediata puede reducir el grado y velocidad de absorción de medicamentos administrados por vía oral. Exenatida de liberación inmediata se debe usar con precaución en pacientes que estén recibiendo medicamentos por vía oral que requieran una rápida absorción gastrointestinal y medicamentos con un estrecho margen terapéutico. En la sección 4.5 se dan recomendaciones específicas relativas a la administración de estos medicamentos en relación a exenatida de liberación inmediata.
La administración concomitante de exenatida de liberación inmediata con derivados de D-fenilalanina (meglitinidas), inhibidores de la alfa-glucosidasa, inhibidores de la dipeptidil peptidasa-4 u otros agonistas del receptor de GLP-1 no ha sido estudiado, por lo que no se puede recomendar.
Excipientes
Este medicamento contiene metacresol, que puede causar reacciones alérgicas.
Este medicamento contiene menos de 1 mmol de sodio por dosis, esencialmente “libre de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
El enlentecimiento del vaciado gástrico producido por exenatida de liberación inmediata puede reducir el grado y velocidad de absorción de medicamentos administrados por vía oral. Se debe realizar un seguimiento cercano de aquellos pacientes que estén recibiendo medicamentos de estrecho margen terapéutico o medicamentos que requieran una cuidadosa monitorización clínica. Estos medicamentos se deben tomar de forma estandarizada en relación con la inyección de exenatida de liberación inmediata. Si dichos medicamentos son administrados con comida, se debe informar a los pacientes que, si es posible, los tomen con una comida en la que no se administre exenatida de liberación inmediata.
Para los medicamentos orales cuya eficacia es particularmente dependiente de su umbral de concentración, como antibióticos, los pacientes deben ser informados que deben tomar esos medicamentos al menos 1 hora antes de la inyección de exenatida de liberación inmediata.
Las formulaciones gastrorresistentes que contengan sustancias susceptibles de ser degradadas en el estómago, como inhibidores de la bomba de protones, se deben tomar al menos 1 hora antes o más de 4 horas después de la inyección de exenatida de liberación inmediata.
Digoxina, lisinopril y warfarina
Se observó un retraso en el tmax de aproximadamente 2 h cuando se administró digoxina, lisinopril o warfarina 30 min después de exenatida. No se observaron efectos clínicamente relevantes sobre la Cmax o el AUC. Sin embargo, desde su introducción en el mercado, se ha notificado de forma espontánea un aumento de la Razón Normalizada Internacional (INR) durante el uso concomitante de warfarina y exenatida. Se debe monitorizar frecuentemente el INR al inicio y durante el aumento de la dosis de exenatida de liberación inmediata en pacientes en tratamiento con warfarina y/o derivados de cumarol (ver sección 4.8).
Metformina o sulfonilureas
No se espera que exenatida de liberación inmediata tenga ningún efecto clínicamente relevante en relación con la farmacocinética de metformina o sulfonilureas. Por lo tanto, no es necesaria ninguna restricción en la hora de la toma de estos medicamentos en relación con la inyección de exenatida de liberación inmediata.
Paracetamol
El paracetamol fue utilizado como un medicamento modelo para evaluar el efecto de exenatida en el vaciado gástrico. Cuando se administraron 1.000 mg de paracetamol con 10 pg de exenatida de liberación inmediata (0 h) y 1 h, 2 h y 4 h después de la inyección de exenatida de liberación inmediata, el área bajo la curva (AUC) del paracetamol disminuyó un 21 %, 23 %, 24 % y 14 % respectivamente; Cmax disminuyó un 37 %, 56 %, 54 % y un 41 % respectivamente y tmax aumentó desde un valor de 0,6 h en el período control a 0,9 h, 4,2 h, 3,3 h y 1,6 h, respectivamente. Los valores de AUC, Cmax y tmax de paracetamol no se modificaron significativamente cuando se administró paracetamol 1 hora antes de la inyección de exenatida de liberación inmediata. Basándose en los resultados de estos estudios, no se requiere ajuste de la dosis de paracetamol.
Inhibidores de la Hidroximetilglutaril Coenzima A (HMG CoA) reductasa Cuando exenatida de liberación inmediata (10 pg dos veces al día) fue administrado concomitantemente con una dosis única de lovastatina (40 mg), los valores de AUC y Cmax de lovastatina disminuyeron aproximadamente un 40 % y 28 %, respectivamente, y el tmax se retrasó unas 4 h comparado con la administración de lovastatina sola. En los ensayos clínicos controlados con placebo de 30 semanas, el uso concomitante de exenatida de liberación inmediata y de inhibidores de la HMG CoA reductasa no se asoció a cambios consistentes en los perfiles lipídicos (ver sección 5.1). Es posible que se produzcan cambios en LDL-C o colesterol total, sin embargo, no se requiere un ajuste predeterminado de dosis. Se debe evaluar regularmente el perfil lipídico.
Etinil estradiol y levonorgestrel
La administración de una combinación de anticonceptivo oral (30 pg de etinil estradiol y 150 pg de levonorgestrel) una hora antes de exenatida de liberación inmediata (10 pg dos veces al día) no alteró el AUC ni la Cmax o la Cmin del etinil estradiol ni del levonorgestrel. La administración de un anticonceptivo oral 30 minutos después de exenatida de liberación inmediata no afectó al AUC, pero provocó una reducción de la Cmax de etinil estradiol en un 45 %, una reducción de la Cmax de levonorgestrel en un 27-41 % y un retraso en el tmax de 2-4 h debido al retraso del vaciado gástrico. La reducción en la Cmax es de limitada relevancia clínica y no se requiere ajuste de la dosis de los anticonceptivos orales.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Si una paciente se quiere quedar embarazada, o se queda embarazada, se debe suspender el tratamiento con exenatida.
Embarazo
No existen datos suficientes sobre la utilización de exenatida en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). Se desconoce el riesgo potencial en humanos. Exenatida no debe utilizarse durante el embarazo y se recomienda el uso de insulina.
Lactancia
Se desconoce si exenatida se excreta en la leche materna. Exenatida no debe ser utilizado durante la lactancia.
Fertilidad
No se han realizado estudios de fertilidad en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de exenatida sobre la capacidad para conducir y utilizar máquinas es pequeña. Cuando se utiliza exenatida en combinación con una sulfonilurea o una insulina basal, se debe advertir a los pacientes que tomen precauciones para evitar la hipoglucemia mientras conduzcan o utilicen máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes fueron principalmente gastrointestinales (náuseas, vómitos y diarrea). La reacción adversa más frecuentemente notificada de forma aislada fue náuseas, asociada con el inicio del tratamiento y que disminuyó a lo largo del tiempo. Los pacientes pueden experimentar hipoglucemia cuando se usa exenatida de liberación inmediata con una sulfonilurea. La mayoría de las reacciones adversas asociadas con exenatida de liberación inmediata fueron de intensidad leve a moderada.
Desde la comercialización de exenatida de liberación inmediata, se han notificado casos de pancreatitis aguda con un frecuencia no conocida e insuficiencia renal aguda notificada de forma poco frecuente (ver sección 4.4).
Tabla de reacciones adversas
La Tabla 1 recoge las reacciones adversas notificadas de exenatida de liberación inmediata en los ensayos clínicos y notificaciones espontáneas (no observadas en ensayos clínicos, frecuencia no conocida).
En los ensayos clínicos, los tratamientos de base incluyeron metformina, una sulfonilurea, una tiazolidindiona o una combinación de medicamentos hipoglucemiantes orales.
Las reacciones se listan a continuación con el término preferente de MedDRA, órgano o sistema y frecuencia absoluta. Se clasifican según su frecuencia en: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1: Reacciones adversas de exenatida de liberación inmediata identificadas a partir de los ensayos clínicos y notificaciones espontáneas
|
Clasificación según Órganos y Sistema /Términos de reacciones adversas |
Frecuencia | |||||
|
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Muy raras |
Frecuencia no conocida | |
|
Trastornos del sistema inmunológico | ||||||
|
Reacciones anafilácticas |
X1 | |||||
|
Trastornos del metabolismo y de la nutrición | ||||||
|
Hipoglucemia (con metformina y una sulfonilurea)2 |
X1 | |||||
|
Hipoglucemia (con una sulfonilurea) |
X1 | |||||
|
Disminución del apetito |
X1 | |||||
|
Deshidratación, generalmente asociada a náuseas, vómitos y/o diarrea |
X1 | |||||
|
Trastornos del sistema nervioso | ||||||
|
Dolor de cabeza2 |
X1 | |||||
|
Mareo |
X1 | |||||
|
Disgeusia |
X1 | |||||
|
Somnolencia |
X1 | |||||
|
Trastornos gastrointestinales | ||||||
|
Obstrucción intestinal |
X1 | |||||
|
Náuseas |
X1 | |||||
|
Vómitos |
X1 | |||||
|
Diarrea |
X1 | |||||
|
Dispepsia |
X1 | |||||
|
Dolor abdominal |
X1 | |||||
|
Enfermedad de reflujo gastroesofágico |
X1 | |||||
|
Distensión abdominal |
X1 | |||||
|
Pancreatitis aguda (ver sección 4.4) |
X3 | |||||
|
Eructo |
X1 | |||||
|
Estreñimiento |
X1 | |||||
|
Flatulencia |
X1 | |||||
|
Trastornos de la piel y del tejido subcutáneo | ||||||
|
Hiperhidrosis2 |
X1 | |||||
|
Alopecia |
X1 | |||||
|
Exantema macular y papular |
X3 | |||||
|
Prurito y/o urticaria |
X1 | |||||
|
Edema angioneurótico |
X3 | |||||
|
Trastornos renales y urinarios | ||||||
|
Alteración de la función renal, incluyendo insuficiencia renal aguda, empeoramiento de la insuficiencia renal crónica, disfunción renal, aumento de la creatinina sérica |
X1 | |||||
|
Trastornos generales y alteraciones en el lugar de administración | ||||||
|
Sensación de nerviosismo |
X1 | |||||
|
Astenia2 |
X1 | |||||
|
Reacciones en el lugar de inyección |
X1 | |||||
|
Exploraciones complementarias |
|
Pérdida de peso |
X1 | |||||
|
Aumento de la Razón Normalizada Internacional (INR) con el uso concomitante de warfarina, en algunos casos asociado con sangrado |
X3 |
1 Frecuencia basada en los estudios de eficacia y seguridad a largo plazo completados con exenatida de liberación inmediata n= 5.753 total, (pacientes tratados con sulfonilurea n= 2.971).
2 En ensayos clínicos controlados con insulina como comparador en los que metformina y sulfonilurea fueron medicamentos concomitantes, la incidencia de estas reacciones adversas fue similar para los pacientes tratados con insulina y con exenatida de liberación inmediata.
3 Datos de las notificaciones espontáneas (denominador desconocido)
Cuando se utilizó exenatida de liberación inmediata en combinación con insulina basal, la incidencia y tipos de otros efectos adversos observados fue similar a los observados en los ensayos clínicos controlados con exenatida en monoterapia, con metformina y/o sulfonilurea o una tiazolidindiona, con o sin metformina.
Descripción de las reacciones adversas seleccionadas
Hipoglucemia
En ensayos clínicos con pacientes tratados con exenatida de liberación inmediata y una sulfonilurea (con o sin metformina), la incidencia de hipoglucemia aumentó en comparación con placebo (23,5 % y 25,2 % frente a 12,6 % y 3,3 %) y pareció ser dependiente de la dosis tanto de exenatida de liberación inmediata como de la sufonilurea.
No hubo diferencias clínicamente relevantes en la incidencia o gravedad de la hipoglucemia con exenatida en comparación con placebo, en combinación con una tiazolidindiona, con o sin metformina. Se notificaron casos de hipoglucemia en el 11 % y el 7 % de los pacientes tratados con exenatida y placebo, respectivamente.
La mayoría de los episodios de hipoglucemia fueron de intensidad leve a moderada y cedieron con la administración oral de carbohidratos.
En un ensayo de 30 semanas, cuando se añadió exenatida de liberación inmediata o placebo al tratamiento de base con insulina basal (insulina glargina), la dosis de insulina basal se redujo en un 20 % en pacientes con una HbA1c < 8,0 %, siguiendo el diseño del protocolo para minimizar el riesgo de hipoglucemia. En ambas ramas del tratamiento se realizó la dosificación necesaria para alcanzar el objetivo de glucosa plasmática en ayunas (ver sección 5.1). No hubo diferencias clínicamente significativas en cuanto a la incidencia de episodios hipoglucémicos en el grupo de exenatida de liberación inmediata comparado con el de placebo (25 % y 29 % respectivamente). No hubo episodios de una hipoglucemia mayor en el brazo de exenatida de liberación inmediata.
En un ensayo de 24 semanas en el que se añadió una suspensión de insulina lispro protamina o bien insulina glargina al tratamiento existente de exenatida de liberación inmediata y metformina o metformina más tiazolidindiona, la incidencia de pacientes con al menos un episodio de hipoglucemia menor, fue del 18 % y 9 % respectivamente y un paciente notificó hipoglucemia mayor. En pacientes en los que el tratamiento existente también incluía una sulfonilurea, la incidencia de pacientes con al menos un episodio de hipoglucemia menor fue del 48 % y 54 % respectivamente y un paciente notificó una hipoglucemia mayor.
Náuseas
La reacción adversa notificada con mayor frecuencia fue la aparición de náuseas. En pacientes tratados con 5 pg o 10 pg de exenatida de liberación inmediata, el 36 % comunicó al menos un episodio de náuseas. Muchos de los episodios de náuseas fueron de leve a moderados y ocurrieron de forma dependiente de la dosis. Con el tratamiento continuado, la frecuencia y gravedad disminuyó en la mayoría de pacientes que inicialmente presentaron náuseas.
La incidencia de abandono debido a acontecimientos adversos fue del 8 % en pacientes tratados con exenatida de liberación inmediata, del 3 % en pacientes tratados con placebo y del 1 % en pacientes tratados con insulina, en ensayos clínicos controlados a largo plazo (16 semanas o más). Los acontecimientos adversos más frecuentes que llevaron al abandono en pacientes tratados con exenatida de liberación inmediata fueron náuseas (4 % de los pacientes) y vómitos (1 %). Para los pacientes tratados con placebo o con insulina, < 1 % abandonaron el tratamiento a consecuencia de náuseas o vómitos.
Los pacientes tratados con exenatida de liberación inmediata en estudios de extensión abiertos a 82 semanas, presentaron el mismo tipo de acontecimientos adversos que en los ensayos controlados.
Reacciones en el lugar de inyección
Se han notificado aproximadamente un 5,1 % de reacciones en el lugar de inyección en sujetos que recibieron exenatida de liberación inmediata en ensayos controlados a largo plazo (16 semanas o más). Estas reacciones han sido habitualmente leves y no han dado lugar a la suspensión del tratamiento con exenatida de liberación inmediata.
Inmunogenicidad
De acuerdo con las propiedades potencialmente inmunogénicas de las proteínas y medicamentos peptídicos, los pacientes pueden desarrollar anticuerpos anti-exenatida durante el tratamiento con exenatida de liberación inmediata. En la mayoría de los pacientes que desarrollaron anticuerpos, los niveles de anticuerpos disminuyeron a lo largo del tiempo y permanecieron bajos a lo largo de 82 semanas.
En conjunto, el porcentaje de pacientes que dieron positivo a anticuerpos fue uniforme en los ensayos clínicos. Los pacientes que desarrollaron anticuerpos a exenatida tendieron a padecer más reacciones en el lugar de inyección (por ejemplo: enrojecimiento de la piel y picor), pero por lo demás, tuvieron la misma incidencia y tipo de acontecimientos adversos que aquellos sin anticuerpos anti-exenatida.
En los tres ensayos controlados con placebo (n=963) el 38 % de los pacientes presentaron un título bajo de anticuerpos anti-exenatida a las 30 semanas. Para este grupo, el nivel de control glucémico (HbA1c) fue generalmente comparable al observado en aquellos que no presentaban anticuerpos. Un 6 % adicional de pacientes tenían un título de anticuerpos más elevado a las 30 semanas. Alrededor de la mitad de este 6 % (3 % del total de los pacientes a los que se les administró exenatida de liberación inmediata en los estudios controlados), no presentaron respuesta glucémica aparente a exenatida de liberación inmediata. En tres ensayos controlados con insulina como comparador (n=790), la eficacia y acontecimientos adversos observados fueron comparables en pacientes tratados con exenatida de liberación inmediata independientemente del título de anticuerpos.
El examen de las muestras con anticuerpos positivos de un estudio no controlado a largo plazo, no reveló reactividad cruzada significativa con péptidos endógenos similares (glucagón o GLP-1).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Los signos y síntomas de sobredosis pueden incluir náuseas graves, vómitos graves y un descenso rápido de las concentraciones de glucosa en sangre. En el caso de sobredosis, se debe iniciar el tratamiento de soporte apropiado (posiblemente se administrará por vía parenteral) en función de los signos y síntomas clínicos del paciente.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antidiabéticos, otros hipoglucemiantes, excluyendo insulinas, código ATC: A10BX04.
Mecanismo de acción
Exenatida es un agonista del receptor del péptido-1 similar al glucagón (GLP-1) que presenta varias acciones antihiperglucémicas del péptido-1 similar al glucagón (GLP-1). La secuencia de aminoácidos de exenatida se solapa parcialmente con la del GLP-1 humano. Se ha demostrado que exenatida se une y activa el conocido receptor de GLP-1 humano in vitro, estando su mecanismo de acción mediado por el AMP cíclico y/u otras vías de señalización intracelular.
Exenatida incrementa, de forma glucosa-dependiente, la secreción de insulina de las células beta del páncreas. A medida que la concentración de glucosa sanguínea disminuye, la secreción de insulina se normaliza. Cuando se utilizó exenatida en combinación solo con metformina, no se observó un incremento de la incidencia de hipoglucemia en comparación con placebo combinado con metformina que pudiera ser debido a este mecanismo insulinotrópico glucosa-dependiente (ver sección 4.4).
Exenatida suprime la secreción de glucagón, el cual se sabe que está anormalmente elevado en la diabetes tipo 2. Bajas concentraciones de glucagón conllevan un descenso de la producción de glucosa hepática. Sin embargo, exenatida no afecta a la respuesta normal de glucagón ni de otras hormonas a la hipoglucemia.
Exenatida enlentece el vaciado gástrico y por ello reduce la velocidad a la cual la glucosa derivada de las comidas aparece en la circulación.
Efectos farmacodinámicos
Exenatida de liberación inmediata mejora el control glucémico en pacientes con diabetes tipo 2 a través de efectos inmediatos y sostenidos de bajada tanto de las concentraciones de glucosa en ayunas como posprandiales.
Eficacia clínica y seguridad
Ensayos de exenatida de liberación inmediata con metformina, sulfonilurea o ambos como tratamiento de base
Los estudios clínicos incluyeron 3.945 sujetos (2.997 tratados con exenatida), 56 % hombres y 44 % mujeres, 319 sujetos (230 tratados con exenatida) fueron > 70 años de edad y 34 sujetos (27 tratados con exenatida) fueron > 75 años de edad.
Exenatida de liberación inmediata redujo la HbA1c y el peso corporal en pacientes tratados durante 30 semanas en tres ensayos controlados con placebo, donde exenatida de liberación inmediata se añadía a metformina, a una sulfonilurea o a una combinación de ambos. Estas reducciones en la HbA1c fueron generalmente observadas a las 12 semanas después de iniciar el tratamiento. Ver Tabla 2. La reducción de HbA1c fue mantenida y la pérdida de peso continuó durante al menos 82 semanas en el subgrupo de pacientes que utilizaban 10 pg dos veces al día que completaron tanto los ensayos controlados con placebo como las extensiones de los ensayos no controlados (n=137).
Tabla 2: Resultados combinados de ensayos controlados con placebo de 30 semanas de duración (pacientes por intención de tratar)
|
Placebo |
Exenatida de liberación inmediata 5 pg dos veces al día |
Exenatida de liberación inmediata 10 pg dos veces al día | |
|
N |
483 |
480 |
483 |
|
HbA1c al inicio (%) |
8,48 |
8,42 |
8,45 |
|
HbAJc(%) cambio desde el inicio |
0,08 |
-0,59 |
-0,89 |
|
Porcentaje de pacientes (%)que alcanzan valores de HbAlc < 7 % |
7,9 |
25,3 |
33,6 |
|
Porcentaje de pacientes (%) que alcanzan valores de HbA1c < 7 % (pacientes que completan los estudios) |
10,0 |
29,6 |
38,5 |
|
Peso basal (kg) |
99,26 |
97,10 |
98,11 |
|
Cambio de peso desde el inicio (kg) |
-0,65 |
-1,41 |
-1,91 |
En ensayos con insulina como comparador, exenatida de liberación inmediata (5 pg dos veces al día durante 4 semanas seguido de 10 pg dos veces al día) en combinación con metformina y una sulfonilurea mejoró el control glucémico de forma significativa (estadística y clínicamente), medido por el descenso en HbA1c. El efecto de este tratamiento fue comparable con el de insulina glargina en un ensayo de 26 semanas (dosis media de insulina 24,9 UI/día, rango de 4-95 UI/día al final del estudio) y con el de insulina aspártica bifásica en un ensayo de 52 semanas (dosis media de insulina 24,4 UI/día, rango 3-78 UI/día al final del estudio). Exenatida de liberación inmediata disminuyó los valores de HbA1c de 8,21 (n=228) y 8,6 % (n=222) en 1,13 y un 1,01 % mientras que la insulina glargina disminuyó los valores de 8,24 (n=227) en un 1,10 % e insulina aspártica bifásica de 8,67 (n=224) en un 0,86 %. Se logró una pérdida de peso de 2,3 kg (2,6 %) en un ensayo de 26 semanas con exenatida de liberación inmediata y una pérdida de 2,5 kg (2,7 %) en un ensayo de 52 semanas mientras el tratamiento con insulina se asoció a una ganancia de peso. Las diferencias en el tratamiento (exenatida de liberación inmediata menos comparador) fueron de -4,1 kg en el ensayo de 26 semanas y de -5,4 kg en el ensayo de 52 semanas. Tras la inyección de exenatida de liberación inmediata, los perfiles de autocontrol de los niveles de glucosa sanguínea elaborados con 7 puntos (realizados antes y después de las comidas y a las 3 de la mañana), demostraron una reducción significativa de los valores de glucosa en los períodos posprandiales, comparados con insulina. Las concentraciones preprandiales de glucosa en sangre fueron generalmente inferiores en pacientes tratados con insulina en comparación con exenatida de liberación inmediata. La media diaria de los valores de glucosa en sangre fue similar entre exenatida de liberación inmediata e insulina. En estos estudios la incidencia de hipoglucemia fue similar para exenatida de liberación inmediata y el tratamiento con insulina.
Ensayos de exenatida de liberación inmediata con metformina, tiazolidindiona o ambos como tratamiento de base
Se realizaron dos ensayos controlados con placebo: uno de 16 y otro de 26 semanas de duración, con 121 y 111 pacientes tratados con exenatida de liberación inmediata y 112 y 54 pacientes tratados con placebo respectivamente, que se añadieron al tratamiento previo con una tiazolidindiona, con o sin metformina. De los pacientes tratados con exenatida de liberación inmediata, el 12 % fueron tratados con una tiazolidindiona y exenatida de liberación inmediata y el 82 % fueron tratados con una tiazolidindiona, metformina y exenatida de liberación inmediata. Exenatida de liberación inmediata (5 pg dos veces al día durante 4 semanas seguido de 10 pg dos veces al día), produjo reducciones estadísticamente significativas de la HbA1c basal en comparación con placebo (-0,7 % frente a +0,1 %), así como reducciones significativas en el peso corporal (-1,5 frente a 0 kg) en el estudio de 16 semanas. El estudio de 26 semanas mostró resultados similares con reducciones estadísticamente significativas de la HbA1c basal en comparación con placebo (-0,8 % frente a -0,1 %). No hubo diferencias significativas entre los grupos de tratamiento en el cambio de peso corporal desde el inicio hasta el final del tratamiento (-1,4 frente a -0,8 kg).
Cuando se utilizó exenatida de liberación inmediata en combinación con una tiazolidindiona, la incidencia de hipoglucemia fue similar a la de placebo en combinación con una tiazolidindiona. La experiencia en pacientes > 65 años y en pacientes con alteración de la función renal es limitada. La incidencia y tipo de otras reacciones adversas observadas fueron similares a las observadas durante los ensayos clínicos controlados a 30 semanas con una sulfonilurea, metformina o ambos.
Ensayos de exenatida de liberación inmediata en combinación con insulina basal En un ensayo de 30 semanas, se añadió bien exenatida de liberación inmediata (5 pg dos veces al día durante 4 semanas, seguido de 10 pg dos veces al día) o placebo a la insulina glargina (con o sin metformina, pioglitazona o ambos). Durante el estudio, en ambos brazos del tratamiento se realizó la dosificación necesaria de insulina glargina, utilizando un algoritmo que refleja la práctica clínica actual para alcanzar el objetivo de glucosa plasmática en ayunas de aproximadamente 5,6 mmol/l. La media de edad de los sujetos fue de 59 años y la media de duración de diabetes fue de 12,3 años.
Al final del estudio, exenatida de liberación inmediata (n=137) demostró una reducción estadísticamente significativa en la HbA1c y en el peso comparado con placebo (n=122). Exenatida de liberación inmediata disminuyó el HbA1c un 1,7 % desde el inicio de 8,3 % mientras que placebo disminuyó el HbA1c un 1,0 % desde el inicio de 8,5 %. La proporción de pacientes que alcanzó un HbA1c < 7 % y HbA1c < 6,5 % fue de 56 % y 42 % con exenatida de liberación inmediata y 29 % y 13 % con placebo. Se observó una pérdida de peso de 1,8 kg desde el inicio de 95 kg con exenatida de liberación inmediata mientras que con placebo se observó un aumento de peso de 1,0 kg desde el inicio de 94 kg.
En el brazo de exenatida de liberación inmediata, la dosis de insulina se incrementó en 13 unidades/día comparado con 20 unidades/día en el brazo de placebo. Exenatida de liberación inmediata redujo la glucosa sérica en ayunas en 1,3 mmol/l y el placebo en 0,9 mmol/l. En el brazo de la exenatida de liberación inmediata en comparación con placebo, se obtuvieron oscilaciones de la glucemia posprandial significativamente menores en el desayuno (-2,0 frente a -0,2 mmol/l) y en la cena (-1,6 frente a + 0,1 mmol/l), no hubo diferencias entre los tratamientos a mediodía.
En un estudio de 24 semanas, donde se añadió o una suspensión de insulina lispro protamina o insulina glargina a la terapia existente de exenatida de liberación inmediata y metformina, metformina y sulfonilurea o metformina y pioglitazona, la HbA1c disminuyó un 1,2 % (n=170) y un 1,4 % (n=167) respectivamente desde el inicio de 8,2 %. Se observó un aumento de peso de 0,2 kg en los pacientes tratados con la suspensión de insulina lispro protamina y de 0,6 kg en los pacientes tratados con insulina glargina desde el inicio de 102 kg y 103 kg respectivamente.
En un estudio de no inferioridad de 30 semanas, abierto, controlado con comparador activo, se evaluó la seguridad y la eficacia de exenatida de liberación inmediata (n=315) comparada con insulina lispro titulada tres veces al día (n=312) sobre una base optimizada de insulina glargina basal y metformina en pacientes con diabetes tipo 2.
Después de una fase de optimización de insulina basal (BIO), los pacientes con HbA1c >7,0% se aleatorizaron para añadirles exenatida de liberación inmediata o insulina lispro a su régimen previo de insulina glargina y metformina. En ambos grupos de tratamiento, a los sujetos se les continuó titulando su dosis de insulina glargina utilizando un algoritmo que reflejara la práctica clínica habitual.
Todos los pacientes asignados a exenatida de liberación inmediata recibieron inicialmente 5 mcg dos veces al día durante cuatro semanas. Después de cuatro semanas, su dosis se aumentó a 10 mcg dos veces al día. Los pacientes del grupo tratado con exenatida de liberación inmediata con una HbA1c <8,0% al final de la fase de BIO disminuyeron su dosis de insulina glargina en al menos un 10%.
Exenatida de liberación inmediata redujo la HbAic en un 1,1% desde un valor basal de 8,3% y la insulina lispro redujo la HbA1c en un 1,1% desde un valor basal de 8,2% y se demostró la no inferioridad de exenatida de liberación inmediata frente a lispro titulada. La proporción de pacientes que alcanzaron una HbA1c <7% fue del 47,9% con exenatida de liberación inmediata y del 42,8% con insulina lispro. Se observó una pérdida de peso de 2,6 kg desde un valor inicial de 89,9 kg con exenatida de liberación inmediata, mientras que se observó un aumento de peso de 1,9 kg desde un valor inicial de 89,3 kg con insulina lispro.
Lípidos en ayunas
Exenatida de liberación inmediata no ha mostrado efectos adversos sobre los parámetros lipídicos. Se ha observado una tendencia a la disminución en triglicéridos con la pérdida de peso.
Función de la célula beta
Estudios clínicos con exenatida de liberación inmediata han demostrado mejoras en la función de las células beta, utilizando indicadores como el modelo de evaluación de la homeostasis para la función de la célula beta (HOMA-B) y el índice de proinsulina/insulina.
Un estudio farmacodinámico en pacientes con diabetes tipo 2 (n=13) ha demostrado un restablecimiento de la primera fase de secreción de insulina y una mejora de la segunda fase de la secreción de insulina en respuesta a un bolo intravenoso de glucosa.
Peso corporal
En los ensayos clínicos controlados a largo plazo de hasta 52 semanas se observó una reducción del peso corporal en pacientes tratados con exenatida de liberación inmediata, independientemente de la aparición de náuseas, aunque la reducción fue mayor en el grupo con náuseas (reducción media de 2,4 kg frente a 1,7 kg).
La administración de exenatida ha mostrado reducir la ingesta de comida, debido a la disminución de apetito y aumento de la saciedad.
Población _ pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de ensayos con exenatida de liberación inmediata en uno o más subgrupos de la población pediátrica con diabetes mellitus tipo 2 (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración subcutánea a pacientes con diabetes tipo 2, la mediana del pico de concentraciones plasmáticas de exenatida se alcanza en 2 h. La media del pico de concentración de exenatida (Cmax) fue de 211 pg/ml y la media global del área bajo la curva (AUC0-inf) fue de 1.036 pg •h/ml tras la administración subcutánea de una dosis de 10 pg de exenatida. La exposición a exenatida se incrementó proporcionalmente en el rango de dosis terapéutica de 5 pg a 10 pg. Se logra una exposición similar con la administración subcutánea de exenatida en el abdomen, muslo o brazo.
Distribución
El valor medio del volumen aparente de distribución de exenatida tras la administración subcutánea de una dosis única de exenatida es de 28 1.
Biotransformación y eliminación
Estudios no clínicos han mostrado que exenatida es eliminada principalmente por filtración glomerular y consiguiente degradación proteolítica. En los estudios clínicos, el aclaramiento aparente medio de exenatida en humanos es de 9 l/h y la media de la semivida terminal es de 2,4 h. Estas características farmacocinéticas de exenatida son independientes de la dosis.
Poblaciones especiales
Insuficiencia renal
En pacientes con insuficiencia renal leve (aclaramiento de creatinina de 50 a 80 ml/min), o moderada (aclaramiento de creatinina de 30 a 50 ml/min), el aclaramiento de exenatida se redujo levemente en comparación con el aclaramiento en individuos con función renal normal (13 % de reducción en la insuficiencia renal leve y un 36 % de reducción en la moderada). El aclaramiento se redujo significativamente un 84 % en pacientes con insuficiencia renal terminal en tratamiento con diálisis (ver sección 4.2).
Insuficiencia hepática
No se ha realizado ningún estudio farmacocinético en pacientes con insuficiencia hepática. Exenatida se elimina principalmente por el riñón, y por tanto, no es esperable que la disfunción hepática afecte a las concentraciones sanguíneas de exenatida.
Sexo y raza
El sexo y la raza no influyen de forma clínicamente significativa en la farmacocinética de exenatida.
Edad avanzada
Los datos controlados a largo plazo en pacientes de edad avanzada son limitados pero sugieren que no hay cambios marcados en la exposición de exenatida con el aumento de edad hasta los 75 años. En un estudio farmacocinético en pacientes con diabetes tipo 2, la administración de exenatida (10 pg) produjo un aumento medio del AUC de exenatida del 36 % en 15 sujetos de edad avanzada de edades comprendidas entre 75 y 85 años en comparación con 15 sujetos de edades comprendidas entre 45 y 65 años, probablemente relacionado con la función renal reducida en el grupo de edad más avanzada (ver sección 4.2).
Población pediátrica
En un estudio farmacocinético a dosis única en 13 pacientes con diabetes tipo 2 y con edades comprendidas entre los 12 y 16 años, la administración de exenatida (5 pg) dio como resultado una media ligeramente más baja del AUC (16 % más baja) y de la Cmax (25 % más baja) en comparación con la observada en adultos.
5.3 Datos preclínicos sobre seguridad
En los estudios no clínicos, los datos no muestran riesgos especiales para los humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas o genotoxicidad.
En ratas hembras que recibieron exenatida durante 2 años, se observó un aumento de la incidencia de adenomas benignos de células-C tiroideas a la dosis más alta, 250 pg/kg/día, una dosis que produjo una exposición de exenatida en plasma 130 veces superior a la exposición clínica en humanos. Esta incidencia no fue estadísticamente significativa cuando se ajustó para supervivencia. No hubo respuesta tumorígena en ratas machos ni en ratones de ambos sexos.
Estudios en animales no indicaron efectos dañinos directos en la fertilidad o gestación. Altas dosis de exenatida durante la mitad de la gestación causaron efectos sobre el esqueleto y redujeron el crecimiento fetal en ratones y redujeron el crecimiento fetal en conejos. El crecimiento neonatal se redujo en ratones expuestos a altas dosis durante los últimos estadios de la gestación y lactancia.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
metacresol
manitol
ácido acético glacial acetato sódico trihidrato
agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
3 años
Pluma en uso:
30 días.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
En uso
Conservar por debajo de 25° C.
La pluma no se debe guardar con la aguja puesta.
Colocar la capucha en la pluma para protegerla de la luz.
6.5 Naturaleza y contenido del envase
Cartucho de vidrio Tipo I con un émbolo de goma (bromobutilo), disco de goma y sello de aluminio. Cada cartucho está ensamblado dentro de una pluma de inyección desechable (pluma).
5 mcg: Cada pluma precargada contiene 60 dosis (aproximadamente 1,2 ml de solución).
10 mcg: Cada pluma precargada contiene 60 dosis (aproximadamente 2,4 ml de solución).
Tamaño del envase de 1 y 3 plumas. Puede que solamente estén comercializados algunos tamaños de envases.
No se incluyen las agujas para inyección.
Las agujas Becton, Dickinson and Company son adecuadas para utilizarse con la pluma de Byetta.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Se debe instruir al paciente para desechar la aguja después de cada inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Instrucciones de uso
Byetta debe ser utilizado por una sola persona.
Se deben seguir cuidadosamente las instrucciones de uso de la pluma incluidas en el prospecto.
No se debe almacenar la pluma con la aguja puesta.
Byetta no debe ser usado si aparecen partículas o si la solución es turbia y/o coloreada.
No utilice Byetta si se ha congelado.
AstraZeneca AB SE-151 85 Sódertalje Suecia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/362/001-4
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20 de noviembre de 2006 Fecha de la última renovación: 20 de noviembre de 2011
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Nombre y dirección del fabricantes responsables de la liberación de los lotes
AstraZeneca UK Limited Silk Road Business Park,
Macclesfield, Cheshire, SK10 2NA Reino Unido
Swords Laboratories T/A Lawrence Laboratories
Unit 12 Distribution Centre, Shannon Industrial Estate, Shannon, Co. Clare Irlanda
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Byetta 5 microgramos solución inyectable en pluma precargada exenatida
2. PRINCIPIO(S) ACTIVO(S)
Cada dosis contiene 5 microgramos de exenatida.
3. LISTA DE EXCIPIENTES
Manitol, ácido acético glacial, acetato sódico trihidrato, agua para preparaciones inyectables. También contiene metacresol. Ver el prospecto para más información.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable 1 pluma (60 dosis)
3 plumas (3 x 60 dosis)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Dos veces al día
Leer el prospecto y el manual del usuario de la pluma antes de utilizar este medicamento. Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Deseche la pluma 30 días después del primer uso.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera.
No congelar.
Una vez en uso: conservar por debajo de 25 °C durante 30 días. No almacenar con la aguja puesta.
Volver a tapar la pluma para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y/O DE LOS MATERIALES DE DESECHO DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca AB SE-151 85 Sodertalje Suecia
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/362/001
EU/1/06/362/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
byetta 5
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
ETIQUETA DE LA PLUMA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Byetta 5 ^g inyección
exenatida
Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
60 dosis (1,2 ml)
6. OTROS
AstraZeneca AB
1. NOMBRE DEL MEDICAMENTO
Byetta 10 microgramos solución inyectable en pluma precargada exenatida
2. PRINCIPIO(S) ACTIVO(S)
Cada dosis contiene 10 microgramos de exenatida.
3. LISTA DE EXCIPIENTES
Manitol, ácido acético glacial, acetato sódico trihidrato, agua para preparaciones inyectables. También contiene metacresol. Ver el prospecto para más información.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable 1 pluma (60 dosis)
3 plumas (3 x 60 dosis)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Dos veces al día
Leer el prospecto y el manual del usuario de la pluma antes de utilizar este medicamento. Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Deseche la pluma 30 días después del primer uso.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera.
No congelar.
Una vez en uso: conservar por debajo de 25 °C durante 30 días. No almacenar con la aguja puesta.
Volver a tapar la pluma para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y/O DE LOS MATERIALES DE DESECHO DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca AB SE-151 85 Sodertalje Suecia
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/362/003
EU/1/06/362/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
byetta 10
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
ETIQUETA DE LA PLUMA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Byetta 10 ^g inyección
exenatida
Vía subcutánea
|
2. |
FORMA DE ADMINISTRACIÓN |
|
3. |
FECHA DE CADUCIDAD |
|
CAD | |
|
4. |
NÚMERO DE LOTE |
|
Lote | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES |
60 dosis (2,4 ml)
6. OTROS
AstraZeneca AB
B. PROSPECTO
Prospecto: información para el usuario
Byetta 5 microgramos solución inyectable en pluma precargada Byetta 10 microgramos solución inyectable en pluma precargada
Exenatida
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto,ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero de diabetes.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero de diabetes, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto:
1. Qué es Byetta y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Byetta
3. Cómo usar Byetta
4. Posibles efectos adversos
5. Conservación de Byetta
6. Contenido del envase e información adicional
1. Qué es Byetta y para qué se utiliza
Byetta contiene la sustancia activa exenatida. Es un medicamento inyectable utilizado para mejorar el control de glucosa en sangre en adultos con diabetes mellitus tipo 2 (no insulino dependiente).
Byetta se utiliza con otros medicamentos para la diabetes, llamados metformina, sulfonilureas, tiazolidindionas e insulina basal o de acción prolongada. Su médico le ha prescrito Byetta como un medicamento adicional que le ayuda a controlar su azúcar en sangre. Continúe con su plan de ejercicio y alimentación.
Usted tiene diabetes porque su cuerpo no genera suficiente insulina para controlar el nivel de azúcar en su sangre o porque su cuerpo no puede utilizar la insulina adecuadamente. La medicina en Byetta ayuda a su cuerpo a incrementar la producción de insulina cuando su azúcar en sangre está alta.
2. Qué necesita saber antes de empezar a usar Byetta
No use Byetta
- Si es alérgico a exenatida o a cualquiera de los demás componentes de de este medicamento, (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero de diabetes antes de empezar a usar Byetta sobre lo
siguiente:
- Uso de este medicamento en combinación con una sulfonilurea, ya que puede tener una bajada de azúcar en sangre (hipoglucemia). Pregunte a su médico, farmacéutico o enfermero de diabetes si no está seguro si cualquiera de sus otros medicamentos contiene una sulfonilurea.
- Si usted tiene diabetes tipo 1 o cetoacidosis diabética (una situación peligrosa que puede ocurrir en la diabetes), ya que usted no debe utilizar este medicamento.
- Cómo debe de inyectarse este medicamento. Se debe inyectar debajo de la piel y no en una vena o en el músculo.
- Si usted tiene problemas graves con el vaciado lento del estómago o con la digestión de las comidas, ya el uso de este medicamento no está recomendado. El principio activo de este medicamento hace más lento el vaciado del estómago, por lo que la comida pasa más despacio a través de su estómago.
- Si alguna vez ha tenido inflamación del páncreas (pancreatitis) (ver sección 4).
- Informe a su médico si pierde peso demasiado rápido (más de 1,5 kg a la semana) ya que puede causarle problemas como cálculos biliares.
- Si presenta enfermedad del riñón grave o si está en tratamiento de diálisis, ya que el uso de este medicamento no está recomendado. Hay poca experiencia con este medicamento en pacientes con problemas de riñon.
Niños y adolescentes
No administrar este medicamento a niños y adolescentes menores de 18 años ya que no hay experiencia con este medicamento en este grupo de edad.
Uso de Byetta con otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento, particularmente:
- medicamentos utilizados para el tratamiento de la diabetes tipo II que funcionan como Byetta (p. ej.: liraglutida y exenatida de liberación prolongada), ya que no esta recomendado el uso de estos medicamentos con Byetta.
- medicamentos utilizados para diluir la sangre (anticoagulantes), p.ej. warfarina, ya que usted requerirá un control adicional de cambios en el INR (una medida de coagulación de la sangre) durante el inicio de la terapia con este medicamento.
Consulte a su médico si debe cambiar la hora de la toma de cualquier comprimido que esté utilizando, porque este medicamento hace más lento el vaciado del estómago y puede afectar a medicamentos que necesiten pasar a través del estómago rápidamente, p. ej.:
- Los comprimidos o cápsulas gastrorresistentes (p. ej. medicamentos que reducen ácidez estomacal (inhibidores de la bomba de protones)) que no deben permanecer mucho tiempo en el estómago pueden necesitar ser tomados una hora antes o cuatro horas después de la administración de este medicamento.
- Algunos antibióticos puede ser necesario tomarlos una hora antes de la inyección de Byetta.
- Para comprimidos que necesite tomar con comida, la mejor opción puede ser tomarlos en una comida donde no se administre este medicamento.
Uso de Byetta con alimentos
Use este medicamento en cualquier momento dentro de los 60 minutos (1 hora) antes de su comida. (Ver sección 3 “Cómo usar Byetta”). No use este medicamento después de la comida.
Embarazo y lactancia
Se desconoce si este medicamento puede tener efectos dañinos en el feto. Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento dado que no debe utlizarse durante el embarazo.
Se desconoce si exenatida pasa a la leche materna. Este medicamento no debe ser utilizado si está dando el pecho.
Conducción y uso de máquinas
Si usa este medicamento en combinación con una sulfonilurea o insulina, puede producirse una bajada del azúcar en sangre (hipoglucemia). La hipoglucemia puede reducir su capacidad para concentrarse.
Por favor, tenga en cuenta este posible problema en todas aquellas situaciones donde pueda ponerse en peligro a usted y a otros (p.ej. al conducir un coche o usando máquinas).
Byetta contiene metacresol.
El metacresol puede causar reacciones alérgicas.
Byetta contiene sodio.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, esencialmente “libre de sodio”.
3. Cómo usar Byetta
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico, farmacéutico o enfermero de diabetes. En caso de duda, consulte de nuevo a su médico, farmacéutico o enfermero de diabetes si tiene dudas.
Hay disponibles dos concentraciones de Byetta: Byetta 5 microgramos y Byetta 10 microgramos. Su médico le puede decir que comience el tratamiento usando Byetta 5 microgramos dos veces al día. Después de usar Byetta 5 microgramos dos veces al día durante 30 días, su médico le puede aumentar la dosis a Byetta 10 microgramos dos veces al día.
Si tiene más de 70 años o tiene problemas de riñón, puede tardar más de 30 días en tolerar la dosis de Byetta 5 microgramos por lo que puede que su médico no le aumente su dosis.
Una inyección de su pluma precargada le dará su dosis. No cambie su dosis a no ser que se lo indique su médico.
Usted se debe inyectar este medicamento en cualquier momento dentro de los 60 minutos (1 hora) antes del desayuno y cena, o antes de sus dos comidas principales del día, que deben estar separadas unas 6 horas o más. No use este medicamento después de las comidas.
Usted se debe inyectar este medicamento debajo de la piel (inyección subcutánea) en la parte superior de la pierna (muslo), zona del estómago (abdomen) o parte superior del brazo. Si usted está utilizando Byetta y una insulina, debe inyectárselas por separado.
Para establecer la dosis de Byetta, no necesita determinar diariamente sus niveles de azúcar. Sin embargo, si también está usando una sulfonilurea o una insulina su médico le puede decir que compruebe sus niveles de azúcar para ajustar la dosis de sulfonilurea o insulina.
En el Manual del Usuario de la Pluma que acompaña a este prospecto, puede ver las instrucciones de uso de la pluma de Byetta.
Su médico o enfermera le deben enseñar cómo inyectarse Byetta antes de utilizarla por primera vez.
Las agujas Becton, Dickinson and Company son adecuadas para utilizarse con la pluma de Byetta. No se incluyen las agujas para inyección.
Utilice una nueva aguja para cada inyección y deséchela después de cada uso. Este medicamento es para usted; nunca comparta la pluma de Byetta con otros.
Si usa más Byetta del que debe
Si usted hace más uso de este medicamento del que debe, consulte a su médico o vaya a un hospital inmediatamente. El uso excesivo de este medicamento puede causar náuseas, vómitos, mareos o síntomas de bajo azúcar en sangre (ver sección 4).
Si olvidó usar Byetta
Si olvida una dosis de este medicamento, salte esa dosis y administre su próxima dosis cuando se le haya prescrito. No se administre una dosis doble ni aumente la cantidad de su siguiente dosis para compensar la dosis olvidada.
Si interrumpe el tratamiento con Byetta
Si cree que debe dejar de usar este medicamento, consulte primero con su médico. Si deja de usar este medicamento, puede afectar sus niveles de azúcar en sangre.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero de diabetes.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Raramente (pueden afectar a 1 de cada 1.000 personas) se han comunicado reacciones alérgicas graves (anafilaxia).
Debe consultar con su médico inmediatamente si presenta síntomas como:
• Inflamación de la cara, lengua o garganta (angioedema)
• Erupciones, picores e inflamación rápida de los tejidos del cuello, cara, boca o garganta
• Dificultad para tragar
• Ronchas y dificultad para respirar
Casos de inflamación del páncreas (pancreatitis) se han comunicado (frecuencia no conocida) en pacientes que estaban recibiendo este medicamento. La pancreatitis puede ser una situación médica grave, y potencialmente mortal.
• Consulte con su médico si ha tenido pancreatitis, cálculos biliares, alcoholismo o triglicéridos muy altos. Estas situaciones médicas pueden aumentar la posibilidad de padecer pancreatitis, o de volver a padecerla, esté o no tomando este medicamento.
• DEJE de tomar este medicamento y contacte con su médico inmediatamente si padece dolor de estómago grave y persistente, con o sin vómitos, porque podría tener el páncreas inflamado (pancreatitis).
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
• náusea, (la náusea es el efecto adverso más frecuente al empezar el tratamiento con este medicamento, pero disminuye con el tiempo en la mayoría de los pacientes)
• vómitos
• diarrea
• hipoglucemia
Cuando se utiliza este medicamento con otro que contiene una sulfonilurea o una insulina, pueden aparecer muy frecuentemente episodios de azúcar bajo en sangre (hipoglucemia, generalmente de leve a moderada). Puede ser necesario reducir la dosis de su sulfonilurea o insulina mientras use este medicamento. Los signos y síntomas de un nivel bajo de azúcar en sangre pueden incluir dolor de cabeza, somnolencia, debilidad, mareos, confusión, irritabilidad, hambre, latidos rápidos del corazón, sudoración y sensación de nerviosismo. Su médico le debe indicar cómo tratar niveles bajos de azúcar en sangre.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas):
• mareos
• dolor de cabeza
• sensación de nerviosismo
• estreñimiento
• dolor en la zona del estómago
• hinchazón
• indigestión
• picores (con o sin erupción)
• flatulencia (gases)
• aumento de la sudoración
• pérdida de energia y fuerza
• ardor de estómago
• pérdida del apetito
Puede que este medicamento reduzca su apetito, la cantidad de comida que toma y su peso.
Informe a su médico si pierde peso demasiado rápidamente (más de 1,5 kg a la semana), ya que esto puede causarle problemas como cálculos biliares.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
• disminución de la función renal
• deshidratación, generalmente asociada con náuseas, vomitos y/o diarreas
• sabor inusual en la boca
• eructos
• reacciones en el lugar de inyección (enrojecimiento)
• somnolencia
• caída de pelo
• pérdida de peso
Efectos adversos raros (pueden afectar hasta 1 de cada 1.000 personas):
• obstrucción intestinal (bloqueo en el intestino)
Adicionalmente han sido comunicados otros efectos adversos (de frecuencia no conocida, que no pueden estimarse con los datos disponibles).
• Se han comunicado cambios en el INR (una medida de coagulación de la sangre) cuando se utiliza conjuntamente con warfarina.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero de diabetes, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Byetta
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). Una vez en uso, conserve su pluma por debajo de 25°C durante 30 días. Deseche la pluma de Byetta después de 30 días, aunque todavía quede medicamento en la pluma.
Colocar el capuchón a la pluma para protegerla de la luz. No congelar. Deseche cualquier pluma de Byetta que se haya congelado.
No utilice este medicamento si observa partículas en la solución o si ésta es turbia o coloreada.
No guarde la pluma con la aguja puesta. Si deja la aguja puesta, el medicamento puede gotear de la pluma o se pueden formar burbujas de aire en el cartucho.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Byetta
- El principio activo es exenatida.
- Hay disponibles dos plumas precargadas. Una para la administración de una dosis de 5 microgramos y otra de 10 microgramos.
- Cada dosis de la solución para inyección de Byetta 5 microgramos, contiene 5 microgramos de exenatida en 20 microlitros.
- Cada dosis de la solución para inyección de Byetta 10 microgramos, contiene 10 microgramos de exenatida en 40 microlitros.
- Cada mililitro (ml) de solución para inyección contiene 0,25 miligramos (mg) de exenatida.
- Los demás componentes son metacresol (44 microgramos/dosis en la solución para inyección de Byetta 5 microgramos y 88 microgramos/dosis en la solución para inyección de Byetta
10 microgramos), manitol, ácido acético glacial, acetato sódico trihidrato y agua para preparaciones inyectables (ver sección 2).
Aspecto del producto y contenido del envase
Byetta es un líquido transparente e incoloro (solución para inyección) que se encuentra en un cartucho de vidrio dentro de una pluma. Cuando la pluma está vacía, no la puede volver a usar. Cada pluma contiene 60 dosis para proporcionar dos inyecciones al día durante 30 días.
Byetta está disponible en envases de 1 y 3 plumas precargadas. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
AstraZeneca AB SE-151 85 Sódertalje Suecia
Responsable de la fabricación
AstraZeneca UK Limited Silk Road Business Park,
Macclesfield, Cheshire, SK10 2NA Reino Unido
Swords Laboratories T/A Lawrence Laboratories
Unit 12 Distribution Centre, Shannon Industrial Estate, Shannon, Co. Clare Irlanda
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Bt^rapna AcTpa3eHeKa B^^rapHH EOOfl Te^.: +359 24455000 |
Luxembourg/Luxemburg AstraZeneca S.A./N.V. Tél/Tel: +32 2 370 48 11 |
|
Ceská republika AstraZeneca Czech Republic s.r.o. Tel: +420 222 807 111 |
Magyarország AstraZeneca Kft. Tel.: +36 1 883 6500 |
|
Danmark AstraZeneca A/S Tlf: +45 43 66 64 62 |
Malta Associated Drug Co. Ltd Tel: +356 2277 8000 |
|
Deutschland AstraZeneca GmbH Tel: +49 41 03 7080 |
Nederland AstraZeneca BV Tel: +31 79 363 2222 |
|
Eesti AstraZeneca Tel: +372 6549 600 |
Norge AstraZeneca AS Tlf: +47 21 00 64 00 |
|
EXXáSa AstraZeneca A.E. Tr(k: +30 210 6871500 |
Osterreich AstraZeneca Osterreich GmbH Tel: +43 1 711 31 0 |
|
España AstraZeneca Farmacéutica Spain, S.A. Tel: +34 91 301 91 00 |
Polska AstraZeneca Pharma Poland Sp. z o.o. Tel.: +48 22 245 73 00 |
|
France AstraZeneca Tél: +33 1 41 29 40 00 |
Portugal AstraZeneca Produtos Farmacéuticos, Lda. Tel: +351 21 434 61 00 |
|
Hrvatska AstraZeneca d.o.o. Tel: +385 1 4628 000 |
Romania AstraZeneca Pharma SRL Tel: +40 21 317 60 41 |
|
Ireland AstraZeneca Pharmaceuticals (Ireland) Ltd Tel: +353 1609 7100 |
Slovenija AstraZeneca UK Limited Tel: +386 1 51 35 600 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika AstraZeneca AB, o.z. Tel: +421 2 5737 7777 |
|
Italia AstraZeneca S.p.A. Tel: +39 02 9801 1 |
Suomi/Finland AstraZeneca Oy Puh/Tel: +358 10 23 010 |
|
Kúnpoq A^skt©p Oap^aKswiKq AxS |
Sverige AstraZeneca AB |
Tel: +371 67377100
Latvija
SIA AstraZeneca Latvija
United Kingdom
AstraZeneca UK Ltd Tel: +44 1582 836 836
Este prospecto ha sido aprobado en:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
MANUAL DEL USUARIO DE LA PLUMA Byetta 5 microgramos solución inyectable en pluma precargada
(exenatida)

Sección 1. LO QUE NECESITA SABER DE SU PLUMA DE BYETTA
Lea completamente esta sección antes de empezar. Luego vaya a la sección 2 - comenzar a utilizar su pluma.
Lea estas instrucciones detenidamente ANTES de utilizar su pluma de Byetta. También, lea el prospecto de Byetta incluido en el envase de la pluma de Byetta.
Debe usar la pluma correctamente para obtener el mayor beneficio de Byetta. Si no sigue exactamente estas instrucciones el resultado puede ser, por ejemplo, que se administre una dosis equivocada, la rotura de la pluma o una infección.
Estas instrucciones no sustituyen el hablar con su profesional sanitario sobre su enfermedad o tratamiento. Si está teniendo problemas con la utilización de la pluma de Byetta, contacte con su profesional sanitario.
INFORMACIÓN IMPORTANTE DE SU PLUMA DE BYETTA
• Byetta se inyecta dos veces al día y la pluma contiene suficiente cantidad de medicamento para 30 días. No tiene que medir la dosis, la pluma establece cada dosis por usted.
• NO TRANSFIERA EL MEDICAMENTO DE LA PLUMA DE BYETTA A UNA JERINGA.
• No use la pluma si cualquier parte de la misma está rota o dañada.
• No comparta su pluma ni agujas ya que puede suponer un riesgo de transmisión de infecciones.
• El uso de esta pluma no está recomendado en personas invidentes o con dificultades de visión. Será necesaria la ayuda de una persona que esté entrenada para la utilización de la pluma.
• Los profesionales sanitarios u otros cuidadores deben seguir la normativa institucional o local relativa al manejo de agujas.
• Siga las instrucciones recomendadas por su profesional sanitario para una técnica de inyección higiénica.
• Siga las instrucciones incluidas de la Sección 2 únicamente para la preparación de una nueva pluma antes del primer uso.
• Para cada inyección debe seguir las instrucciones incluidas en la Sección 3 de este manual. INFORMACIÓN ACERCA DE LAS AGUJAS PARA INYECCIÓN
Su pluma de Byetta es adecuada para utilizarse con las agujas de inyección Becton, Dickinson and Company.
¿Debo usar una aguja nueva para cada inyección?
• Sí. No reutilice las agujas.
• Retire inmediatamente la aguja después de cada inyección. Esto le ayudará a prevenir pérdidas de Byetta, evitar la aparición de burbujas de aire, reducir obstrucciones de las agujas y disminuir el riesgo de infección.
• No presione el botón de inyección a menos que haya una aguja unida a la pluma.
¿Cómo desecho mis agujas?
• Deseche las agujas utilizadas en un contenedor resistente a la punción o como le haya indicado su profesional sanitario.
• No tire la pluma con la aguja puesta.
CONSERVACIÓN DE SU PLUMA DE BYETTA
¿Cómo debo conservar mi pluma de Byetta?
• Conservar en nevera (entre 2 °C y 8 °C).
• No congelar. Deseche cualquier pluma de Byetta que se haya congelado.
• Una vez en uso, su pluma de Byetta debe ser conservada por debajo de 25°C.
• Coloque el capuchón a la pluma para protegerla de la luz.
• No guarde la pluma de Byetta con la aguja puesta. Si deja la aguja puesta, pueden producirse pérdidas de medicamento de la pluma de Byetta o pueden formarse burbujas de aire en el cartucho.
Mantenga la pluma y las agujas fuera de la vista y del alcance de los niños.
¿Durante cuánto tiempo puede utilizar una pluma de Byetta?
• Utilice una pluma de Byetta solamente durante los 30 días siguientes a la preparación de una nueva pluma para su primer uso.
Después de 30 días, deseche la pluma de Byetta utilizada, aunque todavía quede medicamento en la pluma.
• Marque la fecha en la que utilizó su pluma por primera vez y la fecha 30 días posterior en el espacio que aparece a continuación:
Fecha del primer día de uso Fecha de eliminación de la pluma
• No utilice Byetta después de la fecha de caducidad que aparece en la etiqueta y en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
¿Cómo puedo limpiar mi pluma de Byetta?
• Si fuera necesario, limpie el exterior de la pluma con un paño limpio y húmedo.
• Durante el uso habitual, pueden aparecer partículas blancas en el extremo externo del cartucho. Las puede eliminar con una gasa u algodón empapado en alcohol.
Por favor, lea también el prospecto de Byetta incluido en el envase. Para información adicional, consulte con su profesional sanitario.
Sección 2. COMENZAR A UTILIZAR SU PLUMA
Lea y siga las instrucciones en esta sección una vez haya leído la sección 1-lo que necesita saber de su pluma de Byetta.
Prepare su nueva pluma justo antes de utilizarla por primera vez. Siga las instrucciones de Preparación de la Nueva Pluma solamente una vez. No repita la Preparación de la Nueva Pluma para cada uso habitual. Si lo hace, se quedará sin Byetta antes de que trascurran los 30 días de uso.

Capuchón azul de la pluma
PARTES DE LA PLUMA DE BYETTA

Cartucho
Líquido de Byetta
Etiqueta
Ventana
de
dosifi
cación
Botón
de
dosifica
ción
Botón de inyección
PARTES DE LA AGUJA
(No se incluyen agujas)


Capucha Protector Aguja
externa de interno la aguja de la
aguja
Lengüeta de papel
SIMBOLOS DE LA VENTANA DE DOSIFICACIÓN
@ Preparada para extraer el botón de dosificación
V Preparada para girar hacia la
posición de la dosis Preparada para inyectar 5 microgramos (pg)
0 Botón de dosificación dentro y preparada para reiniciar
PREPARACIÓN DE LA NUEVA PLUMA - HAGA ESTO SOLAMENTE UNA VEZ
PASO A. Compruebe la Pluma

• Lávese las manos antes de comenzar.
• Compruebe la etiqueta de la pluma para asegurarse de que es su pluma de 5 microgramos.
• Retire el capuchón azul de la pluma.

Compruebe la apariencia de Byetta en el cartucho. El líquido debe ser transparente e incoloro y sin partículas. Si no es así, no lo utilice.
Nota: Una pequeña burbuja de aire en el cartucho es normal.
PASO B. Fije la Aguja

• Retire la lengüeta de papel de la capucha externa de la aguja.
Presione la capucha extema de la aguja, que contiene la aguja, directamente sobre la pluma, luego enrosque la aguja hasta que esté fija.
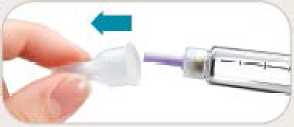
• Retire la capucha externa de la aguja. No la tire. La capucha externa de la aguja se utilizará cuando retire la aguja de la pluma después de la inyección.
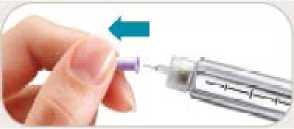
• Retire el protector interno de la aguja y tírelo. Puede aparecer una pequeña gota de líquido. Esto es normal.
PASO C. Marque la Dosis

Compruebe que LJ aparece en la ventana de dosificación. Si no es así, gire el botón
dosificación en el sentido de las agujas del reloj hasta que se pare y aparezca de dosificación.
en
de
la ventana
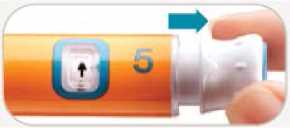

en la ventana de dosificación.
Tire del botón de dosificación hasta que se pare y aparezca

aparezca^. Asegúrese de que el dosificación.
el sentido de las agujas del reloj hasta que 5 con la línea por debajo está en el centro de
se pare y la ventana de
PASO D. Prepare la Pluma

• Coja la pluma con la aguja apuntando hacia arriba y alejada de usted.

EMPUJE Y MANTENGA
• Utilice el dedo pulgar para presionar firmemente el botón de inyección hasta que se pare, luego mantenga presionado firmemente el botón de inyección y cuente despacio hasta 5.
• Si no observa un pequeño flujo o varias gotas saliendo por la punta de la aguja, repita los Pasos C y D.

• La preparación de la Pluma ha terminado cuando aparece en el centro de la ventana de
dosificación Y haya observado un pequeño flujo o varias gotas saliendo por la punta de la aguja.
Nota: Si no observa líquido después de repetir esta operación 4 veces, ver la pregunta número 3 en el apartado Preguntas Frecuentes de la Sección 4 de este manual del usuario.
PASO E. Complete la Preparación de la Nueva Pluma

Gire el botón de dosificación en el sentido de las agujas del reloj hasta que se pare y aparezca 0 en la ventana de dosificación.
La preparación de la nueva pluma ha finalizado. No repita las instrucciones incluidas en la Sección 2 para cada uso habitual, si lo hace, se quedará sin Byetta antes de que transcurran los 30 días de uso.
Ahora está preparado para inyectar su primera dosis de Byetta.
Vaya a la Sección 3, paso 3, donde encontrará las instrucciones para inyectarse su primera dosis habitual.
Sección 3. USO HABITUAL
Ahora que ya ha Preparado la Nueva Pluma, siga las instrucciones incluidas en esta sección para todas sus inyecciones.
PASO 1. Compruebe la Pluma

• Lávese las manos antes de usarla.
• Compruebe la etiqueta de la pluma para asegurarse de que es su pluma de 5 microgramos.
• Retire el capuchón azul de la pluma.

• Compruebe la apariencia de Byetta en el cartucho.
• El líquido debe ser transparente e incoloro y libre de partículas. Si no es así, no lo utilice. Nota: Una pequeña burbuja de aire no le hará daño ni afectará a su dosis.
PASO 2. Fije la Aguja

• Retire la lengüeta de papel de la capucha externa de la aguja.
• Presione la capucha externa de la aguja, que contiene la aguja, directamente sobre la pluma. Enrosque la aguja hasta que esté fija.
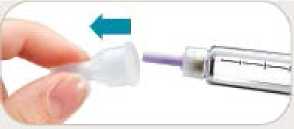
• Retire la capucha externa de la aguja. No la tire. La capucha externa de la aguja se utilizará cuando retire la aguja de la pluma después de la inyección.
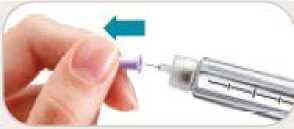
• Retire el protector intemo de la aguja y tírelo. Puede aparecer una pequeña gota de líquido. Esto es normal.
PASO 3. Marque la Dosis

0
Compruebe que
aparece en la ventana de dosificación. Si no es así, gire el botón de
dosificación en sentido de las agujas del reloj hasta que se pare y aparezca 0 en la ventana de dosificación.


en la ventana de dosificación.
Tire del botón de dosificación hasta que se pare y aparezca

Gire el botón de dosificación en sentido de las agujas del reloj hasta que se pare en
Asegúrese de que el 5 con la línea por debajo está en el centro de la ventana de dosificación.
Nota: Si no puede girar el botón de dosificación en el sentido de las agujas del reloj a L=J, ver la pregunta número 9 en el apartado Preguntas Frecuentes de la Sección 4 de este manual del usuario.
PASO 4. Inyecte la Dosis
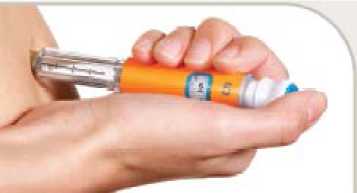
• Sujete la pluma firmemente en su mano.
• Evite pellizcarse fuertemente la piel antes de la inyección. Inserte la aguja en la piel siguiendo las instrucciones recomendadas por su profesional sanitario para una inyección higiénica.

PRESIONE Y MANTENGA
• Utilice el dedo pulgar para presionar firmemente el botón de inyección hasta que se pare, luego mantenga presionado firmemente el botón de inyección y cuente despacio hasta 5 para administrar la dosis completa.
• Mantenga presionado el botón de inyección mientras retira la aguja de la piel. Ver la pregunta 4 en Preguntas Frecuentes.

• Se ha completado la inyección cuando aparece en el centro de la ventana de dosificación.
• La pluma está ahora preparada para reiniciar.
Nota: Si se observan varias gotas de Byetta saliendo por la aguja significa que no se presionó el botón de inyección completamente. Ver la pregunta número 5 en el apartado Preguntas Frecuentes de la Sección 4 de este manual del usuario.
PASO 5. Reinicie la Pluma


Gire el botón de dosificación en el sentido de las agujas del reloj hasta que se pare y
aparezca en la ventana de dosificación.
Nota: Si no puede girar el botón de dosificación o su pluma gotea significa que no se ha inyectado su dosis completa. Ver las preguntas número 5 y 9 en el apartado Preguntas Frecuentes de la Sección 4 de este manual del usuario.
PASO 6. Retire y Deseche la Aguja
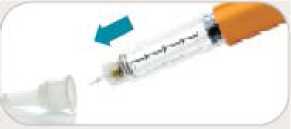
• Retire la aguja después de cada inyección.
• Vuelva a colocar con cuidado la capucha externa de la aguja.

• Desenrosque la aguja.
• Vuelva a colocar el capuchón azul de la pluma antes de guardarla.

• Deseche las agujas utilizadas en un contenedor resistente a la punción o como le haya indicado su profesional sanitario.
PASO 7. Conservación de la Pluma para la Siguiente Dosis
• Conserve la pluma de Byetta adecuadamente. (Para más información, ver Conservación de su Pluma de Byetta en la Sección 1 de este manual del usuario).
• Cuando llegue el momento de administrar su siguiente dosis habitual, repita los pasos 1 al 7 incluidos en la Sección 3.
Sección 4. PREGUNTAS FRECUENTES
1. ¿Necesito seguir las instrucciones de preparación de una nueva pluma antes de cada dosis?
• No. La preparación de la nueva pluma sólo se hace una vez, justo antes de que cada nueva pluma sea utilizada por primera vez.
• El objetivo de la preparación es asegurar que su pluma de Byetta está preparada para usarse durante los próximos 30 días.
• Si repite la Preparación de la Nueva Pluma antes de cada dosis habitual, no dispondrá de cantidad suficiente de Byetta para 30 días. La pequeña cantidad de Byetta usada en la preparación de la nueva pluma, no afectará al contenido de Byetta para los 30 días.
2. ¿Por qué hay burbujas de aire en el cartucho?
• Una pequeña burbuja de aire es normal. No le hará daño ni afectará a su dosis.
• Si almacena la pluma con la aguja puesta, se pueden formar burbujas de aire en el cartucho. No guarde la pluma con la aguja puesta.
3. ¿Qué debo hacer si Byetta no sale por la punta de la aguja tras cuatro intentos durante la
preparación de la nueva pluma?
• Vuelva a colocar cuidadosamente la capucha externa de la aguja y retire la aguja.
Desenrósquela y elimínela adecuadamente.
• Ponga una nueva aguja y repita los pasos B al E del apartado Preparación de la Nueva Pluma de la Sección 2 de este manual del usuario. Una vez que observe un pequeño flujo o varias gotas saliendo por la punta de la aguja, se ha completado la preparación.
4. ¿Por qué veo partículas en el cartucho después de terminar mi inyección?
Pueden aparecer partículas o decoloración en el cartucho después de la inyección. Esto puede ocurrir
si se ha pellizcado la piel demasiado fuerte o si se ha dejado de presionar el botón de inyección antes
de que la aguja se haya retirado de la piel.
5. ¿Por qué veo que Byetta sigue goteando desde mi aguja después de que he terminado mi inyección?
Es normal que una única gota permanezca en la punta de la aguja después de completar la inyección. Si observa más de una gota:
• Puede que no se haya inyectado la dosis completa. No se inyecte otra dosis. Consulte con su profesional sanitario qué hacer en caso de haberse inyectado una dosis incompleta.
• Para prevenir esto, en su próxima dosis, asegúrese de presionar firmemente el botón de inyección, mantenerlo presionado y contar despacio hasta 5 (ver Paso 4: Inyección de la Dosis en la Sección 3).
6. ¿Qué significan las flechas?
Las flechas significan que estás preparado para el siguiente paso. Estas flechas
dirección para tirar o girar el botón de dosificación en el siguiente paso. Este símbolo que el botón de dosificación está presionado y la pluma está preparada para reiniciar.
significa
7. ¿Cómo puedo saber cuándo ha finalizado la inyección?
La inyección se ha completado cuando:
• Haya presionado firmemente el botón de inyección hasta que se pare
y
y
Haya contado despacio hasta 5 mientras todavía mantiene apretado el botón de inyección y la aguja está todavía en su piel

aparece en el centro de la ventana de dosificación.
8. ¿Dónde debo inyectar Byetta?
Byetta debe ser inyectado en su abdomen, muslo o parte superior del brazo usando la técnica de inyección recomendada por su profesional sanitario.
De Frente De Espaldas
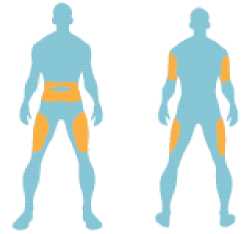
9. ¿Qué debo hacer si no puedo tirar, girar o presionar el botón de dosificación?
Compruebe qué símbolo aparece en la ventana de dosificación. Siga los pasos que se indican al lado de ese símbolo.
¡0
Si 0 aparece en la ventana de dosificación y el botón de dosificación no gira:
• El cartucho en su pluma de Byetta puede no tener suficiente líquido para suministrar una dosis completa. Siempre quedará una pequeña cantidad de Byetta en el cartucho. Si el cartucho contiene una pequeña cantidad o parece estar vacío, consiga una nueva pluma de Byetta.
agujas del reloj hasta que aparezca ID en el centro de la ventana de dosificación.
0
0
Si parte del y parte de LD aparecen en la ventana de dosificación, y no se puede presionar el botón de dosificación:
• La aguja puede estar obstruida, curvada o no está correctamente ajustada.
• Ponga una nueva aguja. Asegúrese de que la aguja esté recta y totalmente enroscada.
• Presione completamente el botón de inyección con firmeza. Byetta debería salir por la punta de
la aguja.
Si 0 aparece en la ventana de dosificación y el botón de dosificación no gira:
• No se ha presionado completamente el botón de inyección y no se ha administrado una dosis completa. Consulte con su profesional sanitario qué hacer en caso de haberse inyectado una dosis incompleta.
• Siga los siguientes pasos para reiniciar su pluma para la próxima inyección:
- Presione firmemente el botón de inyección hasta que se pare. Mantenga presionado el botón de inyección y cuente despacio hasta 5. Luego, gire el botón de dosificación en sentido de las
0,
y parte del ID aparecen en la ventana y no se puede presionar el botón de dosificación:
No se ha girado completamente el botón de dosificación. Continúe girándolo en el sentido de las
agujas del reloj hasta que aparezca LJ en la ventana de dosificación.
- Si no puede girar el botón de dosificación, la aguja puede estar obstruida. Cambie la aguja y repita el paso anterior.
En su próxima dosis, asegúrese de presionar firmemente el botón de inyección, mantenerlo presionado y contar despacio hasta 5 antes de retirar la aguja de la piel.
Por favor, lea también el prospecto incluido en el envase. Para información adicional contacte con su profesional sanitario.
MANUAL DEL USUARIO DE LA PLUMA Byetta 10 microgramos solución inyectable en pluma precargada
(exenatida)

Sección 1. LO QUE NECESITA SABER DE SU PLUMA DE BYETTA
Lea completamente esta sección antes de empezar. Luego vaya a la sección 2 - comenzar a utilizar su pluma.
Lea estas instrucciones detenidamente ANTES de utilizar su pluma de Byetta. También lea el prospecto de Byetta incluido en el envase de la pluma de Byetta.
Debe usar la pluma correctamente para obtener el mayor beneficio de Byetta. Si no sigue exactamente estas instrucciones el resultado puede ser, por ejemplo, que se administre una dosis equivocada, la rotura de la pluma o una infección.
Estas instrucciones no sustituyen el hablar con su profesional sanitario sobre su enfermedad o tratamiento. Si está teniendo problemas con la utilización de la pluma de Byetta, contacte con su profesional sanitario.
INFORMACIÓN IMPORTANTE DE SU PLUMA DE BYETTA
• Byetta se inyecta dos veces al día y la pluma contiene suficiente cantidad de medicamento para 30 días. No tiene que medir la dosis, la pluma establece cada dosis por usted.
• NO TRANSFIERA EL MEDICAMENTO DE LA PLUMA DE BYETTA A UNA JERINGA.
• No use la pluma si cualquier parte de la misma está rota o dañada.
• No comparta su pluma ni agujas ya que puede suponer un riesgo de transmisión de infecciones.
• El uso de esta pluma no está recomendado en personas invidentes o con dificultades de visión. Será necesaria la ayuda de una persona que esté entrenada para la utilización de la pluma.
• Los profesionales sanitarios u otros cuidadores deben seguir la normativa institucional o local relativa al manejo de agujas.
• Siga las instrucciones recomendadas por su profesional sanitario para una técnica de inyección higiénica.
• Siga las instrucciones incluidas de la Sección 2 únicamente para la preparación de una nueva pluma antes del primer uso.
• Para cada inyección debe seguir las instrucciones incluidas en la Sección 3 de este manual. INFORMACIÓN ACERCA DE LAS AGUJAS PARA INYECCIÓN
Su pluma de Byetta es adecuada para utilizarse con las agujas de inyección Becton, Dickinson and Company.
¿Debo usar una aguja nueva para cada inyección?
• Sí. No reutilice las agujas.
• Retire inmediatamente la aguja después de cada inyección. Esto le ayudará a prevenir pérdidas de Byetta, evitar la aparición de burbujas de aire, reducir obstrucciones de las agujas y disminuir el riesgo de infección.
• No presione el botón de inyección a menos que haya una aguja unida a la pluma.
¿Cómo desecho mis agujas?
• Deseche las agujas utilizadas en un contenedor resistente a la punción o como le haya indicado su profesional sanitario.
• No tire la pluma con la aguja puesta.
CONSERVACIÓN DE SU PLUMA DE BYETTA
¿Cómo debo conservar mi pluma de Byetta?
• Conservar en nevera (entre 2 °C y 8 °C).
• No congelar. Deseche cualquier pluma de Byetta que se haya congelado.
• Una vez en uso, su pluma de Byetta debe ser conservada por debajo de 25°C.
• Coloque el capuchón a la pluma para protegerla de la luz.
• No guarde la pluma de Byetta con la aguja puesta. Si deja la aguja puesta, pueden producirse pérdidas de medicamento de la pluma de Byetta o pueden formarse burbujas de aire en el cartucho.
Mantenga la pluma y las agujas fuera de la vista y del alcance de los niños.
¿Durante cuánto tiempo puede utilizar una pluma de Byetta?
• Utilice una pluma de Byetta solamente durante los 30 días siguientes a la preparación de una nueva pluma para su primer uso.
Después de 30 días, deseche la pluma de Byetta utilizada, aunque todavía quede medicamento en la pluma.
• Marque la fecha en la que utilizó su pluma por primera vez y la fecha 30 días posterior en el espacio que aparece a continuación:
Fecha del primer día de uso Fecha de eliminación de la pluma
• No utilice Byetta después de la fecha de caducidad que aparece en la etiqueta y en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
¿Cómo puedo limpiar mi pluma de Byetta?
• Si fuera necesario, limpie el exterior de la pluma con un paño limpio y húmedo.
• Durante el uso habitual, pueden aparecer partículas blancas en el extremo externo del cartucho. Las puede eliminar con una gasa u algodón empapado en alcohol.
Por favor, lea también el prospecto de Byetta incluido en el envase. Para información adicional, consulte con su profesional sanitario.
Sección 2. COMENZAR A UTILIZAR SU PLUMA
Lea y siga las instrucciones en esta sección una vez haya leído la sección 1-lo que necesita saber de su pluma de Byetta.
Prepare su nueva pluma justo antes de utilizarla por primera vez. Siga las instrucciones de Preparación de la Nueva Pluma solamente una vez. No repita la Preparación de la Nueva Pluma para cada uso habitual. Si lo hace, se quedará sin Byetta antes de que trascurran los 30 días de uso.

Capuchón azul de la pluma
PARTES DE LA PLUMA DE BYETTA

Cartucho
|
Líquido |
Etiquet |
Ventan |
Botón |
Botón de |
|
de Byetta |
a |
a de |
de |
inyecció |
|
dosifica |
dosifi |
n | ||
|
ción |
cació | |||
|
n |
PARTES DE LA AGUJA
(No se incluyen agujas)


Capucha Protector Aguja
externa de interno la aguja de la
aguja
Lengüeta de papel
SÍMBOLOS DE LA VENTANA DE DOSIFICACIÓN
Preparada para extraer el botón de dosificación
V Preparada para girar hacia la posición de la dosis (D Preparada para inyectar 10 microgramos (pg)
A Botón de dosificación dentro y preparada para reiniciar
PREPARACIÓN DE LA NUEVA PLUMA - HAGA ESTO SOLAMENTE UNA VEZ
PASO A. Compruebe la Pluma

• Lávese las manos antes de comenzar.
• Compruebe la etiqueta de la pluma para asegurarse de que es su pluma de 10 microgramos.
• Retire el capuchón azul de la pluma.
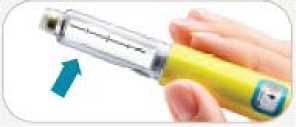
Compruebe la apariencia de Byetta en el cartucho. El líquido debe ser transparente e incoloro y sin partículas. Si no es así, no lo utilice.
Nota: Una pequeña burbuja de aire en el cartucho es normal.
PASO B. Fije la Aguja

Retire la lengüeta de papel de la capucha extema de la aguja.
Presione la capucha externa de la aguja, que contiene la aguja, directamente sobre la pluma, luego enrosque la aguja hasta que esté fija.
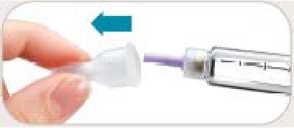
Retire la capucha externa de la aguja. No la tire. La capucha externa de la aguja se utilizará cuando retire la aguja de la pluma después de la inyección.
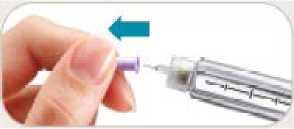
• Retire el protector interno de la aguja y tírelo. Puede aparecer una pequeña gota de líquido. Esto es normal.
PASO C. Marque la Dosis

Compruebe que LJ aparece en la ventana de dosificación. Si no es así, gire el botón de
dosificación en el sentido de las agujas del reloj hasta que se pare y aparezca de dosificación.
en la ventana


en la ventana de dosificación.
Tire del botón de dosificación hasta que se pare y aparezca

• Gire el botón de dosificación en el sentido de las agujas del reloj hasta que se pare y
aparezca®. Asegúrese de que el 10 con la línea por debajo está en el centro de la ventana de dosificación.
PASO D. Prepare la Pluma

• Coja la pluma con la aguja apuntando hacia arriba y alejada de usted.

EMPUJE Y MANTENGA
• Utilice el dedo pulgar para presionar firmemente el botón de inyección hasta que se pare, luego mantenga presionado firmemente el botón de inyección y cuente despacio hasta 5.
• Si no observa un pequeño flujo o varias gotas saliendo por la punta de la aguja, repita los Pasos C y D.

• La preparación de la Pluma ha terminado cuando aparece en el centro de la ventana de
dosificación Y haya observado un pequeño flujo o varias gotas saliendo por la punta de la aguja.
Nota: Si no observa líquido después de repetir esta operación 4 veces, ver la pregunta número 3 en el apartado Preguntas Frecuentes de la Sección 4 de este manual del usuario.
PASO E. Complete la Preparación de la Nueva Pluma

Gire el botón de dosificación en el sentido de las agujas del reloj hasta que se pare y
aparezca 0 en la ventana de dosificación.
La preparación de la nueva pluma ha finalizado. No repita las instrucciones incluidas en la Sección 2 para cada uso habitual, si lo hace, se quedará sin Byetta antes de que transcurran los 30 días de uso.
Ahora está preparado para inyectar su primera dosis de Byetta.
Vaya a la Sección 3, paso 3, donde encontrará las instrucciones para inyectarse su primera dosis habitual.
Sección 3. USO HABITUAL
Ahora que ya ha Preparado la Nueva Pluma, siga las instrucciones incluidas en esta sección para todas sus inyecciones.
PASO 1. Compruebe la Pluma

• Lávese las manos antes de usarla.
• Compruebe la etiqueta de la pluma para asegurarse de que es su pluma de 10 microgramos.
• Retire el capuchón azul de la pluma.

• Compruebe la apariencia de Byetta en el cartucho.
• El líquido debe ser transparente e incoloro y libre de partículas. Si no es así, no lo utilice. Nota: Una pequeña burbuja de aire no le hará daño ni afectará a su dosis.
PASO 2. Fije la Aguja

• Retire la lengüeta de papel de la capucha externa de la aguja.
• Presione la capucha externa de la aguja, que contiene la aguja, directamente sobre la pluma. Enrosque la aguja hasta que esté fija.
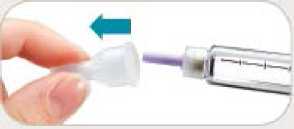
• Retire la capucha externa de la aguja. No la tire. La capucha externa de la aguja se utilizará cuando retire la aguja de la pluma después de la inyección.
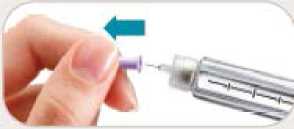
• Retire el protector intemo de la aguja y tírelo. Puede aparecer una pequeña gota de líquido. Esto es normal.
PASO 3. Marque la Dosis

Compruebe que

aparece
en la ventana de dosificación. Si no es así, gire el botón
dosificación en sentido de las agujas del reloj hasta que se pare y aparezca dosificación.

en la
de
ventana de


en la ventana de dosificación.
Tire del botón de dosificación hasta que se pare y aparezca

• Gire el botón de dosificación en sentido de las agujas del reloj hasta que se pare en®. Asegúrese de que el 10 con la línea por debajo está en el centro de la ventana de dosificación.
Nota: Si no puede girar el botón de dosificación en el sentido de las agujas del reloj a®, ver la pregunta número 9 en el apartado Preguntas Frecuentes de la Sección 4 de este manual del usuario.
PASO 4. Inyecte la Dosis
• Sujete la pluma firmemente en su mano.
• Evite pellizcarse fuertemente la piel antes de la inyección. Inserte la aguja en la piel siguiendo las instrucciones recomendadas por su profesional sanitario para una inyección higiénica.

PRESIONE Y MANTENGA
• Utilice el dedo pulgar para presionar firmemente el botón de inyección hasta que se pare, luego mantenga presionado firmemente el botón de inyección y cuente despacio hasta 5 para administrar la dosis completa.
• Mantenga presionado el botón de inyección mientras retira la aguja de la piel. Ver la pregunta 4 en Preguntas Frecuentes.
|fj| IU
• Se ha completado la inyección cuando aparece en el centro de la ventana de dosificación.
• La pluma está ahora preparada para reiniciar.
Nota: Si se observan varias gotas de Byetta saliendo por la aguja significa que no se presionó el botón de inyección completamente. Ver la pregunta número 5 en el apartado Preguntas Frecuentes de la Sección 4 de este manual del usuario.
PASO 5. Reinicie la Pluma

Gire el botón de dosificación en el sentido de las agujas del reloj hasta que
aparezca en la ventana de dosificación.

Nota: Si no puede girar el botón de dosificación o su pluma gotea significa que no se ha inyectado su dosis completa. Ver las preguntas número 5 y 9 en el apartado Preguntas Frecuentes de la Sección 4 de este manual del usuario.
PASO 6. Retire y Deseche la Aguja
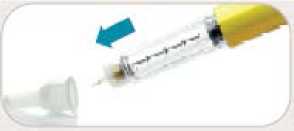
• Retire la aguja después de cada inyección.
• Vuelva a colocar con cuidado la capucha externa de la aguja.

• Desenrosque la aguja.
• Vuelva a colocar el capuchón azul de la pluma antes de guardarla.

m
E
• Deseche las agujas utilizadas en un contenedor resistente a la punción o como le haya indicado su profesional sanitario.
PASO 7. Conservación de la Pluma para la Siguiente Dosis
• Conserve la pluma de Byetta adecuadamente. (Para más información, ver Conservación de su Pluma de Byetta en la Sección 1 de este manual del usuario).
• Cuando llegue el momento de administrar su siguiente dosis habitual, repita los pasos 1 al 7 incluidos en la Sección 3.
Sección 4. PREGUNTAS FRECUENTES
1. ¿Necesito seguir las instrucciones de preparación de una nueva pluma antes de cada dosis?
• No. La preparación de la nueva pluma sólo se hace una vez, justo antes de que cada nueva pluma sea utilizada por primera vez.
• El objetivo de la preparación es asegurar que su pluma de Byetta está preparada para usarse durante los próximos 30 días.
• Si repite la Preparación de la Nueva Pluma antes de cada dosis habitual, no dispondrá de cantidad suficiente de Byetta para 30 días. La pequeña cantidad de Byetta usada en la preparación de la nueva pluma, no afectará al contenido de Byetta para los 30 días.
2. ¿Por qué hay burbujas de aire en el cartucho?
• Una pequeña burbuja de aire es normal. No le hará daño ni afectará a su dosis.
• Si almacena la pluma con la aguja puesta, se pueden formar burbujas de aire en el cartucho. No guarde la pluma con la aguja puesta.
3. ¿Qué debo hacer si Byetta no sale por la punta de la aguja tras cuatro intentos durante la preparación de la nueva pluma?
• Vuelva a colocar cuidadosamente la capucha externa de la aguja y retire la aguja. Desenrósquela y elimínela adecuadamente.
• Ponga una nueva aguja y repita los pasos B al E del apartado Preparación de la Nueva Pluma de la Sección 2 de este manual del usuario. Una vez que observe un pequeño flujo o varias gotas saliendo por la punta de la aguja, se ha completado la preparación.
4. ¿Por qué veo partículas en el cartucho después de terminar mi inyección?
Pueden aparecer partículas o decoloración en el cartucho después de la inyección. Esto puede ocurrir si se ha pellizcado la piel demasiado fuerte o si se ha dejado de presionar el botón de inyección antes de que la aguja se haya retirado de la piel.
5. ¿Por qué veo que Byetta sigue goteando desde mi aguja después de que he terminado mi inyección?
Es normal que una única gota permanezca en la punta de la aguja después de completar la inyección.
Si observa más de una gota:
• Puede que no se haya inyectado la dosis completa. No se inyecte otra dosis. Consulte con su profesional sanitario qué hacer en caso de haberse inyectado una dosis incompleta.
• Para prevenir esto, en su próxima dosis, asegúrese de presionar firmemente el botón de inyección, mantenerlo presionado y contar despacio hasta 5 (ver Paso 4: Inyección de la Dosis en la Sección 3).
6. ¿Qué significan las flechas?
Las flechas significan que estás preparado para el siguiente paso. Estas flechas
muestran la
dirección para tirar o girar el botón de dosificación en el siguiente paso. Este símbolo que el botón de dosificación está presionado y la pluma está preparada para reiniciar.
significa
7. ¿Cómo puedo saber cuándo ha finalizado la inyección?
La inyección se ha completado cuando:
• Haya presionado firmemente el botón de inyección hasta que se pare y
• Haya contado despacio hasta 5 mientras todavía mantiene apretado el botón de inyección y la aguja está todavía en su piel
y

aparece en el centro de la ventana de dosificación.
8. ¿Dónde debo inyectar Byetta?
Byetta debe ser inyectado en su abdomen, muslo o parte superior del brazo usando la técnica de inyección recomendada por su profesional sanitario.
De Frente De Espaldas
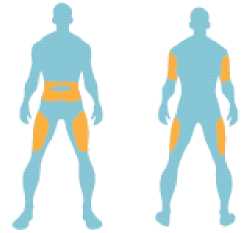
9. ¿Qué debo hacer si no puedo tirar, girar o presionar el botón de dosificación?
Compruebe qué símbolo aparece en la ventana de dosificación. Siga los pasos que se indican al lado de ese símbolo.
Si

aparece en la ventana de dosificación:
Tire del botón de dosificación hasta que aparezca

Si 0 aparece en la ventana de dosificación y el botón de dosificación no gira:
• El cartucho en su pluma de Byetta puede no tener suficiente líquido para suministrar una dosis completa. Siempre quedará una pequeña cantidad de Byetta en el cartucho. Si el cartucho contiene una pequeña cantidad o parece estar vacío, consiga una nueva pluma de Byetta.
Si
i ® y parte del ® aparecen en la ventana y no se puede presionar el botón de dosificación:
No se ha girado completamente el botón de dosificación. Continúe girándolo en el sentido de las
agujas del reloj hasta que aparezca ® en el centro de la ventana de dosificación.
Si parte del ÜS) y parte de Ld aparecen en la ventana de dosificación, y no se puede presionar el botón de dosificación:
• La aguja puede estar obstruida, curvada o no está correctamente ajustada.
• Ponga una nueva aguja. Asegúrese de que la aguja esté recta y totalmente enroscada.
• Presione completamente el botón de inyección con firmeza. Byetta debería salir por la punta de la aguja.
O aparece en la ventana de dosificación y el botón de dosificación no gira:
Si
No se ha presionado completamente el botón de inyección y no se ha administrado una dosis completa. Consulte con su profesional sanitario qué hacer en caso de haberse inyectado una dosis incompleta.
Siga los siguientes pasos para reiniciar su pluma para la próxima inyección:
- Presione firmemente el botón de inyección hasta que se pare. Mantenga presionado el botón de inyección y cuente despacio hasta 5. Luego, gire el botón de dosificación en sentido de las
agujas del reloj hasta que aparezca tí en la ventana de dosificación.
- Si no puede girar el botón de dosificación, la aguja puede estar obstruida. Cambie la aguja y repita el paso anterior.
En su próxima dosis, asegúrese de presionar firmemente el botón de inyección, mantenerlo presionado y contar despacio hasta 5 antes de retirar la aguja de la piel.
Por favor, lea también el prospecto incluido en el envase. Para información adicional contacte con su profesional sanitario.
58