Buccolam 2,5 Mg Solucion Bucal
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
BUCCOLAM 2,5 mg solución bucal BUCCOLAM 5 mg solución bucal BUCCOLAM 7,5 mg solución bucal BUCCOLAM 10 mg solución bucal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
BUCCOLAM 2,5 mg solución bucal
Cada jeringa precargada para uso oral contiene 2,5 mg de midazolam (como clorhidrato) en 0,5 ml de solución
BUCCOLAM 5 mg solución bucal
Cada jeringa precargada para uso oral contiene 5 mg de midazolam (como clorhidrato) en 1 ml de solución
BUCCOLAM 7,5 mg solución bucal
Cada jeringa precargada para uso oral contiene 7,5 mg de midazolam (como clorhidrato) en 1,5 ml de solución
BUCCOLAM 10 mg solución bucal
Cada jeringa precargada para uso oral contiene 10 mg de midazolam (como clorhidrato) en 2 ml de solución
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución bucal
Solución transparente e incolora
PH 2,9 a 3,7
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de las crisis convulsivas agudas y prolongadas en lactantes, niños y adolescentes (de 3 meses a <18 años).
BUCCOLAM debe utilizarse únicamente por padres/cuidadores cuando se haya diagnosticado epilepsia al paciente.
En lactantes de entre 3-6 meses de edad, el tratamiento se debe administrar en un hospital en el que se pueda monitorizar al paciente y que cuente con equipo de reanimación. Ver sección 4.2.
4.2 Posología y forma de administración
Posología
Las dosis normales se indican a continuación:
|
Intervalo de edad |
Dosis |
Color de la etiqueta |
|
3 a 6 meses hospital |
2,5 mg |
Amarilla |
|
>6 meses a <1 año |
2,5 mg |
Amarilla |
|
1 año a <5 años |
5 mg |
Azul |
|
5 años a <10 años |
7,5 mg |
Morada |
|
10 años a <18 años |
10 mg |
Naranja |
Los cuidadores deben administrar una sola dosis de midazolam. Si la crisis convulsiva no remite 10 minutos después de la administración de midazolam, deben solicitar ayuda médica urgente y entregar la jeringa vacía al médico para que sepa qué dosis ha recibido el paciente.
Si la crisis convulsiva recurre después de una respuesta inicial, no se debe administrar una segunda dosis o dosis repetida sin antes consultar con el médico (ver sección 5.2).
Poblaciones especiales
Insuficiencia renal
No se requiere un ajuste de la dosis, sin embargo, BUCCOLAM se debe utilizar con cautela en pacientes con insuficiencia renal crónica ya que puede retrasarse la eliminación del midazolam y prolongarse los efectos (ver sección 4.4).
Insuficiencia hepática
La insuficiencia hepática reduce el aclaramiento del midazolam con el posterior aumento de la semivida terminal. Por lo tanto, los efectos clínicos podrán ser más intensos y duraderos, por esto, se recomienda monitorizar los efectos clínicos y las constantes vitales tras la administración de midazolam en pacientes con insuficiencia hepática (ver sección 4.4).
BUCCOLAM está contraindicado en pacientes con insuficiencia hepática grave (ver sección 4.3).
Población pediátrica
No se ha establecido la seguridad y eficacia de midazolam en niños de 0 a 3 meses. No se dispone de datos.
Forma de administración
BUCCOLAM se administra por vía bucal. Se debe introducir lentamente toda la solución en el espacio entre la encía y la mejilla. Se debe evitar la inserción laringotraqueal para evitar la aspiración accidental de la solución. En caso necesario (para volúmenes mayores y/o pacientes más pequeños), se debe administrar lentamente alrededor de la mitad de la dosis en un lado de la boca y, a continuación, se administrará lentamente la otra mitad en el otro lado.
Para consultar las instrucciones detalladas sobre cómo administrar el medicamento, ver sección 6.6.
Precauciones que se deben tomar antes de manipular o administrar el medicamento
No se deben acoplar a la jeringa para uso oral agujas, cánulas intravenosas o cualquier otro dispositivo para administración parenteral.
BUCCOLAM no se debe administrar por vía intravenosa.
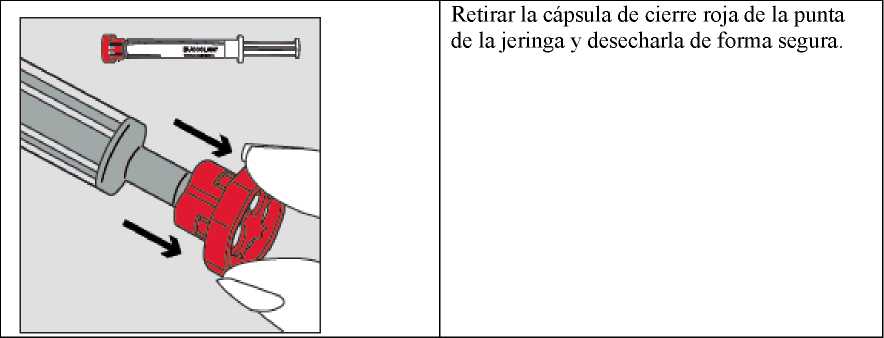
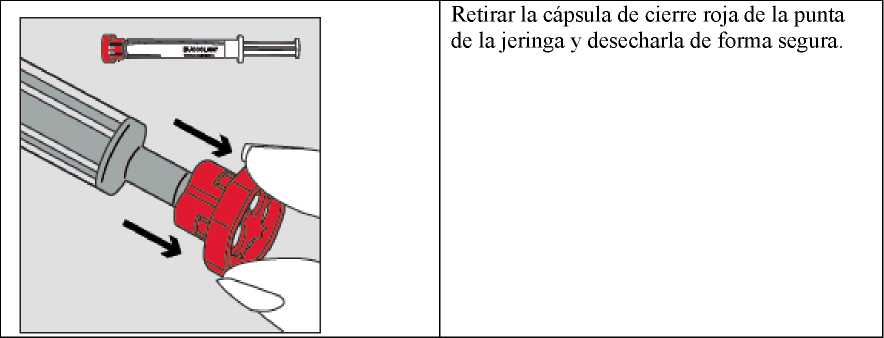
Se debe retirar la cápsula de cierre de la jeringa para uso oral antes del uso para evitar el riesgo de ahogamiento.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a las benzodiazepinas o a alguno de los excipientes incluidos en
la sección 6.1
Miastenia grave
Insuficiencia respiratoria grave
Síndrome de apnea del sueño
Insuficiencia hepática grave
4.4 Advertencias y precauciones especiales de empleo
Insuficiencia respiratoria
El midazolam se debe utilizar con precaución en pacientes con insuficiencia respiratoria crónica ya que el midazolam puede deprimir aún más la respiración.
Pacientes pediátricos de 3 a 6 meses
Dado que la proporción entre el metabolito y el medicamento original es más alta en niños más pequeños, no puede excluirse una depresión respiratoria tardía debida a las concentraciones altas del metabolito activo en el grupo de edad de 3-6 meses. Por lo tanto, el uso de BUCCOLAM en el grupo de edad de 3-6 meses se debe limitar al uso solo bajo supervisión médica cuando se cuente con un equipo de reanimación y se pueda monitorizar la función respiratoria y se cuente con soporte respiratorio por si fuera necesario.
Eliminación alterada del midazolam
El midazolam se debe utilizar con precaución en pacientes con insuficiencia renal crónica, con insuficiencia hepática o con insuficiencia cardiaca. El midazolam se puede acumular en pacientes con insuficiencia renal crónica o con insuficiencia hepática, mientras que en los pacientes con insuficiencia cardiaca puede originar una reducción del aclaramiento del midazolam.
Uso concomitante con otras benzodiazepinas
Los pacientes debilitados son más propensos a sufrir los efectos de las benzodiazepinas en el sistema nervioso central (SNC) y, por lo tanto, podrá ser necesario administrar dosis más bajas.
Antecedentes de alcoholismo o toxicomanía
El midazolam se debe evitar en pacientes con antecedentes de alcoholismo o toxicomanía.
Amnesia
El midazolam puede causar amnesia anterógrada.
4.5 Interacción con otros medicamentos y otras formas de interacción
El midazolam se metaboliza por CYP3A4. Los inhibidores e inductores de CYP3A4 pueden, respectivamente, aumentar y disminuir las concentraciones plasmáticas y, por consiguiente, los efectos del midazolam, por lo que es necesario ajustar la dosis según proceda. Las interacciones farmacocinéticas con inhibidores o inductores de CYP3A4 son más pronunciadas con la administración oral de midazolam que con la administración bucal o parenteral, ya que las enzimas de CYP3A4 también están presentes en el aparato digestivo alto. Después de la administración bucal, solo se verá afectado el aclaramiento sistémico. Tras una sola dosis de midazolam por vía bucal, la consecuencia en el efecto clínico máximo debida a la inhibición del CYP3A4 será menor, aunque la duración del efecto puede prolongarse. Por tanto, se recomienda monitorizar cuidadosamente los efectos clínicos y las constantes vitales durante el uso de midazolam con un inhibidor de CYP3A4, incluso después de una sola dosis.
Anestésicos y analgésicos narcóticos
El fentanilo puede reducir la eliminación del midazolam.
Antiepilépticos
La coadministración con midazolam puede potenciar la sedación o la depresión respiratoria o cardiovascular. El midazolam puede interactuar con otros medicamentos metabolizados por el hígado, p. ej.: la fenitoína, dando lugar a una potenciación.
Bloqueadores de los canales de calcio
Diltiazem y verapamilo han mostrado que reducen la eliminación del midazolam y de otras benzodiazepinas y pueden potenciar sus efectos.
Medicamentos para el tratamiento de las úlceras
Cimetidina, ranitidina y omeprazol han mostrado que reducen la eliminación del midazolam y de otras benzodiazepinas y pueden potenciar sus efectos.
Xantinas
Las xantinas aceleran el metabolismo del midazolam y de otras benzodiazepinas.
Dopaminérgicos
El midazolam puede inhibir la levodopa.
Relajantes musculares
P. ej.: baclofeno. El midazolam puede potenciar el efecto de los relajantes musculares, aumentando los efectos depresores en el SNC.
Nabilona
La coadministración con midazolam puede potenciar la sedación o la depresión respiratoria o cardiovascular.
Medicamentos que inhiben el CYP3A4
Las interacciones medicamentosas tras la administración bucal del midazolam probablemente serán similares a las observadas tras la administración intravenosa del midazolam en vez de las observadas tras la administración oral.
Alimentos
El zumo de pomelo reduce la eliminación del midazolam y potencia su acción.
Antifúngicos azólicos
Con el ketoconazol, las concentraciones plasmáticas del midazolam intravenoso fueron 5 veces mayores, mientras que la semivida terminal fue unas 3 veces mayor.
Con el voriconazol, la exposición al midazolam intravenoso fue 3 veces mayor, y la semivida de eliminación fue unas 3 veces mayor.
Con el fluconazol y el itraconazol, las concentraciones plasmáticas del midazolam intravenoso fueron de 2 a 3 veces mayores, lo que se asoció a un aumento en la semivida terminal de 2,4 veces con el itraconazol y de 1,5 veces con el fluconazol.
Con el posaconazol, las concentraciones plasmáticas del midazolam intravenoso fueron unas 2 veces mayores.
Antibióticos macrólidos
Con la eritromicina, las concentraciones plasmáticas del midazolam intravenoso fueron de 1,6 a 2 veces mayores, lo que se asoció a un aumento en la semivida terminal del midazolam de 1,5 a 1,8 veces.
Con la claritromicina, las concentraciones plasmáticas del midazolam intravenoso fueron hasta 2,5 veces mayores, lo que se asoció a un aumento en la semivida terminal de 1,5 a 2 veces.
Inhibidores de la proteasa para el VIH
La administración de midazolam junto con inhibidores de la proteasa (p. ej., saquinavir y otros inhibidores de la proteasa para el VIH) puede producir un gran aumento en la concentración del midazolam. Con la coadministración de lopinavir potenciado con ritonavir, las concentraciones plasmáticas del midazolam intravenoso fueron 5,4 veces mayores, lo que se asoció a un aumento similar en la semivida terminal.
Bloqueadores de los canales de calcio
Con una sola dosis de diltiazem, las concentraciones plasmáticas del midazolam intravenoso fueron aproximadamente un 25% mayores, y la semivida terminal se prolongó en un 43%.
Otros medicamentos
Con la atorvastatina, las concentraciones plasmáticas del midazolam intravenoso fueron 1,4 veces mayores, en comparación con el grupo de control.
Medicamentos que inducen CYP3A4
Rifampicina
600 mg una vez al día durante 7 días redujo las concentraciones plasmáticas del midazolam intravenoso en un 60% aproximadamente. La semivida terminal se redujo en un 50-60% aproximadamente.
Plantas medicinales
La hierba de San Juan disminuyó las concentraciones plasmáticas del midazolam alrededor del 20-40% que se asoció a una disminución en la semivida terminal del 15-17% aproximadamente. Dependiendo del extracto específico de hierba de San Juan, el efecto en la inducción de CYP3A4 puede variar.
Interacciones medicamentosas farmacodinámicas
Es probable que la coadministración de midazolam con otros sedantes/hipnóticos y depresores del SNC, incluido el alcohol, potencie la sedación y la depresión respiratoria.
Entre estos medicamentos se encuentran los derivados opiáceos (utilizados como analgésicos, antitusivos o tratamientos de sustitución), los antipsicóticos, otras benzodiazepinas utilizadas como ansiolíticos o hipnóticos, los barbitúricos, el propofol, la ketamina, el etomidato; los antidepresivos sedantes, los antihistamínicos H1 no recientes y los antihipertensores de acción central.
El alcohol (incluidos los medicamentos que contienen alcohol) puede potenciar notablemente el efecto sedante del midazolam. En caso de administrarse midazolam, se deberá evitar totalmente la ingesta de alcohol (ver sección 4.4).
El midazolam reduce la concentración alveolar mínima (CAM) de los anestésicos inhalados.
El efecto de los inhibidores de CYP3A4 puede ser mayor en lactantes ya que probablemente traguen parte de la dosis bucal y se absorba en el aparato digestivo.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de midazolam en mujeres embarazadas. Los estudios realizados en animales no sugieren un efecto teratogénico en términos de toxicidad para la reproducción; sin embargo, se ha observado fetotoxicidad en seres humanos, como con otras benzodiazepinas. No se dispone de datos sobre embarazos expuestos durante los dos primeros trimestres de embarazo.
Se ha notificado que la administración de dosis altas de midazolam en el último trimestre del embarazo o durante el parto produce reacciones adversas en la madre o en el feto (riesgo de aspiración de fluidos y contenido estomacal durante el parto en la madre, irregularidades en la frecuencia cardíaca del feto, hipotonía, mala succión, hipotermia y depresión respiratoria en el recién nacido).
Se puede utilizar midazolam durante el embarazo en casos claramente necesarios. Se debe tener en cuenta el riesgo para el recién nacido en caso de administrarse midazolam durante el tercer trimestre del embarazo.
Lactancia
El midazolam se excreta en pequeñas cantidades (0,6 %) en la leche materna. Como consecuencia, podría no ser necesario interrumpir la lactancia materna tras la administración de una sola dosis de midazolam.
Fertilidad
Los estudios en animales no mostraron efectos perjudiciales en la fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de midazolam sobre la capacidad para conducir y utilizar máquinas es importante.
La sedación, la amnesia, la alteración de la atención y la alteración de la función muscular pueden afectar de manera adversa a la capacidad para conducir, montar en bicicleta o utilizar máquinas. Antes de recibir midazolam, se debe advertir al paciente que no conduzca ni utilice máquinas hasta que se haya recuperado completamente.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Los ensayos clínicos publicados muestran que se administró midazolam por vía bucal a aproximadamente 443 niños con crisis convulsivas. La depresión respiratoria se produce en un porcentaje de hasta el 5%, aunque se trata de una complicación conocida de las crisis convulsivas y está asociada también al uso de midazolam. Se atribuyó un episodio de prurito como posiblemente relacionado con el uso de midazolam bucal.
Tabla de reacciones adversas
En la siguiente tabla se relacionan las reacciones adversas notificadas cuando se administró midazolam por vía bucal a niños en los ensayos clínicos.
Las frecuencias se definen de la siguiente forma:
Frecuentes: >1/100 a <1/10
Poco frecuentes: >1/1.000 a <1/100 Muy raras: <1/10.000
Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden decreciente de gravedad:
|
Sistema de clasificación de órganos |
Frecuencia: Reacciones adversas al medicamento |
|
Trastornos psiquiátricos |
Muy raras: Agresión**, agitación**, ira**, confusión**, euforia**, alucinaciones**, hostilidad**, trastornos del movimiento**, agresiones físicas** |
|
Trastornos del sistema nervioso |
Frecuentes: Sedación, somnolencia, disminución del nivel de conciencia Depresión respiratoria Muy raras: Amnesia anterógrada**, ataxia**, mareos**, cefalea**, crisis convulsivas**, reacciones paradójicas** |
|
Trastornos cardiacos |
Muy raras: Bradicardia**, parada cardiaca**, hipotensión**, vasodilatación** |
|
Trastornos respiratorios, torácicos y mediastínicos |
Muy raras: Apnea**, disnea**, espasmos laríngeos**, parada respiratoria** |
|
Trastornos gastrointestinales |
Frecuentes: Náuseas y vómitos Muy raras: Estreñimiento**, sequedad de boca** |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes: Prurito, exantema y urticaria |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy raras: Fatiga**, hipo** |
**Cuando se inyecta midazolam en niños y/o adultos, se han notificado estas reacciones adversas, que pueden ser relevantes a la administración bucal.
Descripción de reacciones adversas seleccionadas
Se ha descrito un aumento del riesgo de caídas y fracturas en personas de edad avanzada que utilizan benzodiazepinas.
Es más probable que ocurran incidentes potencialmente mortales entre los pacientes con insuficiencias respiratorias o insuficiencias cardiacas previas, especialmente cuando se administra una dosis alta (ver sección 4.4).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los
profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Síntomas
La sobredosis de midazolam puede suponer una amenaza para la vida si el paciente tiene una insuficiencia respiratoria o cardiaca previa, o si se combina con depresores del SNC (incluido el alcohol).
La sobredosis de benzodiazepinas habitualmente se manifiesta por grados de depresión del sistema nervioso central que oscilan desde somnolencia hasta coma. En los casos leves, los síntomas incluyen somnolencia, confusión mental y letargo, y en los casos más graves los síntomas pueden incluir ataxia, hipotonía, hipotensión, depresión respiratoria, rara vez coma y muy rara vez la muerte.
Tratamiento
En el tratamiento de la sobredosis con cualquier medicamento, se debe tener en cuenta que se han podido tomar múltiples medicamentos.
Tras la sobredosis con midazolam oral, se debe inducir el vómito (en el plazo de una hora) si el paciente está consciente, o el lavado gástrico con las vías aéreas protegidas si el paciente está inconsciente. Si no se observa mejoría al vaciar el estómago, se debe administrar carbón activado para reducir la absorción. Se debe prestar especial atención a las funciones respiratoria y cardiovascular en cuidados intensivos.
El flumazenilo puede ser un antídoto útil.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Psicolépticos, derivados de la benzodiazepina, código ATC: N05CD08. Mecanismo de acción
El midazolam es un derivado del grupo imidazobenzodiazepínico. La base libre es una sustancia lipofílica con baja solubilidad en agua. El nitrógeno básico en posición 2 del sistema del anillo de imidazobenzodiazepina permite que el midazolam forme la sal clorhídrica con ácidos. Esta produce una solución estable adecuada para la administración bucal.
Efectos farmacodinámicos
La acción farmacológica del midazolam se caracteriza por una duración corta debida a una transformación metabólica rápida. El midazolam tiene un efecto anticonvulsivante. También ejerce un efecto sedante e inductor del sueño de intensidad pronunciada, así como un efecto ansiolítico y relajante muscular.
Eficacia clínica y seguridad
En 4 estudios controlados de diazepam por vía rectal y un estudio frente a diazepam por vía intravenosa, en un total de 688 niños, se observó que los signos visibles de las crisis convulsivas cesaron en el plazo de 10 minutos en el 65 al 78% de los niños que recibieron midazolam por vía bucal. Además, en 2 de los estudios, se observó que los signos visibles de las crisis convulsivas cesaron en el plazo de 10 minutos sin que recurrieran en el plazo de 1 hora tras la administración en el 56 al 70% de los niños. La frecuencia y la gravedad de las reacciones adversas medicamentosas notificadas con midazolam por vía bucal durante los ensayos clínicos publicados fueron similares a las reacciones adversas medicamentosas del grupo comparativo con diazepam por vía rectal.
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con BUCCOLAM en el grupo de la población pediátrica < 3 meses de edad, basándose en que el medicamento en cuestión no aporta un beneficio terapéutico significativo en comparación con los tratamientos existentes para estos pacientes pediátricos.
5.2 Propiedades farmacocinéticas
En la siguiente tabla se presentan los parámetros farmacocinéticos simulados de la posología recomendada en niños de 3 meses a menos de 18 años, en base a un estudio farmacocinético de población:
|
Dosis |
Edad |
Parámetro |
Media |
DE |
|
2,5 mg |
3 m <1 año |
AUQ)_mf (ng.h/ml) |
168 |
98 |
|
Cm4x (ng/ml) |
104 |
46 | ||
|
5 mg |
1 año <5 años |
AUC0-inf (ng.h/ml) |
242 |
116 |
|
Cmáx (ng/ml) |
148 |
62 | ||
|
7,5 mg |
5 años <10 años |
AUQ)_mf (ng.h/ml) |
254 |
136 |
|
Cmáx (ng/ml) |
140 |
60 | ||
|
10 mg |
10 años <18 años |
AUC0-inf (ng.h/ml) |
189 |
96 |
|
Cmáx (ng/ml) |
87 |
44 |
Absorción
Tras la administración por vía bucal, el midazolam se absorbe rápidamente. La concentración plasmática máxima se alcanza en el plazo de 30 minutos en niños. La biodisponibilidad absoluta del midazolam por vía bucal es aproximadamente del 75% en adultos. La biodisponibilidad del midazolam bucal se ha calculado en el 87% en niños con malaria grave y convulsiones.
Distribución
El midazolam es altamente lipofílico y se distribuye de forma extensa. Se estima que el volumen de distribución en estado estacionario tras la administración por vía bucal es de 5,3 l/kg.
Aproximadamente del 96 al 98% del midazolam se une a las proteínas plasmáticas. La principal fracción de la unión a las proteínas plasmáticas se debe a la albúmina. Existe un paso lento y no significativo del midazolam hacia el líquido cefalorraquídeo. En humanos, midazolam ha mostrado que atraviesa la placenta lentamente y entra en la circulación fetal. En la leche materna se encuentran pequeñas cantidades de midazolam.
Biotransformación
El midazolam se elimina casi por completo por biotransformación. Se estima que la fracción de la dosis extraída por el hígado es del 30 al 60%. El midazolam es hidroxilado por la isoenzima del citocromo P450 3A4, y el principal metabolito encontrado en la orina y en el plasma es el alfa-hidroximidazolam. Tras la administración por vía bucal en niños, la proporción del área bajo la curva de alfa-hidroximidazolam frente a midazolam es de 0,46.
En un estudio farmacocinético de población, los niveles de metabolitos muestran ser mayores en pacientes pediátricos más jóvenes que mayores y, por lo tanto, probablemente son más importantes en niños que en adultos.
Eliminación
El aclaramiento plasmático del midazolam en niños tras la administración por vía bucal es de 30 ml/kg/min. Las semividas de eliminación inicial y terminal son de 27 y 204 minutos, respectivamente. El midazolam se excreta principalmente por la vía renal (del 60 al 80% de la dosis inyectada) y se recupera como alfa-hidroximidazolam glucuroconjugado. Menos del 1% de la dosis se recupera en la orina como medicamento inalterado.
Farmacocinética en poblaciones especiales
Obesidad
La semivida media es superior en pacientes obesos (5,9 horas) que en los no obesos (2,3 horas). Esto se debe a un aumento de aproximadamente el 50% en el volumen de distribución corregido del peso corporal total. El aclaramiento no varía significativamente entre los pacientes obesos y los no obesos.
Insuficiencia hepática
La semivida de eliminación en pacientes cirróticos puede ser mayor y el aclaramiento menor en comparación con voluntarios sanos (ver sección 4.4).
Insuficiencia renal
La semivida de eliminación en pacientes con insuficiencia renal crónica es similar a la de los voluntarios sanos.
La semivida de eliminación del midazolam se prolonga hasta seis veces más en los pacientes en estado crítico.
Insuficiencia cardiaca
La semivida de eliminación es mayor en pacientes con insuficiencia cardiaca congestiva en comparación con los sujetos sanos (ver sección 4.4).
Exposición tras una segunda dosis durante el mismo episodio de crisis convulsiva
Los datos simulados de exposición muestran que el AUC total se duplica aproximadamente cuando se
administra una segunda dosis a los 10, 30 y 60 minutos de la primera dosis. Una segunda dosis a los
10 minutos produce un aumento significativo de 1,7 a 1,9 veces aproximadamente en la Cmáx media. A
los 30 y 60 minutos, el midazolam ya se ha eliminado significativamente y, por lo tanto, el aumento en
la Cmáx media es menos pronunciado; de 1,3 a 1,6 y de 1,2 a 1,5 veces respectivamente (ver sección
4.2).
5.3 Datos preclínicos sobre seguridad
En un estudio de fertilidad en ratas, los animales recibieron dosis de hasta 10 veces la dosis clínica y no se observaron efectos adversos en la fertilidad.
No hay otros datos preclínicos relevantes para el médico prescriptor más allá de los ya incluidos en otras secciones de la ficha técnica o resumen de las características del producto.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de sodio Agua para inyectables
Ácido clorhídrico (para ajustar el pH y convertir el midazolam en la sal clorhídrica) Hidróxido de sodio (para ajustar el pH)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
18 meses
6.4 Precauciones especiales de conservación
Mantener la jeringa para uso oral en el tubo de plástico protector.
No refrigerar o congelar.
6.5 Naturaleza y contenido del envase
Jeringa precargada para uso oral (polipropileno) sin aguja, de color ámbar con émbolo (polipropileno) y cápsula de cierre (polietileno de alta densidad) envasada en un tubo de plástico protector con tapón.
|
Concentración |
Volumen de solución |
Volumen de la jeringa |
Intervalo de edad |
Color de la etiqueta |
|
2,5 mg |
0,5 ml |
1 ml |
3 meses a <1 año |
Amarilla |
|
5 mg |
1 ml |
3 ml |
1 año a <5 años |
Azul |
|
7,5 mg |
1,5 ml |
3 ml |
5 años a <10 años |
Morada |
|
10 mg |
2 ml |
3 ml |
10 años a <18 años |
Naranja |
BUCCOLAM se presenta en cajas de 4 jeringas precargadas.
6.6 Precauciones especiales de eliminación y otras manipulaciones Administración de BUCCOLAM
BUCCOLAM no se debe administrar por vía intravenosa. Paso 1
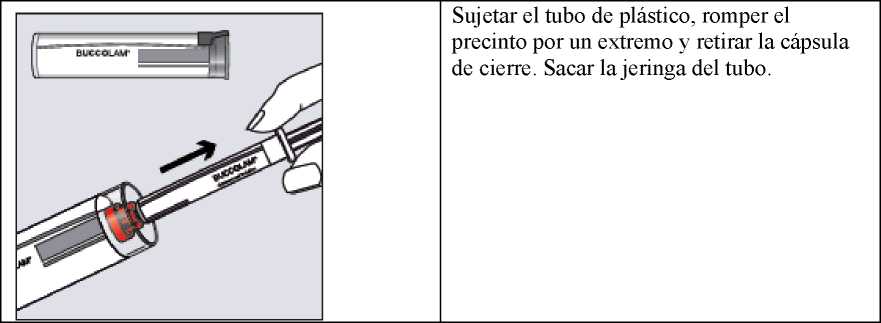
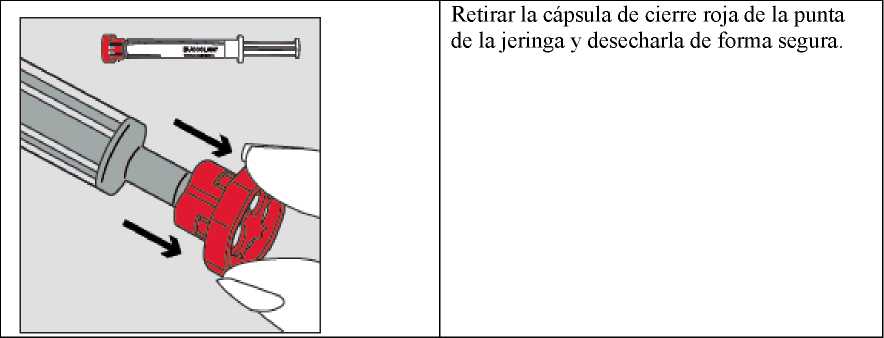
Paso 3
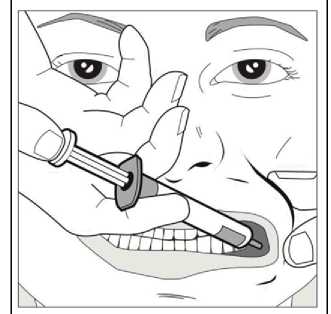
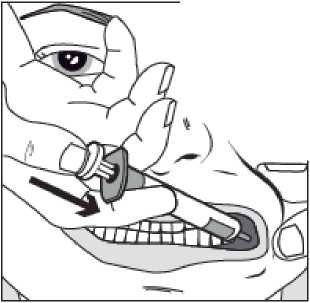
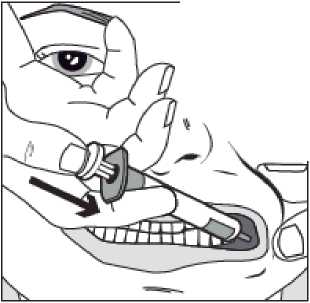
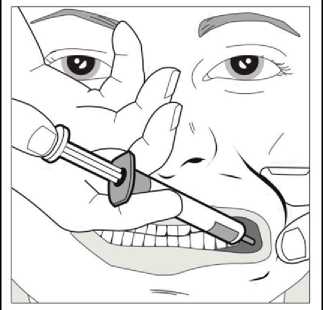
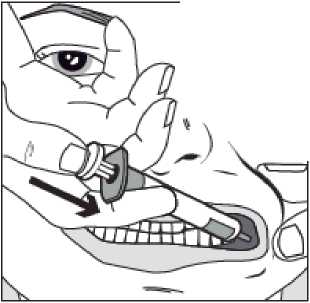
Con ayuda del dedo índice y el pulgar, pellizcar y tirar suavemente hacia atrás de la mejilla del niño. Colocar la punta de la jeringa en la parte posterior del espacio entre el interior de la mejilla y la encía inferior.
Paso 4
/
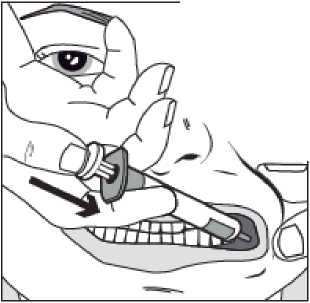
Presionar lentamente el émbolo de la jeringa hasta que se detenga.
Se debe introducir lentamente toda la solución en el espacio entre la encía y la mejilla (cavidad bucal).
En caso necesario (para volúmenes mayores y/o pacientes más pequeños), se debe administrar lentamente alrededor de la mitad de la dosis en un lado de la boca y, a continuación, se administrará lentamente la otra mitad en el otro lado.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Shire Services BVBA rue Montoyer 47 1000 Bruselas Bélgica
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
BUCCOLAM 2,5 mg solución bucal
EU/1/11/709/001
BUCCOLAM 5 mg solución bucal EU/1/11/709/002
BUCCOLAM 7,5 mg solución bucal EU/1/11/709/003
BUCCOLAM 10 mg solución bucal EU/1/11/709/004
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 05/septiembre/2011 Fecha de la última renovación:
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Shire Services BVBA rue Montoyer 47 1000 Bruselas Bélgica
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Concentración de 2,5 mg:
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
Concentraciones de 5 mg, 7,5 mg y 10 mg:
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo
acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de
Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
- A petición de la Agencia Europea de Medicamentos.
- Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
BUCCOLAM 2,5 mg solución bucal midazolam
Para niños de 3 meses a menores de 1 año
Cada jeringa precargada para uso oral (0,5 ml) contiene 2,5 mg de midazolam (como clorhidrato)
Solución bucal
4 jeringas precargadas para uso oral
Leer el prospecto antes de utilizar este medicamento.
Solo por vía bucal.
Cada jeringa es de un solo uso.
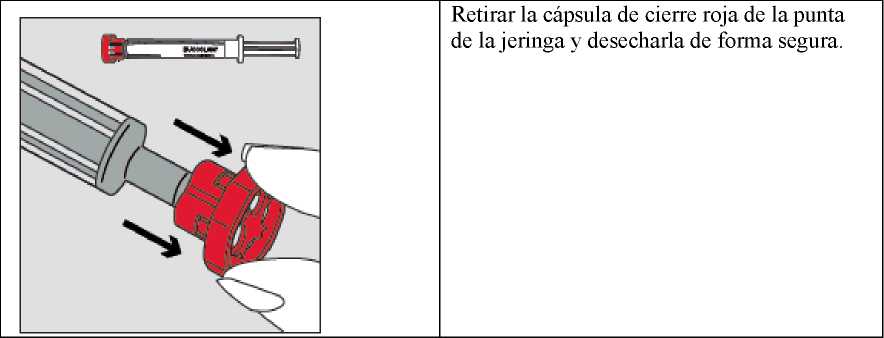
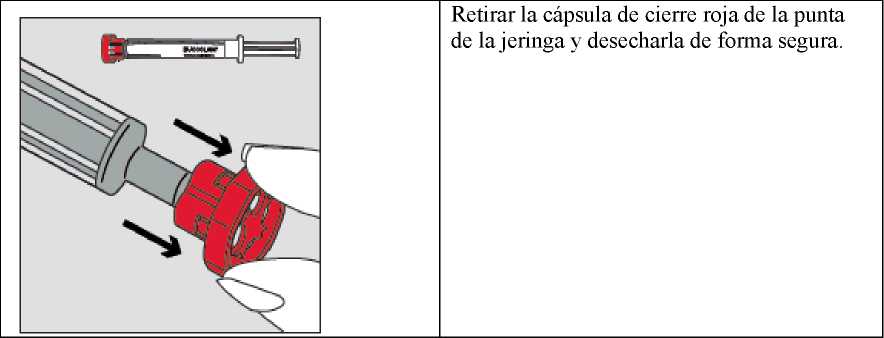
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso para evitar el riesgo de ahogamiento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No refrigerar o congelar.
Mantener la jeringa para uso oral en el tubo de plástico protector.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Shire Services BVBA rue Montoyer 47 1000 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/709/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
BUCCOLAM 2,5 mg
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS Etiqueta del tubo de plástico 2,5 mg/0,5 ml_
1. NOMBRE DEL MEDICAMENTO
BUCCOLAM 2,5 mg solución bucal midazolam
Para niños de 3 meses a menores de 1 año
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Logotipo de Shire
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
Solo por vía bucal
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso Mantener la jeringa para uso oral en el tubo de plástico protector
^ “abrir aquí”
Cómo administrar este medicamento
BUCCOLAM no debe inyectarse. No se debe colocar ninguna aguja en la jeringa. Una jeringa contiene una dosis completa. No administrar más de una dosis.
Paso 1
Paso 3
Con ayuda del dedo índice y el pulgar, pellizcar y tirar suavemente hacia atrás de la mejilla del niño. Colocar la punta de la jeringa en la parte posterior del espacio entre el interior de la mejilla y la encía inferior.
Paso 4
/
Presionar lentamente el émbolo de la jeringa hasta que se detenga.
Se debe introducir lentamente toda la solución en el espacio entre la encía y la mejilla (cavidad bucal).
Si lo prescribe su médico (para volúmenes mayores y/o pacientes más pequeños), se puede administrar lentamente alrededor de la mitad de la dosis en un lado de la boca y, a continuación, la otra mitad en el otro lado de la boca del niño.
Cuándo llamar a una ambulancia
Siga SIEMPRE las recomendaciones de tratamiento proporcionadas por el médico del paciente o tal como le indicó el profesional sanitario. En caso de duda, solicite ayuda médica urgente si:
• La crisis convulsiva no remite en un plazo de 10 minutos.
• Es incapaz de vaciar el contenido de la jeringa o derrama algo del mismo.
• La respiración del niño se ralentiza o detiene (p. ej.: respiración lenta o superficial o
labios azules).
• Observa signos de infarto de miocardio que pueden incluir dolor torácico o dolor que irradia al cuello y hombros y se extiende hasta el brazo izquierdo.
• El niño vomita y la crisis convulsiva no remite en un plazo de 10 minutos.
• Le administra demasiado BUCCOLAM y observa signos de sobredosis que incluyen:
o Somnolencia, cansancio, fatiga
o Confusión o desorientación
o Ausencia de reflejo en la rodilla o de respuesta a un pellizco o Dificultades respiratorias (respiración lenta o superficial)
o Tensión arterial baja (vértigo y sensación de desmayo)
o Coma
Conserve la jeringa para mostrársela al personal sanitario de la ambulancia o al médico.
No administre más cantidad de medicamento de la prescrita por el médico para el paciente.
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Jeringa de plástico para uso oral 2,5 mg/0,5 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
BUCCOLAM 2,5 mg solución bucal midazolam
Para niños de 3 meses a menores de 1 año Solo por vía bucal
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
2,5 mg
6. OTROS
Un solo uso.
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso.
BUCCOLAM 5 mg solución bucal midazolam
Para niños de 1 año a menores de 5 años
Cada jeringa precargada para uso oral (1 ml) contiene 5 mg de midazolam (como clorhidrato)
Solución bucal
4 jeringas precargadas para uso oral
Leer el prospecto antes de utilizar este medicamento.
Solo por vía bucal.
Cada jeringa es de un solo uso.
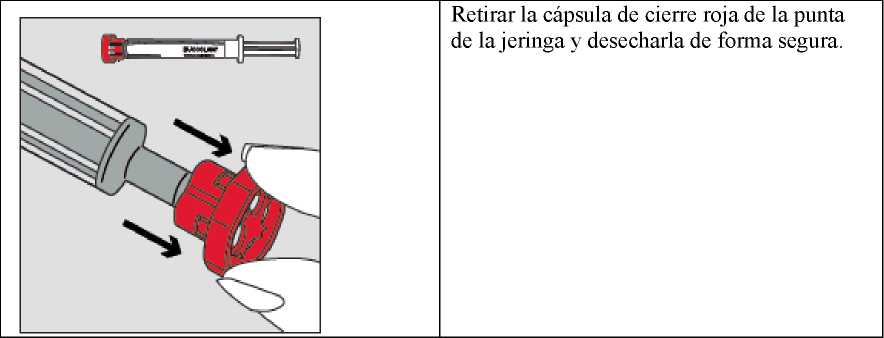
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso para evitar el riesgo de ahogamiento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No refrigerar o congelar.
Mantener la jeringa para uso oral en el tubo de plástico protector.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Shire Services BVBA rue Montoyer 47 1000 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/709/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
BUCCOLAM 5 mg
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS Etiqueta del tubo de plástico 5 mg/1 ml_
1. NOMBRE DEL MEDICAMENTO
BUCCOLAM 5 mg solución bucal midazolam
Para niños de 1 año a menores de 5 años
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Logotipo de Shire
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
Solo por vía bucal
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso Mantener la jeringa para uso oral en el tubo de plástico protector
‘abrir aquí”
Cómo administrar este medicamento
BUCCOLAM no debe inyectarse. No se debe colocar ninguna aguja en la jeringa. Una jeringa contiene una dosis completa. No administrar más de una dosis.
Paso 1
Paso 3
Con ayuda del dedo índice y el pulgar, pellizcar y tirar suavemente hacia atrás de la mejilla del niño. Colocar la punta de la jeringa en la parte posterior del espacio entre el interior de la mejilla y la encía inferior.
Paso 4
/
Presionar lentamente el émbolo de la jeringa hasta que se detenga.
Se debe introducir lentamente toda la solución en el espacio entre la encía y la mejilla (cavidad bucal).
Si lo prescribe su médico (para volúmenes mayores y/o pacientes más pequeños), se puede administrar lentamente alrededor de la mitad de la dosis en un lado de la boca y, a continuación, la otra mitad en el otro lado de la boca del niño.
Cuándo llamar a una ambulancia
Siga SIEMPRE las recomendaciones de tratamiento proporcionadas por el médico del paciente o tal como le indicó el profesional sanitario. En caso de duda, solicite ayuda médica urgente si:
• La crisis convulsiva no remite en un plazo de 10 minutos.
• Es incapaz de vaciar el contenido de la jeringa o derrama algo del mismo.
• La respiración del niño se ralentiza o detiene (p. ej.: respiración lenta o superficial o labios azules).
• Observa signos de infarto de miocardio que pueden incluir dolor torácico o dolor que irradia al cuello y hombros y se extiende hasta el brazo izquierdo.
• El niño vomita y la crisis convulsiva no remite en un plazo de 10 minutos.
• Le administra demasiado BUCCOLAM y observa signos de sobredosis que incluyen:
o Somnolencia, cansancio, fatiga
o Confusión o desorientación
o Ausencia de reflejo en la rodilla o de respuesta a un pellizco o Dificultades respiratorias (respiración lenta o superficial)
o Tensión arterial baja (vértigo y sensación de desmayo)
o Coma
Conserve la jeringa para mostrársela al personal sanitario de la ambulancia o al médico.
No administre más cantidad de medicamento de la prescrita por el médico para el paciente.
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Jeringa de plástico para uso oral 5 mg/1 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
BUCCOLAM 5 mg solución bucal midazolam
Para niños de 1 año a menores de 5 años Solo por vía bucal
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 mg
6. OTROS
Un solo uso.
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso.
BUCCOLAM 7,5 mg solución bucal midazolam
Para niños de 5 años a menores de 10 años
Cada jeringa precargada para uso oral (1,5 ml) contiene 7,5 mg de midazolam (como clorhidrato)
Solución bucal
4 jeringas precargadas para uso oral
Leer el prospecto antes de utilizar este medicamento.
Solo por vía bucal.
Cada jeringa es de un solo uso.
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso para evitar el riesgo de ahogamiento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No refrigerar o congelar.
Mantener la jeringa para uso oral en el tubo de plástico protector.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Shire Services BVBA rue Montoyer 47 1000 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/709/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
BUCCOLAM 7,5 mg
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS Etiqueta del tubo de plástico 7,5 mg/1,5 ml_
1. NOMBRE DEL MEDICAMENTO
BUCCOLAM 7,5 mg solución bucal midazolam
Para niños de 5 años a menores de 10 años
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Logotipo de Shire
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
Solo por vía bucal
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso Mantener la jeringa para uso oral en el tubo de plástico protector
^ “abrir aquí”
Cómo administrar este medicamento
BUCCOLAM no debe inyectarse. No se debe colocar ninguna aguja en la jeringa. Una jeringa contiene una dosis completa. No administrar más de una dosis.
Paso 1
Paso 3
Con ayuda del dedo índice y el pulgar, pellizcar y tirar suavemente hacia atrás de la mejilla del niño. Colocar la punta de la jeringa en la parte posterior del espacio entre el interior de la mejilla y la encía inferior.
Paso 4
/
Presionar lentamente el émbolo de la jeringa hasta que se detenga.
Se debe introducir lentamente toda la solución en el espacio entre la encía y la mejilla (cavidad bucal).
Si lo prescribe su médico (para volúmenes mayores y/o pacientes más pequeños), se puede administrar lentamente alrededor de la mitad de la dosis en un lado de la boca y, a continuación, la otra mitad en el otro lado de la boca del niño.
Cuándo llamar a una ambulancia
Siga SIEMPRE las recomendaciones de tratamiento proporcionadas por el médico del paciente o tal como le indicó el profesional sanitario. En caso de duda, solicite ayuda médica urgente si:
• La crisis convulsiva no remite en un plazo de 10 minutos.
• Es incapaz de vaciar el contenido de la jeringa o derrama algo del mismo.
• La respiración del niño se ralentiza o detiene (p. ej.: respiración lenta o superficial o labios azules).
• Observa signos de infarto de miocardio que pueden incluir dolor torácico o dolor que irradia al cuello y hombros y se extiende hasta el brazo izquierdo.
• El niño vomita y la crisis convulsiva no remite en un plazo de 10 minutos.
• Le administra demasiado BUCCOLAM y observa signos de sobredosis que incluyen:
o Somnolencia, cansancio, fatiga
o Confusión o desorientación
o Ausencia de reflejo en la rodilla o de respuesta a un pellizco o Dificultades respiratorias (respiración lenta o superficial)
o Tensión arterial baja (vértigo y sensación de desmayo)
o Coma
Conserve la jeringa para mostrársela al personal sanitario de la ambulancia o al médico.
No administre más cantidad de medicamento de la prescrita por el médico para el paciente.
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Jeringa de plástico para uso oral 7,5 mg/1,5 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
BUCCOLAM 7,5 mg solución bucal midazolam
Para niños de 5 años a menores de 10 años Solo por vía bucal
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
7,5 mg
6. OTROS
Un solo uso
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso.
BUCCOLAM 10 mg solución bucal midazolam
Para niños de 10 años a menores de 18 años
Cada jeringa precargada para uso oral (2 ml) contiene 10 mg de midazolam (como clorhidrato)
Solución bucal
4 jeringas precargadas para uso oral
Leer el prospecto antes de utilizar este medicamento.
Solo por vía bucal.
Cada jeringa es de un solo uso.
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso para evitar el riesgo de ahogamiento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
No refrigerar o congelar.
Mantener la jeringa para uso oral en el tubo de plástico protector.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Shire Services BVBA rue Montoyer 47 1000 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/709/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
BUCCOLAM 10 mg
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS Etiqueta del tubo de plástico 10 mg/2 ml_
1. NOMBRE DEL MEDICAMENTO
BUCCOLAM 10 mg solución bucal midazolam
Para niños de 10 años a menores de 18 años
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Logotipo de Shire
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
Solo por vía bucal
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso Mantener la jeringa para uso oral en el tubo de plástico protector
\ “abrir aquí”
Cómo administrar este medicamento
BUCCOLAM no debe inyectarse. No se debe colocar ninguna aguja en la jeringa. Una jeringa contiene una dosis completa. No administrar más de una dosis.
Paso 1
Paso 3
Con ayuda del dedo índice y el pulgar, pellizcar y tirar suavemente hacia atrás de la mejilla del niño. Colocar la punta de la jeringa en la parte posterior del espacio entre el interior de la mejilla y la encía inferior.
Paso 4
/
Presionar lentamente el émbolo de la jeringa hasta que se detenga.
Se debe introducir lentamente toda la solución en el espacio entre la encía y la mejilla (cavidad bucal).
Si lo prescribe su médico (para volúmenes mayores y/o pacientes más pequeños), se puede administrar lentamente alrededor de la mitad de la dosis en un lado de la boca y, a continuación, la otra mitad en el otro lado de la boca del niño.
Cuándo llamar a una ambulancia
Siga SIEMPRE las recomendaciones de tratamiento proporcionadas por el médico del paciente o tal como le indicó el profesional sanitario. En caso de duda, solicite ayuda médica urgente si:
• La crisis convulsiva no remite en un plazo de 10 minutos.
• Es incapaz de vaciar el contenido de la jeringa o derrama algo del mismo.
• La respiración del niño se ralentiza o detiene (p. ej.: respiración lenta o superficial o labios azules).
• Observa signos de infarto de miocardio que pueden incluir dolor torácico o dolor que irradia al cuello y hombros y se extiende hasta el brazo izquierdo.
• El niño vomita y la crisis convulsiva no remite en un plazo de 10 minutos.
• Le administra demasiado BUCCOLAM y observa signos de sobredosis que incluyen:
o Somnolencia, cansancio, fatiga
o Confusión o desorientación
o Ausencia de reflejo en la rodilla o de respuesta a un pellizco o Dificultades respiratorias (respiración lenta o superficial)
o Tensión arterial baja (vértigo y sensación de desmayo)
o Coma
Conserve la jeringa para mostrársela al personal sanitario de la ambulancia o al médico.
No administre más cantidad de medicamento de la prescrita por el médico para el paciente.
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Jeringa de plástico para uso oral 10 mg/2 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
BUCCOLAM 10 mg solución bucal midazolam
Para niños de 10 años a menores de 18 años Solo por vía bucal
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
10 mg
6. OTROS
Un solo uso.
Retirar la cápsula de cierre de la jeringa para uso oral antes del uso.
B. PROSPECTO
Prospecto: información para el usuario
BUCCOLAM 2,5 mg solución bucal Para niños de 3 meses a menores de 1 año
BUCCOLAM 5 mg solución bucal Para niños de 1 año a menores de 5 años
BUCCOLAM 7.5 mg solución bucal Para niños de 5 años a menores de 10 años
BUCCOLAM 10 mg solución bucal Para niños de 10 años a menores de 18 años
Midazolam
Lea todo el prospecto detenidamente antes de empezar a administrar este medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado a su hijo, y no debe dárselo a otras personas aunque tengan los mismos síntomas que los del niño al que se le ha recetado este medicamento, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es BUCCOLAM y para qué se utiliza
2. Qué necesita saber antes de empezar a administrar BUCCOLAM
3. Cómo administrar BUCCOLAM
4. Posibles efectos adversos
5. Conservación de BUCCOLAM
6. Contenido del envase e información adicional
1. Qué es BUCCOLAM y para qué se utiliza
BUCCOLAM contiene un medicamento llamado midazolam. El midazolam pertenece a un grupo de medicamentos conocidos como benzodiazepinas. BUCCOLAM se utiliza para detener una crisis convulsiva prolongada súbita en lactantes, niños y adolescentes (de 3 meses a menores de 18 años).
En lactantes de 3 meses a menores de 6 meses, el tratamiento se debe administrar únicamente en un hospital en el que se pueda monitorizar al paciente y que cuente con equipo de reanimación.
Este medicamento debe ser utilizado únicamente por padres/cuidadores cuando se haya diagnosticado epilepsia al niño.
2. Qué necesita saber antes de empezar a administrar BUCCOLAM
No administre BUCCOLAM si el paciente:
• tiene alergia al midazolam, a las benzodiazepinas (como el diazepam) o a alguno de los demás componentes de este medicamento (incluidos en la sección 6);
• tiene una enfermedad de los nervios y músculos que produce debilidad muscular (miastenia grave);
• tiene serias dificultades respiratorias en descanso (BUCCOLAM puede hacer que las dificultades respiratorias empeoren);
• tiene una enfermedad que produce interrupciones frecuentes de la respiración mientras se duerme (síndrome de apnea del sueño);
• tiene problemas hepáticos graves.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a administrar BUCCOLAM si el paciente:
• tiene una afección renal, hepática o cardiaca;
• tiene una afección pulmonar que produce dificultad respiratoria de forma periódica.
Este medicamento puede hacer que las personas se olviden de lo ocurrido después de que se les haya administrado. Se debe observar detenidamente a los pacientes después de administrarles este medicamento.
Este medicamento se debe evitar en pacientes con antecedentes de alcoholismo o toxicomanía.
Es más probable que ocurran incidentes potencialmente mortales entre los pacientes con dificultades respiratorias o problemas cardiacos, especialmente cuando se administran dosis más altas de BUCCOLAM.
Niños menores de 3 meses: BUCCOLAM no se debe administrar a niños menores de 3 meses debido a la falta de información en este grupo de edad.
Si tiene alguna duda sobre si algo de lo anterior es aplicable al paciente, consulte a su médico o farmacéutico antes de administrar este medicamento.
Uso de BUCCOLAM con otros medicamentos
Informe a su médico o farmacéutico si el paciente está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento. Si tiene alguna duda sobre algún medicamento que el paciente está tomando y que pueda afectar al uso de BUCCOLAM, consulte a su médico o farmacéutico.
Esto es sumamente importante, ya que el uso de más de un medicamento al mismo tiempo puede potenciar o debilitar el efecto de los medicamentos tomados.
Los efectos de BUCCOLAM pueden intensificarse con los siguientes medicamentos:
• antiepilépticos (para tratar la epilepsia), p. ej.: fenitoína
• antibióticos, p. ej.: eritromicina, claritromicina
• antifúngicos, p. ej.: ketoconazol, voriconazol, fluconazol, itraconazol, pozaconazol
• medicamentos para las úlceras, p. ej.: cimetidina, ranitidina y omeprazol
• medicamentos utilizados para tratar la tensión arterial, p. ej.: diltiazem, verapamilo
• algunos medicamentos utilizados para el VIH y SIDA, p. ej.: saquinavir, combinación de lopinavir/ritonavir
• analgésicos narcóticos (calmantes muy fuertes), p. ej.: fentanilo
• medicamentos utilizados para reducir la grasa de la sangre, p. ej.: atorvastatina
• medicamentos utilizados para tratar las náuseas, p. ej.: nabilona
• hipnóticos (medicamentos para inducir el sueño)
• antidepresivos sedantes (medicamentos para tratar la depresión que producen sueño)
• sedantes (medicamentos para ayudar a relajarse)
• anestésicos (medicamentos para aliviar el dolor)
• antihistamínicos (medicamentos para tratar alergias)
Los efectos de BUCCOLAM pueden reducirse con los siguientes medicamentos:
• rifampicina (se utiliza para tratar la tuberculosis)
• xantinas (se utilizan para tratar el asma)
• la hierba de San Juan (un medicamento a base de plantas). Se debe evitar en los pacientes que tomen BUCCOLAM.
BUCCOLAM puede aumentar el efecto de algunos relajantes musculares, p. ej.: baclofeno (produciendo un aumento del sueño). Este medicamento también puede hacer que algunos medicamentos dejen de funcionar igual de bien, p. ej.: levodopa (un medicamento que se utiliza para tratar la enfermedad de Parkinson).
Consulte a su médico o farmacéutico para obtener más información sobre los medicamentos que el paciente debe evitar mientras toma BUCCOLAM.
Uso de BUCCOLAM con alimentos y bebidas
El paciente no debe beber alcohol mientras toma BUCCOLAM. El alcohol puede incrementar los efectos sedantes de este medicamento y producirle mucho sueño.
El paciente no debe beber zumo de pomelo mientras toma BUCCOLAM. El zumo de pomelo puede incrementar los efectos sedantes de este medicamento y producirle mucho sueño.
Embarazo
Si la paciente que va a recibir este medicamento está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
La administración de dosis altas de BUCCOLAM durante los últimos 3 meses de embarazo puede producir latido cardiaco anómalo en el feto. Los niños nacidos después de la administración de este medicamento durante el parto pueden también presentar dificultad para mamar, dificultades respiratorias y un tono muscular malo al nacer.
Lactancia
Informe al médico si la paciente está dando el pecho. A pesar de que pequeñas cantidades de BUCCOLAM pueden pasar a la leche materna, puede que no sea necesario suspender la lactancia materna. El médico le aconsejará sobre si la paciente debe amamantar al bebé después de recibir este medicamento.
Conducción y uso de máquinas
BUCCOLAM puede hacer que el paciente se sienta somnoliento, se olvide de las cosas o vea afectada su concentración y coordinación. Esto puede interferir en la ejecución de tareas que requieren habilidad tales como conducir, montar en bicicleta o utilizar máquinas.
Tras recibir este medicamento, el paciente no debe conducir, montar en bicicleta ni utilizar máquinas hasta que se haya recuperado por completo. Pregunte a su médico si necesita más información.
3. Cómo administrar BUCCOLAM
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Dosis
Su médico le recetará la dosis de BUCCOLAM apropiada para su hijo, normalmente depende de la edad del niño. Cada una de las dosis tiene un color diferente, que se muestra en la caja, el tubo y la jeringa que contiene el medicamento.
Su hijo recibirá una de las siguientes dosis específicas a su edad en un envase etiquetado expresamente por colores:
3 meses a menores de 1 año: 2,5 mg - envase con etiqueta amarilla
1 año a menores de 5 años: 5 mg - envase con etiqueta azul
5 años a menores de 10 años: 7,5 - envase con etiqueta morada
10 años a menores de 18 años: 10 mg - envase con etiqueta naranja
Una jeringa oral contiene una dosis completa. No administrar más de una dosis.
Los lactantes de 3 meses a menores de 6 meses únicamente deben recibir tratamiento en un hospital en el que se pueda monitorizar al paciente y que cuente con equipo de reanimación.
Preparación para la administración de este medicamento
Si el niño presenta una crisis convulsiva, deje que su cuerpo se mueva libremente, no intente sujetarle. Muévale solamente si corre peligro por su proximidad a, por ejemplo, aguas profundas, fuego u objetos cortantes.
Apoye la cabeza de su hijo sobre algún objeto acolchado como, por ejemplo, un cojín o en su regazo. Compruebe que el medicamento contiene la dosis correcta para su hijo, específica para su edad.
Cómo administrar este medicamento
Pida a un médico, farmacéutico o enfermero que le enseñen cómo tomar o administrar este medicamento. En caso de duda, pregunte siempre a su médico, farmacéutico o enfermero.
La información sobre cómo administrar este medicamento también aparece en la etiqueta del tubo.
BUCCOLAM no debe inyectarse. No se debe colocar ninguna aguja en la jeringa.
Paso 1 _
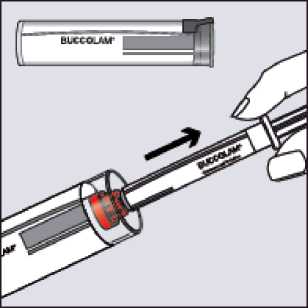
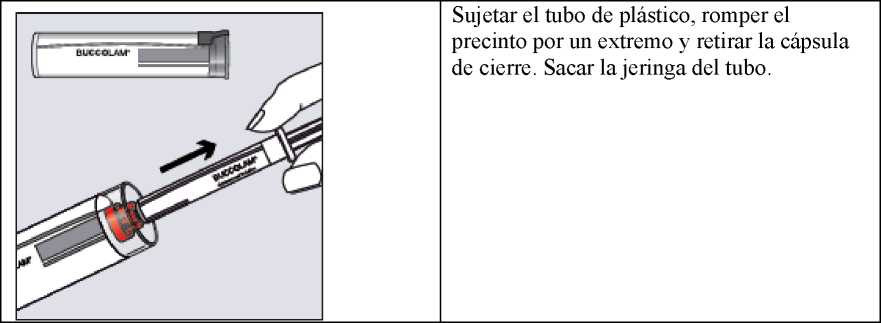
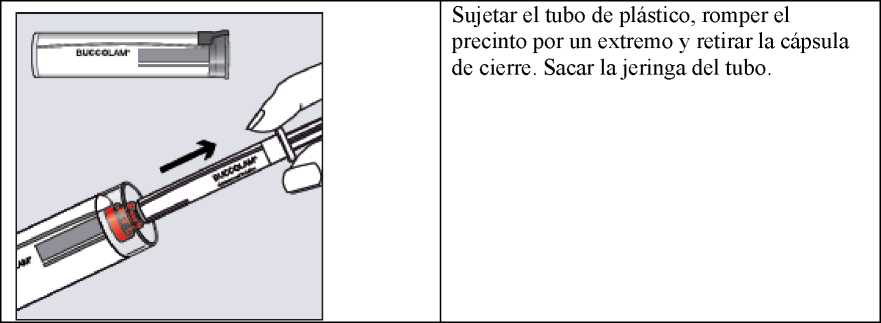
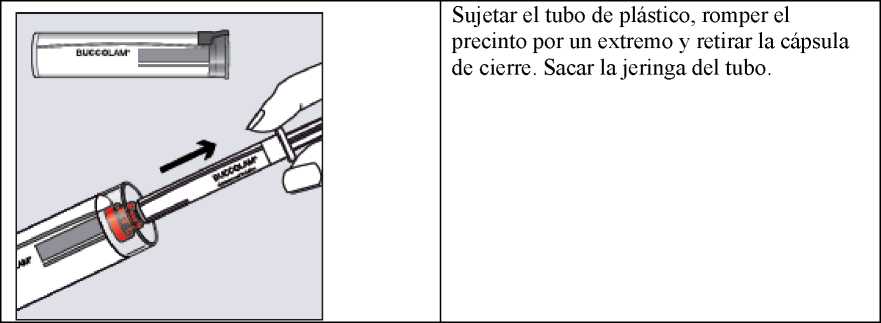
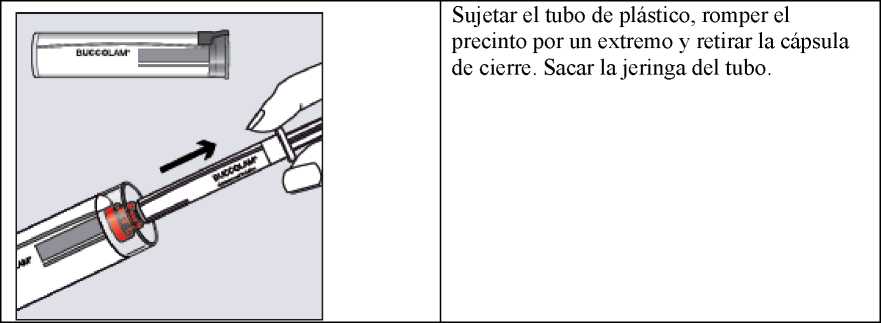
Sujetar el tubo de plástico, romper el precinto por un extremo y retirar la cápsula de cierre. Sacar la jeringa del tubo.
Paso 2
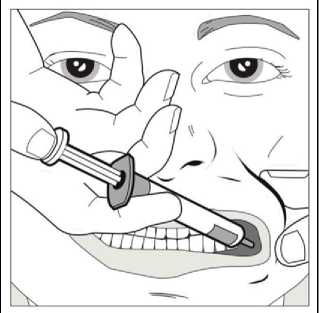
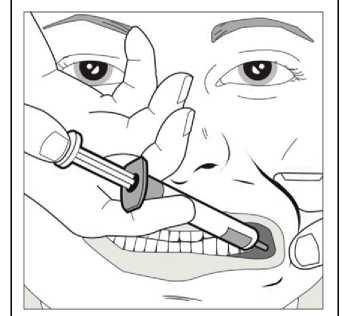
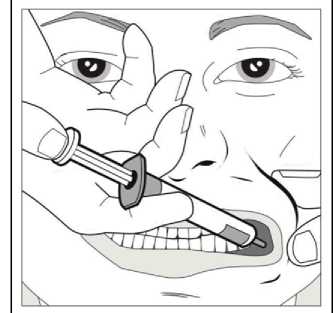
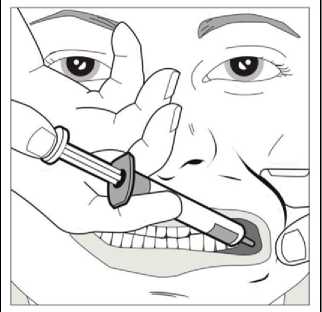
Con ayuda del dedo índice y el pulgar, pellizcar y tirar suavemente hacia atrás de la mejilla del niño. Colocar la punta de la jeringa en la parte posterior del espacio entre el interior de la mejilla y la encía inferior.
Paso 4
/
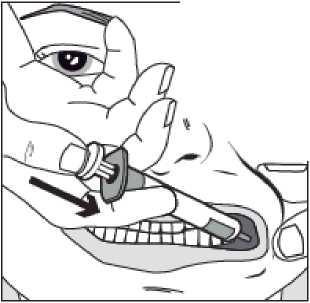
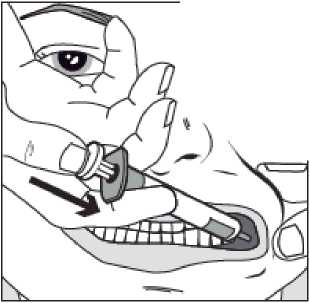
Presionar lentamente el émbolo de la jeringa hasta que se detenga.
Se debe introducir lentamente toda la solución en el espacio entre la encía y la mejilla (cavidad bucal).
Si lo prescribe su médico (para volúmenes mayores y/o pacientes más pequeños), se puede administrar lentamente alrededor de la mitad de la dosis en un lado de la boca y, a continuación, la otra mitad en el otro lado de la boca del niño.
Cuándo llamar a una ambulancia
Siga SIEMPRE las recomendaciones de tratamiento proporcionadas por el médico del paciente o tal como le indicó el profesional sanitario. En caso de duda, solicite ayuda médica urgente si:
• La crisis convulsiva no remite en un plazo de 10 minutos.
• Es incapaz de vaciar el contenido de la jeringa o derrama algo del mismo.
• La respiración del niño se ralentiza o detiene (p. ej.: respiración lenta o superficial o labios
azules).
• Observa signos de infarto de miocardio que pueden incluir dolor torácico o dolor que irradia al cuello y hombros y se extiende hasta el brazo izquierdo.
• El niño vomita y la crisis convulsiva no remite en un plazo de 10 minutos.
• Le administra demasiado BUCCOLAM y observa signos de sobredosis que incluyen:
o Somnolencia, cansancio, fatiga
o Confusión o desorientación
o Ausencia de reflejo en la rodilla o de respuesta a un pellizco o Dificultades respiratorias (respiración lenta o superficial)
o Tensión arterial baja (vértigo y sensación de desmayo)
o Coma
Conserve la jeringa para mostrársela al personal sanitario de la ambulancia o al médico.
No administre más cantidad de medicamento de la prescrita por el médico para el paciente.
Si el niño vomita
• No administre al paciente otra dosis de BUCCOLAM.
• Si la crisis convulsiva no remite en el plazo de 10 minutos, llame a una ambulancia.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Solicite atención médica inmediata o llame por teléfono para pedir una ambulancia si el paciente experimenta los siguientes efectos adversos:
• Dificultad respiratoria grave, p. ej.: respiración lenta o superficial o labios azules. En muy raros casos, podrá pararse la respiración.
• Infarto de miocardio. Los signos pueden incluir dolor torácico que puede irradiarse al cuello y hombros del niño y extenderse hasta su brazo izquierdo.
Otros efectos adversos
Si el paciente experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto.
Efectos adversos frecuentes (pueden afectar hasta a 1 de cada 10 personas):
• Náuseas y vómitos
• Somnolencia o estar menos consciente
Efectos adversos poco frecuentes (pueden afectar hasta a 1 de cada 100 personas):
• Erupción cutánea, urticaria (ronchas), picor
Efectos adversos muy raros (pueden afectar hasta a 1 de cada 10.000 personas):
• Agitación, inquietud, hostilidad, ira o agresión, excitación, confusión, euforia (sensación excesiva de alegría o excitación) o alucinaciones (ver y posiblemente oír cosas que realmente no ocurren)
• Espasmos musculares y temblores musculares (temblor de los músculos que no se puede controlar)
• Nivel de alerta reducido
• Dolor de cabeza
• Mareos
• Dificultad para coordinar los músculos
• Crisis convulsivas (convulsiones)
• Pérdida transitoria de la memoria. La duración depende de la cantidad de BUCCOLAM administrada.
• Tensión arterial baja, frecuencia cardiaca lenta o enrojecimiento de la cara y cuello (rubefacción)
• Espasmo laríngeo (contracción de las cuerdas vocales que produce dificultad respiratoria y ruido al respirar)
• Estreñimiento
• Sequedad de boca
• Cansancio
• Hipo
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
Conservación de BUCCOLAM
5.
Mantener este medicamento fuera de la vista y del alcance de los niños.
No administrar este medicamento después de la fecha de caducidad que aparece en la caja y en las etiquetas del tubo y de la jeringa para uso oral después de CAD. La fecha de caducidad es el último día del mes que se indica.
No refrigerar o congelar.
Mantener la jeringa para uso oral en el tubo de plástico protector.
No utilice este medicamento si el envase está abierto o dañado.
Eliminación de las jeringas para uso oral
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de BUCCOLAM
• El principio activo es midazolam
2.5 mg contiene 2,5 mg de midazolam (como
5 mg contiene 5 mg de midazolam (como clorhidrato)
7.5 mg contiene 7,5 mg de midazolam (como 10 mg contiene 10 mg de midazolam (como
• Cada jeringa precargada para uso oral de clorhidrato) en 0,5 ml de solución.
• Cada jeringa precargada para uso oral de en 1 ml de solución.
• Cada jeringa precargada para uso oral de clorhidrato) en 1,5 ml de solución.
• Cada jeringa precargada para uso oral de clorhidrato) en 2 ml de solución.
Los demás componentes son cloruro de sodio, agua para inyectables, ácido clorhídrico e hidróxido de sodio (para ajustar el pH).
Aspecto del producto y contenido del envase
3 meses a menores de 1 año: 2,5 mg - envase con etiqueta amarilla 1 año a menores de 5 años: 5 mg - envase con etiqueta azul 5 años a menores de 10 años: 7,5 - envase con etiqueta morada 10 años a menores de 18 años: 10 mg - envase con etiqueta naranja
BUCCOLAM solución bucal es un líquido transparente e incoloro. Se suministra en una jeringa precargada para uso oral de color ámbar, de un solo uso. Cada jeringa para uso oral viene envasada individualmente en un tubo de plástico protector. BUCCOLAM se presenta en cajas que contienen 4 jeringas precargadas para uso oral/tubos (de la misma dosis).
Titular de la autorización de comercialización y responsable de la fabricación
Shire Services BVBA rue Montoyer 47 1000 Bruselas Bélgica
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
51