Biresp Spiromax 160 Microgramos / 4,5 Microgramos Polvo Para Inhalacion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
BiResp Spiromax 160 microgramos/4,5 microgramos polvo para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada dosis administrada (la dosis que sale por la boquilla del Spiromax) contiene 160 microgramos de budesónida y 4,5 microgramos de formoterol fumarato dihidrato.
Esto equivale a una dosis medida de 200 microgramos de budesónida y 6 microgramos de formoterol fumarato dihidrato.
Excipiente(s) con efecto conocido:
Cada dosis contiene aproximadamente 5 miligramos de lactosa (como monohidrato).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para inhalación.
Polvo blanco.
Inhalador blanco con tapa semitransparente de color rojo vino para la boquilla.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
BiResp Spiromax está indicado solamente en adultos de 18 años de edad en adelante. Asma
BiResp Spiromax está indicado para el tratamiento habitual del asma cuando sea adecuado el uso de una combinación (un corticosteroide por vía inhalatoria y un agonista de los receptores adrenérgicos P2 de acción prolongada):
- en pacientes no controlados adecuadamente con corticosteroides inhalados y con agonistas de los receptores adrenérgicos P2 de acción corta inhalados a demanda.
o bien
- en pacientes ya controlados adecuadamente con corticosteroides y con agonistas de los receptores adrenérgicos P2 de acción prolongada inhalados.
EPOC
Tratamiento sintomático de pacientes con EPOC grave (VEMS < 50 % de lo normal previsto) y antecedentes de exacerbaciones repetidas, que continúan presentando síntomas significativos a pesar del tratamiento regular con broncodilatadores de acción prolongada.
4.2 Posología y forma de administración
BiResp Spiromax está indicado solamente en adultos de 18 años de edad en adelante. BiResp Spiromax no está indicado para su uso en niños menores de 12 años inclusive ni en adolescentes de 13 a 17 años de edad.
Posología
Asma
BiResp Spiromax no está indicado para el tratamiento inicial del asma.
BiResp Spiromax no es un tratamiento adecuado para pacientes adultos que solo presenten asma leve no controlada adecuadamente con un corticoesteroide inhalado y con agonistas de los receptores adrenérgicos P2 de acción corta inhalados a demanda.
La dosificación de BiResp Spiromax es individual y debe ajustarse a la gravedad de la enfermedad. Esto debe tenerse en cuenta no solo al iniciar un tratamiento con medicamentos combinados, sino también cuando se ajuste la dosis de mantenimiento. Si un paciente en concreto requiere una combinación de dosis distintas a las existentes en el inhalador combinado, deben prescribirse dosis adecuadas de agonistas de los receptores adrenérgicos P2 o corticosteroides mediante el uso de inhaladores individuales.
Una vez controlados los síntomas del asma, podrá contemplarse reducir gradualmente la dosis de BiResp Spiromax. Es preciso que el médico o el profesional sanitario revalúen periódicamente a los pacientes para que la dosis de BiResp Spiromax siga siendo la óptima. Deberá buscarse una dosis lo más baja posible pero que permita mantener un control eficaz de los síntomas.
Cuando resulte adecuado ajustar la dosis a la baja hasta una concentración menor que la de BiResp Spiromax, será necesario cambiar a una combinación alternativa de dosis fija con budesónida y fumarato de formoterol que contenga una dosis menor del corticosteroide inhalado. Cuando se mantenga un control a largo plazo de los síntomas con la dosis recomendada más baja, el paso siguiente puede consistir en realizar una prueba con el corticosteroide inhalado solo.
En la práctica habitual, cuando se consigue controlar los síntomas con el régimen posológico de dos veces al día con una menor concentración de producto, el descenso hasta una dosis eficaz menor puede incluir la administración una vez al día si, en opinión del médico, es necesario un broncodilatador de acción prolongada para mantener el control en lugar de un tratamiento con un corticoesteroide inhalado solo.
En el caso de BiResp Spiromax existen dos enfoques terapéuticos:
Terapia de mantenimiento con BiResp Spiromax: BiResp Spiromax se toma como terapia de mantenimiento regular con un broncodilatador de acción rápida adicional como inhalador de alivio.
Terapia de mantenimiento y de alivio con BiResp Spiromax: BiResp Spiromax se toma como terapia de mantenimiento regular y a demanda en respuesta a los síntomas.
Terapia de mantenimiento con BiResp Spiromax
Es necesario advertir a los pacientes que tengan disponible su otro inhalador de alivio broncodilatador de acción rápida como tratamiento de rescate en todo momento.
Dosis recomendadas:
Adultos (de 18 años en adelante): 1-2 inhalaciones dos veces al día. Algunos pacientes pueden requerir hasta un máximo de 4 inhalaciones dos veces al día.
El uso creciente de un broncodilatador adicional de acción rápida indica un empeoramiento de la enfermedad subyacente y exige revaluar el tratamiento contra el asma.
Terapia de mantenimiento y de alivio con BiResp Spiromax
Los pacientes toman una dosis de mantenimiento de BiResp Spiromax y además BiResp Spiromax a demanda en respuesta a los síntomas. Es necesario advertir a los pacientes que tengan siempre disponible BiResp Spiromax para su uso como rescate.
Debe contemplarse especialmente la terapia de mantenimiento y de alivio con BiResp Spiromax en aquellos pacientes con:
• control inadecuado del asma y que necesiten frecuentemente un medicamento inhalador de alivio;
• exacerbaciones del asma en el pasado que hayan requerido intervención médica.
Es preciso vigilar estrechamente las reacciones adversas relacionadas con la dosis en los pacientes que realicen un gran número de inhalaciones de BiResp Spiromax a demanda.
Dosis recomendadas:
Adultos (de 18 años en adelante): la dosis de mantenimiento recomendada es de 2 inhalaciones diarias, administradas en una inhalación por la mañana y otra por la noche o en 2 inhalaciones por la mañana o por la noche. En algunos pacientes puede ser adecuada una dosis de mantenimiento de 2 inhalaciones dos veces al día. Los pacientes deben realizar 1 inhalación adicional a demanda en respuesta a los síntomas. Si los síntomas persisten después de unos minutos, deberán realizar una inhalación adicional. En una misma ocasión no deben realizarse más de 6 inhalaciones.
Normalmente no se necesita una dosis diaria total superior a 8 inhalaciones; sin embargo, se puede utilizar una dosis total diaria de hasta 12 inhalaciones durante un período limitado. A los pacientes que se realicen más de 8 inhalaciones al día se les debe insistir en que acudan al médico. Es preciso revaluarles y replantear su terapia de mantenimiento.
EPOC
Dosis recomendadas:
Adultos (de 18 años en adelante): 2 inhalaciones dos veces al día.
Poblaciones especiales:
Pacientes de edad avanzada (> 65 años)
No existen requisitos de dosificación especiales para pacientes de edad avanzada.
Pacientes con insuficiencia renal o hepática
No se dispone de datos para el uso de una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato en pacientes con insuficiencia hepática o renal. Dado que la budesónida y el formoterol se eliminan principalmente a través del metabolismo hepático, cabe esperar un aumento de la exposición en pacientes con cirrosis hepática grave.
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de BiResp Spiromax en niños de hasta 12 años y adolescentes de 13 a 17 años de edad. No se dispone de datos.
No se recomienda el uso de este medicamento en niños ni en adolescentes menores de 18 años de edad.
Forma de administración
Vía inhalatoria.
Spiromax es un inhalador impulsado por el flujo inspiratorio de la respiración, lo que significa que los principios activos se liberan en las vías respiratorias cuando el paciente inhala a través de la boquilla. Se ha visto que los pacientes con asma moderada y grave podían generar un caudal inspiratorio suficiente para que Spiromax administrara la dosis terapéutica (ver sección 5.1).
BiResp Spiromax debe utilizarse correctamente para conseguir un tratamiento eficaz. Así pues, es preciso advertir a los pacientes que lean el prospecto del paciente con atención y que sigan las instrucciones de uso que en él se especifican.
El uso de BiResp Spiromax requiere tres pasos sencillos que se explican a continuación: abrir, respirar y cerrar.
Abrir: sujetar el Spiromax de manera que la tapa de la boquilla quede abajo y abrir la tapa de la boquilla replegándola hacia abajo hasta que se abra del todo cuando se oiga un clic.
Respirar: colocar la boquilla entre los dientes con los labios cerrados alrededor de la boquilla, no morder la boquilla del inhalador. Inspirar con fuerza y profundamente a través de la boquilla. Retirar el Spiromax de la boca y retener la respiración 10 segundos o todo el tiempo que puedan los pacientes sin sentirse incómodos.
Cerrar: espirar suavemente y cerrar la tapa de la boquilla.
También es importante advertir a los pacientes que no agiten el inhalador antes de usarlo, que no exhalen a través del Spiromax y que no bloqueen las entradas de aire cuando estén preparando el paso de “Respirar”.
Debe aconsejarse igualmente a los pacientes que se enjuaguen la boca con agua después de la inhalación (ver sección 4.4).
El paciente puede notar un sabor al utilizar BiResp Spiromax debido al uso de lactosa como excipiente.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o al excipiente incluido en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
General
Se recomienda ir reduciendo progresivamente la dosis a la hora de interrumpir el tratamiento en lugar de suspenderlo bruscamente.
Si los pacientes consideran que el tratamiento es ineficaz o superan la dosis máxima recomendada de BiResp Spiromax, deben recibir asistencia médica (ver sección 4.2). Un empeoramiento repentino y progresivo en el control del asma o de la EPOC puede poner en peligro la vida del paciente, y este debe ser examinado por un médico de inmediato. En este caso, debe estudiarse la necesidad de incrementar el tratamiento con corticosteroides, p. ej., con un ciclo de corticosteroides orales o con antibioterapia si existe infección.
Es necesario advertir a los pacientes que tengan disponible su inhalador de rescate en todo momento, ya sea BiResp Spiromax (para los pacientes con asma que utilicen BiResp Spiromax como terapia de mantenimiento y alivio) o un broncodilatador adicional de acción rápida (para los pacientes de asma que utilicen BiResp Spiromax solo como terapia de mantenimiento).
Debe recordarse a los pacientes que se administren su dosis de mantenimiento de BiResp Spiromax según lo prescrito, aunque no tengan síntomas. No se ha investigado el uso preventivo de BiResp Spiromax, p. ej., antes de hacer ejercicio. Las inhalaciones de alivio de BiResp Spiromax deben realizarse en respuesta a los síntomas, pero no están pensadas para un uso preventivo regular, p. ej., antes de hacer ejercicio. En esos casos debe sopesarse el uso de un broncodilatador adicional de acción rápida.
Síntomas de asma
Es preciso que el médico o el profesional sanitario revalúen periódicamente a los pacientes para que la dosis de BiResp Spiromax siga siendo la óptima. Se debe buscar una dosis lo más baja posible pero que permita mantener un control eficaz de los síntomas. Una vez controlados los síntomas del asma, se debe sopesar la posibilidad de reducir gradualmente la dosis de BiResp Spiromax. Cuando resulte adecuado ajustar la dosis a la baja hasta una concentración menor que la de BiResp Spiromax, será necesario cambiar a una combinación alternativa de dosis fija con budesónida y fumarato de formoterol que contenga una dosis menor del corticoesteroide inhalado.
Es importante vigilar con regularidad a los pacientes a medida que se vaya reduciendo el tratamiento.
Los pacientes no deben iniciar el tratamiento con BiResp Spiromax durante las exacerbaciones o si muestran un empeoramiento significativo o un deterioro agudo del asma.
Pueden producirse exacerbaciones y reacciones adversas graves relacionadas con el asma durante el tratamiento con BiResp Spiromax. Debe pedirse a los pacientes que continúen el tratamiento, pero que acudan al médico si los síntomas del asma siguen sin estar controlados o empeoran después de iniciar el tratamiento con BiResp Spiromax.
Pueden producirse broncoespasmos paradójicos, con un aumento inmediato de las sibilancias y de la disnea después de administrar la dosis. Si el paciente experimenta un broncoespasmo paradójico, es preciso suspender de inmediato el BiResp Spiromax, evaluar al paciente e instaurar un tratamiento alternativo, si es necesario. El broncoespasmo paradójico responde a los broncodilatadores inhalados de acción rápida y debe tratarse de inmediato (ver sección 4.8).
Efectos sistémicos
Pueden aparecer efectos sistémicos con cualquier corticosteroide inhalado, especialmente con la administración de dosis elevadas durante períodos prolongados. La probabilidad de que estos efectos aparezcan con un tratamiento por vía inhalatoria es mucho menor que con los corticosteroides por vía oral.
Entre los posibles efectos sistémicos se incluyen síndrome de Cushing, manifestaciones cushingoides, inhibición suprarrenal, retraso del crecimiento en niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma y, con menos frecuencia, diversos efectos psicológicos o conductuales, como hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresividad (especialmente en niños) (ver sección 4.8).
Se recomienda vigilar regularmente la estatura de los niños que reciban tratamientos prolongados con corticoesteroides inhalados. Si se ralentiza el crecimiento, debe revaluarse el tratamiento con el fin de reducir la dosis de corticoesteroide inhalado al mínimo necesario para mantener un control eficaz del asma, si es posible. Es preciso sopesar cuidadosamente las ventajas del tratamiento con
corticosteroides y el riesgo de inhibición del crecimiento. Asimismo, debe contemplarse remitir al paciente a un especialista en neumología pediátrica.
Los escasos datos que existen procedentes de estudios a largo plazo indican que la mayoría de los niños y de los adolescentes tratados con budesónida inhalada acaban por alcanzar su estatura de adultos. Sin embargo, se ha observado una reducción inicial pequeña pero transitoria en el crecimiento (aproximadamente de 1 cm). Por lo general esto se produce durante el primer año de tratamiento.
Efectos sobre la densidad ósea
Es preciso tener en cuenta los posibles efectos sobre la densidad ósea, particularmente en pacientes tratados con dosis elevadas durante períodos prolongados que presenten factores de riesgo de osteoporosis coexistentes.
Los estudios a largo plazo realizados en niños con budesónida inhalada a dosis medias diarias de 400 microgramos (dosis medida) o en adultos a dosis diarias de 800 microgramos (dosis medida) no han mostrado ningún efecto significativo sobre la densidad mineral ósea. No se dispone de información acerca del efecto de una combinación de dosis fija de budesónida/formoterol fumarato dihidrato a dosis más altas.
Funcionamiento suprarrenal
Si hubiera algún motivo para suponer que se ha producido insuficiencia suprarrenal con tratamientos anteriores a base de corticosteroides sistémicos, se debe tener cuidado cuando los pacientes pasen a recibir un tratamiento combinado de dosis fija a base de budesónida/fumarato de formoterol.
Las ventajas del tratamiento con budesónida inhalada normalmente minimizarían la necesidad de corticosteroides por vía oral, pero los pacientes que provengan de un tratamiento con corticosteroides por vía oral pueden seguir presentando riesgo de insuficiencia de la reserva suprarrenal durante un período considerable. La recuperación puede prolongarse durante un período considerable una vez suspendidos los corticosteroides por vía oral, de manera que los pacientes con dependencia de los corticosteroides por vía oral que cambien a la budesónida por vía inhalatoria pueden seguir presentando riesgo de insuficiencia suprarrenal durante un período considerable. En estas circunstancias, es preciso vigilar con regularidad el funcionamiento del eje hipotalámico-pituitario-adrenal (HPA).
Altas dosis de corticosteroides
El tratamiento prolongado con dosis elevadas de corticosteroides inhalados, particularmente si se trata de dosis superiores a las recomendadas, también puede producir una inhibición suprarrenal clínicamente significativa. Por tanto, debe sopesarse la instauración de cobertura sistémica adicional con corticosteroides durante períodos de estrés, como por ejemplo, en caso de infecciones graves o de intervenciones quirúrgicas programadas. Una reducción rápida en la dosis de corticosteroides puede provocar una crisis suprarrenal aguda. Los síntomas y los signos que pueden observarse en las crisis suprarrenales agudas tal vez sean vagos, pero pueden incluir, entre otros, anorexia, dolor abdominal, pérdida de peso, cansancio, cefalea, náuseas, vómitos, disminución del nivel de consciencia, convulsiones, hipotensión e hipoglucemia.
El tratamiento con budesónida inhalada o corticosteroides sistemáticos complementarios no debe interrumpirse bruscamente.
Transferencia desde un tratamiento por vía oral
Durante el paso de un tratamiento por vía oral a uno combinado de dosis fija de budesónida/fumarato de formoterol se experimenta una acción sistémica de los corticosteroides generalmente más baja que puede dar lugar a la aparición de síntomas alérgicos o artríticos, como rinitis, eccema y dolor muscular y articular. Debe instaurarse tratamiento específico para estas enfermedades. Debe sospecharse un efecto insuficiente en general de los glucocorticosteroides si, en casos aislados, se producen síntomas como cansancio, cefalea, náuseas y vómitos. En estos casos puede ser necesario incrementar temporalmente la dosis de glucocorticosteroides orales.
Infecciones bucales
Para minimizar el riesgo de infección bucofaríngea por cándida, debe indicarse al paciente que se enjuague la boca con agua después de inhalar la dosis. En caso de candidiasis bucofaríngea, los pacientes también deben enjuagarse la boca con agua después de las inhalaciones necesarias.
Neumonía en pacientes con EPOC
Se ha observado un aumento en la incidencia de neumonía, incluyendo neumonía que requiere hospitalización, en pacientes con EPOC que reciben corticoides inhalados. Existe alguna evidencia de un mayor riesgo de neumonía con el aumento de la dosis de esteroides, pero esto no ha sido demostrado de manera concluyente en todos los estudios.
No hay evidencia clínica concluyente de diferencias intra-clase en la magnitud del riesgo de neumonía entre los corticoides inhalados.
Los médicos deben permanecer vigilantes ante el posible desarrollo de neumonía en pacientes con EPOC, ya que las características clínicas de estas infecciones se superponen con los síntomas de exacerbación de la EPOC.
Los factores de riesgo de neumonía en pacientes con EPOC incluyen el tabaquismo habitual, pacientes de edad avanzada, bajo índice de masa corporal (IMC) y EPOC grave.
Interacción con otros medicamentos
Debe evitarse el tratamiento concomitante con itraconazol, ritonavir u otros inhibidores potentes del CYP3A4 (ver sección 4.5). Si esto no es posible, el período de separación entre administraciones de los medicamentos que interaccionen debe ser lo más largo posible. No se recomienda el uso de tratamientos combinados con dosis fija de budesónida/fumarato de formoterol en los pacientes que estén consumiendo inhibidores potentes del CYP3A4.
Precaución con enfermedades especiales
La combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato debe administrarse con precaución en pacientes que presenten hipertiroidismo, feocromocitoma, diabetes mellitus, hipopotasemia sin tratar, miocardiopatía obstructiva hipertrófica, estenosis aórtica subvalvular idiopática, hipertensión grave, aneurisma u otros trastornos cardiovasculares graves, como isquemia cardíaca, taquiarritmias o insuficiencia cardíaca grave.
Es preciso tener cuidado al tratar a pacientes con prolongación del intervalo QTc. El propio formoterol puede provocar prolongación del intervalo QTc.
Es preciso revaluar la necesidad del tratamiento y la dosis de los corticosteroides inhalados en pacientes con tuberculosis pulmonar activa o latente, o con infecciones fungicas y víricas en las vías respiratorias.
En los pacientes diabéticos deben efectuarse controles de glucemia adicionales.
Agonistas de los receptores adrenérgicos B?
Puede producirse hipopotasemia grave con la administración de dosis elevadas de agonistas de los receptores adrenérgicos B2. El tratamiento concomitante de agonistas de los receptores adrenérgicos B2 con medicamentos que puedan producir hipopotasemia o potenciar un efecto hipopotasiémico, p. ej., los derivados de la xantina, los corticosteroides y los diuréticos, puede incrementar el posible efecto hipopotasiémico del agonista de los receptores adrenérgicos P2.
El tratamiento con agonistas de los receptores adrenérgicos P2 puede provocar un incremento de los niveles sanguíneos de insulina, ácidos grasos libres, glicerol y cuerpos cetónicos.
Se recomienda precaución especial en caso de asma inestable con el uso variable de broncodilatadores de rescate, en el asma grave aguda (ya que el riesgo asociado puede incrementarse por la hipoxia) y en otras enfermedades en las que exista una mayor probabilidad de desarrollar hipopotasemia. Se recomienda vigilar los niveles séricos de potasio en estas circunstancias.
Excipientes
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a la galactosa, deficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa, no deben tomar este medicamento. El excipiente lactosa contiene pequeñas cantidades de proteínas lácteas que pueden provocar reacciones alérgicas.
4.5 Interacción con otros medicamentos y otras formas de interacción
Interacciones farmacocinéticas
Los inhibidores potentes del CYP3A4 (p. ej., ketoconazol, itraconazol, voriconazol, posaconazol, claritromicina, telitromicina, nefazodona e inhibidores de la proteasa del VIH) pueden incrementar considerablemente los niveles plasmáticos de budesónida, y debe evitarse su uso concomitante. Si esto no es posible, el período de separación entre administraciones del inhibidor y la budesónida debe ser lo más largo posible (ver sección 4.4). No se recomienda el uso de una terapia de mantenimiento y de alivio con una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato en pacientes que consuman inhibidores potentes del CYP3A4.
El potente inhibidor del CYP3A4 ketoconazol, a una dosis de 200 mg diarios, multiplicó por seis por término medio los niveles plasmáticos de budesónida (una sola dosis de 3 mg) administrada concomitantemente por vía oral. Cuando se administró el ketoconazol 12 horas después de la budesónida, la concentración únicamente se triplicó por término medio, lo que muestra que la separación de los momentos de administración puede reducir el incremento en los niveles plasmáticos. Algunos datos acerca de esta interacción con dosis elevadas de budesónida inhalada indican que pueden producirse incrementos considerables de los niveles plasmáticos (del cuádruple, por término medio) al administrar 200 mg una vez al día de itraconazol junto con budesónida inhalada (dosis única de 1000 microgramos).
Interacciones farmacodinámicas
Los bloqueantes adrenérgicos P pueden debilitar o inhibir el efecto del formoterol. Así pues, una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato no debe administrarse junto con bloqueantes adrenérgicos P (incluidos los colirios), a menos que existan motivos importantes para ello.
El tratamiento concomitante con quinidina, disopiramida, procainamida, fenotiazinas, antihistamínicos (terfenadina), inhibidores de la monoaminooxidasa y antidepresivos tricíclicos puede prolongar el intervalo QTc e incrementar el riesgo de arritmias ventriculares.
Asimismo, la levodopa, la levotiroxina, la oxitocina y el alcohol pueden alterar la tolerancia cardíaca hacia los simpaticomiméticos P2.
El tratamiento concomitante con inhibidores de la monoaminooxidasa, incluidos los medicamentos con propiedades similares, como la furazolidona y la procarbazina, puede precipitar reacciones hipertensivas.
Existe un riesgo elevado de arritmias en pacientes que reciben anestesia concomitante con hidrocarburos halogenados.
El uso concomitante de otros adrenérgicos 0 y anticolinérgicos puede tener un efecto broncodilatador aditivo.
La hipopotasemia puede incrementar la tendencia a las arritmias en pacientes tratados con glucósidos digitálicos.
No se ha observado que la budesónida y el formoterol interaccionen con ningún otro medicamento utilizado en el tratamiento del asma.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos clínicos sobre embarazos con exposición a una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato o al tratamiento concomitante con formoterol y budesónida. Los datos procedentes de un estudio sobre desarrollo embriofetal en ratas no mostraron pruebas de efectos adicionales con la combinación.
No existen datos adecuados sobre el uso de formoterol en mujeres embarazadas. En estudios reproductivos con animales, el formoterol ha provocado reacciones adversas a niveles de exposición sistémica muy elevados (ver sección 5.3).
Los datos de aproximadamente 2000 gestaciones con exposición no indican un mayor riesgo teratógeno asociado al uso de la budesónida inhalada. En estudios con animales se ha demostrado que los glucocorticosteroides provocan malformaciones (ver sección 5.3). Es probable que esto no sea relevante para los seres humanos dadas las dosis recomendadas.
Los estudios realizados en animales han detectado también la intervención de los niveles excesivos prenatales de glucocorticosteroides en el aumento del riesgo de retraso del desarrollo intrauterino, de enfermedades cardiovasculares en adultos y de cambios permanentes en la densidad de los receptores de glucocorticosteroides, en el ciclo metabólico de los neurotransmisores y en el comportamiento a exposiciones inferiores al intervalo de dosis teratógenas.
Durante el embarazo, una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato solo debe utilizarse cuando las ventajas superen a los riesgos. Se debe utilizar la dosis eficaz más baja de budesónida necesaria para mantener un control adecuado del asma.
Lactancia
La budesónida se excreta en la leche materna. Sin embargo, a dosis terapéuticas no se prevén efectos sobre los niños lactantes. Se desconoce si el formoterol pasa a la leche materna. Se han detectado pequeñas cantidades de formoterol en la leche materna de ratas. Solo debe estudiarse la administración de una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato en mujeres lactantes si el beneficio esperado para la madre es mayor que cualquier riesgo para el hijo.
Fertilidad
No se dispone de datos sobre fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de BiResp Spiromax sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Dado que BiResp Spiromax contiene tanto budesónida como formoterol, puede producirse el mismo patrón de reacciones adversas descrito con estas sustancias. No se ha observado un incremento en la incidencia de reacciones adversas con la administración simultánea de ambos compuestos. Las reacciones adversas más frecuentes son las predecibles desde el punto de vista farmacológico con los tratamientos de agonistas de los receptores adrenérgicos P2, como temblor y palpitaciones. Estas tienden a ser leves y por lo general desaparecen a los pocos días del tratamiento. En un ensayo clínico de 3 años sobre la budesónida en la EPOC se produjeron hematomas y neumonía con una frecuencia del 10 % y del 6 %, respectivamente, en comparación con el 4 % y el 3 % del grupo tratado con placebo (p < 0,001 y p < 0,01, respectivamente). BiResp Spiromax no está indicado en niños ni en adolescentes menores de 18 años de edad (véase la sección 4.2).
Tabla de reacciones adversas
Las reacciones adversas que se han asociado a la budesónida o al formoterol figuran a continuación aparecen ordenadas según la clasificación por órganos y sistemas y la frecuencia. Las frecuencias se definen como: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000), muy raras (< 1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Sistema de clasificación de órganos |
Frecuencia |
Reacción adversa |
|
Infecciones e infestaciones |
Frecuentes |
Candidiasis bucofaríngeas, neumonía (en pacientes con EPOC) |
|
Trastornos del sistema inmunológico |
Raras |
Reacciones de hipersensibilidad inmediatas y tardías, p. ej., exantema, urticaria, prurito, dermatitis, angioedema y reacción anafiláctica |
|
Trastornos endocrinos |
Muy raras |
Síndrome de Cushing, inhibición suprarrenal, retraso del crecimiento y disminución de la densidad mineral ósea |
|
Trastornos del metabolismo y de la nutrición |
Raras |
Hipopotasemia |
|
Muy raras |
Hiperglucemia | |
|
Trastornos psiquiátricos |
Poco frecuentes |
Agresividad, hiperactividad psicomotora, ansiedad y trastornos del sueño |
|
Muy raras |
Depresión y cambios conductuales (predominantemente en niños) | |
|
Trastornos del sistema nervioso |
Frecuentes |
Cefalea y temblor |
|
Poco frecuentes |
Mareo | |
|
Muy raras |
Alteraciones del gusto | |
|
Trastornos oculares |
Muy raras |
Cataratas y glaucoma |
|
Trastornos cardíacos |
Frecuentes |
Palpitaciones |
|
Poco frecuentes |
Taquicardia | |
|
Raras |
Arritmias cardíacas, p. ej., fibrilación auricular, taquicardia supraventricular y extrasístoles | |
|
Muy raras |
Angina de pecho. Prolongación del intervalo QTc | |
|
Trastornos vasculares |
Muy raras |
Variaciones en la tensión arterial |
|
Trastornos respiratorios, |
Frecuentes |
Irritación leve de garganta, tos y ronquera |
|
torácicos y mediastínicos |
Raras |
Broncoespasmo |
|
Muy raras |
Broncoespasmo paradójico | |
|
Trastornos gastrointestinales |
Poco frecuentes |
Náuseas |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
Hematomas |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes |
Calambres musculares |
Descripción de reacciones adversas seleccionadas
La candidiasis bucofaríngea se debe al depósito de principio activo. Indicar al paciente que se enjuague la boca con agua después de cada dosis minimizará el riesgo. Las candidiasis bucofaríngeas suelen responder al tratamiento con antifungicos tópicos sin necesidad de suspender el corticosteroide inhalado.
En muy raras ocasiones pueden producirse broncoespasmos paradójicos, que afectan a menos de 1 por cada 10.000 personas y que producen un aumento inmediato de las sibilancias y de la disnea después de administrar la dosis. El broncoespasmo paradójico responde a los broncodilatadores inhalados de acción rápida y debe tratarse de inmediato. Es preciso suspender de inmediato el BiResp Spiromax, evaluar al paciente e instaurar un tratamiento alternativo, si es necesario (ver sección 4.4).
Pueden aparecer efectos sistémicos con los corticosteroides inhalados, especialmente con la administración de dosis elevadas durante períodos prolongados. La probabilidad de que estos efectos aparezcan es mucho menor que con los corticosteroides por vía oral. Entre los posibles efectos sistémicos se incluyen síndrome de Cushing, manifestaciones cushingoides, inhibición suprarrenal, retraso del crecimiento en niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma. También pueden producirse aumento de la susceptibilidad a las infecciones y alteración de la capacidad para adaptarse al estrés. Es probable que los efectos dependan de la dosis, del tiempo de exposición, de la exposición concomitante y previa a corticosteroides y de la sensibilidad individual.
El tratamiento con agonistas de los receptores adrenérgicos P2 puede provocar un incremento de los niveles sanguíneos de insulina, ácidos grasos libres, glicerol y cuerpos cetónicos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Una sobredosis de formoterol podría producir efectos típicos de los agonistas de los receptores adrenérgicos P2: temblor, cefalea y palpitaciones. Los síntomas descritos en casos aislados fueron taquicardia, hiperglucemia, hipopotasemia, prolongación del intervalo QTc, arritmia, náuseas y vómitos. Puede estar indicado un tratamiento complementario y sintomático. Una dosis de 90 microgramos administrados durante tres horas a pacientes con obstrucción bronquial aguda no produjo problemas de seguridad.
No se prevé que las sobredosis repentinas con budesónida, incluso a dosis excesivas, supongan un problema clínico. En caso de uso crónico en dosis excesivas, pueden aparecer efectos sistémicos de los glucocorticosteroides, como hipercorticalismo e inhibición suprarrenal.
Si fuera preciso suspender el tratamiento con BiResp Spiromax por sobredosis del componente de formoterol del medicamento, debe contemplarse la instauración de un tratamiento adecuado con corticosteroides inhalados.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos para enfermedades obstructivas de las vías respiratorias, adrenérgicos y otros fármacos para enfermedades obstructivas de las vías respiratorias.
Código ATC: R03AK07
Mecanismo de acción y efectos farmacodinámicos
BiResp Spiromax contiene formoterol y budesónida, que poseen modos de actuación distintos y muestran efectos aditivos en cuanto a reducción de las exacerbaciones del asma. Las propiedades específicas de la budesónida y del formoterol permiten usar la combinación como terapia de mantenimiento y de alivio, o como terapia de mantenimiento para el asma. A continuación, se tratan los mecanismos de acción de las dos sustancias farmacéuticas respectivamente.
Budesónida
La budesónida es un glucocorticosteroide que, mediante su uso por vía inhalatoria, ejerce una acción antiinflamatoria dependiente de la dosis en las vías respiratorias, lo que reduce los síntomas y las exacerbaciones del asma. La budesónida inhalada causa menos reacciones adversas graves que los corticosteroides sistémicos. Se desconoce el mecanismo exacto responsable del efecto antiinflamatorio de los glucocorticosteroides.
Formoterol
El formoterol es un agonista selectivo de los receptores adrenérgicos P2 cuya inhalación provoca una relajación rápida y de acción prolongada de la musculatura lisa bronquial en pacientes con obstrucción reversible de las vías respiratorias. El efecto broncodilatador depende de la dosis y tarda en producirse entre 1 y 3 minutos. La duración del efecto es de al menos 12 horas después de administrar una sola dosis.
Eficacia clínica y seguridad
Asma
Tratamiento de mantenimiento con budesónida/formoterol para el asma
Los estudios clínicos realizados en adultos indican que la adición de formoterol a la budesónida mejoró los síntomas de asma y el funcionamiento pulmonar, además de reducir las exacerbaciones.
En dos estudios de 12 semanas de duración, el efecto de budesónida/formoterol sobre el funcionamiento pulmonar fue el mismo que el de la combinación no fija de budesónida y formoterol, y mayor que el de la budesónida sola. En todos los grupos de tratamiento se utilizó un agonista de los receptores adrenérgicos P2 de acción corta a demanda. No se produjeron signos de atenuación del efecto antiasmático con el tiempo.
Se llevaron a cabo dos estudios pediátricos de 12 semanas de duración en los cuales se trató a 265 niños de 6 a 11 años de edad con una dosis de mantenimiento de budesónida/formoterol (2 inhalaciones de 80 microgramos/4,5 microgramos/inhalación dos veces al día) y un agonista de los receptores adrenérgicos P2 de acción corta a demanda. En ambos estudios mejoró el funcionamiento
pulmonar y el tratamiento fue bien tolerado en comparación con la dosis correspondiente de budesónida sola.
Tratamiento de mantenimiento y de alivio con budesónida/formoterol para el asma
En 5 estudios clínicos doble ciego se trató a un total de 12.076 pacientes con asma (4.447 asignados aleatoriamente a una terapia de mantenimiento y alivio con budesónida/formoterol) durante 6 o 12 meses. Los pacientes tenían que ser sintomáticos a pesar del uso de glucocorticosteroides inhalados.
La terapia de mantenimiento y alivio con budesónida/formoterol logró reducciones estadísticamente significativas y clínicamente útiles en las exacerbaciones graves en todas las comparaciones efectuadas en los 5 estudios. Esto incluyó una comparación con budesónida/formoterol a una dosis de mantenimiento mayor con terbutalina como fármaco de alivio (estudio 735) y budesónida/formoterol a la misma dosis de mantenimiento con formoterol o terbutalina como tratamiento de alivio (estudio 734) (véase la tabla siguiente). En el estudio 735, el funcionamiento pulmonar, el control de los síntomas y el uso del fármaco de alivio fueron similares en todos los grupos de tratamiento. En el estudio 734, se redujeron los síntomas y el uso del fármaco de alivio, y el funcionamiento pulmonar mejoró en comparación con ambos tratamientos de referencia. En los 5 estudios combinados, los pacientes que recibieron terapia de mantenimiento y alivio con budesónida/formoterol no utilizaron, por término medio, ninguna inhalación de alivio en un 57 % de los días de tratamiento. No hubo signos de desarrollo de tolerancias con el tiempo.
Panorámica de las exacerbaciones graves producidas en los estudios clínicos
|
N.° de estudio Duración |
Grupos de tratamiento |
N |
Exacerbaciones graves3 Episodios Episodios/ años-paciente | |
|
Estudio 735 6 meses |
Budesónida/formoterol fumarato dihidrato 160/4,5 gg 2/día + a demanda. |
1.103 |
125 |
0,23b |
|
Budesónida/formoterol fumarato dihidrato 320/9 gg 2/día + terbutalina 0,4 mg a demanda |
1.099 |
173 |
0,32 | |
|
Salmeterol/fluticasona 2 x 25/125 gg 2/día + terbutalina 0,4 mg a demanda |
1.119 |
208 |
0,38 | |
|
Estudio 734 12 meses |
Budesónida/formoterol fumarato dihidrato 160/4,5 gg 2/día + a demanda. |
1.107 |
194 |
O 'h* N.O cr |
|
Budesónida/formoterol fumarato dihidrato 160/4,5 gg 2/día + formoterol 4,5 mg a demanda |
1.137 |
296 |
0,29 | |
|
Budesónida/formoterol fumarato dihidrato 160/4,5 gg 2/día + terbutalina 0,4 mg a demanda |
1.138 |
377 |
0,37 | |
a Hospitalización/tratamiento en urgencias o tratamiento con corticosteroides orales b La reducción del índice de exacerbaciones es estadísticamente significativa (valor de P < 0,01) en ambas comparaciones
En otros 2 estudios con pacientes que solicitaron atención médica por síntomas agudos de asma, la budesónida/formoterol proporcionó un alivio rápido y eficaz de la broncoconstricción similar al de salbutamol y formoterol.
EPOC
En dos estudios de 12 meses de duración se evaluó el efecto sobre el funcionamiento pulmonar y el índice de exacerbaciones (definido como necesidad de tratamientos con corticosteroides orales, de tratamientos con antibióticos o de hospitalizaciones) en pacientes con EPOC grave. La mediana del VEMS en el momento de la inclusión en los ensayos fue de un 36 % del valor normal pronosticado. El promedio de exacerbaciones por año (según la definición anterior) mostró una reducción significativa con budesónida/formoterol en comparación con el tratamiento con formoterol solo o placebo (tasa media de 1,4 en comparación con 1,8-1,9 en el grupo tratado con placebo/formoterol). El promedio de
días con tratamiento de corticosteroides orales por paciente durante los 12 meses se redujo ligeramente en el grupo tratado con budesónida/formoterol (7-8 días/paciente/año en comparación con las cifras de 11-12 y 9-12 días de los grupos tratados con placebo y formoterol, respectivamente). En cuanto a los cambios producidos en los parámetros de funcionamiento pulmonar como el VEMS, el tratamiento con budesónida/formoterol no fue superior al tratamiento con formoterol solo.
Caudal inspiratorio máximo a través del dispositivo Spiromax
Se llevó a cabo un estudio abierto aleatorizado con placebo en niños y adolescentes con asma (de 6 a 17 años de edad), adultos con asma (de 18 a 45 años de edad), adultos con enfermedad pulmonar obstructiva crónica (EPOC - edad > 50 años) y voluntarios sanos (de 18 a 45 años de edad) para evaluar el caudal inspiratorio máximo (CIM) y otros parámetros inhalatorios después de la inhalación a través de un dispositivo Spiromax (con placebo) comparado con la inhalación a través de un dispositivo inhalador de polvo seco multidosis ya comercializado (con placebo). También se evaluó en estos grupos de sujetos la influencia de la mejora del entrenamiento en la técnica inhalatoria con el inhalador de polvo seco sobre la velocidad y el volumen de la inhalación. Los datos de este estudio indican que, independientemente de la edad y de la intensidad de la enfermedad subyacente, los niños, los adolescentes y los adultos con asma, al igual que los pacientes con EPOC, pudieron generar caudales inspiratorios a través del dispositivo Spiromax similares a los generados a través del dispositivo inhalador de polvo seco multidosis comercializado. El CIM medio conseguido por los pacientes con asma o con EPOC estuvo por encima de 60 l/min, un caudal inspiratorio con el que se sabe que ambos dispositivos estudiados liberan cantidades similares de fármaco en los pulmones. Muy pocos pacientes tuvieron un CIM por debajo de 40 l/min; cuando los CIM fueron inferiores a 40 l/min parece que no se crearon agrupamientos por edad o por gravedad de la enfermedad.
5.2 Propiedades farmacocinéticas
Absorción
Tanto la combinación de dosis fija de budesónida y formoterol como los productos correspondientes por separado han demostrado ser bioequivalentes con respecto a la exposición sistémica de budesónida y formoterol, respectivamente. A pesar de esto, se ha observado un pequeño aumento de la inhibición del cortisol tras la administración de la combinación a dosis fija en comparación con los productos por separado. Sin embargo, se considera que esta diferencia no afecta a la seguridad clínica.
No hubo indicios de interacciones farmacocinéticas entre la budesónida y el formoterol.
Los parámetros farmacocinéticos de ambas sustancias fueron similares después de la administración de budesónida y formoterol por separado o como combinación de dosis fija. En el caso de la budesónida, el área bajo la curva (AUC) fue ligeramente mayor, su tasa de absorción más rápida y su concentración plasmática máxima más alta después de la administración de la combinación de dosis fija. En el formoterol, la concentración plasmática máxima fue similar tras administrar la combinación de dosis fija. La budesónida inhalada se absorbe rápidamente y la concentración plasmática máxima se alcanza a los 30 minutos de la inhalación. En los estudios, el depósito pulmonar medio de la budesónida después de la inhalación a través del inhalador de polvo osciló entre el 32 y el 44 % de la dosis administrada. La biodisponibilidad sistémica es de aproximadamente el 49 % de la dosis administrada. En niños de 6 a 16 años, el depósito pulmonar se mantiene dentro del mismo margen que en los adultos tras la administración de una misma dosis. Sin embargo, no se han hallado las concentraciones plasmáticas resultantes.
El formoterol inhalado se absorbe rápidamente, y la concentración plasmática máxima se alcanza a los 10 minutos de la inhalación. En los estudios, el depósito pulmonar medio del formoterol después de la inhalación a través del inhalador de polvo osciló entre el 28 y el 49 % de la dosis administrada. La biodisponibilidad sistémica es de aproximadamente el 61 % de la dosis administrada.
Distribución
La unión a proteínas plasmáticas es aproximadamente del 50 % en el caso del formoterol y del 90 % en la budesónida. El volumen de distribución es de unos 4 l/kg en el formoterol y de 3 l/kg para la budesónida. El formoterol se inactiva a través de reacciones de conjugación (se forman metabolitos activos O-desmetilado y desformilado, pero se observan principalmente como conjugados inactivos). La budesónida experimenta un amplio grado de biotransformación (aproximadamente del 90 %) en su primer paso por el hígado hacia metabolitos de baja actividad glucocorticosteroide. La actividad glucocorticosteroide de los metabolitos principales, 6-p-hidroxi-budesónida y 16-a-hidroxi-prednisolona, es inferior al 1 % de la que muestra la budesónida. No hubo indicios de interacciones metabólicas ni de reacciones de desplazamiento entre el formoterol y la budesónida.
Eliminación
La mayor parte de la dosis de formoterol se transforma a través del metabolismo hepático y después se elimina por el riñón. Tras la inhalación, entre un 8 y un 13 % de la dosis administrada de formoterol se excreta sin metabolizar en la orina. El formoterol muestra un elevado aclaramiento sistémico (aproximadamente 1,4 l/min), y su semivida de eliminación terminal es de 17 horas por término medio.
La budesónida se elimina a través de un proceso metabólico catalizado principalmente por la enzima CYP3A4. Los metabolitos de la budesónida se eliminan como tales o en forma conjugada en la orina. En la orina se han detectado solo cantidades insignificantes de budesónida no modificada. La budesónida muestra un elevado aclaramiento sistémico (aproximadamente 1,2 l/min) y su semivida de eliminación plasmática tras la administración intravenosa es de 4 horas por término medio.
Relación(es) farmacocinéticas/farmacodinámica(s)
Se desconoce la farmacocinética de la budesónida o del formoterol en niños y en pacientes con insuficiencia renal. La exposición a la budesónida y al formoterol podría incrementarse en pacientes con enfermedades hepáticas.
Perfil farmacocinético de BiResp Spiromax
En estudios farmacocinéticos con y sin bloqueo con carbón vegetal se comparó BiResp Spiromax con un producto alternativo autorizado por vía inhalatoria con una combinación de dosis fija que contiene los mismos principios activos, budesónida y formoterol, y demostró ser equivalente en cuanto a exposición sistémica (seguridad) y depósito pulmonar (eficacia).
5.3 Datos preclínicos sobre seguridad
La toxicidad observada en estudios en animales con budesónida y formoterol en combinación o por separado consistió en efectos asociados a una actividad farmacológica desmesurada.
En estudios de reproducción con animales, se ha observado que los glucocorticosteroides como la budesónida provocan malformaciones (fisura palatina o malformaciones esqueléticas). Sin embargo, estos resultados experimentales en animales no parecen ser relevantes para los seres humanos a las dosis recomendadas. Los estudios de reproducción en animales tratados con formoterol han mostrado cierta reducción de la fertilidad en ratas macho tras una exposición sistémica elevada y pérdidas de implantación, así como menor supervivencia posnatal temprana y peso al nacer con exposiciones sistémicas considerablemente más altas de las alcanzadas durante el uso clínico. Sin embargo, estos resultados experimentales en animales no parecen ser relevantes para los seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Lactosa monohidrato.
6.2 Incompatibilidades
No procede.
6.3 Período de validez
3 años.
Después de abrir el envoltorio laminado: 6 meses.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C.
Mantenga la tapa de la boquilla cerrada después de retirar el envoltorio laminado.
6.5 Naturaleza y contenido del envase
El inhalador es blanco, con una tapa semitransparente de color rojo vino para la boquilla. El inhalador está hecho de acrilonitrilobutadienoestireno (ABS), polietilentereftalato (PT) y polipropileno (PP). Cada inhalador contiene 120 dosis y lleva un envoltorio laminado.
Envases múltiples con 1, 2 o 3 inhaladores.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Teva Pharma B.V.
Swensweg 5, 2031GA Haarlem Países Bajos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/921/001
EU/1/14/921/002
EU/1/14/921/003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 28 abril 2014 Fecha de la última renovación:
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.com.
1. NOMBRE DEL MEDICAMENTO
BiResp Spiromax 320 microgramos/9 microgramos polvo para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada dosis administrada (la dosis que sale por la boquilla del Spiromax) contiene 320 microgramos de budesónida y 9 microgramos de formoterol fumarato dihidrato.
Esto equivale a una dosis medida de 400 microgramos de budesónida y 12 microgramos de formoterol fumarato dihidrato.
Excipiente(s) con efecto conocido:
Cada dosis contiene aproximadamente 10 miligramos de lactosa (como monohidrato).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para inhalación.
Polvo blanco.
Inhalador blanco con tapa semitransparente de color rojo vino para la boquilla.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
BiResp Spiromax está indicado solamente en adultos de 18 años de edad en adelante.
Asma
BiResp Spiromax está indicado para el tratamiento habitual del asma cuando sea adecuado el uso de una combinación (un corticosteroide por vía inhalatoria y un agonista de los receptores adrenérgicos P2 de acción prolongada):
- en pacientes no controlados adecuadamente con corticosteroides inhalados y con agonistas de los receptores adrenérgicos P2 de acción corta inhalados a demanda.
o bien
- en pacientes ya controlados adecuadamente con corticosteroides y con agonistas de los receptores adrenérgicos P2 de acción prolongada inhalados.
EPOC
Tratamiento sintomático de pacientes con EPOC grave (VEMS < 50 % de lo normal previsto) y antecedentes de exacerbaciones repetidas, que continúan presentando síntomas significativos a pesar del tratamiento regular con broncodilatadores de acción prolongada.
4.2 Posología y forma de administración
BiResp Spiromax está indicado solamente en adultos de 18 años de edad en adelante. BiResp Spiromax no está indicado para su uso en niños de 12 años o menores, ni en adolescentes de 13 a 17 años de edad.
Posología
Asma
BiResp Spiromax no está indicado para el tratamiento inicial del asma.
BiResp Spiromax no es un tratamiento adecuado para pacientes adultos que solo presenten asma leve no controlada adecuadamente con un corticoesteroide inhalado y con agonistas de los receptores adrenérgicos P2 de acción corta inhalados a demanda.
La dosificación de BiResp Spiromax es individual y debe ajustarse a la gravedad de la enfermedad. Esto debe tenerse en cuenta no solo al iniciar un tratamiento con medicamentos combinados, sino también cuando se ajuste la dosis de mantenimiento. Si un paciente en concreto requiere una combinación de dosis distintas a las existentes en el inhalador combinado, deben prescribirse dosis adecuadas de agonistas de los receptores adrenérgicos P2 o corticosteroides mediante el uso de inhaladores individuales.
Una vez controlados los síntomas del asma, podrá contemplarse reducir gradualmente la dosis de BiResp Spiromax. Es preciso que el médico o el profesional sanitario revalúen periódicamente a los pacientes para que la dosis de BiResp Spiromax siga siendo la óptima. Deberá buscarse la dosis más baja posible que permita mantener un control eficaz de los síntomas.
Cuando resulte adecuado ajustar la dosis a la baja hasta una concentración menor que la de BiResp Spiromax, será necesario cambiar a una combinación alternativa de dosis fija con budesónida y fumarato de formoterol que contenga una dosis menor del corticoesteroide inhalado. Cuando se mantenga un control a largo plazo de los síntomas con la dosis recomendada más baja, el paso siguiente puede consistir en realizar una prueba con el corticosteroide inhalado solo.
En la práctica habitual, cuando se consigue controlar los síntomas con el régimen posológico de dos veces al día con una menor concentración de producto, el descenso hasta una dosis eficaz menor puede incluir la administración una vez al día si, en opinión del médico, es necesario un broncodilatador de acción prolongada para mantener el control en lugar de un tratamiento con un corticoesteroide inhalado solo.
Es necesario advertir a los pacientes que tengan disponible su broncodilatador adicional de acción rápida como tratamiento de “rescate” en todo momento.
Dosis recomendadas:
Adultos (de 18 años en adelante): 1 inhalación dos veces al día. Algunos pacientes pueden requerir hasta un máximo de 2 inhalaciones dos veces al día.
El uso creciente de un broncodilatador adicional de acción rápida indica un empeoramiento de la enfermedad subyacente y exige reevaluar el tratamiento contra el asma.
BiResp Spiromax de 320 microgramos/9 microgramos solo debe utilizarse como terapia de mantenimiento. Existen concentraciones más bajas de BiResp Spiromax para tratamientos de mantenimiento y alivio.
EPOC
Dosis recomendadas:
Adultos (de 18 años en adelante): 1 inhalación dos veces al día
Pacientes de edad avanzada (> 65 años)
No existen requisitos de dosificación especiales para pacientes de edad avanzada.
Pacientes con insuficiencia renal o hepática
No se dispone de datos para el uso de una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato en pacientes con insuficiencia hepática o renal. Dado que la budesónida y el formoterol se eliminan principalmente a través del metabolismo hepático, cabe esperar un aumento de la exposición en pacientes con cirrosis hepática grave.
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de BiResp Spiromax en niños de hasta 12 años y adolescentes de 13 a 17 años de edad. No se dispone de datos.
No se recomienda el uso de este medicamento en niños ni en adolescentes menores de 18 años de edad.
Forma de administración
Vía inhalatoria.
Spiromax es un inhalador impulsado por el flujo inspiratorio de la respiración, lo que significa que los principios activos se liberan en las vías respiratorias cuando el paciente inhala a través de la boquilla. Se ha visto que los pacientes con asma moderada y grave podían generar un caudal inspiratorio suficiente para que Spiromax administrara la dosis terapéutica (ver sección 5.1).
BiResp Spiromax debe utilizarse correctamente para conseguir un tratamiento eficaz. Así pues, es preciso advertir a los pacientes que lean el prospecto del paciente con atención y que sigan las instrucciones de uso que en él se especifican.
El uso de BiResp Spiromax requiere tres pasos sencillos que se explican a continuación: abrir, respirar y cerrar.
Abrir: sujetar el Spiromax de manera que la tapa de la boquilla quede abajo y abrir la tapa de la boquilla replegándola hacia abajo hasta que se abra del todo cuando se oiga un clic.
Respirar: colocar la boquilla entre los dientes con los labios cerrados alrededor de la boquilla, no morder la boquilla del inhalador. Inspirar con fuerza y profundamente a través de la boquilla. Retirar el Spiromax de la boca y retener la respiración 10 segundos o todo el tiempo que puedan los pacientes sin sentirse incómodos.
Cerrar: espirar suavemente y cerrar la tapa de la boquilla.
También es importante advertir a los pacientes que no agiten el inhalador antes de usarlo, que no exhalen a través del Spiromax y que no bloqueen las entradas de aire cuando estén preparando el paso de “Respirar”.
Debe aconsejarse igualmente a los pacientes que se enjuaguen la boca con agua después de la inhalación (ver sección 4.4).
El paciente puede notar un sabor al utilizar BiResp Spiromax debido al uso de lactosa como excipiente.
Hipersensibilidad a los principios activos o al excipiente incluido en la sección 6.1. 4.4 Advertencias y precauciones especiales de empleo
General
Se recomienda ir reduciendo progresivamente la dosis a la hora de interrumpir el tratamiento en lugar de suspenderlo bruscamente.
Si los pacientes consideran que el tratamiento es ineficaz o superan la dosis máxima recomendada de BiResp Spiromax, deben recibir asistencia médica (ver sección 4.2). Un empeoramiento repentino y progresivo en el control del asma o de la EPOC puede poner en peligro la vida del paciente, y este debe ser examinado por un médico de inmediato. En este caso, debe estudiarse la necesidad de incrementar el tratamiento con corticosteroides, p. ej., con un ciclo de corticosteroides orales o con antibioterapia si existe infección.
Es necesario advertir a los pacientes que tengan disponible su inhalador de rescate en todo momento, ya sea BiResp Spiromax (para los pacientes con asma que utilicen BiResp Spiromax como terapia de mantenimiento y alivio) o un broncodilatador adicional de acción rápida (para los pacientes de asma que utilicen BiResp Spiromax solo como terapia de mantenimiento).
Debe recordarse a los pacientes que se administren su dosis de mantenimiento de BiResp Spiromax según lo prescrito, aunque no tengan síntomas. No se ha investigado el uso preventivo de BiResp Spiromax, p. ej., antes de hacer ejercicio. Las inhalaciones de alivio de BiResp Spiromax deben realizarse en respuesta a los síntomas, pero no están pensadas para un uso preventivo regular, p. ej., antes de hacer ejercicio. En esos casos debe sopesarse el uso de un broncodilatador adicional de acción rápida.
Síntomas de asma
Es preciso que el médico o el profesional sanitario revalúen periódicamente a los pacientes para que la dosis de BiResp Spiromax siga siendo la óptima. Se debe buscarse una dosis lo más baja posible pero que permita mantener un control eficaz de los síntomas. Una vez controlados los síntomas del asma, podrá contemplarse reducir gradualmente la dosis de BiResp Spiromax. Cuando resulte adecuado ajustar la dosis a la baja hasta una concentración menor que la de BiResp Spiromax, será necesario cambiar a una combinación alternativa de dosis fija con budesónida y fumarato de formoterol que contenga una dosis menor del corticoesteroide inhalado.
Es importante vigilar con regularidad a los pacientes a medida que se vaya reduciendo el tratamiento. Los pacientes no deben iniciar el tratamiento con BiResp Spiromax durante las exacerbaciones o si muestran un empeoramiento significativo o un deterioro agudo del asma.
Pueden producirse exacerbaciones y reacciones adversas graves relacionadas con el asma durante el tratamiento con BiResp Spiromax. Debe pedirse a los pacientes que continúen el tratamiento, pero que acudan al médico si los síntomas del asma siguen sin estar controlados o empeoran después de iniciar el tratamiento con BiResp Spiromax.
Pueden producirse broncoespasmos paradójicos, con un aumento inmediato de las sibilancias y de la disnea después de administrar la dosis. Si el paciente experimenta un broncoespasmo paradójico, es preciso suspender de inmediato el BiResp Spiromax, evaluar al paciente e instaurar un tratamiento alternativo, si es necesario. El broncoespasmo paradójico responde a los broncodilatadores inhalados de acción rápida y debe tratarse de inmediato (ver sección 4.8).
Efectos sistémicos
Pueden aparecer efectos sistémicos con cualquier corticosteroide inhalado, especialmente con la administración de dosis elevadas durante períodos prolongados. La probabilidad de que estos efectos aparezcan con un tratamiento por vía inhalatoria es mucho menor que con los corticosteroides por vía oral.
Entre los posibles efectos sistémicos se incluyen síndrome de Cushing, manifestaciones cushingoides, inhibición suprarrenal, retraso del crecimiento en niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma y, con menos frecuencia, diversos efectos psicológicos o conductuales, como hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresividad (especialmente en niños) (ver sección 4.8).
Se recomienda vigilar regularmente la estatura de los niños que reciban tratamientos prolongados con corticoesteroides inhalados. Si se ralentiza el crecimiento, se debe revaluar el tratamiento con el fin de reducir la dosis de corticoesteroide inhalado al mínimo necesario para mantener un control eficaz del asma, si es posible. Es preciso sopesar cuidadosamente las ventajas del tratamiento con corticoesteroides y el riesgo de inhibición del crecimiento. Asimismo, debe contemplarse remitir al paciente a un especialista en neumología pediátrica.
Los escasos datos que existen procedentes de estudios a largo plazo indican que la mayoría de los niños y de los adolescentes tratados con budesónida inhalada acaban por alcanzar su estatura de adultos. Sin embargo, se ha observado una reducción inicial pequeña pero transitoria en el crecimiento (aproximadamente de 1 cm). Por lo general esto se produce durante el primer año de tratamiento.
Efectos sobre la densidad ósea
Es preciso tener en cuenta los posibles efectos sobre la densidad ósea, particularmente en pacientes tratados con dosis elevadas durante períodos prolongados que presenten factores de riesgo de osteoporosis coexistentes.
Los estudios a largo plazo realizados en niños con budesónida inhalada a dosis medias diarias de 400 microgramos (dosis medida) o en adultos a dosis diarias de 800 microgramos (dosis medida) no han mostrado ningún efecto significativo sobre la densidad mineral ósea. No se dispone de información acerca del efecto de una combinación de dosis fija a base de budesónida/formoterol fumarato dihidrato a dosis más altas.
Funcionamiento suprarrenal
Si hubiera algún motivo para suponer que se ha producido insuficiencia suprarrenal con tratamientos anteriores a base de corticosteroides sistémicos, deberá tenerse cuidado cuando los pacientes pasen a recibir un tratamiento combinado de dosis fija a base de budesónida/fumarato de formoterol.
Las ventajas del tratamiento con budesónida inhalada normalmente minimizarían la necesidad de corticosteroides por vía oral, pero los pacientes que provengan de un tratamiento con corticosteroides por vía oral pueden seguir presentando riesgo de insuficiencia de la reserva suprarrenal durante un período considerable. La recuperación puede prolongarse durante un período considerable una vez suspendidos los corticosteroides por vía oral, de manera que los pacientes con dependencia de los corticosteroides por vía oral que cambien a la budesónida por vía inhalatoria pueden seguir presentando riesgo de insuficiencia suprarrenal durante un período considerable. En estas circunstancias, es preciso vigilar con regularidad el funcionamiento del eje hipotalámico-pituitario-adrenal (HPA).
Altas dosis de corticosteroides
El tratamiento prolongado con dosis elevadas de corticosteroides inhalados, particularmente si se trata de dosis superiores a las recomendadas, también puede producir una inhibición suprarrenal clínicamente significativa. Por tanto, debe sopesarse la instauración de cobertura sistémica adicional con corticosteroides durante períodos de estrés, como por ejemplo, en caso de infecciones graves o de intervenciones quirúrgicas programadas. Una reducción rápida en la dosis de corticosteroides puede provocar una crisis suprarrenal aguda. Los síntomas y los signos que pueden observarse en las crisis suprarrenales agudas tal vez sean vagos, pero pueden incluir, entre otros, anorexia, dolor abdominal, pérdida de peso, cansancio, cefalea, náuseas, vómitos, disminución del nivel de consciencia, convulsiones, hipotensión e hipoglucemia.
El tratamiento con budesónida inhalada o corticosteroides sistemáticos complementarios no debe interrumpirse bruscamente.
Transferencia desde un tratamiento por vía oral
Durante el paso de un tratamiento por vía oral a uno combinado de dosis fija de budesónida/fumarato de formoterol se experimenta una acción sistémica de los corticosteroides generalmente más baja que puede dar lugar a la aparición de síntomas alérgicos o artríticos, como rinitis, eccema y dolor muscular y articular. Debe instaurarse tratamiento específico para estas enfermedades. Debe sospecharse un efecto insuficiente en general de los glucocorticosteroides si, en casos aislados, se producen síntomas como cansancio, cefalea, náuseas y vómitos. En estos casos puede ser necesario incrementar temporalmente la dosis de glucocorticosteroides orales.
Infecciones bucales
Para minimizar el riesgo de infección bucofaríngea por cándida, debe indicarse al paciente que se enjuague la boca con agua después de inhalar la dosis. En caso de candidiasis bucofaríngea, los pacientes también deben enjuagarse la boca con agua después de las inhalaciones necesarias.
Neumonía en pacientes con EPOC
Se ha observado un aumento en la incidencia de neumonía, incluyendo neumonía que requiere hospitalización, en pacientes con EPOC que reciben corticoides inhalados. Existe alguna evidencia de un mayor riesgo de neumonía con el aumento de la dosis de esteroides, pero esto no ha sido demostrado de manera concluyente en todos los estudios.
No hay evidencia clínica concluyente de diferencias intra-clase en la magnitud del riesgo de neumonía entre los corticoides inhalados.
Los médicos deben permanecer vigilantes ante el posible desarrollo de neumonía en pacientes con EPOC, ya que las características clínicas de estas infecciones se superponen con los síntomas de exacerbación de la EPOC.
Los factores de riesgo de neumonía en pacientes con EPOC incluyen el tabaquismo habitual, pacientes de edad avanzada, bajo índice de masa corporal (IMC) y EPOC grave.
Interacción con otros medicamentos
Debe evitarse el tratamiento concomitante con itraconazol, ritonavir u otros inhibidores potentes del CYP3A4 (ver sección 4.5). Si esto no es posible, el período de separación entre administraciones de los medicamentos que interaccionen debe ser lo más largo posible. No se recomienda el uso de tratamientos combinados con dosis fija de budesónida/fumarato de formoterol en los pacientes que estén consumiendo inhibidores potentes del CYP3A4.
Precaución con enfermedades especiales
La combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato debe administrarse con precaución en pacientes que presenten hipertiroidismo, feocromocitoma, diabetes mellitus, hipopotasemia sin tratar, miocardiopatía obstructiva hipertrófica, estenosis aórtica subvalvular idiopática, hipertensión grave, aneurisma u otros trastornos cardiovasculares graves, como isquemia cardíaca, taquiarritmias o insuficiencia cardíaca grave.
Es preciso tener cuidado al tratar a pacientes con prolongación del intervalo QTc. El propio formoterol puede provocar prolongación del intervalo QTc.
Es preciso reevaluar la necesidad del tratamiento y la dosis de los corticosteroides inhalados en pacientes con tuberculosis pulmonar activa o latente, o con infecciones fungicas y víricas en las vías respiratorias.
En los pacientes diabéticos deben efectuarse controles de glucemia adicionales.
Agonistas de los receptores adrenérgicos B2
Puede producirse hipopotasemia grave con la administración de dosis elevadas de agonistas de los receptores adrenérgicos B2. El tratamiento concomitante de agonistas de los receptores adrenérgicos B2 con medicamentos que puedan producir hipopotasemia o potenciar un efecto hipopotasiémico, p. ej., los derivados de la xantina, los corticosteroides y los diuréticos, puede incrementar el posible efecto hipopotasiémico del agonista de los receptores adrenérgicos B2.
El tratamiento con agonistas de los receptores adrenérgicos B2 puede provocar un incremento de los niveles sanguíneos de insulina, ácidos grasos libres, glicerol y cuerpos cetónicos.
Se recomienda precaución especial en caso de asma inestable con el uso variable de broncodilatadores de rescate, en el asma grave aguda (ya que el riesgo asociado puede incrementarse por la hipoxia) y en otras enfermedades en las que exista una mayor probabilidad de desarrollar hipopotasemia. Se recomienda vigilar los niveles séricos de potasio en estas circunstancias.
Excipientes
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a la galactosa, deficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa, no deben tomar este medicamento. El excipiente lactosa contiene pequeñas cantidades de proteínas lácteas que podrían provocar reacciones alérgicas.
4.5 Interacción con otros medicamentos y otras formas de interacción
Interacciones farmacocinéticas
Los inhibidores potentes del CYP3A4 (p. ej., ketoconazol, itraconazol, voriconazol, posaconazol, claritromicina, telitromicina, nefazodona e inhibidores de la proteasa del VIH) pueden incrementar considerablemente los niveles plasmáticos de budesónida, y debe evitarse su uso concomitante. Si esto no es posible, el período de separación entre administraciones del inhibidor y la budesónida debe ser lo más largo posible (ver sección 4.4).
El potente inhibidor del CYP3A4 ketoconazol, a una dosis de 200 mg diarios, multiplicó por seis por término medio los niveles plasmáticos de budesónida (una sola dosis de 3 mg) administrada concomitantemente por vía oral. Cuando se administró el ketoconazol 12 horas después de la budesónida, la concentración unicamente se triplicó por término medio, lo que muestra que la separación de los momentos de administración puede reducir el incremento en los niveles plasmáticos. Algunos datos acerca de esta interacción con dosis elevadas de budesónida inhalada indican que pueden producirse incrementos considerables en los niveles plasmáticos (del cuádruple, por término medio) al administrar 200 mg una vez al día de itraconazol junto con budesónida inhalada (dosis unica de 1000 microgramos).
Interacciones farmacodinámicas
Los bloqueantes adrenérgicos P pueden debilitar o inhibir el efecto del formoterol. Así pues, una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato no debe administrarse junto con bloqueantes adrenérgicos P (incluidos los colirios), a menos que existan motivos importantes para ello.
El tratamiento concomitante con quinidina, disopiramida, procainamida, fenotiazinas, antihistamínicos (terfenadina), inhibidores de la monoaminooxidasa y antidepresivos tricíclicos puede prolongar el intervalo QTc e incrementar el riesgo de arritmias ventriculares.
Asimismo, la levodopa, la levotiroxina, la oxitocina y el alcohol pueden alterar la tolerancia cardíaca hacia los simpaticomiméticos P2.
El tratamiento concomitante con inhibidores de la monoaminooxidasa, incluidos los medicamentos con propiedades similares, como la furazolidona y la procarbazina, puede precipitar reacciones hipertensivas.
Existe un riesgo elevado de arritmias en pacientes que reciben anestesia concomitante con hidrocarburos halogenados.
El uso concomitante de otros adrenérgicos P y anticolinérgicos puede tener un efecto broncodilatador aditivo.
La hipopotasemia puede incrementar la tendencia a las arritmias en pacientes tratados con glucósidos digitálicos.
No se ha observado que la budesónida y el formoterol interaccionen con ningún otro medicamento utilizado en el tratamiento del asma.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos clínicos sobre embarazos con exposición a una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato o al tratamiento concomitante con formoterol y budesónida. Los datos procedentes de un estudio sobre desarrollo embriofetal en ratas no mostraron pruebas de efectos adicionales con la combinación.
No existen datos adecuados sobre el uso de formoterol en mujeres embarazadas. En estudios reproductivos con animales, el formoterol ha provocado reacciones adversas a niveles de exposición sistémica muy elevados (ver sección 5.3).
Los datos de aproximadamente 2000 gestaciones con exposición no indican un mayor riesgo teratógeno asociado al uso de la budesónida inhalada. En estudios con animales se ha demostrado que los glucocorticosteroides provocan malformaciones (ver sección 5.3). Es probable que esto no sea relevante para los seres humanos dadas las dosis recomendadas.
Los estudios realizados en animales han detectado también la intervención de los niveles excesivos prenatales de glucocorticosteroides en el aumento del riesgo de retraso del desarrollo intrauterino, de enfermedades cardiovasculares en adultos y de cambios permanentes en la densidad de los receptores de glucocorticosteroides, en el ciclo metabólico de los neurotransmisores y en el comportamiento a exposiciones inferiores al intervalo de dosis teratógenas.
Durante el embarazo, una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato solo debe utilizarse cuando las ventajas superen a los riesgos. Se debe utilizar la dosis eficaz más baja de budesónida necesaria para mantener un control adecuado del asma.
Lactancia
La budesónida se excreta en la leche materna. Sin embargo, a dosis terapéuticas no se prevén efectos sobre los niños lactantes. Se desconoce si el formoterol pasa a la leche materna. Se han detectado pequeñas cantidades de formoterol en la leche materna de ratas. Solo debe estudiarse la administración de una combinación de dosis fija a base de budesónida y formoterol fumarato dihidrato en mujeres lactantes si el beneficio esperado para la madre es mayor que cualquier riesgo para el hijo.
Fertilidad
No se dispone de datos sobre fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de BiResp Spiromax sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Dado que BiResp Spiromax contiene tanto budesónida como formoterol, puede producirse el mismo patrón de reacciones adversas descrito con estas sustancias. No se ha observado un incremento en la incidencia de reacciones adversas con la administración simultánea de ambos compuestos. Las reacciones adversas más frecuentes son las predecibles desde el punto de vista farmacológico con los tratamientos de agonistas de los receptores adrenérgicos P2, como temblor y palpitaciones. Estas tienden a ser leves y por lo general desaparecen a los pocos días del tratamiento. En un ensayo clínico de 3 años sobre la budesónida en la EPOC se produjeron hematomas y neumonía con una frecuencia del 10 % y del 6 %, respectivamente, en comparación con el 4 % y el 3 % del grupo tratado con placebo (p < 0,001 y p < 0,01, respectivamente). BiResp Spiromax no está indicado en niños ni en adolescentes menores de 18 años de edad (véase la sección 4.2).
Tabla de reacciones adversas
Las reacciones adversas que se han asociado a la budesónida o al formoterol figuran a continuación aparecen ordenadas según la clasificación por órganos y sistemas y la frecuencia. Las frecuencias se definen como: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000), muy raras (< 1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Sistema de clasificación de órganos |
Frecuencia |
Reacción adversa |
|
Infecciones e infestaciones |
Frecuentes |
Candidiasis bucofaríngeas, neumonía (en pacientes con EPOC) |
|
Trastornos del sistema inmunológico |
Raras |
Reacciones de hipersensibilidad inmediatas y tardías, p. ej., exantema, urticaria, prurito, dermatitis, angioedema y reacción anafiláctica |
|
Trastornos endocrinos |
Muy raras |
Síndrome de Cushing, inhibición suprarrenal, retraso del crecimiento y disminución de la densidad mineral ósea |
|
Trastornos del |
Raros |
Hipopotasemia |
|
metabolismo y de la nutrición |
Muy raros |
Hiperglucemia |
|
Trastornos psiquiátricos |
Poco frecuentes |
Agresividad, hiperactividad psicomotora, ansiedad y trastornos del sueño |
|
Muy raras |
Depresión y cambios conductuales (predominantemente en niños) | |
|
Trastornos del sistema nervioso |
Frecuentes |
Cefalea y temblor |
|
Poco frecuentes |
Mareo | |
|
Muy raras |
Alteraciones del gusto | |
|
Trastornos oculares |
Muy raras |
Cataratas y glaucoma |
|
Trastornos cardíacos |
Frecuentes |
Palpitaciones |
|
Poco frecuentes |
Taquicardia | |
|
Raras |
Arritmias cardíacas, p. ej., fibrilación auricular, taquicardia supraventricular y extrasístoles | |
|
Muy raras |
Angina de pecho. Prolongación del intervalo QTc | |
|
Trastornos vasculares |
Muy raras |
Variaciones en la tensión arterial |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
Irritación leve de garganta, tos y ronquera |
|
Raras |
Broncoespasmo | |
|
Muy raras |
Broncoespasmo paradójico | |
|
Trastornos gastrointestinales |
Poco frecuentes |
Náuseas |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
Hematomas |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes |
Calambres musculares |
Descripción de reacciones adversas seleccionadas
La candidiasis bucofaríngea se debe al depósito de principio activo. Indicar al paciente que se enjuague la boca con agua después de cada dosis minimizará el riesgo. Las candidiasis bucofaríngeas suelen responder al tratamiento con antifungicos tópicos sin necesidad de suspender el corticosteroide inhalado.
En muy raras ocasiones pueden producirse broncoespasmos paradójicos, que afectan a menos de 1 por cada 10.000 personas y que producen un aumento inmediato de las sibilancias y de la disnea después de administrar la dosis. El broncoespasmo paradójico responde a los broncodilatadores inhalados de acción rápida y debe tratarse de inmediato. Es preciso suspender de inmediato el BiResp Spiromax, evaluar al paciente e instaurar un tratamiento alternativo, si es necesario (ver sección 4.4).
Pueden aparecer efectos sistémicos con los corticosteroides inhalados, especialmente con la administración de dosis elevadas durante períodos prolongados. La probabilidad de que estos efectos aparezcan es mucho menor que con los corticosteroides por vía oral. Entre los posibles efectos sistémicos se incluyen síndrome de Cushing, manifestaciones cushingoides, inhibición suprarrenal, retraso del crecimiento en niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma. También pueden producirse aumento de la susceptibilidad a las infecciones y alteración de la capacidad para adaptarse al estrés. Es probable que los efectos dependan de la dosis, del tiempo de exposición, de la exposición concomitante y previa a corticosteroides y de la sensibilidad individual.
El tratamiento con agonistas de los receptores adrenérgicos P2 puede provocar un incremento de los niveles sanguíneos de insulina, ácidos grasos libres, glicerol y cuerpos cetónicos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Una sobredosis de formoterol podría producir efectos típicos de los agonistas de los receptores adrenérgicos P2: temblor, cefalea y palpitaciones. Los síntomas descritos en casos aislados fueron taquicardia, hiperglucemia, hipopotasemia, prolongación del intervalo QTc, arritmia, náuseas y vómitos. Puede estar indicado un tratamiento complementario y sintomático. Una dosis de 90 microgramos administrados durante tres horas a pacientes con obstrucción bronquial aguda no produjo problemas de seguridad.
No se prevé que las sobredosis repentinas con budesónida, incluso a dosis excesivas, supongan un problema clínico. En caso de uso crónico en dosis excesivas, pueden aparecer efectos sistémicos de los glucocorticosteroides, como hipercorticalismo e inhibición suprarrenal.
Si fuera preciso suspender el tratamiento con BiResp Spiromax por sobredosis del componente de formoterol del medicamento, debe contemplarse la instauración de un tratamiento adecuado con corticosteroides inhalados.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos para enfermedades obstructivas de las vías respiratorias, adrenérgicos y otros fármacos para enfermedades obstructivas de las vías respiratorias.
Código ATC: R03AK07
Mecanismo de acción y efectos farmacodinámicos
BiResp Spiromax contiene formoterol y budesónida, que poseen modos de actuación distintos y muestran efectos aditivos en cuanto a reducción de las exacerbaciones del asma. A continuación se exponen los mecanismos de acción respectivos de ambos fármacos.
Budesónida
La budesónida es un glucocorticosteroide que, mediante su uso por vía inhalatoria, ejerce una acción antiinflamatoria dependiente de la dosis en las vías respiratorias, lo que reduce los síntomas y las exacerbaciones del asma. La budesónida inhalada causa menos reacciones adversas graves que los corticosteroides sistémicos. Se desconoce el mecanismo exacto responsable del efecto antiinflamatorio de los glucocorticosteroides.
Formoterol
El formoterol es un agonista selectivo de los receptores adrenérgicos P2 cuya inhalación provoca una relajación rápida y de acción prolongada de la musculatura lisa bronquial en pacientes con obstrucción reversible de las vías respiratorias. El efecto broncodilatador depende de la dosis y tarda en producirse entre 1 y 3 minutos. La duración del efecto es de al menos 12 horas después de administrar una sola dosis.
Eficacia clínica y seguridad
Asma
Los estudios clínicos realizados en adultos indican que la adición de formoterol a la budesónida mejoró los síntomas de asma y el funcionamiento pulmonar, además de reducir las exacerbaciones.
En dos estudios de 12 semanas de duración, el efecto de budesónida/formoterol sobre el funcionamiento pulmonar fue el mismo que el de la combinación no fija de budesónida y formoterol, y mayor que el de la budesónida sola. En todos los grupos de tratamiento se utilizó un agonista de los receptores adrenérgicos P2 de acción corta a demanda. No se produjeron signos de atenuación del efecto antiasmático con el tiempo.
Se llevaron a cabo dos estudios pediátricos de 12 semanas de duración en los cuales se trató a 265 niños de 6 a 11 años de edad con una dosis de mantenimiento de budesónida/formoterol (2 inhalaciones de 80 microgramos/4,5 microgramos/inhalación dos veces al día) y un agonista de los receptores adrenérgicos P2 de acción corta a demanda. En ambos estudios mejoró el funcionamiento pulmonar y el tratamiento fue bien tolerado en comparación con la dosis correspondiente de budesónida sola.
EPOC
En dos estudios de 12 meses de duración se evaluó el efecto sobre el funcionamiento pulmonar y el índice de exacerbaciones (definido como necesidad de tratamientos con corticosteroides orales, de tratamientos con antibióticos o de hospitalizaciones) en pacientes con EPOC grave. La mediana del VEMS en el momento de la inclusión en los ensayos fue de un 36 % del valor normal pronosticado. El promedio de exacerbaciones por año (según la definición anterior) mostró una reducción significativa con budesónida/formoterol en comparación con el tratamiento con formoterol solo o placebo (tasa media de 1,4 en comparación con 1,8-1,9 en el grupo tratado con placebo/formoterol). El promedio de días con tratamiento de corticosteroides orales por paciente durante los 12 meses se redujo ligeramente en el grupo tratado con budesónida/formoterol (7-8 días/paciente/año en comparación con las cifras de 11-12 y 9-12 días de los grupos tratados con placebo y formoterol, respectivamente). En cuanto a los cambios producidos en los parámetros de funcionamiento pulmonar como el VEMS, el tratamiento con budesónida/formoterol no fue superior al tratamiento con formoterol solo.
Caudal inspiratorio máximo a través del dispositivo Spiromax
Se llevó a cabo un estudio abierto aleatorizado con placebo en niños y adolescentes con asma (de 6 a 17 años de edad), adultos con asma (de 18 a 45 años de edad), adultos con enfermedad pulmonar obstructiva crónica (EPOC - edad > 50 años) y voluntarios sanos (de 18 a 45 años de edad) para evaluar el caudal inspiratorio máximo (CIM) y otros parámetros inhalatorios después de la inhalación a través de un dispositivo Spiromax (con placebo) comparado con la inhalación a través de un dispositivo inhalador de polvo seco multidosis ya comercializado (con placebo). También se evaluó en estos grupos de sujetos, la influencia de la mejora del entrenamiento en la técnica inhalatoria con el inhalador de polvo seco sobre la velocidad y el volumen de la inhalación. Los datos de este estudio indican que, independientemente de la edad y de la intensidad de la enfermedad subyacente, los niños, los adolescentes y los adultos con asma, al igual que los pacientes con EPOC, pudieron generar caudales inspiratorios a través del dispositivo Spiromax similares a los generados a través del dispositivo inhalador de polvo seco multidosis comercializado. El CIM medio conseguido por los pacientes con asma o con EPOC estuvo por encima de 60 l/min, un caudal inspiratorio con el que se sabe que ambos dispositivos estudiados liberan cantidades similares de fármaco en los pulmones. Muy pocos pacientes tuvieron un CIM por debajo de 40 l/min; cuando los CIM fueron inferiores a 40 l/min parece que no se crearon agrupamientos por edad o por gravedad de la enfermedad.
5.2 Propiedades farmacocinéticas
Absorción
Tanto la combinación de dosis fija de budesónida y formoterol como los productos correspondientes por separado han demostrado ser bioequivalentes con respecto a la exposición sistémica de budesónida y formoterol, respectivamente. A pesar de esto, se ha observado un pequeño aumento de la inhibición del cortisol tras la administración de la combinación a dosis fija en comparación con los productos por separado. Sin embargo, se considera que esta diferencia no afecta a la seguridad clínica.
No hubo indicios de interacciones farmacocinéticas entre la budesónida y el formoterol.
Los parámetros farmacocinéticos de ambas sustancias fueron similares después de la administración de budesónida y formoterol por separado o como combinación de dosis fija. En el caso de budesónida, el área bajo la curva (AUC) fue ligeramente mayor, su tasa de absorción más rápida y su concentración plasmática máxima más alta después de la administración de la combinación de dosis fija. En el formoterol, la concentración plasmática máxima fue similar tras administrar la combinación de dosis fija. La budesónida inhalada se absorbe rápidamente y la concentración plasmática máxima se alcanza a los 30 minutos de la inhalación. En los estudios, el depósito pulmonar medio de la budesónida después de la inhalación a través del inhalador de polvo osciló entre el 32 y el 44 % de la dosis administrada. La biodisponibilidad sistémica es de aproximadamente el 49 % de la dosis administrada. En niños de 6 a 16 años, el depósito pulmonar se mantiene dentro del mismo margen que en los adultos tras la administración de una misma dosis. Sin embargo, no se han hallado las concentraciones plasmáticas resultantes.
El formoterol inhalado se absorbe rápidamente, y la concentración plasmática máxima se alcanza a los 10 minutos de la inhalación. En los estudios, el depósito pulmonar medio del formoterol después de la inhalación a través del inhalador de polvo osciló entre el 28 y el 49 % de la dosis administrada. La biodisponibilidad sistémica es de aproximadamente el 61 % de la dosis administrada.
Distribución
La unión a proteínas plasmáticas es aproximadamente del 50 % en el caso del formoterol y del 90 % en la budesónida. El volumen de distribución es de unos 4 l/kg en el formoterol y de 3 l/kg para la budesónida. El formoterol se inactiva a través de reacciones de conjugación (se forman metabolitos activos O-desmetilado y desformilado, pero se observan principalmente como conjugados inactivos). La budesónida experimenta un amplio grado de biotransformación (aproximadamente del 90 %) en su primer paso por el hígado hacia metabolitos de baja actividad glucocorticosteroide. La actividad glucocorticosteroide de los metabolitos principales, 6-p-hidroxi-budesónida y 16-a-hidroxi-prednisolona, es inferior al 1 % de la que muestra la budesónida. No hubo indicios de interacciones metabólicas ni de reacciones de desplazamiento entre el formoterol y la budesónida.
Eliminación
La mayor parte de la dosis de formoterol se transforma a través del metabolismo hepático y después se elimina por el riñón. Tras la inhalación, entre un 8 y un 13 % de la dosis administrada de formoterol se excreta sin metabolizar en la orina. El formoterol muestra un elevado aclaramiento sistémico (aproximadamente 1,4 l/min), y su semivida de eliminación terminal es de 17 horas por término medio.
La budesónida se elimina a través de un proceso metabólico catalizado principalmente por la enzima CYP3A4. Los metabolitos de la budesónida se eliminan como tales o en forma conjugada en la orina. En la orina se han detectado solo cantidades insignificantes de budesónida no modificada. La budesónida muestra un elevado aclaramiento sistémico (aproximadamente 1,2 l/min) y su semivida de eliminación plasmática tras la administración intravenosa es de 4 horas por término medio.
Relación(es) farmacocinéticas/farmacodinámica(s)
Se desconoce la farmacocinética de la budesónida o del formoterol en niños y pacientes con insuficiencia renal. La exposición a la budesónida y al formoterol podría incrementarse en pacientes con enfermedades hepáticas.
Perfil farmacocinético de BiResp Spiromax
En estudios farmacocinéticos con y sin bloqueo con carbón vegetal se comparó BiResp Spiromax con un producto alternativo autorizado por vía inhalatoria con una combinación de dosis fija que contiene los mismos principios activos, budesónida y formoterol, y demostró ser equivalente en cuanto a exposición sistémica (seguridad) y depósito pulmonar (eficacia).
5.3 Datos preclínicos sobre seguridad
La toxicidad observada en estudios en animales con budesónida y formoterol en combinación o por separado consistió en efectos asociados a una actividad farmacológica desmesurada.
En estudios de reproducción con animales, se ha observado que los glucocorticosteroides como la budesónida provocan malformaciones (fisura palatina o malformaciones esqueléticas). Sin embargo, estos resultados experimentales en animales no parecen ser relevantes para los seres humanos a las dosis recomendadas. Los estudios de reproducción en animales tratados con formoterol han mostrado cierta reducción de la fertilidad en ratas macho tras una exposición sistémica elevada y pérdidas de implantación, así como menor supervivencia posnatal temprana y peso al nacer con exposiciones sistémicas considerablemente más altas de las alcanzadas durante el uso clínico. Sin embargo, estos resultados experimentales en animales no parecen ser relevantes para los seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Lactosa monohidrato.
6.2 Incompatibilidades
No procede.
6.3 Período de validez
3 años.
Después de abrir el envoltorio laminado: 6 meses.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C.
Mantenga la tapa de la boquilla cerrada después de retirar el envoltorio laminado.
6.5 Naturaleza y contenido del envase
El inhalador es blanco, con una tapa semitransparente de color rojo vino para la boquilla. El inhalador está hecho de acrilonitrilobutadienoestireno (ABS), polietilentereftalato (PT) y polipropileno (PP). Cada inhalador contiene 60 dosis y lleva un envoltorio laminado.
Envases múltiples con 1, 2 o 3 inhaladores.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
Teva Pharma B.V.
Swensweg 5, 2031GA Haarlem Países Bajos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/921/004
EU/1/14/921/005
EU/1/14/921/006
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 28 abril 2014 Fecha de la última renovación:
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.com.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACION CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Norton (Waterford) Limited T/A Teva Pharmaceuticals Ireland
Unit 27/35 IDA Industrial Park
Cork Road
Waterford
Republic of Ireland
Teva Pharmaceuticals Europe B.V.
Swensweg 5 NL-2031 GA Haarlem The Netherlands
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Las exigencias para la presentación de los informes periódicos de seguridad están establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y las actualizaciones posteriores publicadas en el portal web europeo sobre medicamentos
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva
información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
BiResp Spiromax 160 microgramos/4,5 microgramos polvo para inhalación budesónida / formoterol fumarato dihidrato
2. PRINCIPIO(S) ACTIVO(S)
Panel lateral: Cada dosis administrada contiene 160 microgramos de budesónida y 4,5 microgramos de formoterol fumarato dihidrato.
Esto equivale a una dosis medida de 200 microgramos de budesónida y 6 microgramos de formoterol fumarato dihidrato.
Panel delantero: Esta dosis administrada es equivalente a una dosis medida de 200 microgramos de budesónida y 6 microgramos de formoterol fumarato dihidrato.
3. LISTA DE EXCIPIENTES
Contiene lactosa. Para mayor información consultar el prospecto
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo para inhalación
1 inhalador con 120 dosis.
2 inhaladores y cada uno con 120 dosis
3 inhaladores y cada uno con 120 dosis
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía inhalatoria.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS_
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO_
Panel delantero: No apto para su uso en niños y adolescentes.
Panel lateral: Solo apto para adultos mayores de 18 años de edad en adelante.
8. FECHA DE CADUCIDAD
CAD
Usar el producto en los 6 meses siguientes a su extracción del envoltorio laminado.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25°C. Mantenga la tapa de la boquilla cerrada después de retirar el envoltorio laminado.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Teva Pharma B.V., Swensweg 5, 2031GA Haarlem, Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/921/001
EU/1/14/921/002
EU/1/14/921/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
BiResp Spiromax 160 mcg/4,5 mcg.
LÁMINA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
BiResp Spiromax 160 microgramos/4,5 microgramos polvo para inhalación. Budesónida / formoterol fumarato dihidrato Vía inhalatoria.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
Contiene 1 inhalador
6. OTROS
Mantenga la tapa de la boquilla cerrada y usar en los 6 meses siguientes a su extracción del envoltorio laminado.
Teva Pharma B.V.
INHALADOR
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
BiResp Spiromax 160 mcg/4,5 mcg polvo para inhalación budesónida/formoterol fumarato dihidrato Vía inhalatoria.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
120 dosis.
6. OTROS
Inicio
Teva Pharma B.V.
1. NOMBRE DEL MEDICAMENTO
BiResp Spiromax 320 microgramos/9 microgramos polvo para inhalación budesónida/formoterol fumarato dihidrato
2. PRINCIPIO(S) ACTIVO(S)
Panel lateral: Cada dosis administrada contiene 320 microgramos de budesónida y 9 microgramos de formoterol fumarato dihidrato.
Esto equivale a una dosis medida de 400 microgramos de budesónida y 12 microgramos de formoterol fumarato dihidrato.
Panel delantero: Esta dosis administrada es equivalente a una dosis medida de 400 microgramos de budesónida y 12 microgramos de formoterol fumarato dihidrato.
3. LISTA DE EXCIPIENTES
Contiene lactosa. Para mayor información consultar el prospecto
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo para inhalación
1 inhalador con 60 dosis.
2 inhaladores y cada uno con 60 dosis
3 inhaladores y cada uno con 60 dosis
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía inhalatoria.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS_
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO_
Panel delantero: No apto para su uso en niños y adolescentes.
Panel lateral: Solo apto para adultos de 18 años de edad en adelante.
8. FECHA DE CADUCIDAD
CAD
Usar el producto en los 6 meses siguientes a su extracción del envoltorio laminado.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25°C. Mantenga la tapa de la boquilla cerrada después de retirar el envoltorio laminado.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Teva Pharma B.V., Swensweg 5, 2031GA Haarlem, Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/921/004
EU/1/14/921/005
EU/1/14/921/006
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
BiResp Spiromax 320 mcg/9 mcg
LÁMINA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
BiResp Spiromax 320 microgramos/9 microgramos polvo para inhalación budesónida/formoterol fumarato dihidrato Vía inhalatoria.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
Contiene 1 inhalador
6. OTROS
Mantenga la tapa de la boquilla cerrada y usar en los 6 meses siguientes a su extracción del envoltorio laminado.
Teva Pharma B.V.
INHALADOR
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
BiResp Spiromax 320 mcg/9 mcg polvo para inhalación budesónida/formoterol fumarato dihidrato Vía inhalatoria.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
60 dosis.
6. OTROS
Inicio
Teva Pharma B.V.
B. PROSPECTO
Prospecto: información para el paciente
BiResp Spiromax 160 microgramos/4,5 microgramos polvo para inhalación
(budesónida/formoterol fumarato dihidrato)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es BiResp Spiromax y para qué se utiliza (página 3)
2. Qué necesita saber antes de empezar a usar BiResp Spiromax (página 5)
3. Cómo usar BiResp Spiromax (página 9)
4. Posibles efectos adversos (página 18)
5. Conservación de BiResp Spiromax (página 21)
6. Contenido del envase e información adicional (página 22)
1. Qué es BiResp Spiromax y para qué se utiliza
BiResp Spiromax contiene dos principios activos distintos: budesónida y formoterol fumarato dihidrato.
• La budesónida pertenece a un grupo de medicamentos denominados “corticosteroides” también conocidos como “esteroides”. Actúa reduciendo y previniendo la hinchazón y la inflamación de los pulmones y le ayuda a respirar más fácilmente.
• El formoterol fumarato dihidrato pertenece a un grupo de medicamentos denominados “agonistas de los receptores adrenérgicos P2 de acción prolongada” o “broncodilatadores”. Actúa relajando los músculos de las vías respiratorias. Esto contribuirá a abrir las vías respiratorias y le ayudará a respirar más fácilmente.
BiResp Spiromax está indicado para su uso solo en adultos de 18 años en adelante. BiResp Spiromax NO está indicado para su uso en niños menores de 12 años inclusive ni en adolescentes de 13 a 17 años de edad.
Su médico le ha prescrito este medicamento como tratamiento para el asma o la enfermedad pulmonar obstructiva crónica (EPOC).
Asma
BiResp Spiromax se puede recetar para el asma de dos formas distintas.
a) Es posible que le hayan recetado dos inhaladores para el asma: BiResp Spiromax junto con un “inhalador de alivio” adicional como salbutamol.
• Utilice BiResp Spiromax todos los días. Esto ayuda a evitar que aparezcan síntomas de asma como dificultad para respirar y sibilancias (pitidos en el pecho).
• Utilice el “inhalador de alivio” cuando tenga síntomas de asma para volver a respirar con facilidad.
b) Es posible que le hayan recetado BiResp Spiromax como inhalador único para el asma.
• Utilice BiResp Spiromax todos los días. Esto ayuda a evitar que aparezcan síntomas de asma como dificultad para respirar y sibilancias (pitidos en el pecho).
• Utilice BiResp Spiromax cuando necesite hacerse inhalaciones o administraciones adicionales para aliviar los síntomas de asma y volver a respirar con facilidad. No necesita un “inhalador de alivio” aparte para esto.
Enfermedad pulmonar obstructiva crónica (EPOC)
La EPOC es una enfermedad pulmonar de larga duración de las vías respiratorias de los pulmones, a menudo producida por fumar cigarrillos. Algunos de sus síntomas son dificultad para respirar, tos, molestias en el pecho y expectoración. BiResp Spiromax también se puede utilizar para tratar los síntomas de EPOC grave en adultos.
2. Qué necesita saber antes de empezar a usar BiResp Spiromax No use BiResp Spiromax:
Si es alérgico a la budesónida, al formoterol fumarato dihidrato o al otro componente de este medicamento (incluido en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a tomar BiResp Spiromax si
• es usted diabético.
• tiene alguna infección pulmonar.
• tiene la tensión arterial alta o si alguna vez ha tenido algún problema de corazón (incluyendo latido irregular del corazón, pulso muy rápido, estrechamiento de las arterias o insuficiencia cardíaca).
• tiene problemas de tiroides o de glándulas suprarrenales.
• tiene niveles bajos de potasio en la sangre.
• padece problemas graves de hígado.
Si ha estado tomando comprimidos de corticosteroides para el asma o la EPOC, el médico tal vez le reduzca el número de comprimidos cuando empiece a usar BiResp Spiromax. Si lleva mucho tiempo tomando comprimidos de corticosteroides, tal vez el médico quiera hacerle análisis de sangre con regularidad. Al reducir el número de comprimidos de corticosteroides es posible que en general no se encuentre bien aunque mejoren sus síntomas del pecho. Quizá note síntomas como nariz taponada o moqueo, debilidad o dolor de articulaciones o muscular y erupción (eccema). Si le molesta alguno de estos síntomas o si nota síntomas como dolor de cabeza, cansancio, náuseas (estómago revuelto) o vómitos (devolver), llame al médico inmediatamente. Tal vez tenga que tomar otros medicamentos si empieza a tener síntomas de alergia o de artritis. Hable con el médico si no está seguro de si debe seguir utilizando BiResp Spiromax.
El médico tal vez estudie añadir comprimidos de corticosteroides a su tratamiento habitual en épocas de estrés (por ejemplo, cuando tenga una infección de pecho o antes de una operación).
Niños y adolescentes
Este medicamento no deben utilizarlo niños ni adolescentes menores de 18 años.
Uso de BiResp Spiromax con otros medicamentos
Informe a su médico o farmacéutico si está tomando, si ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
En particular, informe a su médico o farmacéutico si está tomando cualquiera de los medicamentos siguientes:
• £ bloqueantes (como atenolol o propranolol para la tensión arterial alta o para enfermedades del corazón), incluidos los colirios (como timolol para el glaucoma).
• Medicamentos para el latido cardíaco rápido o irregular (como quinidina, disopiramida y procainamida).
• Medicamentos como la digoxina, que suelen usarse para la insuficiencia cardíaca.
• Diuréticos, también conocidos como “comprimidos para orinar” (como furosemida). Se utilizan para la tensión arterial alta.
• Corticosteroides tomados por la boca (como prednisolona).
• Medicamentos con xantina (como teofilina o aminofilina). Se utilizan a menudo para el asma.
• Otros broncodilatadores (como salbutamol).
• Antidepresivos tricíclicos (como amitriptilina) y el antidepresivo nefazodona.
• Medicamentos denominados inhibidores de la monoaminooxidasa (como fenelzina, furazolidona y procardazina).
• Fenotiazinas (como clorpromazina y proclorperazina).
• Medicamentos denominados “inhibidores de la proteasa del VIH” (como ritonavir) para tratar las infecciones por VIH.
• Medicamentos para tratar infecciones (como ketoconazol, itraconazol, voriconazol, posaconazol, claritromicina y telitromicina).
• Medicamentos para la enfermedad de Parkinson (como la levodopa).
• Medicamentos para problemas de tiroides (como la levotiroxina).
• Medicamentos para la alergia o antihistamínicos como terfenadina.
Si se encuentra en cualquiera de estas situaciones o si no está seguro, hable con su médico, farmacéutico o enfermero antes de utilizar BiResp Spiromax.
Avise también a su médico, farmacéutico o enfermero si le van a poner anestesia general para alguna operación o tratamiento dental.
Embarazo, lactancia y fertilidad
• Si está embarazada o en período de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico, farmacéutico o enfermero antes de utilizar BiResp Spiromax; NO utilice este medicamento a menos que se lo diga el médico.
• Si se queda embarazada mientras usa BiResp Spiromax, NO deje de usar BiResp Spiromax; hable con el médico inmediatamente.
Conducción y uso de máquinas
No es probable que BiResp Spiromax afecte a su capacidad para conducir o utilizar herramientas o máquinas.
BiResp Spiromax contiene lactosa.
La lactosa es un tipo de azúcar que se encuentra en la leche. La lactosa contiene pequeñas cantidades de proteínas lácteas que pueden provocar reacciones alérgicas. Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo usar BiResp Spiromax
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
• Es importante utilizar BiResp Spiromax a diario, aunque no tenga síntomas de asma o de EPOC en ese momento.
• Si está utilizando BiResp Spiromax para el asma, su médico querrá comprobar regularmente sus síntomas.
Asma
BiResp Spiromax se puede recetar para el asma de dos formas distintas. La cantidad de BiResp Spiromax que vaya a utilizar y cuándo lo haga dependerá de cómo se le haya recetado.
• Si se le ha recetado BiResp Spiromax y un inhalador de alivio aparte, lea la sección denominada “(A) Uso de BiResp Spiromax y de un 'inhalador de alivio aparte’”.
• Si se le ha recetado BiResp Spiromax como inhalador único, lea la sección denominada “(B) Uso de BiResp Spiromax como inhalador único para el asma”.
(A) Uso de BiResp Spiromax y de un inhalador de alivio aparte
Use BiResp Spiromax todos los días. Esto ayuda a evitar que aparezcan síntomas de asma.
Dosis recomendada:
Adultos (de 18 años en adelante)
1 o 2 inhalaciones (aplicaciones) dos veces al día.
Su médico puede aumentar la dosis hasta 4 inhalaciones dos veces al día.
Si sus síntomas están bien controlados, el médico puede pedirle que use este medicamento una vez al día.
El médico le ayudará a controlar el asma y ajustará la dosis de este medicamento a la más baja posible para controlar su asma. Si su médico cree que necesita una dosis más baja de la que está disponible en su BiResp Spiromax, su médico puede recetarle un inhalador alternativo que contenga los mismos principios activos que su BiResp Spiromax, pero con una dosis menor del corticoesteroide. Sin embargo, no ajuste el número de inhalaciones que le ha recetado su médico sin hablar primero con él.
Utilice el otro “inhalador de alivio” para tratar los síntomas de asma cuando aparezcan.
Lleve siempre consigo el “inhalador de alivio” y utilícelo para aliviar los ataques repentinos de disnea y sibilancias (pitidos en el pecho). No utilice BiResp Spiromax para tratar estos síntomas de asma.
(B) Uso de BiResp Spiromax como inhalador único para el asma
Solamente utilice BiResp Spiromax de este modo si se lo dice el médico.
Use BiResp Spiromax todos los días. Esto ayuda a evitar que aparezcan síntomas de asma.
Dosis recomendada:
Adultos (de 18 años en adelante):
1 inhalación por la mañana y 1 inhalación por la noche o bien
2 inhalaciones por la mañana o bien
2 inhalaciones por la noche.
Su médico puede aumentar la dosis a 2 inhalaciones dos veces al día.
síntomas de asma
(pitidos en el pecho),
Utilice también BiResp Spiromax como “inhalador de alivio” para tratar los cuando aparezcan.
• Si tiene síntomas de asma, como ataques repentinos de disnea y sibilancias haga 1 inhalación y espere unos minutos.
• Si no se encuentra mejor, haga otra inhalación.
• NO haga más de 6 inhalaciones en una misma ocasión.
Lleve siempre consigo el BiResp Spiromax y utilícelo para aliviar los ataques repentinos de disnea y sibilancias (pitidos en el pecho).
Normalmente no se necesita una dosis diaria total superior a 8 inhalaciones. Sin embargo, el médico le puede permitir hacer hasta 12 inhalaciones al día durante un período limitado.
Si habitualmente necesita hacer 8 o más inhalaciones al día, pida cita con el médico. Tal vez tengan que cambiarle el tratamiento.
NO use más de 12 inhalaciones en un total de 24 horas.
Si está haciendo ejercicio y nota síntomas de asma, use BiResp Spiromax tal como se describe aquí. Sin embargo, no use BiResp Spiromax justo antes de hacer ejercicio para evitar que aparezcan síntomas de asma.
Enfermedad pulmonar obstructiva crónica (EPOC)
Dosis recomendada:
Adultos (de 18 años en adelante):
2 inhalaciones dos veces al día.
El médico también puede prescribirle otro medicamento broncodilatador, como por ejemplo, un anticolinérgico (como el bromuro de tiotropio o de ipratropio), para su EPOC.
Preparación de su nuevo BiResp Spiromax
Antes de utilizar su nuevo inhalador BiResp Spiromax por primera vez, debe prepararlo del modo siguiente:
• Compruebe el indicador de dosis para ver que hay 120 inhalaciones en el inhalador.
• Anote en la etiqueta del inhalador la fecha en la que haya abierto el envase laminado.
• No agite el inhalador antes de usarlo.
Cómo realizar una inhalación
Cada vez que necesite hacer una inhalación, siga las instrucciones siguientes:
1. Sostenga el inhalador con la tapa semitransparente de la boquilla de color rojo vino por la parte inferior.

2. Abra la tapa de la boquilla replegándola hacia abajo hasta que se oiga un clic fuerte. El medicamento se mide de forma activa. El inhalador está listo para su uso.

3. Expulse todo el aire suavemente (sin que le llegue a resultar incómodo). No expulse el aire a través del inhalador.
4. Colóquese la boquilla entre los dientes. No muerda la boquilla. Cierre los labios alrededor de la boquilla. Tenga cuidado de no bloquear las entradas de aire.
Inspire por la boca lo más profundo y fuerte que pueda.
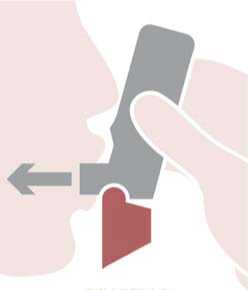
RESPIRAR
5. Aguante la respiración 10 segundos o todo el tiempo que pueda sin que llegue a resultarle incómodo.
6. Retírese el inhalador de la boca. Tal vez note algún sabor al realizar la inhalación.
7. A continuación, expulse el aire suavemente (pero sin expulsar el aire a través del inhalador). Cierre la tapa de la boquilla.
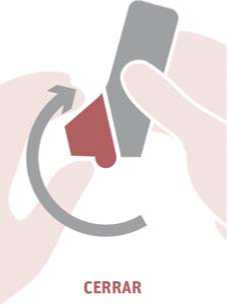
Si va a hacer una segunda inhalación, repita los pasos del 1 al 7.
Enjuáguese la boca con agua después de cada dosis y escúpala.
No intente desmontar el inhalador y tampoco retirar o torcer la tapa de la boquilla, ya que está fijada al inhalador y no debe desprenderse. No use el Spiromax si está deteriorado o si la boquilla se ha desprendido del Spiromax. No abra ni cierre la tapa de la boquilla a menos que vaya a usar el inhalador.
Limpieza del Spiromax
Mantenga el Spiromax seco y limpio.
Si es necesario, pase un paño o un pañuelo seco por la boquilla del Spiromax después de usarlo. Cuándo empezar a utilizar un nuevo Spiromax
• El indicador de dosis le informa de cuántas dosis (inhalaciones) quedan en el inhalador,
empezando por 120 inhalaciones cuando está lleno.

• El indicador de dosis, situado en la parte trasera del dispositivo, indica el número de inhalaciones que quedan solo con los números pares.
• Cuando queden 20 inhalaciones o menos hasta “8”, “6”, “4” o “2”, los números aparecerán en rojo sobre fondo blanco. Cuando los números aparezcan en rojo en la ventana, consulte al médico y solicite un nuevo inhalador.
Nota:
• La boquilla seguirá haciendo “clic” aunque el Spiromax esté vacío.
• Si abre y cierra la boquilla sin administrarse la inhalación, aun así el indicador de dosis la contará como una inhalación. Esta dosis quedará guardada en el inhalador para cuando tenga que administrarse la siguiente inhalación. Es imposible tomar accidentalmente medicamento extra o una dosis doble en una inhalación.
• Mantenga la boquilla cerrada en todo momento, salvo cuando se vaya a usar el inhalador.
Información importante acerca de los síntomas de asma o de EPOC
Si nota que se queda sin aliento o que tiene “pitidos” durante el uso de BiResp Spiromax, debe seguir
usándolo, pero acuda al médico lo antes posible, ya que puede necesitar tratamiento adicional.
Póngase en contacto con el médico inmediatamente si:
• Respira peor o si se despierta con frecuencia por la noche con dificultad para respirar o sibilancia (pitidos en el pecho).
• Nota opresión en el pecho por la mañana o si la sensación de opresión dura más de lo habitual.
Estos signos pueden indicar que no se le está controlando correctamente el asma o la EPOC y que tal
vez necesite inmediatamente un tratamiento distinto o adicional.
Una vez controlado el asma, tal vez el médico considere oportuno reducir gradualmente la dosis de BiResp Spiromax.
Si usa más BiResp Spiromax del que debe
Es importante que tome la dosis que le haya indicado el médico. No debe superar la dosis que le hayan recetado sin consultar con el médico.
Si usa más BiResp Spiromax del que debe, consulte al médico, farmacéutico o enfermero.
Los síntomas más frecuentes que pueden producirse si utiliza más BiResp Spiromax del que debe son temblores, dolor de cabeza o latidos rápidos del corazón.
Si olvidó usar BiResp Spiromax
Si olvidó tomar una dosis, hágalo en cuanto se acuerde. Sin embargo, no tome una dosis doble para compensar las dosis olvidadas. Si casi es la hora de su siguiente dosis, simplemente adminístrese la siguiente dosis a la hora habitual.
Si nota que tiene “pitidos” o que se queda sin aliento, o bien si nota cualquier otro síntoma de ataque de asma, use su “inhalador de alivio” y vaya al médico.
Si interrumpe el tratamiento con BiResp Spiromax
No deje de usar el inhalador sin hablar primero con el médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Si nota cualquiera de los síntomas siguientes, deje de utilizar BiResp Spiromax y consulte al
médico inmediatamente:
Efectos adversos raros: pueden afectar hasta 1 de cada 1.000 personas
• Hinchazón de la cara, especialmente alrededor de la boca (la lengua o la garganta, o bien dificultad para tragar) o urticaria junto con dificultad para respirar (angioedema) o sensación repentina de desmayo. Esto puede indicar que está teniendo una reacción alérgica, lo que también puede incluir erupción y picor.
• Broncoespasmo (opresión de los músculos de las vías respiratorias que provoca pitidos y dificultad para respirar). Si los pitidos aparecen repentinamente después de utilizar este medicamento, deje de usarlo y consulte con el médico inmediatamente.
Efectos adversos muy raros: pueden afectar hasta 1 de cada 10.000 personas
• Sibilancia (pitidos) aguda repentina y/o falta de aliento inmediatamente después de usar el inhalador (también denominado “broncoespasmo paradójico”). Si se produce cualquiera de estos síntomas, deje inmediatamente de usar BiResp Spiromax y utilice el “inhalador de alivio”. Consulte al médico inmediatamente, ya que tal vez tenga que cambiar de tratamiento.
Otros posibles efectos adversos:
Frecuentes: pueden afectar hasta 1 de cada 10 personas
• Palpitaciones (conciencia de los latidos de su propio corazón), temblores o agitación. Si se producen estos efectos, por lo general serán leves y desaparecerán a medida que siga utilizando BiResp Spiromax.
• Cándidas (una infección por hongos) en la boca. Esto será menos probable que ocurra si se enjuaga la boca con agua después de utilizar el medicamento.
• Dolor de garganta leve, tos y ronquera.
• Dolor de cabeza.
• Neumonía (infección de los pulmones) en pacientes con EPOC (efecto adverso frecuente).
Informe a su médico si usted tiene cualquiera de los siguientes síntomas mientras inhala BiResp Spiromax, podrían ser síntomas de una infección pulmonar:
• Fiebre o escalofríos
• Aumento de la producción de moco, cambio en el color del moco
• Aumento de la tos o aumento de dificultades para respirar
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas
• Sensación de inquietud, nerviosismo, agitación, ansiedad o enfado.
• Problemas para dormir.
• Sensación de mareo.
• Náuseas (estómago revuelto).
• Latidos cardíacos acelerados.
• Moratones.
• Calambres musculares.
Raros:
• Niveles bajos de potasio en la sangre.
• Latidos cardíacos irregulares.
Muy raros:
• Depresión.
• Cambios en el comportamiento, especialmente en niños.
• Dolor u opresión en el pecho (angina de pecho).
• Alteración del sistema eléctrico del corazón (prolongación del intervalo QTc).
• Aumento de la cantidad de azúcar (glucosa) en la sangre.
• Alteraciones en la percepción del gusto, como sabor desagradable en la boca.
• Cambios en la tensión arterial.
• Los corticosteroides inhalados pueden afectar a la producción normal de hormonas esteroideas en el organismo, especialmente si se utilizan en dosis altas durante períodos prolongados. Entre sus efectos se encuentran:
- cambios en la densidad mineral ósea (debilitamiento de los huesos)
- cataratas (enturbiamiento del cristalino del ojo)
- glaucoma (aumento de la presión en el ojo)
- ralentización de la velocidad de crecimiento de niños y adolescentes
- efectos sobre la glándula suprarrenal (glándula pequeña situada junto al riñón).
Estos efectos se producen muy rara vez y es mucho menos probable que aparezcan con los corticosteroides inhalados que en comprimidos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V.
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de BiResp Spiromax
• Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en la caja o en la etiqueta del inhalador después de CAD. La fecha de caducidad es el último día del mes que se indica.
• No conservar a temperatura superior a 25oC. Mantenga la tapa de la boquilla cerrada después de retirar el envoltorio laminado.
• Úselo en los 6 meses siguientes a su extracción del envoltorio laminado. Utilice la etiqueta del inhalador para anotar la fecha de apertura del envase laminado.
• Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de BiResp Spiromax
- Los principios activos son budesónida y formoterol fumarato dihidrato. Cada dosis administrada (inhalada) contiene 160 microgramos de budesónida y 4,5 microgramos de formoterol fumarato dihidrato. Esto equivale a una dosis medida de 200 microgramos de budesónida y
6 microgramos de formoterol fumarato dihidrato.
- El otro componente es lactosa monohidrato (ver sección 2, apartado “BiResp Spiromax contiene lactosa”).
Aspecto de BiResp Spiromax y contenido del envase
BiResp Spiromax es un polvo para inhalación.
Cada inhalador BiResp Spiromax contiene 120 inhalaciones y es de color blanco, con una tapa semitransparente de color rojo vino para la boquilla.
Envases de 1, 2 y 3 inhaladores. Puede que solamente estén comercializados algunos tamaños de envases en su país.
Titular de la autorización de comercialización
Teva Pharma B.V.,
Swensweg 5, 2031GA Haarlem, Países Bajos.
Responsable de la fabricación
Norton (Waterford) Limited T/A Teva Pharmaceuticals Ireland Unit 27/35, IDA Industrial Park, Cork Road, Waterford, Irlanda
Teva Pharmaceuticals Europe B.V., Swensweg 5, 2031 GA Haarlem, Países Bajos
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien Luxembourg/Luxemburg
Deutschland Teva GmbH Tel: +49 731 402 08
Norge
Teva Norway AS Tlf: +47 6677 55 90
Teva Pharma Belgium N.V./S.A./AG Tel/Tél: +32 3 820 73 73
Bt^rapna
TeBa ^apMacroTHKt^c Bt^rapna EOO^, Te.n: +359 2 489 95 82
Ceská republika
Teva Pharmaceuticals CR, s.r.o.
Tel: +420 251 007 111
Danmark
Teva Denmark A/S
Tlf: +45 44 98 55 11
Teva Pharma Belgium N.V./S.A./AG Tel/Tél: +32 3 820 73 73
Magyarország
Teva Gyógyszergyár Zrt
Tel.: +36 1 288 64 00
Malta
Teva Pharmaceuticals Ireland L-Irlanda
Tel: +356 21 419 070/1/2
Nederland
Teva Nederland B.V.
Tel: +31 800 0228 400
Eesti
Teva Eesti esindus UAB Sicor Biotech Eesti filiaal
Tel: +372 661 0801
Osterreich
ratiopharm Arzneimittel Vertriebs GmbH Tel: +43 1 97007 0
|
Kúnpoq |
Sverige |
|
Teva EXXáq A.E. |
Teva Sweden AB |
|
Tn^: +30 210 72 79 099 |
Tel: +46 42 12 11 00 |
Latvija United Kingdom
Polska
Teva Pharmaceuticals Polska Sp. z o.o.
Tel.: +48 22 345 93 00
Portugal
Teva Pharma - Produtos Farmacéuticos Lda Tel: +351 21 476 75 50
Romania
Teva Pharmaceuticals S.R.L Tel: +4021 230 6524
|
Slovenská republika | ||
|
Teva Pharmaceuticals Slovakia s.r.o. | ||
|
Tel: +421 2 5726 7911 | ||
EXXáSa
Teva EXXáq A.E.
Tn^: +30 210 72 79 099
España
Teva Pharma S.L.U.
Tel.: +34 91 387 32 80
France
Teva Santé
Tél: +33 1 55 91 7800
Ireland
Teva Pharmaceuticals Ireland Tel: +353 51 321 740
Ísland Vistor h.f.
Puh/Tel: +358 20 180 5900 Italia
Teva Italia S.r.l.
Tel: +39 028 917 981
Slovenija
Pliva Ljubljana d.o.o. Tel: +386 1 58 90 390
Suomi/Finland ratiopharm Oy Puh/Tel: +358 20 180 5900
Sicor Biotech filíale Latvija Tel: +371 67 323 666
Teva UK Limited Tel: +44 1977 628 500
Lietuva
UAB “Sicor Biotech” Tel: +370 5 266 02 03
Hrvatska
Pliva Hrvatska d.o.o Tel: + 385 1 37 20 000
Fecha de la última revisión de este prospecto: mes AAAA.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Prospecto: información para el paciente
BiResp Spiromax 320 microgramos/9 microgramos polvo para inhalación
(budesónida/formoterol fumarato dihidrato)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es BiResp Spiromax y para qué se utiliza (página 3)
2. Qué necesita saber antes de empezar a usar BiResp Spiromax (página 5)
3. Cómo usar BiResp Spiromax (página 8)
4. Posibles efectos adversos (página 16)
5. Conservación de BiResp Spiromax (página 19)
6. Contenido del envase e información adicional (página 19)
1. Qué es BiResp Spiromax y para qué se utiliza
BiResp Spiromax contiene dos principios activos distintos: budesónida y formoterol fumarato dihidrato.
• La budesónida pertenece a un grupo de medicamentos denominados “corticosteroides” también conocidos como “esteroides”. Actúa reduciendo y previniendo la hinchazón y la inflamación de los pulmones y le ayuda a respirar más fácilmente.
• El formoterol fumarato dihidrato pertenece a un grupo de medicamentos denominados “agonistas de los receptores adrenérgicos P2 de acción prolongada” o “broncodilatadores”. Actúa relajando los músculos de las vías respiratorias. Esto contribuirá a abrir las vías respiratorias y le ayudará a respirar más fácilmente.
BiResp Spiromax está indicado para su uso solo en adultos de 18 años en adelante. BiResp Spiromax NO está indicado para su uso en niños menores de 12 años inclusive ni en adolescentes de 13 a 17 años de edad.
Su médico le ha prescrito este medicamento como tratamiento para el asma o la enfermedad pulmonar obstructiva crónica (EPOC).
Asma
Si se utiliza para tratar el asma, el médico le recetará BiResp Spiromax junto con un “inhalador de alivio” adicional como por ejemplo, salbutamol.
• Use BiResp Spiromax todos los días. Esto ayuda a evitar que aparezcan síntomas de asma como dificultad para respirar y sibilancias (pitidos en el pecho).
• Utilice el “inhalador de alivio” cuando tenga síntomas de asma, para volver a respirar con facilidad.
No use BiResp Spiromax 320/9 microgramos como “inhalador de alivio”.
Enfermedad pulmonar obstructiva crónica (EPOC)
La EPOC es una enfermedad de larga duración que afecta a las vías respiratorias de los pulmones, a menudo producida por fumar cigarrillos. Algunos de sus síntomas son dificultad para respirar, tos, molestias en el pecho y expectoración. BiResp Spiromax también se puede utilizar para tratar los síntomas de EPOC grave en adultos.
2. Qué necesita saber antes de empezar a usar BiResp Spiromax No use BiResp Spiromax:
Si es alérgico a la budesónida, al formoterol fumarato dihidrato o al otro componente de este medicamento (incluido en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a tomar BiResp Spiromax si
• es usted diabético.
• tiene alguna infección pulmonar.
• tiene la tensión arterial alta o si alguna vez ha tenido algún problema de corazón (incluyendo latido irregular del corazón, pulso muy rápido, estrechamiento de las arterias o insuficiencia cardíaca).
• tiene problemas de tiroides o de glándulas suprarrenales.
• tiene niveles bajos de potasio en la sangre.
• padece problemas graves de hígado.
Si ha estado tomando comprimidos de corticosteroides para el asma o la EPOC, el médico tal vez le reduzca el número de comprimidos cuando empiece a usar BiResp Spiromax. Si lleva mucho tiempo tomando comprimidos de corticosteroides, tal vez el médico quiera hacerle análisis de sangre con regularidad. Al reducir el número de comprimidos de corticosteroides es posible que en general no se encuentre bien aunque mejoren sus síntomas del pecho. Quizá note síntomas como nariz taponada o moqueo, debilidad o dolor de articulaciones o muscular y erupción (eccema). Si le molesta alguno de estos síntomas o si nota síntomas como dolor de cabeza, cansancio, náuseas (estómago revuelto) o vómitos (devolver), llame al médico inmediatamente. Tal vez tenga que tomar otros medicamentos si empieza a tener síntomas de alergia o de artritis. Hable con el médico si no está seguro de si debe seguir utilizando BiResp Spiromax.
El médico tal vez considere añadir comprimidos de corticosteroides a su tratamiento habitual en épocas de estrés (por ejemplo, cuando tenga una infección de pecho o antes de una operación).
Niños y adolescentes
Este medicamento no deben utilizarlo niños ni adolescentes menores de 18 años.
Uso de BiResp Spiromax con otros medicamentos
Informe a su médico o farmacéutico si está tomando, si ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
En particular, informe a su médico o farmacéutico si está tomando cualquiera de los medicamentos siguientes:
• Betabloqueantes (como atenolol o propranolol para la tensión arterial alta o para enfermedades del corazón), incluidos los colirios (como timolol para el glaucoma).
• Medicamentos para el latido cardíaco rápido o irregular (como quinidina, disopiramida y procainamida).
• Medicamentos como la digoxina, que suelen usarse para la insuficiencia cardíaca.
• Diuréticos, también conocidos como “comprimidos para orinar” (como furosemida). Se utilizan para la tensión arterial alta.
• Corticosteroides tomados por la boca (como prednisolona).
• Medicamentos con xantina (como teofilina o aminofilina). Se utilizan a menudo para el asma.
• Otros broncodilatadores (como salbutamol).
• Antidepresivos tricíclicos (como amitriptilina) y el antidepresivo nefazodona.
• Medicamentos denominados inhibidores de la monoaminooxidasa (como fenelzina, furazolidona y procardazina).
• Fenotiazinas (como clorpromazina y proclorperazina).
• Medicamentos denominados “inhibidores de la proteasa del VIH” (como ritonavir) para tratar las infecciones por VIH.
• Medicamentos para tratar infecciones (como ketoconazol, itraconazol, voriconazol, posaconazol, claritromicina y telitromicina).
• Medicamentos para la enfermedad de Parkinson (como la levodopa).
• Medicamentos para problemas de tiroides (como la levotiroxina).
• Medicamentos para la alergia o antihistamínicos como terfenadina.
Si se encuentra en cualquiera de estas situaciones o si no está seguro, hable con su médico, farmacéutico o enfermero antes de utilizar BiResp Spiromax.
Avise también a su médico, farmacéutico o enfermero si le van a poner anestesia general para alguna operación o tratamiento dental.
Embarazo, lactancia y fertilidad
• Si está embarazada o en período de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico, farmacéutico o enfermero antes de utilizar BiResp Spiromax; NO utilice este medicamento a menos que se lo diga el médico.
• Si se queda embarazada mientras usa BiResp Spiromax, NO deje de usar BiResp Spiromax; hable con el médico inmediatamente.
Conducción y uso de máquinas
No es probable que BiResp Spiromax afecte a su capacidad para conducir o utilizar herramientas o máquinas.
BiResp Spiromax contiene lactosa.
La lactosa es un tipo de azúcar que se encuentra en la leche. La lactosa contiene pequeñas cantidades de proteínas lácteas que pueden provocar reacciones alérgicas. Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
4. Cómo usar BiResp Spiromax
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico, farmacéutico o enfermero.
• Es importante utilizar BiResp Spiromax a diario, aunque no tenga síntomas de asma o de EPOC en ese momento.
• Si está utilizando BiResp Spiromax para el asma, su médico querrá comprobar regularmente sus síntomas.
Asma
Use BiResp Spiromax todos los días. Esto ayuda a evitar que aparezcan síntomas de asma.
Dosis recomendada:
Adultos (de 18 años en adelante)
1 inhalación (aplicación) dos veces al día.
Su médico puede aumentar la dosis hasta 2 inhalaciones dos veces al día.
Si sus síntomas están bien controlados, el médico puede pedirle que use esta medicina una vez al día.
El médico le ayudará a controlar el asma y ajustará la dosis de este medicamento a la más baja posible para controlar su asma. Si su médico cree que necesita una dosis más baja de la que está disponible en su BiResp Spiromax, su médico puede recetarle un inhalador alternativo que contenga los mismos principios activos que su BiResp Spiromax, pero con una dosis menor del corticoesteroide. Sin embargo, no ajuste el número de inhalaciones que le ha recetado su médico sin hablar primero con él.
Utilice el otro “inhalador de alivio” para tratar los síntomas de asma cuando aparezcan.
Lleve siempre consigo el “inhalador de alivio” y utilícelo para aliviar los ataques repentinos de dificultad para respirar y sibilancias (pitidos en el pecho). No utilice BiResp Spiromax para tratar estos síntomas de asma.
Enfermedad pulmonar obstructiva crónica (EPOC)
Dosis recomendada:
Adultos (de 18 años en adelante):
• 1 inhalación dos veces al día.
El médico también puede prescribirle otro medicamento broncodilatador, como por ejemplo, un anticolinérgico (como el bromuro de tiotropio o de ipratropio), para su EPOC.
Preparación de su nuevo BiResp Spiromax
Antes de utilizar su nuevo inhalador BiResp Spiromax por primera vez, debe prepararlo del modo siguiente:
• Compruebe el indicador de dosis para ver que hay 60 inhalaciones en el inhalador.
• Anote en la etiqueta del inhalador la fecha en la que haya abierto el envase laminado.
• No agite el inhalador antes de usarlo.
Cómo realizar una inhalación
Cada vez que necesite hacer una inhalación, siga las instrucciones siguientes:
1. Sostenga el inhalador con la tapa semitransparente de la boquilla de color rojo vino por la parte inferior
2. Abra la tapa de la boquilla replegándola hacia abajo hasta que se oiga un clic fuerte. El medicamento se mide de forma activa. El inhalador está listo para su uso.
3. Expulse todo el aire suavemente (sin que le llegue a resultar incómodo). No expulse el aire a través del inhalador.
4. Colóquese la boquilla entre los dientes. No muerda la boquilla. Cierre los labios alrededor de la
boquilla. Tenga cuidado de no bloquear las entradas de aire.
Inspire por la boca lo más profundo y fuerte que pueda.
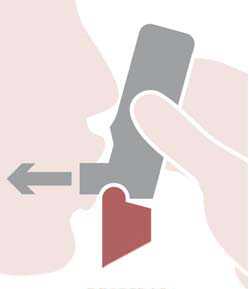
RESPIRAR
todo el tiempo que pueda sin que llegue a resultarle
5. Aguante la respiración 10 segundos o
incómodo.
vez note algún sabor al realizar la inhalación.

6. Retírese el inhalador de la boca. Tal
7. A continuación, expulse el aire suavemente (pero sin expulsar el aire a través del inhalador). Cierre la tapa de la boquilla.
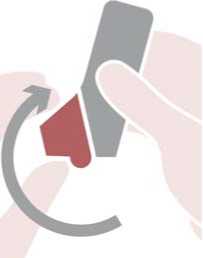
CERRAR
Si va a hacer una segunda inhalación, repita los pasos del 1 al 7. Enjuáguese la boca con agua después de cada dosis y escúpala.
No intente desmontar el inhalador ni tampoco retirar o torcer la tapa de la boquilla, ya que está fijada al inhalador y no debe desprenderse. No use el Spiromax si está deteriorado o si la boquilla se ha desprendido del Spiromax. No abra ni cierre la tapa de la boquilla a menos que vaya a usar el inhalador.
Limpieza del Spiromax
Mantenga el Spiromax seco y limpio.
Si es necesario, pase un paño o un pañuelo seco por la boquilla del Spiromax después de usarlo. Cuándo empezar a utilizar un nuevo Spiromax
• El indicador de dosis le informa de cuántas dosis (inhalaciones) quedan en el inhalador, empezando por 60 inhalaciones cuando está lleno.

• El indicador de dosis, situado en la parte trasera del dispositivo, indica el número de inhalaciones que quedan solo con los números pares.
• Cuando queden 20 inhalaciones o menos hasta “8”, “6”, “4” o “2”, los números aparecerán en rojo sobre fondo blanco. Cuando los números aparezcan en rojo en la ventana, consulte al médico y solicite un nuevo inhalador.
Nota:
• La boquilla seguirá haciendo “clic” aunque el Spiromax esté vacío.
• Si abre y cierra la boquilla sin administrarse la inhalación, aun así el indicador de dosis la contará como una inhalación. Esta dosis quedará guardada en el inhalador para cuando tenga que administrarse la siguiente inhalación. Es imposible tomar accidentalmente medicamento extra o una dosis doble en una inhalación.
• Mantenga la boquilla cerrada en todo momento, salvo cuando se vaya a usar el inhalador.
Información importante acerca de los síntomas de asma o de EPOC
Si nota que se queda sin aliento o que tiene “pitidos” durante el uso de BiResp Spiromax, debe seguir
usándolo, pero acuda al médico lo antes posible, ya que puede necesitar tratamiento adicional.
Póngase en contacto con el médico inmediatamente si:
• Respira peor o si se despierta con frecuencia por la noche con dificultad para respirar o sibilancia (pitidos en el pecho).
• Nota opresión en el pecho por la mañana o si la sensación de opresión dura más de lo habitual.
Estos signos pueden indicar que no se le está controlando correctamente el asma o la EPOC y que tal vez necesite inmediatamente un tratamiento distinto o adicional.
Una vez controlado el asma, tal vez el médico considere oportuno reducir gradualmente la dosis de BiResp Spiromax.
Si usa más BiResp Spiromax del que debe
Es importante que tome la dosis que le haya indicado el médico. No debe superar la dosis que le hayan recetado sin consultar con el médico.
Si usa más BiResp Spiromax del que debe, consulte al médico, farmacéutico o enfermero.
Los síntomas más frecuentes que pueden producirse si utiliza más BiResp Spiromax del que debe son temblores, dolor de cabeza o latidos rápidos del corazón.
Si olvidó usar BiResp Spiromax
Si olvidó tomar una dosis, hágalo en cuanto se acuerde. Sin embargo, no tome una dosis doble para compensar las dosis olvidadas. Si casi es la hora de su siguiente dosis, simplemente adminístrese la siguiente dosis a la hora habitual.
Si nota que tiene “pitidos” o que se queda sin aliento, o bien si nota cualquier otro síntoma de ataque de asma, use su “inhalador de alivio” y vaya al médico.
Si interrumpe el tratamiento con BiResp Spiromax
No deje de usar el inhalador sin hablar primero con el médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Si nota cualquiera de los síntomas siguientes, deje de utilizar BiResp Spiromax y consulte al
médico inmediatamente:
Efectos adversos raros: pueden afectar hasta 1 de cada 1.000 personas
• Hinchazón de la cara, especialmente alrededor de la boca (la lengua o la garganta, o bien dificultad para tragar) o urticaria junto con dificultad para respirar (angioedema) o sensación repentina de desmayo. Esto puede indicar que está teniendo una reacción alérgica, lo que también puede incluir erupción y picor.
• Broncoespasmo (opresión de los músculos de las vías respiratorias que provoca pitidos y dificultad para respirar). Si los pitidos aparecen repentinamente después de utilizar este medicamento, deje de usarlo y consulte con el médico inmediatamente.
Efectos adversos muy raros: pueden afectar hasta 1 de cada 10.000 personas
• Sibilancia (pitidos) aguda repentina y/o falta de aliento inmediatamente después de usar el inhalador (también denominado “broncoespasmo paradójico”). Si se produce cualquiera de estos síntomas, deje inmediatamente de usar BiResp Spiromax y utilice el “inhalador de alivio”. Consulte al médico inmediatamente, ya que tal vez tenga que cambiar de tratamiento.
Otros posibles efectos adversos:
Frecuentes: pueden afectar hasta 1 de cada 10 personas
• Palpitaciones (conciencia de los latidos de su propio corazón), temblores o agitación. Si se producen estos efectos, por lo general serán leves y desaparecerán a medida que siga utilizando BiResp Spiromax.
• Cándidas (una infección por hongos) en la boca. Esto será menos probable que ocurra si se enjuaga la boca con agua después de utilizar el medicamento.
• Dolor de garganta leve, tos y ronquera.
• Dolor de cabeza.
• Neumonía (infección de los pulmones) en pacientes con EPOC (efecto adverso frecuente).
Informe a su médico si usted tiene cualquiera de los siguientes síntomas mientras inhala BiResp Spiromax, podrían ser síntomas de una infección pulmonar:
• Fiebre o escalofríos
• Aumento de la producción de moco, cambio en el color del moco
• Aumento de la tos o aumento de dificultades para respirar
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas
• Sensación de inquietud, nerviosismo, agitación, ansiedad o enfado.
• Problemas para dormir.
• Sensación de mareo.
• Náuseas (estómago revuelto).
• Latidos cardíacos acelerados.
• Moratones.
• Calambres musculares.
Raros:
• Niveles bajos de potasio en la sangre.
• Latidos cardíacos irregulares.
Muy raros:
• Depresión.
• Cambios en el comportamiento, especialmente en niños.
• Dolor u opresión en el pecho (angina de pecho).
• Alteración del sistema eléctrico del corazón (prolongación del intervalo QTc).
• Aumento de la cantidad de azúcar (glucosa) en la sangre.
• Alteraciones en la percepción del gusto, como sabor desagradable en la boca.
• Cambios en la tensión arterial.
• Los corticosteroides inhalados pueden afectar a la producción normal de hormonas esteroideas en el organismo, especialmente si se utilizan en dosis altas durante períodos prolongados. Entre sus efectos se encuentran:
- cambios en la densidad mineral ósea (debilitamiento de los huesos)
- cataratas (enturbiamiento del cristalino del ojo)
- glaucoma (aumento de la presión en el ojo)
- ralentización de la velocidad de crecimiento de niños y adolescentes
- efectos sobre la glándula suprarrenal (glándula pequeña situada junto al riñón).
Estos efectos se producen muy rara vez y es mucho menos probable que aparezcan con los corticosteroides inhalados que en comprimidos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico. farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V.
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de BiResp Spiromax
• Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en la caja o en la etiqueta del inhalador después de CAD. La fecha de caducidad es el último día del mes que se indica.
• No conservar a temperatura superior a 25oC. Mantenga la tapa de la boquilla cerrada después de retirar el envoltorio laminado.
• Debe usarse en los 6 meses siguientes a la retirada del envoltorio laminado. Utilice la etiqueta del inhalador para anotar la fecha de apertura del envase laminado.
• Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de BiResp Spiromax
- Los principios activos son budesónida y formoterol fumarato dihidrato. Cada dosis administrada (inhalada) contiene 320 microgramos de budesónida y 9 microgramos de formoterol fumarato dihidrato. Esto equivale a una dosis medida de 400 microgramos de budesónida y
12 microgramos de formoterol fumarato dihidrato.
- El otro componente es lactosa monohidrato (ver sección 2, apartado “BiResp Spiromax contiene lactosa”).
Aspecto de BiResp Spiromax y contenido del envase
BiResp Spiromax es un polvo para inhalación.
Cada inhalador BiResp Spiromax contiene 60 inhalaciones y es de color blanco, con una tapa
semitransparente de color rojo vino para la boquilla.
Envases de 1, 2 y 3 inhaladores. Puede que solamente estén comercializados algunos tamaños de
envases en su país.
Titular de la autorización de comercialización
Teva Pharma B.V.,
Swensweg 5, 2031GA Haarlem, Países Bajos.
Responsable de la fabricación
Norton (Waterford) Limited T/A Teva Pharmaceuticals Ireland
Unit 27/35, IDA Industrial Park, Cork Road, Waterford, Irlanda
Teva Pharmaceuticals Europe B.V., Swensweg 5, 2031 GA Haarlem, Países Bajos
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Teva Pharma Belgium N.V./S.A./AG
Luxembourg/Luxemburg
Teva Pharma Belgium N.V./S.A./AG
Tel/Tél: +32 3 820 73 73
Tel/Tél: +32 3 820 73 73
Bt^rapna
TeBa ^apMacroTHKt^c Bt^rapna EOO^, Te.n: +359 2 489 95 82
Ceská republika
Teva Pharmaceuticals CR, s.r.o.
Tel: +420 251 007 111
Danmark
Teva Denmark A/S
Tlf: +45 44 98 55 11
Deutschland Teva GmbH Tel: +49 731 402 08
Eesti
Teva Eesti esindus UAB Sicor Biotech Eesti filiaal
Tel: +372 661 0801 EXXáSa
Teva EXXág A.E.
Tn^: +30 210 72 79 099
España
Teva Pharma S.L.U.
Tel.: +34 91 387 32 80
France
Teva Santé
Tél: +33 1 55 91 7800
Ireland
Teva Pharmaceuticals Ireland Tel: +353 51 321 740
Ísland Vistor h.f.
Puh/Tel: +358 20 180 5900 Italia
Teva Italia S.r.l.
Tel: +39 028 917 981
Kúrcpog
Teva EXXág A.E.
Tn^: +30 210 72 79 099
Latvija
Sicor Biotech filiale Latvija Tel: +371 67 323 666
Magyarország
Teva Gyógyszergyár Zrt
Tel.: +36 1 288 64 00
Malta
Teva Pharmaceuticals Ireland L-Irlanda
Tel: +353 51 321 740
Nederland
Teva Nederland B.V.
Tel: +31 800 0228 400
Norge
Teva Norway AS Tlf: +47 6677 55 90
Osterreich
ratiopharm Arzneimittel Vertriebs GmbH Tel: +43 1 97007 0
Polska
Teva Pharmaceuticals Polska Sp. z o.o.
Tel.: +48 22 345 93 00
Portugal
Teva Pharma - Produtos Farmacéuticos Lda Tel: +351 21 476 75 50
Romania
Teva Pharmaceuticals S.R.L Tel: +4021 230 6524
Slovenija
Pliva Ljubljana d.o.o. Tel: +386 1 58 90 390
|
Slovenská republika | ||
|
Teva Pharmaceuticals Slovakia s.r.o. | ||
|
Tel: +421 2 5726 7911 | ||
Suomi/Finland ratiopharm Oy Puh/Tel: +358 20 180 5900
Sverige
Teva Sweden AB Tel: +46 42 12 11 00
United Kingdom Teva UK Limited Tel: +44 1977 628 500
Lietuva
UAB “Sicor Biotech” Tel: +370 5 266 02 03
Hrvatska
Pliva Hrvatska d.o.o Tel: + 385 1 37 20 000
Fecha de la última revisión de este prospecto: mes AAAA.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
69