Bilina 0,5 Mg/Ml Suspensión Para Pulverización Nasal
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Bilina 0,5 mg/ml suspensión para pulverización nasal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
2.2 Composición cualitativa y cuantitativa
Cada ml contiene 0,54 mg de levocabastina hidrocloruro equivalente a 0,5 mg de levocabastina (50 microgramos en cada aplicación)..
2.2.1 Excipiente(s) con efecto conocido
Contiene 0,15 mg/ml de cloruro de benzalconio.
Para consultar la lista completa de excipientes, ver sección 6.1..
3. FORMA FARMACÉUTICA
Suspensión para pulverización nasal.
Suspensión de color blanco..
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento sintomático de la rinitis alérgica en adultos y en niños y adolescentes de 4 a menos de 18 años de edad..
4.2 Posología y forma de administración
Dado que Bilina 0,5 mg/ml suspensión para pulverización nasal es una microsuspensión, el frasco se debe agitar antes de cada aplicación..
4.2.1 Posología
El tratamiento se debe continuar hasta que se eliminen los síntomas.
- Adultos
La dosis habitual es de 2 aplicaciones por fosa nasal, dos veces al día. La dosis puede aumentarse hasta 2 aplicaciones, de 3 a 4 veces al día.
- Población pediátrica
18 años de edad
por fosa nasal, dos veces al día. La dosis puede aumentarse día.
Niños y adolescentes de 4 a menos de La dosis habitual es de 2 aplicaciones hasta 2 aplicaciones, de 3 a 4 veces al
Niños menores de 4 años
No se ha establecido la seguridad y eficacia de este medicamento en niños menores de 4 años. No hay datos disponibles.

4.2.2 Forma de administración
Vía nasal.
Agitar bien antes de usar.
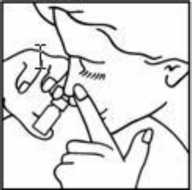
El paciente debe limpiar los conductos nasales antes de administrar el medicamento e inhalarlo por la nariz. Instrucciones de uso:
1. Agite el frasco antes de quitar el tapón
2. Antes de utilizar Bilina por primera vez, quite el tapón y presione una o dos veces el frasco hasta que se elimine una fina pulverización
3. Suénese la nariz
4. Incline la cabeza según se muestra en la imagen e introduzca el dosificador del frasco en uno de los orificios de la nariz mientras presiona fuertemente el otro orificio
5. Presione dos veces el atomizador en el orificio al mismo tiempo que respira por ese orificio
6. Repita los mismo pasos 4 y 5 por el otro orificio.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1..
4.4 Advertencias y precauciones especiales de empleo
- Pacientes de edad avanzada:
No existen datos disponibles de la utilización de levocabastina en pacientes de edad avanzada. Debido a que levocabastina se elimina principalmente por vía renal y a que es habitual una disminución en la funcionalidad renal en los pacientes de edad avanzada, se deben tomar precauciones cuando se administre Bilina en este grupo de pacientes.
- Insuficiencia renal:
Hay datos limitados del uso oral de levocabastina en pacientes con insuficiencia renal. Bilina debe usarse con precaución en pacientes con insuficiencia renal (ver sección 5.2).
Este medicamento contiene cloruro de benzalconio. Puede producir inflamación de la mucosa nasal, especialmente con tratamientos de larga duración. Si se sospecha tal reacción (congestión nasal persistente), siempre que sea posible, se debería utilizar un medicamento de uso nasal que no contenga este excipiente.
4.5 Interacción con otros medicamentos y otras formas de interacción
Interacciones farmacodinámicas
En los ensayos clínicos realizados no se han notificado interacciones con alcohol o con otros medicamentos. En estudios específicos diseñados para ello, no se ha detectado evidencia de potenciación de los efectos del alcohol ni diazepam con Bilina cuando éste, se usa a las dosis recomendadas.
Interacciones farmacocinéticas
El descongestivo oximetazolina puede disminuir de forma transitoria la absorción de levocabastina nasal. La coadministración con inhibidores de la CYP3A4 como ketoconazol o eritromicina no tuvo ningún impacto en la farmacocinética de levocabastina intranasal.
La farmacocinética de loratadina no se vio modificada por levocabastina intranasal.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
Existen datos limitados tras la comercialización de levocabastina en mujeres embarazadas. El riesgo en humanos no se conoce. Por lo tanto, Bilina no debe usarse durante el embarazo a menos que el beneficio potencial para la mujer justifique el riesgo potencial para el feto.
4.6.2 Lactancia
Según las determinaciones de las concentraciones de levocabastina en saliva y en la leche de mujeres lactantes a las que fueron administradas una única dosis oral de 0,5 mg de levocabastina, se estima que aproximadamente un 0,6% de la dosis total administrada de levocabastina vía intranasal se pueda transferirse al lactante. Sin embargo, teniendo en cuenta los datos clínicos y experimentales tan limitados, se recomienda precaución cuando se administra Bilina a madres lactantes.
4.6.3 Fertilidad
Los datos en animals no muestran ningún efecto en la fertilidad masculina o femenina.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Bilina no produce sedación ni interfiere con la actividad psicomotora por lo que no cabe esperar, ningún efecto sobre la capacidad para conducir y utilizar máquinas..
4.8 Reacciones adversas
La seguridad de levocabastina se ha evaluado en 2328 pacientes que participaron en 12 ensayos clínicos ciegos, controlados con placebo. Todas las reacciones adversas (RAs) notificadas en > 1% de los pacientes en estos ensayos se indican en la Tabla 1.
Tabla 1: Reacciones Adversas al medicamento identificadas en > 1% de los pacientes tratados con Bilina suspensión para pulverización nasal en 12 ensayos clínicos doble ciego, controlado con placebo
|
Clasificación por órganos y sistemas de MedDRA |
Bilina suspensión para pulverización nasal (n=2328) % |
Placebo (n=1537) % |
|
Trastornos del sistema nervioso Cefalea |
10,1 |
11,9 |
|
Somnolencia |
2,1 |
0,8 |
|
Mareo |
1.3 |
0,9 |
|
Trastornos respiratorios, torácicos y mediastínicos Dolor faringolaríngeo |
2,9 |
2,3 |
|
Epistaxis |
1,6 |
1,0 |
|
Tos |
1,7 |
1,3 |
|
Trastornos gastrointestinales Nauseas |
1,3 |
1,2 |
|
Infecciones e infestaciones Sinusitis |
1,8 |
0,9 |
|
Trastornos generales y alteraciones en el lugar de administración Fatiga |
2,1 |
0,9 |
|
Dolor |
1,2 |
0,9 |
Se notificaron reacciones adversas adicionales en < 1% de los pacientes tratados con Bilina suspensión para pulverizaciónnasal en los 12 ensayos clínicos que se indican en la Tabla 2.
Tabla 2: Reacciones Adversas al medicamento identificadas en < 1% de los pacientes tratados con Bilina suspensión para pulverización nasal en 12 ensayos clínicos doble ciego, controlado con placebo
Clasificación por órganos y sistemas de MedDRA
Trastornos respiratorios, torácicos y mediastínicos: Molestia nasal, congestión
Trastornos generales y alteraciones en el lugar de administración: Irritación, dolor, sequedad, quemazón, molestia en el lugar de administración
Las primeras reacciones adversas al medicamento (RAs) identificadas tras la comercialización con Bilina se indican en la Tabla 3. Dado que estas reacciones son comunicadas voluntariamente por una cantidad de población indecisa, no siempre es posible estimar su frecuencia o establecer una relación causal con la exposición del medicamento. Por tanto, se enumeran las frecuencias empleando la siguiente convención: Muy frecuentes (>1/10), Frecuentes (>1/100 a <1/10), Poco frecuentes (>1/1.000 a <1/100), Raras (>1/10.000 a <1/1.000), Muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Tabla 3: Reacciones adversas al medicamento identificadas durante la experiencia post-comercialización con Bilina suspensión para pulverización nasal por intervalos de frecuencia basado en el índice de notificaciones espontáneas. | |
|
Trastornos cardiacos |
Muy raras: Palpitaciones, taquicardia |
|
Trastornos oculares |
Muy raras: Edema palpebral |
|
Trastornos respiratorios, torácicos y mediastínicos |
Muy raras: Broncoespasmo, disnea, edema nasal |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy raras: Malestar |
|
Trastornos del sistema inmunológico |
Muy raras: Anafilaxia, hipersensibilidad |
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
Síntomas:
No se han notificado casos de sobredosis con Bilina. En caso de ingerirse accidentalmente el contenido del envase, no podría excluirse la posibilidad de cierto grado de sedación.
Tratamiento:
En caso de ingestión accidental, debe aconsejarse al paciente la ingesta de líquidos no alcohólicos en cantidad importante con el fin de acelerar la excreción renal de levocabastina..
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Preparados de uso nasal; descongestivos y otros preparados nasales para uso tópico, agentes antialérgicos, excluyendo corticosteroides; levocabastina; código ATC: R01AC02.
La levocabastina es un potente antagonista selectivo de los receptores Hj de Histamina con un inicio de acción prácticamente inmediato y una larga duración de acción.
Después de la aplicación en la nariz, de una forma casi inmediata y durante horas se produce el alivio de los síntomas de la rinitis alérgica (estornudos, prurito nasal y rinorrea).
5.2 Propiedades farmacocinéticas
5.2.1 Absorción
Después de una aplicación intranasal de una dosis de 50 pg/pulverización, aproximadamente se absorben de 30 a 45 pg de levocabastina. Tras la administración nasal, los niveles plasmáticos más altos de levocabastina se alcanzan después de 3 horas.
5.2.2 Distribución
5.2.3 Metabolismo o Biotransformación
El metabolito primario de levocabastina, acilglucurónido, se produce por glucuronidación que es la principal vía metabólica.
5.2.4 Eliminación
Levocabastina se elimina predominantemente en la orina sin alterar (aproximadamente un 70% de la dosis absorbida).
La semivida final de levocabastina es de aproximadamente 35 a 40 horas.
La farmacocinética plasmática de levocabastina nasal es lineal y previsible.
5.2.6 Datos de farmacocinética/ farmacodinamia(s)
Poblaciones especiales
Población pediátrica
Se han medido escasas concentraciones plasmáticas de levocaboastina en niños y adolescentes de 6 a 17 años que han recibido levocabastina por pulverizacion nasal en varios regimenes de dosis hasta un máximo de 0,2 mg cuatro veces al dia durante 4 semanas, algunos de ellos estaban también utilizando levocabastina en colirio según necesitaban. Las concentraciones plasmáticas después de 2 a 4 semanas de tratamiento fueron indectables o alcanzaron un máximo de 18,2 ng/ml. En base a la limitada información disponible, no se pueden extraer conclusiones definitivas en relación a una comparación con los adultos.
Pacientes de edad avanzada
En pacientes de edad avanzada, tras la administración nasal repetida de 0,4 mg de levocabastina, la semivida final se incrementó en un 15% y el nivel plasmático más alto en un 26%.
Insuficiencia renal
Después de una única dosis oral de 0,5 mg en solución de levocabastina, la semivida final de levocabastina en pacientes con insuficiencia renal de moderada a grave (aclaramiento de creatinina 10-50 ml/min) se incrementó de 36 a 95 horas. La exposición global en función del AUC se incrementó en un 56% (ver sección 4.4).
Insuficiencia hepática
No se ha investigado la farmacocinetica de levocabastina en pacientes con insuficiencia hepática.
5.3 Datos preclínicos sobre seguridad
En ratas, ratones y conejos, levocabastina a dosis sistémicas de hasta 1250 veces la dosis nasal máxima clínicamente recomendada (basado en mg/kg), no mostró efectos embriotóxicos ni teratogénicos. En roedores, se observó teratogenicidad y/o reabsorción embrional con levocabastina a dosis sistémica de más de 2500 veces la dosis nasal máxima recomendada (basado en mg/kg).
Los datos de los estudios no clínicos no muestran riesgos tópicos especiales para los seres humanos según los estudios convencionales a dosis agudas (administración vía oral, intravenosa, inhalatoria y dérmica) y dosis repetidas (administración oral, intravenosa, dérmica u ocular) incluyendo estudios de irritación ocular, sensibilización dérmica, farmacología de seguridad cardiovascular, reproducción oral, toxicidad génica y carcinogenicidad oral. Se observaron efectos únicamente en exposiciones consideradas muy por encima del nivel de la dosis máxima humana que indican poco o casi ninguna relevancia para el uso clínico.
Datos preclínicos sugieren que el cloruro de benzalconio puede producir un efecto ciliar tóxico, incluyendo inmovilidad irreversible, dependiente de la concentración y del tiempo de exposición, y puede producir cambios histopatológicos en la mucosa nasal.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Propilenglicol
Fosfato de disodio anhidro
Fosfato monosódico monohidratado
Hipromelosa
Polisorbato 80
Edetato de disodio
]£
Cloruro de benzalconio Agua purificada
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C..
6.5 Naturaleza y contenido del envase
Envase de plástico conteniendo una microsuspensión blanca.
Tamaños de envase:
1 envase que contiene 10 ml de suspensión 1 envase que contiene 20 ml de suspension.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local..
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratorios Dr. Esteve, S.A.
Av. Mare de Déu Montserrat, 221 08041 Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Bilina 0,5 mg/ml suspensión para pulverización nasal; n° de registro: 60918
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN Fecha de la primera autorización: 16 de julio 1996
10. FECHA DE LA REVISIÓN DEL TEXTO
Septiembre 2015
MINISTER10DE )E
SAN IDAD, POLITICA LITIGA
SOCIAL E IGUALDAD IALDAD
Agencia esparto» de cSacse-
medicamentos y ¡y
Sfoouctos san-tanos taws
7 de 7