Berinert 1500 Ui Polvo Y Disolvente Para Solucion Inyectable
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Berinert 500 UI polvo y disolvente para solución inyectable y para perfusión.
Berinert 1500 UI polvo y disolvente para solución inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Principio activo: Inhibidor de la C1 esterasa, humano.
Berinert 500 UI contiene 500 UI de inhibidor de la C1 esterasa por vial.
Berinert 1500 UI contiene 1500 UI de inhibidor de la C1 esterasa por vial.
La potencia del inhibidor de la C1 esterasa se expresa en Unidades Internacionales (UI), que está relacionado con los actuales estándar de la OMS para los productos inhibidores de la C1 esterasa.
Composición cualitativa y cuantitativa
Berinert 500 contiene 50 UI de inhibidor de la C1 esterasa /ml tras la reconstitución con 10 ml de agua para preparaciones inyectables.
Berinert 1500 contiene 500 UI de inhibidor de la C1 esterasa /ml tras la reconstitución con 3 ml de agua para preparaciones inyectables.
El contenido de proteína total de la solución reconstituida de 500 UI es 6,5 mg/ml.
El contenido de proteína total de la solución reconstituida de 1500 UI es 65 mg/ml.
Excipiente(s) con efecto conocido
Hasta 486 mg de sodio (aproximadamente 21 mmol ) por 100 ml de solución.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA Berinert 500:
Polvo y disolvente para solución inyectable o perfusión.
Berinert 1500:
Polvo y disolvente para solución inyectable.
Polvo blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas Angioedema hereditario de tipo I y II (AEH).
Tratamiento y prevención preoperatoria de episodios agudos.
4.2 Posología y forma de administración
El tratamiento debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de la deficiencia del inhibidor de la C1 esterasa.
Posología
Adultos
Tratamiento de ataques de angioedema agudo:
20 UI por kilo de peso corporal (20 Ul/kg de p.c).
Prevención preoperatoria de ataques de angioedema agudo:
1000 UI antes de 6 horas de una intervención médica, dental o quirúrgica.
Población pediátrica
Tratamiento de ataques de angioedema agudo:
20 UI por kilo de peso corporal (20 UI/kg de p.c).
Prevención preoperatoria de ataques de angioedema agudo:
De 15 a 30 UI por kilogramo de peso corporal (15-30 UI/kg de p.c.) antes de 6 horas de una intervención médica, dental o quirúrgica. La dosis debe escogerse teniendo en cuenta las circunstancias clínicas (por ejemplo, el tipo de intervención y la gravedad de la enfermedad).
Forma de administración
Berinert debe reconstituirse siguiendo las instrucciones incluidas en la Sección 6.6. La solución reconstituida de
- Berinert 500 debe ser transparente y clara.
- Berinert 1500 debe ser transparente y clara a ligeramente opalescente.
La solución debe administrarse por inyección intravenosa lenta. Berinert 500 también puede administrarse mediante perfusión (4 ml/minuto).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la Sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
A los pacientes con predisposición conocida a alergias se les deben administrar antihistamínicos y corticosteroides como tratamiento profiláctico.
Si se producen reacciones alérgicas o anafilácticas, la administración de Berinert se debe interrumpir inmediatamente (por ejemplo, interrumpiendo la inyección / perfusión) y se debe iniciar un tratamiento adecuado. Las medidas terapéuticas dependen del tipo y la gravedad de la reacción adversa. Se deben aplicar las pautas médicas estándares para el tratamiento del shock.
Los pacientes con edema de laringe necesitan una supervisión especialmente cuidadosa y tener tratamiento de urgencia listo para usar.
No se aconseja el tratamiento del Síndrome de extravasación capilar (SEV) con Berinert, ya que no se ha aprobado (consulte la Sección "4.8 Reacciones adversas").
Este medicamento contiene aproximadamente 21 mmol (hasta 486 mg) de sodio por 100 ml de solución, lo que deberá tenerse en cuenta en el tratamiento de pacientes con dietas pobres en sodio.
Tratamiento domiciliario y autoadministración
Existe información limitada sobre el uso de este medicamento en el domicilio o autoadministrado. Los riesgos potenciales asociados al tratamiento domiciliario están relacionados con la propia administración del mismo así como con la gestión de los efectos adversos, particularmente la hipersensibilidad. La
decisión del tratamiento domiciliario de un paciente la debe tomar el médico que lo trata, quien se debe asegurar de que se proporciona un entrenamiento apropiado y de revisarlo cada cierto tiempo.
Seguridad vírica
Para prevenir la transmisión de enfermedades infecciosas cuando se administran medicamentos derivados de la sangre o plasma humanos, se toman medidas estándares como la selección de donantes, análisis de marcadores específicos de infecciones en la donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar / inactivar virus. A pesar de esto, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente. Esto también se refiere a virus de naturaleza desconocida o emergentes y otros patógenos.
Las medidas aplicadas se consideran eficaces para los virus envueltos tales como el virus VIH, VHB y VHC y virus no envueltos como el virus VHA y el parvovirus B19.
Es posible que su médico le recomiende la vacunación contra la hepatitis A y B si usted se trata periódicamente/repetidamente con medicamentos derivados del plasma humano.
Se recomienda encarecidamente que cada vez que se administre Berinert a un paciente, se registre el nombre y número de lote del producto con el fin de mantener la trazabilidad entre el paciente y el lote de producto.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Se dispone de información limitada sobre la ausencia de incremento de riesgo del uso de Berinert durante el embarazo. Berinert es un componente fisiológico del plasma humano. Por lo que no se han realizado estudios toxicológicos en animales sobre la reproducción y el desarrollo, y no se esperan efectos nocivos sobre la fertilidad, desarrollo pre y posnatal en humanos.
Por lo tanto, Berinert solo deberá usarse durante el embarazo si está claramente indicado.
Lactancia
Se desconoce si Berinert se elimina a través de la leche materna, pero debido a su alto peso molecular el paso a la leche materna parece improbable. Sin embargo, la lactancia está cuestionada en mujeres que padecen angioedema hereditario. La decisión de discontinuar la lactancia o discontinuar el tratamiento con Berinert debe basarse en el beneficio de la lactancia para el niño y el beneficio del tratamiento para la mujer.
Fertilidad
Berinert es un componente fisiológico del plasma humano. Por lo tanto, no se han realizado ensayos sobre toxicidad para la reproducción y el desarrollo en animales ni se esperan efectos adversos sobre la fertilidad ni en el desarrollo pre y postnatal en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Berinert sobre la capacidad para conducir y usar máquinas es nula o insignificante.
4.8 Reacciones adversas
Las reacciones adversas siguientes se basan en la experiencia postcomercialización, así como en la literatura científica. Se utilizan las siguientes categorías estándares de frecuencia:
Muy frecuentes: Frecuentes:
Poco frecuentes: Raras:
Muy raras:
> 1/10
> 1/100 a < 1/10
> 1/1.000 a < 1/100
> 1/10.000 a < 1/1.000
< 1/10.000 (incluidas notificaciones individuales)
Las reacciones adversas con Berinert son raras.
|
Órgano |
Muy frecuentes |
F recuentes |
Poco frecuentes |
Raras |
Muy raras |
|
Trastornos vasculares |
Desarrollo de trombosis* | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
Incremento de la temperatura, reacción en el punto de inyección | ||||
|
Trastornos del sistema inmunológico |
Reacciones alérgicas o anafilácticas (por ejemplo, taquicardia, hipertensión o hipotensión, enrojecimiento, ronchas, disnea, cefalea, mareos, náuseas) |
Shock |
* En el intento de aplicar altas dosis de Berinert en el tratamiento o profilaxis del Síndrome de extravasación capilar (SEC) antes, durante o después de cirugía cardíaca con circulación extracorpórea (indicación y posología no aprobadas), en casos individuales con desenlace fatal.
Para mayor información sobre seguridad en relación con agentes transmisibles, ver la Sección 4.4.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es.
4.9 Sobredosis
No se han descrito casos de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: C1-inhibidor, derivado plasmático. Código ATC: B06AC01.
El inhibidor de la C1 esterasa es una glicoproteína plasmática con un peso molecular de 105 kD y una fracción media de carbohidratos del 40%. Su concentración aproximada en el plasma humano es de 240 mg/l. Además de estar presente en el plasma humano, la placenta, los hepatocitos, los monocitos y las plaquetas también contienen inhibidor de la C1 esterasa.
El inhibidor de la C1 esterasa pertenece al sistema inhibidor de las serin-proteasas (serpinas) del plasma humano, igual que otras proteínas como la antitrombina III, la alfa-2-antiplasmina, la alfa-1-antitripsina y otras.
En condiciones fisiológicas, el inhibidor de la C1 esterasa bloquea la ruta clásica del sistema del complemento al inactivar los componentes enzimáticos activos C1s y C1r. La enzima activa forma un complejo con el inhibidor en proporción estequiométrica 1:1.
Además, el inhibidor de la C1 esterasa es el inhibidor más importante de la activación de la coagulación por contacto al inhibir el factor XIIa y sus fragmentos. También actúa como el principal inhibidor de la calicreína plasmática, junto con la alfa-2-macroglobulina.
El efecto terapéutico de Berinert en el angioedema hereditario se consigue por la sustitución de la deficiente actividad del inhibidor de la C1 esterasa.
5.2 Propiedades farmacocinéticas
El medicamento se debe administrar por vía intravenosa y se encuentra disponible inmediatamente en el plasma con una concentración en plasma que se corresponde con la dosis administrada.
Las propiedades farmacocinéticas de Berinert se han investigado en dos estudios.
Un estudio de fase I realizado con 15 sujetos adultos sanos proporcionó datos farmacocinéticos que se utilizaron para evaluar la biodisponibilidad relativa de Berinert 1500 y Berinert 500. Se demostró una biodisponibilidad similar en las dos presentaciones de Berinert. Para las concentraciones de antígeno C1-INH los ratios medios geométricos (IC 90%) de Cmax y AUC 0-t fueron de 1,02 (0,99- 1,04) y 1,02 (0,99 -1,05) respectivamente. La semivida se estimó en un subgrupo de sujetos utilizando un análisis farmacocinético no compartimental. La semivida media de Berinert 1500 y Berinert 500 fue de 87,7 horas y 91,4 horas, respectivamente.
Las propiedades farmacocinéticas se han investigado en pacientes con angioedema hereditario (34 pacientes > 18 años, 6 pacientes < 18 años). De estos pacientes, 15 estaban en tratamiento profiláctico (con ataques frecuentes/graves) y los otros 25 en tratamiento “a demanda” con ataques menos frecuentes/moderados. Los datos se obtuvieron en un intervalo sin ataques.
La mediana de la recuperación in-vivo (RIV) fue del 86,7% (rango: 54,0 - 254,1 %). La RIV para niños fue ligeramente superior (98,2% rango: 69,2 - 106,8 %) que para adultos (82,5%, rango: 54,0 - 254,1 %). Los pacientes con ataques graves tenían una RIV más alta (101,4%) que los pacientes con ataques moderados (75,8% rango: 57,2 - 195,9 %).
La mediana del incremento de la actividad fue 2,3%/ UI/Kg p. c. (rango: 1,4 - 6,9 %/UI/Kg p. c.). No se observaron diferencias significativas entre adultos y niños. Los pacientes con ataques graves mostraron un incremento ligeramente mayor de actividad que los pacientes con ataques moderados (2,9, rango: 1,4 - 6,9 versus 2,1, rango: 1,5 - 5,1 %/UI/kg p.c.).
La concentración máxima de la actividad inhibidora de la C1 esterasa en plasma se alcanzó a las 0,8 horas después de la administración de Berinert sin diferencias significativas entre grupos de pacientes.
La mediana de la semivida fue de 36,1 horas. Fue ligeramente más corta en niños que en adultos (32,9 horas en comparación con 36,1) y en pacientes con ataques graves que en pacientes con ataques moderados (30,9 horas en comparación con 37,0).
5.3 Datos preclínicos sobre seguridad
Berinert contiene el inhibidor de la C1 esterasa como principio activo. Se obtiene a partir de plasma humano y actúa como el constituyente endógeno del plasma. Las administraciones de dosis únicas de Berinert en ratas y ratones así como las administraciones de dosis repetidas en ratas no mostraron ningún síntoma de toxicidad.
Los estudios preclínicos con administraciones de dosis repetidas para investigar la carcinogenicidad y la toxicidad reproductiva son impracticables en modelos animales convencionales debido al desarrollo de anticuerpos tras la administración de proteínas humanas heterólogas.
La prueba in vitro de Ouchterlony y la prueba PCA in vivo en cobayas no mostraron evidencia de la aparición de nuevos determinantes antigénicos en Berinert tras la pasteurización.
Las pruebas de trombogenicidad in vivo en conejos se realizaron con dosis de hasta 800 UI/kg de Berinert. No hubo un riesgo pro-trombótico asociado a la administración intravenosa de Bertinert hasta 800 UI/kg.
Los estudios de tolerancia local en conejos demostraron que Berinert era clínica, local e histológicamente bien tolerado tras la administración intravenosa, subcutánea, intra-arterial e intramuscular.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
Glicina Cloruro sódico Citrato sódico
Disolvente:
Agua para preparaciones inyectables.
6.2 Incompatibilidades
Debido a la ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos y diluyentes en la misma jeringa o equipo de perfusión.
6.3 Periodo de validez
Berinert 500: 30 meses.
Berinert 1500: 36 meses
Después de la reconstitución se ha demostrado la estabilidad físico-química durante 48 horas a temperatura ambiente (máx. 25 C). Desde un punto de vista microbiológico y como Berinert no contiene ningún conservante, el producto reconstituido debe usarse inmediatamente. Sin embargo, si no se administra inmediatamente, no debe conservarse más de 8 horas a temperatura ambiente. El producto reconstituido sólo se debe conservar en el vial.
6.4 Precauciones especiales de conservación
Berinert 500: No conservar a temperatura superior a 25 °C.
Berinert 1500: No conservar a temperatura superior a 30 °C.
No congelar.
Mantener el vial en el embalaje exterior para protegerlo de la luz.
Para condiciones de conservación después de la reconstitución, ver la sección 6.3.
6.5 Naturaleza y contenido del envase
Berinert 500:
Polvo (500 UI) en un vial (vidrio tipo II) con un tapón (goma de bromobutilo), precinto (aluminio) y cápsula (plástico).
10 ml de disolvente en un vial (vidrio tipo I) con un tapón (goma de clorobutilo), precinto (aluminio) y cápsula (plástico).
Berinert 1500:
Polvo (1500 UI) en un vial (vidrio tipo I) con un tapón (goma de bromobutilo), precinto (aluminio) y cápsula (plástico).
3 ml de disolvente en un vial (vidrio tipo I) con un tapón (goma de clorobutilo), precinto (aluminio) y cápsula (plástico).
Estuche con accesorios: 1 trasvasador con filtro 20/20, 1 jeringa de un solo uso (Berinert 500: 10 ml, Berinert 1500: 5 ml), 1 equipo de venopunción, 2 toallitas impregnadas de alcohol y 1 apósito.
Tamaño del envase de 1.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Cualquier cantidad de medicamento que no se haya usado o cualquier material residual debe eliminarse cumpliendo la normativa local.
Método de administración
Instrucciones generales
- La solución de Berinert 500 debe ser transparente y clara.
- La solución de Berinert 1500 debe ser transparente y clara a ligeramente opalescente.
- Después del filtrado o trasvase (consulte más adelante), el producto reconstituido debe
inspeccionarse visualmente para comprobar que no contiene partículas ni presenta decoloración antes de administrarlo al paciente.
- No use soluciones turbias o que contengan depósitos.
- La reconstitución y el trasvase deben realizarse bajo condiciones asépticas. Utilice la jeringa
proporcionada con el producto.
Reconstitución
Atempere el disolvente a temperatura ambiente. Asegúrese de que se han retirado los precintos de los viales de polvo y de disolvente y que se han desinfectado los tapones con una solución antiséptica y se han dejado secar antes de abrir el envase que contiene el Mix2Vial.
|
¡SD i |
1. Abra el envase del Mix2Vial desprendiendo el precinto. No retire el Mix2Vial del blister. | ||
|
l s__ ___ |
O 2 |
2. Coloque el vial del disolvente sobre una superficie limpia y plana y sujételo con firmeza. Sujete el Mix2Vial junto con el blister y empuje el terminal azul hacia abajo haciéndolo encajar en el tapón del vial del disolvente. | |

3
4
5

6
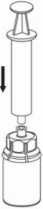
7
3. Retire con cuidado el blister del Mix2Vial sujetando el borde y tirando verticalmente hacia arriba. Asegúrese de que sólo retira el blister y no el Mix2Vial.
4. Coloque el vial del polvo sobre una superficie plana y firme. Invierta el vial del disolvente con el Mix2Vial acoplado y empuje el terminal del adaptador transparente hacia abajo encajándolo en el tapón del vial del polvo. El disolvente se transferirá automáticamente al vial del polvo.
5. Con una mano, sujete el lado del vial del polvo con el Mix2Vial y, con la otra mano, sujete el lado del vial del disolvente y desenrosque con cuidado el sistema de transferencia separándolo en dos piezas.
Deseche el vial del disolvente con el adaptador azul del Mix2Vial acoplado.
6. Someta el vial de la solución con el adaptador transparente acoplado a movimientos de rotación suaves hasta que la sustancia se haya disuelto por completo. No lo agite.
7. Llene de aire una jeringa vacía y estéril. Utilice la jeringa proporcionada con el producto. Manteniendo el vial con la solución reconstituida en posición vertical, conecte la jeringa al adaptador Luer Lock del Mix2Vial acoplado. Inyecte el aire al vial de la solución.
Transvase de la solución reconstituida a la jeringa y administración
|
l |
U 8 |
8. Mientras mantiene el émbolo de la jeringa presionado, invierta el sistema y aspire la solución reconstituida al interior de la jeringa haciendo retroceder lentamente el émbolo de la jeringa. | |
|
i |
i 9 |
9. Una vez que la solución se haya transferido a la jeringa, sujete con firmeza el cuerpo de la jeringa (manteniendo el émbolo hacia abajo) y desconecte el adaptador transparente del Mix2Vial de la jeringa. |
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CSL Behring GmbH Emil-von-Behring-Strasse 76 35041 Marburg Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Enero 2016
10. FECHA DE LA REVISIÓN DEL TEXTO
Enero 2016
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es
9 de 9