Benepali 50Mg Solucion Inyectable En Pluma Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Benepali 50 mg solución inyectable en jeringa precargada. Benepali 50 mg solución inyectable en pluma precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
50 mg de solución inyectable en jeringa precargada
Cada jeringa precargada contiene 50 mg de etanercept en un volumen total de 1 ml.
50 mg de solución inyectable en pluma precargada
Cada pluma precargada contiene 50 mg de etanercept en un volumen total de 1 ml.
Etanercept es una proteína humana compuesta por el receptor p75 del factor de necrosis tumoral y la porción Fc de la IgG1 humana, obtenida por tecnología del ADN recombinante a partir de un cultivo de células de ovario de hámster chino (CHO). Etanercept es una proteína dimérica construida genéticamente por fusión del dominio extracelular soluble del receptor-2 del factor de necrosis tumoral humano (TNFR2/p75), unido al dominio Fc de la IgG1 humana. Este componente Fc contiene la región bisagra, las regiones CH2 y CH3, pero no la región CH de la IgG1. Etanercept contiene 934 aminoácidos y tiene un peso molecular aparente de aproximadamente 150 kilodaltons. La actividad específica de etanercept es 1,7 * 106 unidades/mg.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyección).
La solución es transparente e incolora o de color amarillo pálido, y está formulada a un pH de
6,2 ± 0,3. La osmolalidad de la solución es de 325 ± 35 mOsm/kg.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Artritis reumatoide
Benepali, en combinación con metotrexato, está indicado en el tratamiento de la artritis reumatoide activa de moderada a grave en adultos, cuando la respuesta a fármacos antirreumáticos que modifican la enfermedad, incluido metotrexato (a no ser que esté contraindicado), ha sido inadecuada.
Benepali puede administrarse como monoterapia en caso de intolerancia a metotrexato o cuando el tratamiento continuo con metotrexato no sea apropiado.
Benepali también está indicado para el tratamiento de la artritis reumatoide progresiva, activa y grave en adultos que no han sido tratados previamente con metotrexato.
Benepali, solo o en combinación con metotrexato, ha demostrado reducir la tasa de progresión del daño de las articulaciones, medido a través de análisis radiológico, así como mejorar la función física.
Artritis psoriásica
Tratamiento de la artritis psoriásica activa y progresiva en adultos cuando la respuesta a una terapia previa con fármacos antirreumáticos modificadores de la enfermedad, ha sido inadecuada. Se ha demostrado que etanercept mejora la función física en pacientes con artritis psoriásica, y que reduce la tasa de progresión del daño de las articulaciones periféricas, medido a través de análisis radiológico, en pacientes con subtipos poliarticulares simétricos de la enfermedad.
Espondiloartritis axial
Espondilitis anquilosante
Tratamiento de la espondilitis anquilosante activa grave en adultos que han tenido una respuesta inadecuada a la terapia convencional.
Espondiloartritis axial no radiográfica
Tratamiento de la espondiloartritis axial no radiográfica grave en adultos con signos objetivos de inflamación, como elevación de la proteína C-reactiva y/o Imagen por Resonancia Magnética (IRM), que han tenido una respuesta inadecuada a los antiinflamatorios no esteroideos (AINEs).
Psoriasis en placas
Tratamiento de adultos con psoriasis en placas de moderada a grave que no han respondido o que tienen contraindicada, o no toleran otra terapia sistémica incluyendo ciclosporina, metotrexato o psoraleno y luz ultravioleta A (PUVA) (ver sección 5.1).
4.2 Posología y forma de administración
El tratamiento con Benepali debe iniciarse y supervisarse por un médico especialista experimentado en el diagnóstico y tratamiento de la artritis reumatoide, artritis psoriásica, espondilitis anquilosante, espondiloartritis axial no radiográfica o psoriasis en placas. A los pacientes tratados con Benepali se les debe dar la Tarjeta de Información para el Paciente.
Posología
Artritis reumatoide
La dosis recomendada es 50 mg de etanercept administrados una vez a la semana (ver sección 5.1).
Artritis psoriásica, espondilitis anquilosante y espondiloartritis axial no radiográfica La dosis recomendada es 50 mg de etanercept administrados una vez a la semana.
Para todas las indicaciones mencionadas anteriormente, los datos disponibles sugieren que la respuesta clínica se consigue, por lo general, dentro de las primeras 12 semanas de tratamiento. La continuación del tratamiento debe ser reconsiderada cuidadosamente si el paciente no ha respondido en este periodo de tiempo.
Psoriasis en placas
La dosis recomendada de etanercept es de 50 mg administrados una vez a la semana.
Alternativamente, pueden ser administrados 50 mg dos veces a la semana durante un periodo máximo de 12 semanas, seguidos, si es necesario, de una dosis de 50 mg una vez a la semana. El tratamiento con Benepali debe continuar hasta conseguir la remisión, durante un periodo máximo de 24 semanas. La terapia continua más allá de 24 semanas puede ser apropiada para algunos pacientes adultos (ver sección 5.1). El tratamiento debe ser interrumpido en pacientes en los que no se observe respuesta después de 12 semanas. Si una repetición del tratamiento con Benepali está indicada, deben seguirse las mismas pautas sobre la duración del tratamiento. La dosis debe ser 50 mg una vez a la semana.
Poblaciones especiales
Pacientes con insuficiencia renal y hepática No se requiere ajuste de la dosis.
Pacientes de edad avanzada
No se requiere ajuste de la dosis. La posología y administración es la misma que la de adultos de 18 a 64 años de edad.
Población pediátrica
El uso de Benepali no está indicado en niños menores de 18 años. Benepali solo se presenta como jeringa precargada de 50 mg y como un pluma precargada de 50 mg. La dosis recomendada de etanercept para los pacientes pediátricos es de 0,8 mg/kg administrados una vez a la semana como presentación liofilizada.
Hay disponibles otros productos de etanercept con las dosis adecuadas para los niños.
Forma de administración
Benepali es administrado mediante una inyección subcutánea (ver sección 6.6).
En la sección 7, “Instrucciones de uso”, del prospecto, se incluyen instrucciones detalladas para la administración.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Sepsis o riesgo de sepsis.
En pacientes con infecciones activas, incluyendo infecciones crónicas o localizadas, no debe iniciarse el tratamiento con Benepali.
4.4 Advertencias y precauciones especiales de empleo
A fin de mejorar la trazabilidad de los medicamentos biológicos, el nombre comercial y el número de lote del producto administrado debe estar claramente registrado (o mencionado) en la historia clínica del paciente.
Infecciones
Se debe evaluar la posibilidad de infección en el paciente antes, durante y después del tratamiento con Benepali, teniendo en cuenta que la media de la semivida de eliminación de etanercept es aproximadamente 70 horas (rango 7 a 300 horas).
Se han notificado infecciones graves, sepsis, tuberculosis, e infecciones oportunistas, incluyendo infecciones fúngicas invasivas, listeriosis y legionelosis con el uso de etanercept (ver sección 4.8). Estas infecciones se debieron a bacterias, micobacterias, hongos, virus y parásitos (incluyendo protozoos). En algunos casos no se han detectado infecciones fúngicas particulares y otras infecciones oportunistas, dando como resultado el retraso en el tratamiento apropiado y en ocasiones la muerte. En la valoración de los pacientes para determinar la presencia de infecciones, debe considerarse el riesgo para el paciente de padecer infecciones oportunistas relevantes (por ejemplo, exposición a micosis endémicas).
Debe monitorizarse estrechamente a los pacientes que desarrollen una nueva infección mientras están en tratamiento con Benepali. Debe suspenderse la administración de Benepali si un paciente desarrolla una infección grave. No han sido evaluadas la seguridad y eficacia de etanercept en pacientes con infecciones crónicas. Los médicos deben extremar las precauciones cuando consideren el uso de Benepali en pacientes con historial de infecciones crónicas o recurrentes o con trastornos subyacentes que pudieran predisponer a los pacientes a infecciones, tales como diabetes avanzada o mal controlada.
Tuberculosis
Se han notificado casos de tuberculosis activa, incluyendo tuberculosis miliar, y tuberculosis con localización extra-pulmonar en pacientes en tratamiento con etanercept.
Se debe evaluar a los pacientes para un posible diagnóstico de tuberculosis activa o inactiva (“latente”) antes de empezar el tratamiento con Benepali. Esta evaluación debe incluir una historia médica detallada con una historia personal de tuberculosis o un posible contacto previo con la tuberculosis y previas y/o actuales terapias inmunosupresoras. Los estudios de detección adecuados, por ejemplo análisis de tuberculina en piel y radiografía de tórax, deben realizarse a todos los pacientes (deben aplicarse las recomendaciones locales). Se recomienda que se registre en la tarjeta de alerta para el paciente la realización de estas pruebas. Se recuerda a los prescriptores del riesgo de un resultado falso negativo en la prueba de tuberculina en piel, especialmente en pacientes que están gravemente enfermos o inmunocomprometidos.
No se debe iniciar la terapia con Benepali si se diagnostica una tuberculosis activa. Si se diagnostica una tuberculosis inactiva (“latente”), debe iniciarse un tratamiento para la tuberculosis latente con una terapia anti-tuberculosis antes del inicio del tratamiento con Benepali, y de acuerdo a las recomendaciones locales. En esta situación, el balance riesgo/beneficio de la terapia con Benepali debe ser considerado cuidadosamente.
Se debe informar a todos los pacientes que deben consultar con su médico si aparecen signos o síntomas que sugieran tuberculosis (por ejemplo tos persistente, pérdida de peso, febrícula) durante o después del tratamiento con Benepali.
Reactivación de la hepatitis B
Se ha notificado la reactivación de hepatitis B en pacientes que estuvieron previamente infectados por el virus de la hepatitis B (VHB) y habían recibido tratamiento concomitante con antagonistas del TNF, incluyendo etanercept. Estas notificaciones incluyen casos de reactivación de hepatitis B en pacientes que eran anticuerpos antiHBc positivos, pero antígeno HBs negativos. Se deberá realizar un análisis al paciente para determinar la presencia de infección por el VHB antes de iniciar el tratamiento con Benepali. En el caso de los pacientes cuyo resultado para la infección por VHB sea positivo, se recomienda consultar a un médico especialista en el tratamiento de la hepatitis B. Debe actuarse con precaución cuando se administre Benepali a pacientes previamente infectados por el VHB. Se debe monitorizar a estos pacientes durante todo el tratamiento, y durante varias semanas después de finalizarlo, para detectar síntomas y signos de una infección activa por VHB. No se dispone de datos adecuados de pacientes infectados por VHB y tratados con antivirales en combinación con antagonistas TNF. En los pacientes que desarrollen una infección por VHB, se debe interrumpir el tratamiento con Benepali e iniciarse un tratamiento antiviral efectivo junto con el tratamiento de apoyo apropiado.
Empeoramiento de la hepatitis C
Se han notificado casos de empeoramiento de la hepatitis C en pacientes en tratamiento con etanercept. Se debe utilizar Benepali con precaución en pacientes con historial de hepatitis C.
Tratamiento concomitante con anakinra
La administración concomitante de etanercept y anakinra se ha asociado con un riesgo incrementado de infecciones graves y neutropenia en comparación con la administración sola de etanercept. Esta combinación no ha demostrado incremento del beneficio clínico. Por tanto, no se recomienda el uso combinado de Benepali y anakinra (ver secciones 4.5 y 4.8).
Tratamiento concomitante con abatacept
En los ensayos clínicos, la administración concomitante de abatacept y etanercept dio como resultado un incremento de la incidencia de las reacciones adversas graves. Esta combinación no ha demostrado un beneficio clínico incrementado; tal uso no se recomienda (ver sección 4.5).
Reacciones alérgicas
Se han observado con frecuencia reacciones alérgicas asociadas a la administración de etanercept. Las reacciones alérgicas han incluido angioedema y urticaria: se han producido reacciones graves. Si se produce cualquier reacción alérgica o anafiláctica grave, la terapia con Benepali debe interrumpirse inmediatamente y comenzar una terapia apropiada.
Inmunosupresión
Existe la posibilidad de que los antagonistas TNF, incluyendo etanercept, afecten a las defensas del huésped frente a infecciones y neoplasias, ya que el TNF es un mediador de la inflamación y modula la respuesta inmune celular. En un ensayo con 49 pacientes adultos con artritis reumatoide tratados con etanercept, no hubo evidencia de depresión de hipersensibilidad de tipo retardado, disminución de los niveles de inmunoglobulinas o cambio en el número de poblaciones de células efectoras.
Dos pacientes con artritis idiopática juvenil desarrollaron infección por varicela y signos y síntomas de meningitis aséptica que se resolvieron sin secuelas. Los pacientes con una exposición significativa al virus de la varicela deben interrumpir temporalmente el tratamiento con Benepali y debe considerarse el tratamiento profiláctico con inmunoglobulina de varicela Zoster.
La seguridad y eficacia de etanercept en pacientes con inmunosupresión no ha sido evaluada. Neoplasias y trastornos linfoproliferativos
Neoplasias sólidas y hematopoyéticas (excluyendo cánceres de piel)
Se han notificado varias neoplasias (incluyendo cáncer de mama y pulmón y linfoma) en el periodo de post-comercialización (ver sección 4.8).
En las partes controladas de los ensayos clínicos de los antagonistas del TNF, se han observado más casos de linfomas entre los pacientes que recibieron un antagonista del TNF en comparación con el grupo control. Sin embargo, la incidencia fue rara, y el periodo de seguimiento de los pacientes con placebo fue más corto que el de los pacientes que recibían el tratamiento con el antagonista del TNF. En el periodo post-comercialización, se han notificado casos de leucemia en pacientes tratados con antagonistas del TNF. Existe un mayor riesgo basal de linfomas y leucemia en pacientes con artritis reumatoide con enfermedad inflamatoria, de larga evolución y de alta actividad, que complica la estimación del riesgo.
Sobre la base del conocimiento actual, no se puede excluir un posible riesgo de desarrollo de linfomas, leucemia u otras neoplasias hematopoyéticas o de tumores sólidos en pacientes tratados con un antagonista del TNF. Se debe tener precaución cuando se considera la terapia con antagonistas del TNF para pacientes con una historia de neoplasia o cuando se considera continuar el tratamiento en pacientes que desarrollen una neoplasia.
En el periodo de post-comercialización, se han notificado neoplasias, algunas mortales, en niños, adolescentes y adultos jóvenes (hasta 22 años de edad) tratados con antagonistas del TNF (inicio de la terapia < 18 años de edad), incluyendo etanercept. Aproximadamente la mitad de los casos eran linfomas. Los otros casos representaban una variedad de diferentes neoplasias e incluían neoplasias raras normalmente asociadas con inmunosupresión. No puede excluirse un riesgo de desarrollo de neoplasias en niños y adolescentes tratados con antagonistas del TNF.
Cánceres de piel
Se han notificado melanomas y cáncer de piel no melanoma (CPNM) en pacientes tratados con antagonistas del TNF, incluyendo etanercept. De manera muy infrecuente, se han notificado casos post-comercialización de carcinoma de células de Merkel en pacientes tratados con etanercept. Se recomienda un examen cutáneo periódico de todos los pacientes, especialmente de aquellos con factores de riesgo de cáncer de piel.
Combinando los resultados de ensayos clínicos controlados, se observaron más casos de NMSC en los pacientes que recibieron etanercept en comparación con los pacientes control, particularmente en los pacientes con psoriasis.
Vacunas
No deben administrarse vacunas vivas simultáneamente con Benepali. No se dispone de datos sobre la transmisión secundaria de la infección por vacunas vivas en pacientes que reciben etanercept. En un ensayo clínico doble ciego, aleatorizado, controlado con placebo 184 pacientes adultos con artritis psoriásica también recibieron una vacuna polisacárida neumocócica multivalente en la semana 4. En este ensayo la mayoría de los pacientes con artritis psoriásica que recibieron etanercept fueron capaces de generar una respuesta inmune efectiva de células B a la vacuna polisacárida neumocócica, pero los títulos en conjunto fueron moderadamente inferiores y pocos pacientes duplicaron los títulos en comparación con pacientes que no recibieron etanercept, de lo cual se desconoce el significado clínico.
Formación de autoanticuerpos
El tratamiento con Benepali puede producir la formación de anticuerpos autoinmunes (ver sección 4.8).
Reacciones hematológicas
En pacientes tratados con etanercept se han notificado raramente casos de pancitopenia y muy raramente casos de anemia aplásica, algunos con resultado mortal. Se debe tener precaución en pacientes tratados con Benepali los cuales tengan un historial de discrasias sanguíneas. Todos los pacientes y los padres/cuidadores deben ser advertidos de que si el paciente desarrolla signos y síntomas que sugieren la existencia de discrasias sanguíneas o infecciones (como por ejemplo, fiebre persistente, odinofagia, hematomas, sangrado y palidez) mientras están tratándose con Benepali deben informar inmediatamente a su médico. Estos pacientes deberán ser estudiados urgentemente incluyendo un recuento de células sanguíneas completo. Si se confirma una discrasia sanguínea, se deberá interrumpir el tratamiento con Benepali.
Trastornos neurológicos
Ha habido, muy ocasionalmente, informes de trastornos desmielinizantes del SNC en pacientes tratados con etanercept (ver sección 4.8). Además, en muy raras ocasiones, ha habido informes de polineuropatías desmielinizantes periféricas (incluidos síndrome de Guillain-Barré, polineuropatía desmielinizante inflamatoria crónica, polineuropatía desmielinizante y neuropatía motora multifocal). Aunque no se han desarrollado ensayos clínicos para evaluar el tratamiento con etanercept en pacientes con esclerosis múltiple, los ensayos clínicos de otros antagonistas del TNF en pacientes con esclerosis múltiple han mostrado un incremento en la actividad de la enfermedad. Cuando se prescriba Benepali a pacientes con enfermedad desmielinizante preexistente o de reciente comienzo, o a aquellos que se considere que tienen un riesgo incrementado de desarrollar enfermedad desmielinizante, se recomienda una cuidadosa evaluación del riesgo beneficio, incluyendo una evaluación neurológica.
Terapia combinada
En un ensayo clínico controlado de dos años de duración en pacientes adultos con artritis reumatoide, la combinación de etanercept y metotrexato, no evidenció hallazgos inesperados sobre la seguridad, y el perfil de seguridad de etanercept cuando se administra con metotrexato fue similar a los perfiles notificados en los ensayos de etanercept y metotrexato solos. Están en marcha ensayos a largo plazo para evaluar la seguridad de la combinación. La seguridad a largo plazo cuando etanercept se administra en combinación con otros fármacos antirreumáticos modificadores de la enfermedad (FARMEs), no ha sido establecida.
No se ha estudiado el uso de etanercept en combinación con otras terapias sistémicas o fototerapia para el tratamiento de la psoriasis.
Insuficiencia renal y hepática
Basado en datos farmacocinéticos (ver sección 5.2), en pacientes con insuficiencia renal o hepática, no se requiere ajuste de dosis; la experiencia clínica en este tipo de pacientes es limitada.
Insuficiencia cardíaca congestiva
Los médicos deben tener precaución cuando se use Benepali en pacientes que tienen insuficiencia cardíaca congestiva (ICC). Ha habido informes post-comercialización sobre empeoramiento de la ICC, con y sin factores de precipitación identificables, en pacientes que están tomando etanercept. También se han observado casos raros (< 0,1 %) de ICC de novo, incluyendo ICC en pacientes sin enfermedad cardiovascular preexistente conocida. Algunos de estos pacientes tenían menos de 50 años de edad. Dos grandes ensayos clínicos en los que se estaba evaluando el uso de etanercept en el tratamiento de la ICC terminaron antes de tiempo debido a la falta de eficacia. Aunque no es concluyente, los datos de uno de estos ensayos sugieren una posible tendencia al empeoramiento de la ICC en aquellos pacientes asignados al tratamiento con etanercept.
Hepatitis alcohólica
En un ensayo fase II, aleatorizado, controlado con placebo de 48 pacientes hospitalizados tratados con etanercept o placebo para hepatitis alcohólica de moderada a grave, etanercept no fue eficaz y la tasa de mortalidad en los pacientes tratados con etanercept fue significativamente superior tras 6 meses. En consecuencia, Benepali no debe usarse en pacientes para el tratamiento de la hepatitis alcohólica. Los médicos deben tener cuidado cuando utilicen Benepali en pacientes que también tienen hepatitis alcohólica de moderada a grave.
Granulomatosis de Wegener
En un ensayo controlado con placebo, en el que 89 pacientes adultos fueron tratados con etanercept en adición a la terapia estándar (incluyendo ciclofosfamida o metotrexato y glucocorticoides) para una duración media de 25 meses, no se ha demostrado que etanercept sea un tratamiento eficaz para la granulomatosis de Wegener. La incidencia de neoplasias no cutáneas de diferentes tipos fue significativamente más elevada en pacientes tratados con etanercept que en pacientes del grupo de control. No se recomienda Benepali para el tratamiento de la granulomatosis.
Hipoglucemia en pacientes tratados para la diabetes
En pacientes que reciben medicamentos para la diabetes, se ha observado hipoglucemia tras el inicio del tratamiento con etanercept, necesitándose una reducción de los medicamentos antidiabéticos en algunos de estos pacientes.
Poblaciones especiales
Pacientes de edad avanzada
En un ensayo fase III en artritis reumatoide, artritis psoriásica y espondilitis anquilosante, no hubo diferencias globales en reacciones adversas, reacciones adversas graves e infecciones graves en pacientes de 65 años o mayores que han recibido etanercept en comparación con pacientes más jóvenes. De todas formas, se debe tener precaución cuando se trata a ancianos y con particular atención con respecto a la ocurrencia de infecciones.
Población pediátrica
Benepali no está indicado en niños. Los datos disponibles acerca del tratamiento con etanercept en la población pediátrica se resumen más adelante:
Vacunas
Se recomienda que, si es posible, los pacientes pediátricos sean vacunados de acuerdo a los calendarios de vacunación previstos, antes de iniciar el tratamiento con etanercept (ver más arriba el apartado de Vacunas).
Enfermedad inflamatoria intestinal (EII) y uveítis en pacientes con artritis idiopática juvenil (AIJ)
Se han notificado casos de EII y uveítis en pacientes con AIJ que estaban en tratamiento con etanercept (ver sección 4.8).
4.5 Interacción con otros medicamentos y otras formas de interacción
Tratamiento concomitante con anakinra
Se ha observado que los pacientes adultos en tratamiento con etanercept y anakinra tienen una tasa superior de infecciones graves en comparación con los pacientes en tratamiento solo con etanercept o solo con anakinra (datos históricos).
Además, en un ensayo doble ciego, controlado con placebo realizado en pacientes adultos que estaban en tratamiento con metotrexato, se ha observado que en los pacientes en tratamiento con etanercept y anakinra la tasa de infecciones graves (7%) y neutropenia fue superior a la de los pacientes en tratamiento con etanercept (ver secciones 4.4 y 4.8). La combinación etanercept y anakinra no ha demostrado un mayor beneficio clínico y por tanto no se recomienda su uso.
Tratamiento concomitante con abatacept
En los ensayos clínicos, la administración concomitante de abatacept y etanercept dio como resultado un incremento de la incidencia de las reacciones adversas graves. Esta combinación no ha demostrado un beneficio clínico incrementado; tal uso no se recomienda (ver sección 4.4).
Tratamiento concomitante con sulfasalazina
En un ensayo clínico con pacientes adultos que estaban recibiendo una dosis establecida de sulfasalazina, a la cual se le añadió etanercept, los pacientes en el grupo de combinación experimentaron una disminución estadísticamente significativa en el recuento medio de glóbulos blancos en comparación con los grupos tratados con etanercept o sulfasalazina solos. El significado clínico de esta interacción es desconocido. Los médicos deben tener cuidado cuando consideren el tratamiento combinado con sulfasalazina.
Sin interacción
En ensayos clínicos, no se han observado interacciones cuando etanercept se administró con glucocorticoides, salicilatos (excepto sulfasalazina), antiinflamatorios no esteroideos (AINEs), analgésicos o metotrexato. Para recomendaciones de vacunación, ver sección 4.4.
No se han observado interacciones farmacocinéticas clínicamente significativas entre medicamentos en ensayos con metotrexato, digoxina o warfarina.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Se debe advertir a las mujeres en edad fértil que durante el tratamiento con Benepali y hasta 3 semanas después de interrumpir el tratamiento, deben utilizar métodos anticonceptivos adecuados para evitar el embarazo.
Embarazo
En estudios de desarrollo de toxicidad llevados a cabo en ratas y conejos no se observó evidencia de daño fetal o neonatal en ratas debido a etanercept. En un estudio observacional se observó una mayor tasa de defectos congénitos importantes al comparar los embarazos en los que existió una exposición a etanercept durante el primer trimestre, frente a los embarazos en los que no existió exposición a etanercept ni a otros antagonistas del TNF (odds ratio ajustada: 2,4; IC del 95%: 1,0-5,5). Los tipos de defectos congénitos importantes fueron consistentes con los que se notificaron con mayor frecuencia en la población general, y no se identificaron patrones de anomalías concretos. No se observaron cambios en las tasas de abortos espontáneos, nacidos muertos o malformaciones leves. No se recomienda el uso de Benepali durante el embarazo.
Etanercept atraviesa la placenta y se ha detectado en el suero de niños nacidos de pacientes mujeres tratadas con etanercept durante el embarazo. Se desconoce la repercusión clínica de este hecho; sin embargo, los lactantes pueden presentar un aumento del riesgo de infección. No se recomienda la administración de vacunas vivas a lactantes durante las 16 semanas siguientes a la última dosis de Benepali administrada a la madre.
Lactancia
Se ha notificado que etanercept se excreta en la leche materna tras la administración subcutánea. En ratas lactantes, tras la administración subcutánea, etanercept se excretó en la leche y se detectó en el suero de las crías. Debido a que, al igual que ocurre con otros muchos medicamentos, las inmunoglobulinas pueden ser excretadas en la leche materna, se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con Benepali, tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
No se dispone de datos preclínicos sobre la toxicidad peri y postnatal de etanercept, ni tampoco de los efectos de etanercept sobre la fertilidad y la capacidad reproductiva.
4.7 Efectos sobre la capacidad de conducir y utilizar máquinas
No se han realizado estudios sobre los efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas Resumen del perfil de seguridad
Las reacciones adversas notificadas con mayor frecuencia son reacciones en la zona de inyección (tales como dolor, hinchazón, picor, enrojecimiento y sangrado en el lugar de punción), infecciones (tales como infecciones del tracto respiratorio alto, bronquitis, infecciones vesicales e infecciones cutáneas), reacciones alérgicas, desarrollo de autoanticuerpos, picor y fiebre.
Se han notificado también reacciones adversas graves con etanercept. Los antagonistas de TNF, como etanercept, afectan al sistema inmune, y su utilización puede afectar a las defensas del organismo frente a infecciones y cáncer. Las infecciones graves afectan a menos de 1 de cada 100 pacientes tratados con etanercept. Las notificaciones incluyen infecciones mortales y potencialmente mortales y sepsis. También se han notificado varias neoplasias con el uso de etanercept, incluyendo cánceres de mama, pulmón, piel y ganglios linfáticos (linfoma).
Así mismo también se han notificado reacciones hematológicas, neurológicas y autoinmunes graves. Estas incluyen casos raros de pancitopenia, y casos muy raros de anemia aplásica. Con el uso de etanercept, también se han observado casos raros o muy raros de desmielinización central y periférica, respectivamente. También ha habido notificaciones de lupus, enfermedades relacionadas con lupus y vasculitis.
Tabla de reacciones adversas
El siguiente listado de reacciones adversas se basa en la experiencia de los ensayos clínicos en adultos y en la experiencia post-comercialización.
Dentro de la clasificación por órganos y sistemas, las reacciones adversas están listadas por orden frecuencia (número de pacientes que se espera experimenten la reacción), utilizando las siguientes categorías: muy frecuentes (> 1/10); frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1.000); muy raras (< 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Infecciones e infestaciones:
Muy frecuentes:
Poco frecuentes:
Raras:
Frecuencia no
Infecciones (incluyendo infecciones del tracto respiratorio alto, bronquitis, cistitis, infecciones cutáneas)*
Infecciones graves (incluyendo neumonía, celulitis, artritis séptica, sepsis e infecciones parasitarias)*
Tuberculosis, infecciones oportunistas (incluyendo infecciones fúngicas invasivas, protozoarias, bacterianas, por micobacterias atípicas, infecciones víricas e infección por Legionella) Infección por Listeria, reactivación de hepatitis B
conocida:
Neoplasias benignas, malignas y no especificadas (incl. quistes y pólipos)
|
Poco frecuentes: Raras: Frecuencia no conocida: |
Cáncer de piel no-melanoma* (ver sección 4.4) Linfoma, melanoma (ver sección 4.4) Leucemia, carcinoma de células de Merkel (ver sección 4.4) |
Trastornos de la sangre y del sistema linfático:
Poco frecuentes: Trombocitopenia
|
Raras: Muy raras: |
Anemia, leucopenia, neutropenia, pancitopenia* Anemia aplásica |
Trastornos del sistema inmunológico:
Frecuentes: Reacciones alérgicas (ver trastornos de la piel y del tejido
|
Poco frecuentes: |
subcutáneo), formación de autoanticuerpos* Vasculitis sistémica (incluyendo vasculitis anticuerpo anticitoplasma de neutrófilo positiva) |
|
Raros: |
Reacciones alérgicas/anafilácticas graves (incluyendo |
|
Frecuencia no conocida: |
angioedema, broncoespasmo), sarcoidosis Síndrome de activación macrofágica*, empeoramiento de los síntomas de dermatomiositis |
|
Trastornos del sistema nervioso: Raros: |
Convulsiones |
|
Muy raros: |
Casos de desmielinización del SNC que sugieren esclerosis múltiple o afectación desmielinizante localizada como neuritis óptica y mielitis transversa (ver sección 4.4) Casos de desmielinización periférica, incluyendo síndrome de Guillain-Barré, polineuropatía desmielinizante inflamatoria crónica, polineuropatía desmielinizante, y neuropatía motora multifocal (ver sección 4.4) |
|
Trastornos oculares: Poco frecuentes: |
Uveítis, escleritis |
|
Trastornos cardíacos: Raros: |
Insuficiencia cardíaca congestiva (ver sección 4.4). |
Trastornos respiratorios, torácicos y mediastínicos:
Poco frecuentes: Enfermedad pulmonar intersticial (incluyendo neumonitis y
|
fibrosis pulmonar)* | |
|
Trastornos hepatobiliares: Raros: |
Enzimas hepáticas aumentadas, hepatitis autoinmune |
Trastornos de la piel y tejido subcutáneo:
Frecuentes: Prurito
|
Poco frecuentes: |
Angioedema, urticaria, erupción, erupción psoriasiforme, |
|
Raros: |
psoriasis (incluyendo de nueva aparición o empeoramiento y pustular, principalmente en las palmas de las manos y las plantas de los pies) Vasculitis cutánea (incluyendo vasculitis leucocitoclástica), síndrome de Stevens-Johnson, eritema multiforme |
|
Muy raros: |
Necrolisis epidérmica tóxica |
Trastornos musculoesqueléticos y del tejido conjuntivo:
Raros: Lupus eritematoso cutáneo subagudo, lupus eritematoso
discoide, síndrome tipo lupus
Trastornos generales y alteraciones en el lugar de administración:_
Muy frecuentes: Reacciones en la zona de inyección (incluyendo hemorragia, hematomas, eritema, picor, dolor, hinchazón)*
Frecuentes: Fiebre
Ver la descripción de estas reacciones adversas que figura a continuación
Descripción reacciones adversas seleccionadas
Neoplasias y trastornos linfoproliferativos
Se observaron ciento veintinueve (129) nuevas neoplasias de distintos tipos en 4.114 pacientes con artritis reumatoide tratados con etanercept en ensayos clínicos de hasta 6 años de duración aproximadamente, incluyendo 231 pacientes tratados con etanercept en combinación con metotrexato en el ensayo de 2 años controlado con comparador activo. Los porcentajes e incidencias en estos ensayos clínicos fueron similares a los esperados para la población estudiada. Se notificaron un total de dos casos de neoplasias en los ensayos clínicos de aproximadamente 2 años de duración, en los que había 240 pacientes con artritis psoriásica tratados con etanercept. En los ensayos clínicos llevados a cabo durante más de dos años con 351 pacientes con espondilitis anquilosante, se notificaron 6 casos de neoplasias en pacientes tratados con etanercept. En un grupo de 2.711 pacientes con psoriasis en placas tratados con etanercept, en los ensayos doble ciego y abiertos de hasta 2,5 años de duración, se notificaron 30 neoplasias y 43 cánceres de piel no-melanoma.
En un grupo de 7.416 pacientes tratados con etanercept en ensayos clínicos de artritis reumatoide, artritis psoriásica, espondilitis anquilosante y psoriasis se notificaron 18 linfomas.
Durante el periodo post-comercialización, se han recibido notificaciones de varias neoplasias (incluyendo cáncer de mama y pulmón y linfoma) (ver sección 4.4).
Reacciones en la zona de inyección
Los pacientes con enfermedades reumatológicas tratados con etanercept tuvieron una incidencia de reacciones en la zona de inyección significativamente mayor que los pacientes tratados con placebo (36% frente a 9%). Las reacciones en la zona de inyección ocurrieron normalmente en el primer mes. La duración media fue aproximadamente de 3 a 5 días. En los grupos tratados con etanercept, la mayoría de las reacciones en la zona de inyección no fueron tratadas; de los pacientes a los que se les administró tratamiento, la mayoría recibieron preparaciones tópicas, tales como corticosteroides, o antihistamínicos orales. Adicionalmente, algunos pacientes desarrollaron reacciones de recuerdo en la zona de inyección, caracterizadas por una reacción cutánea en la zona de inyección más reciente, así como por la aparición simultánea de reacciones en zonas de inyección previas. Estas reacciones fueron generalmente transitorias y no se repitieron con el tratamiento.
En los ensayos controlados en pacientes con psoriasis en placas, aproximadamente el 13,6% de los pacientes tratados con etanercept desarrollaron reacciones en la zona de inyección durante las primeras 12 semanas de tratamiento frente al 3,4% de los pacientes tratados con placebo.
Infecciones graves
En los ensayos clínicos controlados con placebo no se observó aumento alguno en la incidencia de infecciones graves (con resultado de muerte, potencialmente mortales o que requieren hospitalización o la administración de antibióticos por vía intravenosa). Las infecciones graves ocurrieron en un 6,3% de los pacientes con artritis reumatoide tratados con etanercept durante un período de tiempo de hasta 48 meses. Estas incluyeron abscesos (en diferentes lugares), bacteriemia, bronquitis, bursitis, celulitis, colecistitis, diarrea, diverticulitis, endocarditis (sospecha), gastroenteritis, hepatitis B, herpes zoster, úlcera en piernas, infección bucal, osteomielitis, otitis, peritonitis, neumonía, pielonefritis, sepsis, artritis séptica, sinusitis, infección cutánea, úlcera cutánea, infección del tracto urinario, vasculitis e infección de heridas. En el ensayo controlado con comparador activo de 2 años de duración, donde los pacientes eran tratados con etanercept en monoterapia, con metotrexato en monoterapia o con etanercept combinado con metotrexato, las tasas de infecciones graves fueron similares entre los grupos de tratamiento. Sin embargo, no se puede excluir que la combinación de etanercept con metotrexato pudiera estar asociada con un incremento en la tasa de infecciones.
En los ensayos clínicos controlados con placebo de hasta 24 semanas de duración, en psoriasis en placas, no hubo diferencias en las tasas de infección entre los pacientes tratados con etanercept y los tratados con placebo. Las infecciones graves ocurridas en pacientes tratados con etanercept incluyen celulitis, gastroenteritis, neumonía, colecistitis, osteomielitis, gastritis, apendicitis, fascitis por estreptococos, miositis, shock séptico, diverticulitis y abscesos. En los ensayos doble ciego y abiertos en artritis psoriásica, se notificó un caso de 1 paciente que presentó una infección grave (neumonía).
Durante el uso de etanercept se han notificado infecciones graves y mortales; los patógenos identificados incluyen bacterias, micobacterias (incluyendo tuberculosis), virus y hongos. Algunas se produjeron a las pocas semanas después de iniciar el tratamiento con etanercept en pacientes que, además de su artritis reumatoide, presentaban enfermedades subyacentes (por ejemplo, diabetes, insuficiencia cardíaca congestiva, antecedentes de infecciones activas o crónicas) (ver sección 4.4). El tratamiento con Benepali puede incrementar la mortalidad en pacientes con sepsis demostrada.
Se han notificado infecciones oportunistas en asociación con etanercept, incluyendo infecciones fúngicas invasivas, parasitarias (incluyendo las infecciones protozoarias), víricas (incluyendo herpes zoster), bacterianas (incluyendo las producidas por Listeria y Legionella) y por micobacterias atípicas. En un conjunto de datos de ensayos clínicos, la incidencia global de infecciones oportunistas fue del 0,09% para los 15.402 sujetos que recibieron etanercept. La tasa ajustada por exposición fue de 0,06 acontecimientos por 100 pacientes-año. Durante la experiencia post-comercialización, aproximadamente la mitad de todos los casos clínicos de infecciones oportunistas en todo el mundo fueron infecciones fúngicas invasivas. Las infecciones fúngicas invasivas más comúnmente notificadas fueron por Candida, Pneumocystis, Aspergillus e Histoplasma. Las infecciones fúngicas invasivas explicaron más de la mitad de las muertes de los pacientes que desarrollaron infecciones oportunistas. La mayoría de los casos con desenlace de muerte fueron en pacientes con Pneumocystis pneumoniae, infecciones fúngicas sistémicas no especificadas y aspergilosis (ver sección 4.4).
Autoanticuerpos
En pacientes adultos, se analizaron muestras de suero en distintos puntos de los ensayos para la determinación de autoanticuerpos. De los pacientes con artritis reumatoide evaluados, el porcentaje de pacientes que desarrollaron nuevos ANA positivos (> 1:40) fue superior en los pacientes tratados con etanercept (11%) que en los tratados con placebo (5%). El porcentaje de pacientes que desarrolló nuevos anticuerpos positivos anti ADN de doble cadena fue también superior por radioinmunoensayo (15% de los pacientes tratados con etanercept frente al 4% de los pacientes tratados con placebo) y con el ensayo Crithidia luciliae (3% de los pacientes tratados con etanercept frente a ningún paciente de los tratados con placebo). La proporción de pacientes tratados con etanercept que desarrollaron anticuerpos anticardiolipina aumentó de forma similar en comparación con los pacientes tratados con placebo. No se conoce el impacto del tratamiento a largo plazo con etanercept sobre el desarrollo de enfermedades autoinmunes.
Ha habido casos raros de pacientes, incluyendo pacientes con factor reumatoide positivo, que han desarrollado otros autoanticuerpos junto a un síndrome tipo lupus o a erupciones compatibles clínicamente, y tras la realización de biopsia, con lupus cutáneo subagudo o lupus discoide.
Pancitopenia y anemia aplásica
Durante el periodo post-comercialización, se han notificado casos de pancitopenia y anemia aplásica, algunos de los cuales tuvieron desenlace de muerte (ver sección 4.4).
Enfermedad pulmonar intersticial
Durante el periodo post-comercialización, se han notificado casos de enfermedad pulmonar intersticial (incluyendo neumonitis y fibrosis pulmonar), algunos de los cuales tuvieron desenlace de muerte.
Tratamiento concomitante con anakinra
En los ensayos en los que pacientes adultos recibieron un tratamiento concomitante con etanercept y anakinra, se observó una tasa superior de infecciones graves en comparación con los que recibieron solo etanercept, y un 2% de los pacientes (3/139) desarrollaron neutropenia (recuento de neutrófilos totales < 1.000/mm3). Durante la fase neutropénica, un paciente desarrolló celulitis que se resolvió tras su hospitalización (ver secciones 4.4 y 4.5).
Población pediátrica
Benepali no está indicado en niños. Los datos disponibles acerca del tratamiento con etanercept en la población pediátrica se resumen más adelante:
Reacciones adversas en pacientes pediátricos con artritis idiopática juvenil En general, las reacciones adversas en pacientes pediátricos con artritis idiopática juvenil fueron similares en frecuencia y tipo a las observadas en pacientes adultos. En los siguientes párrafos se comentan las diferencias con adultos y otras consideraciones especiales.
Los tipos de infecciones observados en los ensayos clínicos realizados en pacientes de edades comprendidas entre 2 y 18 años con artritis idiopática juvenil, fueron generalmente de leves a moderados y concordaban con los comúnmente observados en la población pediátrica ambulatoria. Entre las reacciones adversas graves notificadas se incluyen varicela con signos y síntomas de meningitis aséptica, que se resolvió sin secuelas (ver también sección 4.4), apendicitis, gastroenteritis, depresión/trastornos de personalidad, úlcera cutánea, esofagitis/gastritis, shock séptico por estreptococos del grupo A, diabetes mellitus tipo I, e infección en tejidos blandos y en heridas postoperatorias.
En un ensayo realizado en niños con artritis idiopática juvenil, de edades comprendidas entre 4 y 17 años, 43 de 69 niños (62%) experimentaron una infección mientras recibían etanercept durante 3 meses de ensayo (Parte 1, fase abierta), y la frecuencia y gravedad de las infecciones fue similar en los 58 pacientes que completaron los 12 meses de la fase de extensión abierta. Los tipos y la proporción de acontecimientos adversos en pacientes con artritis idiopática juvenil fueron similares a las observadas en los ensayos con etanercept en pacientes adultos con artritis reumatoide, siendo la mayoría de carácter leve. Varios acontecimientos adversos se notificaron con más frecuencia en 69 pacientes con artritis idiopática juvenil que recibieron etanercept durante 3 meses, en comparación con los 349 pacientes adultos con artritis reumatoide. Estos incluyen cefalea (19% de los pacientes,
1,7 acontecimientos por paciente año), náuseas (9%, 1,0 acontecimientos por paciente año), dolor abdominal (19%, 0,74 acontecimientos por paciente año) y vómitos (13%, 0,74 acontecimientos por paciente año).
Se notificaron 4 casos de síndrome de activación macrofágica en ensayos clínicos en artritis idiopática juvenil.
Durante el periodo post-comercialización, se han notificado casos de enfermedad inflamatoria intestinal y uveítis en pacientes con AIJ en tratamiento con etanercept, entre los que se incluyen un número muy pequeño de casos que experimentaron una recuperación positiva tras interrumpir el tratamiento (ver sección 4.4).
Reacciones adversas en pacientes pediátricos con psoriasis en placas
En un ensayo de 48 semanas en 211 niños de edades entre 4 y 17 años, con psoriasis pediátrica en placas, los acontecimientos adversos notificados fueron similares a los observados en ensayos anteriores en adultos con psoriasis en placas.
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Apéndice V.
4.9 Sobredosis
En los ensayos clínicos en pacientes con artritis reumatoide, no se observó toxicidad limitante de la dosis. La dosis más alta evaluada ha sido una dosis de carga inicial intravenosa de 32 mg/m2 seguida de dosis subcutánea de 16 mg/m2 administradas dos veces a la semana. Un paciente con artritis reumatoide se autoadministró por error 62 mg de etanercept subcutáneo dos veces a la semana durante 3 semanas sin experimentar efectos adversos. No se conoce ningún antídoto para etanercept.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: inmunosupresores, inhibidores del factor de necrosis tumoral alfa (TNF-a), código ATC: L04AB01
Benepali es un medicamento biosimilar. La información detallada sobre este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
El factor de necrosis tumoral (TNF) es una citoquina dominante en el proceso inflamatorio de la artritis reumatoide. También se han encontrado niveles elevados de TNF en la membrana sinovial y placas psoriásicas de pacientes con artritis psoriásica y en el suero y el tejido sinovial de pacientes con espondilitis anquilosante. En psoriasis en placas, la infiltración por células inflamatorias incluyendo las células T conduce al incremento de los niveles de TNF en lesiones psoriásicas comparadas con los niveles en la piel no involucrada. Etanercept es un inhibidor competitivo de la unión del TNF a sus receptores de superficie celular, y, por ello, inhibe la actividad biológica del TNF. El TNF y la linfotoxina son citoquinas proinflamatorias que se unen a dos receptores de superficie diferentes: los receptores del factor de necrosis tumoral (TNFR) 55-kilodalton (p55) y 75-kilodalton (p75). Ambos TNFR existen de forma natural unidos a la membrana y en forma soluble. Se cree que los TNFR solubles regulan la actividad biológica del TNF.
El TNF y la linfotoxina existen predominantemente como homotrímeros, dependiendo su actividad biológica del entrecruzamiento de los TNFR de la superficie celular Los receptores solubles diméricos, tales como etanercept poseen mayor afinidad por el TNF que los receptores monoméricos y son inhibidores competitivos considerablemente más potentes de la unión del TNF a sus receptores celulares. Además, la utilización de una región Fc de inmunoglobulina como elemento de fusión en la construcción de un receptor dimérico la dota de una vida media sérica más larga.
Mecanismo de acción
Gran parte de la patología articular en la artritis reumatoide y espondilitis anquilosante y de la patología cutánea en psoriasis en placas, está mediada por moléculas proinflamatorias ligadas a una red controlada por el TNF. Se piensa que el mecanismo de acción del etanercept es la inhibición competitiva de la unión del TNF al TNFR de la superficie celular impidiendo la respuesta celular mediada por el TNF provocando que el TNF sea biológicamente inactivo. El etanercept también puede modular la respuesta biológica controlada por moléculas adicionales que regulan a la baja (por ejemplo, citoquinas, moléculas de adhesión o proteinasas) que se inducen o regulan por el TNF.
Eficacia clínica y seguridad
Esta sección presenta datos de cuatro ensayos controlados aleatorizados en pacientes adultos con artritis reumatoide, un ensayo en pacientes adultos con artritis psoriásica, un ensayo en pacientes adultos con espondilitis anquilosante, un ensayo en pacientes adultos con espondiloartritis axial no radiográfica, cuatro ensayos en pacientes adultos con psoriasis en placas.
Pacientes adultos con artritis reumatoide
La eficacia de etanercept fue evaluada en un ensayo aleatorizado, doble ciego, controlado con placebo. El ensayo evaluó 234 pacientes adultos con artritis reumatoide (AR) activa, que habían fracasado al tratamiento previo con, al menos, uno pero no más de cuatro, fármacos antirreumáticos modificadores de la enfermedad (FARMEs). Se administraron dosis subcutáneas de 10 mg o 25 mg de etanercept o placebo, dos veces a la semana durante 6 meses consecutivos. Los resultados de este ensayo controlado se expresaron en forma de porcentaje de mejoría de la artritis reumatoide utilizando los criterios de respuesta del Colegio Americano de Reumatología (ACR).
La respuesta ACR20 y 50 a los 3 y 6 meses, fue mayor en los pacientes tratados con etanercept que en los pacientes tratados con placebo (ACR20: etanercept 62% y 59%, placebo 23% y 11% a los 3 y 6 meses respectivamente; ACR50: etanercept 41% y 40%, placebo 8% y 5% a los 3 y 6 meses respectivamente; p < 0,01 etanercept vs placebo en todos los puntos de tiempo para las respuestas ACR20 y ACR50).
Aproximadamente el 15% de los pacientes que recibieron etanercept alcanzaron una respuesta ACR70 en el mes 3 y 6, en comparación con menos del 5% de los pacientes en el grupo placebo. Entre los pacientes que recibieron etanercept, las respuestas clínicas aparecieron, generalmente, entre la primera y segunda semana desde el inicio del tratamiento y prácticamente siempre ocurrieron en tres meses. Se observó una relación dosis respuesta; los resultados con 10 mg fueron intermedios entre el placebo y la dosis de 25 mg. Etanercept fue significativamente mejor que el placebo en todos los componentes de los criterios de la ACR, así como en otras medidas de actividad de la enfermedad en la artritis reumatoide, no incluidas en los criterios de respuesta de la ACR, como la rigidez matutina. Durante el ensayo, cada 3 meses se administró un Cuestionario de Evaluación de la Salud (HAQ) que incluye parámetros de discapacidad, vitalidad, salud mental, estado general de salud y subdominios del estado de salud asociado a la artritis. Todos los subdominios del cuestionario HAQ mejoraron en los pacientes tratados con etanercept a los 3 y 6 meses en comparación con los pacientes control.
Después de la interrupción de etanercept, los síntomas de la artritis generalmente reaparecieron en un mes. La reintroducción del tratamiento con etanercept después de interrupciones de hasta 24 meses resultó en la misma magnitud de respuesta que los pacientes que recibieron etanercept sin interrupción del tratamiento en base a los resultados de los ensayos abiertos. Se han observado respuestas duraderas continuadas de hasta 10 años en los ensayos abiertos de extensión del tratamiento cuando los pacientes recibieron etanercept sin interrupción.
La eficacia de etanercept se comparó con la de metotrexato en un ensayo, aleatorizado, controlado con comparador activo, con evaluaciones radiográficas ciegas como variable primaria de evaluación en 632 pacientes adultos con artritis reumatoide activa (< 3 años de duración), que no habían recibido nunca antes tratamiento con metotrexato. Se administraron dosis de 10 o 25 mg de etanercept por vía subcutánea (SC) dos veces por semana durante 24 meses. Las dosis de metotrexato se fueron aumentando desde 7,5 mg/semana hasta un máximo de 20 mg/semana durante las primeras 8 semanas del ensayo, manteniéndose hasta los 24 meses. La mejoría clínica incluyendo un comienzo de acción de 2 semanas conseguida con 25 mg de etanercept, fue similar a la observada en los ensayos previos, y se mantuvo hasta 24 meses. En la visita de inicio, los pacientes presentaron un grado moderado de discapacidad, con puntuaciones medias de HAQ de 1,4 a 1,5. El tratamiento con etanercept 25 mg produjo una mejora sustancial a los 12 meses, con un 44% aproximadamente de pacientes que alcanzaron una puntuación normal de HAQ (menor a 0,5). Este beneficio se mantuvo en el segundo año del ensayo.
En este ensayo, se evaluó radiográficamente el daño estructural en las articulaciones, expresándose como cambio en la prueba de puntuación total de Sharp (TSS) y en sus componentes, la puntuación de la erosión y la puntuación del Estrechamiento del Espacio Articular (EEA). Las radiografías de manos/muñecas y pies se leyeron en la visita de inicio y a los 6, 12 y 24 meses. La dosis de etanercept de 10 mg presentó de forma consistente un efecto menor que la de 25 mg sobre el daño estructural. Etanercept 25 mg fue significativamente superior a metotrexato en términos de erosión tanto a los 12 como a los 24 meses. Las diferencias en TSS y EEA no fueron estadísticamente significativas entre metotrexato y etanercept 25 mg. Los resultados se muestran en la figura que aparece a continuación.
Progresión radiográfica: Comparación de etanercept vs metotrexato en pacientes con AR de < 3 años de duración
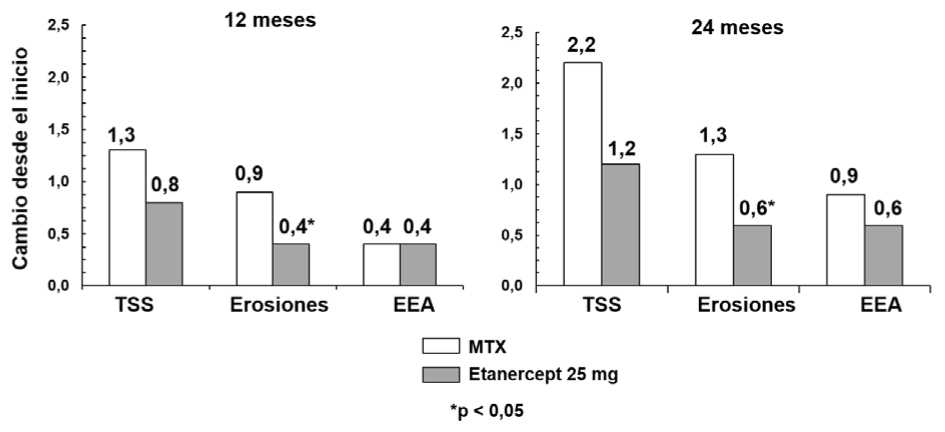
En otro ensayo controlado con comparador activo doble-ciego, aleatorizado, en pacientes con AR tratados con etanercept en monoterapia (25 mg dos veces por semana), metotrexato en monoterapia (7,5 a 20 mg por semana, siendo 20 mg la dosis media), y la combinación de etanercept y metotrexato iniciada concomitantemente, se compararon la eficacia clínica, la seguridad y la progresión radiográfica en 682 pacientes adultos con artritis reumatoide activa de 6 meses a 20 años de duración (mediana 5 años) que tuvieron una respuesta no satisfactoria a al menos 1 fármaco modificador de la enfermedad (FARMEs) distinto de metotrexato.
Los pacientes en el grupo de etanercept en combinación con metotrexato tuvieron respuestas ACR20, ACR50 y ACR70 y mejoras de las escalas DAS y HAQ significativamente mayores, a las 24 y a las 52 semanas, que los pacientes de cualquiera de los grupos de tratamiento en monoterapia (los resultados se muestran en la tabla a continuación). Después de 24 meses de tratamiento, también se observaron ventajas significativas con la administración de etanercept en combinación con metotrexato, al compararla con la administración de ambos, etanercept y metotrexato, como monoterapia.
Resultados de eficacia clínica a los 12 meses: Comparación de etanercept vs metotrexato vs etanercept en combinación con metotrexato en pacientes con AR de 6 meses a 20 años de duración
|
Variable |
Metotrexato (n = 228) |
Etanercept (n = 223) |
Etanercept + Metotrexato (n = 231) | |
|
Respuestas ACRa |
ACR20 |
58,8% |
65,5% |
74,5%f, ® |
|
ACR50 |
36,4% |
43,0% |
63,2%T’ ® | |
|
ACR70 |
16,7% |
22,0% |
39,8%T’ ® | |
|
DAS |
Basal |
5,5 |
5,7 |
5,5 |
|
(Índiceb)Semana 52 |
3,0 |
3,0 |
2,3f ° | |
|
(Índiceb) Remisiónc |
14% |
18% |
37%f, ® | |
|
HAQ |
Basal |
1,7 |
1,7 |
1,8 |
|
Semana 52 |
1,1 |
1,0 |
0,8f, ° | |
a Los pacientes que no completaron los 12 meses en el ensayo fueron considerados como pacientes no respondedores. b Los valores para DAS (escala de actividad de la enfermedad) son valores medios. c La remisión se define como DAS < 1,6.
Valores p de comparación de pares: f = p < 0,05 para comparaciones de etanercept + metotrexato vs metotrexato y ® = p < 0,05 para comparaciones de etanercept + metotrexato vs etanercept.
La progresión radiográfica a los 12 meses fue significativamente menor en el grupo de etanercept que en el grupo de metotrexato, mientras que la combinación fue significativamente mejor que cualquiera de los grupos de monoterapia en lo relativo al enlentecimiento de la progresión radiográfica (ver la figura siguiente).
Progresión radiográfica: Comparación de etanercept vs metotrexato vs etanercept en combinación con metotrexato en pacientes con AR de 6 meses a 20 años de duración (resultados a los 12 meses)
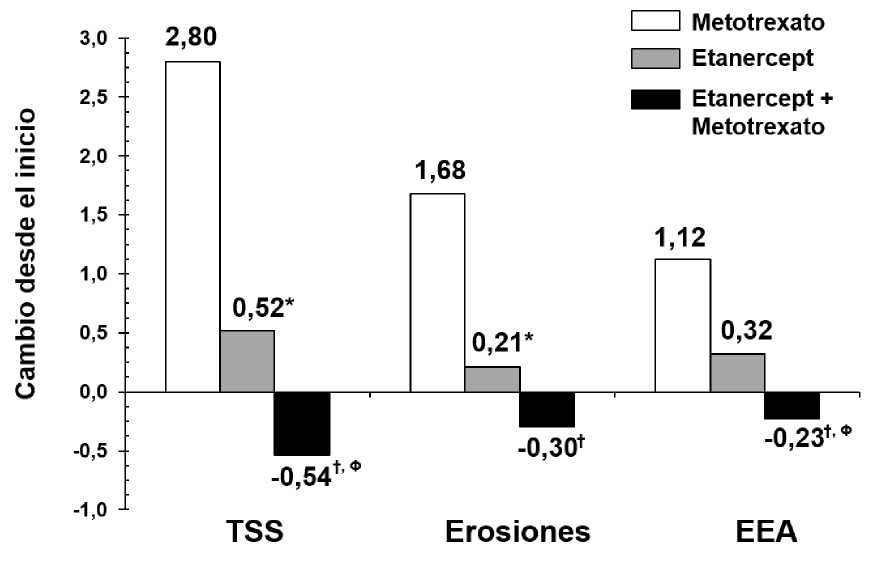
Valores p de comparación de pares: * = p < 0,05 para comparaciones de etanercept vs metotrexato, f = p < 0,05 para comparaciones de etanercept + metotrexato vs metotrexato y ® = p < 0,05 para comparaciones de etanercept + metotrexato vs etanercept.
Después de 24 meses de tratamiento, también se observaron ventajas significativas con la administración de etanercept en combinación con metotrexato, al compararla con la administración de ambos, etanercept y metotrexato, en monoterapia. De forma similar, también se observaron, después de 24 meses de tratamiento, ventajas significativas del tratamiento con etanercept en monoterapia frente al tratamiento con metotrexato en monoterapia.
En un análisis, en el que se consideró que todos los pacientes que habían abandonado el ensayo por cualquier motivo habían progresado, el porcentaje de pacientes que no experimentó una progresión (cambio en TSS < 0,5) a los 24 meses fue mayor en el grupo de etanercept en combinación con metotrexato, comparado con los grupos de etanercept en monoterapia y de metotrexato en monoterapia (62%, 50% y 36%, respectivamente; p < 0,05). La diferencia entre los grupos de etanercept en monoterapia y metotrexato en monoterapia también fue significativa (p < 0,05). Las tasas de ausencia de progresión, entre los pacientes del ensayo que completaron el periodo total de 24 meses de tratamiento, fueron de un 78%, 70% y 61%, respectivamente.
La seguridad y eficacia de 50 mg de etanercept (dos inyecciones subcutáneas de 25 mg) administrados una vez a la semana fue evaluada en un ensayo doble ciego controlado con placebo en 420 pacientes con artritis reumatoide activa. En este ensayo, 53 pacientes recibieron placebo, 214 pacientes recibieron 50 mg de etanercept una vez a la semana y 153 pacientes recibieron 25 mg de etanercept dos veces a la semana. Los perfiles de seguridad y eficacia de los dos regímenes de tratamiento de etanercept fueron comparables en la semana 8 en lo que se refiere a los efectos sobre los signos y síntomas de artritis reumatoide; los datos a 16 semanas no mostraron comparabilidad (ni inferioridad) entre los dos regímenes. Una inyección única de 50 mg/ml de etanercept resultó ser bioequivalente a dos inyecciones simultáneas de 25 mg/ml.
Pacientes adultos con artritis psoriásica
Se evaluó la eficacia de etanercept en un ensayo aleatorizado, doble ciego, controlado con placebo en 205 pacientes con artritis psoriásica. Los pacientes tenían entre 18 y 70 años de edad y tenían artritis psoriásica activa (> 3 articulaciones inflamadas y > 3 articulaciones dolorosas) en al menos una de las siguientes formas: (1) afectación interfalángica distal (IFD); (2) artritis poliarticular (ausencia de nódulos reumatoides y presencia de psoriasis); (3) artritis mutilante; (4) artritis psoriásica asimétrica; o (5) tipo espondilitis anquilosante. Los pacientes también tenían psoriasis en placas con una lesión valorable > a 2 cm de diámetro.
Los pacientes habían sido tratados previamente con AINEs (86%), FARMEs (80%) y corticosteroides (24%). Los pacientes que en ese momento estaban en tratamiento con metotrexato (estables durante 2 o más meses) pudieron continuar a una dosis estable igual o inferior a 25 mg/semana de metotrexato. Se administraron 2 veces a la semana dosis SC de 25 mg de etanercept (en base a los ensayos de búsqueda de dosis en pacientes con artritis reumatoide) o placebo durante 6 meses. Una vez finalizado el ensayo doble ciego, los pacientes pudieron participar en un ensayo de extensión, abierto, a largo plazo, durante un periodo máximo de 2 años.
Las respuestas clínicas se expresaron como porcentajes de pacientes que consiguieron la respuesta ACR20, 50 y 70 y porcentajes con mejora en el criterio de respuesta de artritis psoriásica (PsARC). La tabla siguiente resume los resultados.
Respuestas de pacientes con artritis psoriásica en un ensayo controlado con placebo
|
Respuesta artritis psoriásica |
Porcentaje de pacientes | ||
|
Placebo n = 104 |
Etanercepta n = 101 | ||
|
ACR 20 |
Mes 3 |
15 |
""59 |
|
Mes 6 |
13 |
“50 | |
|
ACR 50 |
Mes 3 |
4 |
-O OO m |
|
Mes 6 |
4 |
37b | |
|
ACR 70 |
Mes 3 |
0 |
11b |
|
Mes 6 |
1 |
9c | |
|
PsARC |
Mes 3 |
31 |
”7? |
|
Mes 6 |
23 |
^1 O cr | |
a 25 mg etanercept SC dos veces a la semana b p < 0,001, etanercept vs. placebo c p < 0,01, etanercept vs. placebo
Las respuestas clínicas entre pacientes con artritis psoriásica que recibieron etanercept fueron visibles en la primera visita (4 semanas) y se mantuvieron a lo largo de los 6 meses de tratamiento. Etanercept resultó significativamente mejor que placebo en todas las determinaciones de actividad de la enfermedad (p < 0,001), y las respuestas fueron similares con y sin tratamiento concomitante con metotrexato. Se evaluó la calidad de vida de los pacientes con artritis psoriásica en cada momento utilizando el índice de discapacidad del HAQ. El resultado del índice de discapacidad resultó significativamente mejorado en todo momento en los pacientes con artritis psoriásica tratados con etanercept en relación con los tratados con placebo (p < 0,001).
En el ensayo de artritis psoriásica se evaluaron las alteraciones radiográficas. Se obtuvieron radiografías de las manos y de las muñecas al comienzo del ensayo, y a los 6, 12 y 24 meses. En la tabla que se incluye a continuación, se presenta la TSS modificada a los 12 meses. En un análisis, en el que se consideró que todos los pacientes que habían abandonado el ensayo por cualquier motivo, habían progresado, el porcentaje de pacientes que no experimentó una progresión (cambio en TSS < 0,5) a los 12 meses fue mayor en el grupo de etanercept, en comparación con el grupo de placebo (73% vs 47%, respectivamente, p < 0,001). El efecto de etanercept sobre la progresión radiográfica se mantuvo en los pacientes que continuaron el tratamiento durante el segundo año. En los pacientes con afectación poliarticular simétrica de las articulaciones, se observó un enlentecimiento del desarrollo del daño de las articulaciones periféricas.
Cambio anual medio (SE), desde la visita de inicio, según la puntuación total de Sharp
|
Periodo |
Placebo (n = 104) |
Etanercept (n = 101) |
|
Mes 12 |
1,00 (0,29) |
-0,03 (0,09)a |
SE = error estándar
a p = 0,0001
El tratamiento con Etanercept produjo una mejoría en la función física durante el periodo doble ciego, manteniéndose dicho beneficio durante el periodo máximo de exposición a largo plazo de hasta
2 años.
No existen datos suficientes sobre la eficacia de etanercept, en los pacientes que presentan artropatías tipo artritis psoriásica mutilante y artropatías tipo espondilitis anquilosante, debido al reducido número de pacientes estudiados.
No se ha realizado ningún ensayo en pacientes con artritis psoriásica, utilizando el régimen de dosificación de 50 mg una vez a la semana. La evidencia sobre la eficacia del régimen de dosificación de una vez a la semana en esta población de pacientes se ha basado en los datos procedentes del ensayo llevado a cabo en pacientes con espondilitis anquilosante.
Pacientes adultos con espondilitis anquilosante
La eficacia de etanercept en la espondilitis anquilosante se evaluó en 3 ensayos aleatorizados, doble ciego, en los que se comparó la administración de 25 mg de etanercept dos veces a la semana frente a placebo. Un total de 401 pacientes fueron incluidos en el ensayo, de los cuales 203 fueron tratados con etanercept. El mayor de estos ensayos (n = 277) incluyó a pacientes de edades comprendidas entre 18 y 70 años y que tenían espondilitis anquilosante activa definida según los marcadores de la escala analógica visual (EAV) de > 30 para un promedio de duración e intensidad de rigidez matutina y marcadores de la escala analógica visual > 30 para al menos 2 de los siguientes 3 parámetros: evaluación global del paciente; la media de la escala analógica visual para dolor de espalda nocturno y dolor de espalda total; media de 10 preguntas sobre el índice funcional de espondilitis anquilosante (Bath Ankylosing Spondylitis Functional Index: BASFI). Los pacientes que recibieron FARMEs, AINEs o corticosteroides pudieron continuar con ellos a dosis estables. No se incluyeron en el ensayo pacientes con anquilosis completa de la columna. Se administraron por vía subcutánea dosis de 25 mg de etanercept (en base a los ensayos de búsqueda de dosis en pacientes con artritis reumatoide) o placebo dos veces por semana durante 6 meses en 138 pacientes.
La variable primaria de eficacia (ASAS 20) se definió como mejoría > 20% en al menos
3 de los 4 parámetros (evaluaciones globales del paciente, dolor de espalda, BASFI e inflamación) en la evaluación de espondilitis anquilosante (ASAS) y ausencia de deterioro en el parámetro restante.
Las respuestas ASAS 50 y ASAS 70 utilizaron los mismos criterios con mejorías del 50% o del 70%, respectivamente.
Comparado con placebo, el tratamiento con etanercept dio lugar a mejoras significativas en la respuesta ASAS 20, ASAS 50 y ASAS 70, a las dos semanas del inicio del tratamiento.
Respuestas de pacientes con espondilitis anquilosante en un ensayo controlado con placebo
|
Porcentaje de pacientes | ||
|
Respuesta espondilitis anquilosante |
Placebo n = 139 |
Etanercept n = 138 |
|
ASAS 20 | ||
|
2 semanas |
22 |
46a |
|
3 meses |
27 |
60a |
|
6 meses |
23 |
58a |
|
ASAS 50 | ||
|
2 semanas |
7 |
24a |
|
3 meses |
13 |
45a |
|
6 meses |
10 |
42a |
|
ASAS 70 | ||
|
2 semanas |
2 |
12 |
|
3 meses |
7 |
19 |
|
6 meses |
5 |
19 |
a p < 0,001, etanercept vs. placebo b p < 0,002, etanercept vs. placebo
Entre los pacientes con espondilitis anquilosante que recibieron etanercept, las respuestas clínicas fueron evidentes en el momento de la primera visita (2 semanas) y se mantuvieron a lo largo de los 6 meses de tratamiento. Las respuestas fueron similares tanto en los pacientes que estaban recibiendo tratamientos concomitantes al inicio del estudio, como en los que no.
En los dos ensayos más pequeños de espondilitis anquilosante se obtuvieron resultados similares.
En un cuarto ensayo, se evaluó la seguridad y la eficacia de 50 mg de etanercept (dos inyecciones subcutáneas de 25 mg) administrados una vez a la semana frente a etanercept 25 mg administrado dos veces a la semana, en un ensayo doble ciego, controlado con placebo en 356 pacientes que padecían espondilitis anquilosante activa. Los perfiles de seguridad y de eficacia de los regímenes de 50 mg una vez a la semana y de 25 mg dos veces a la semana fueron similares.
Pacientes adultos con espondiloartritis axial no radiográfica
La eficacia de etanercept en pacientes con espondiloartritis axial no radiográfica (SpAax-nr) se evaluó en un ensayo aleatorizado, doble ciego, controlado con placebo, de 12 semanas de duración. En el ensayo se evaluó a 215 pacientes adultos (población por intención de tratar modificada) con SpAax-nr activa (de entre 18 y 49 años), definida como aquellos pacientes que cumplían los criterios de clasificación de ASAS de la espondiloartritis axial, pero no cumplían los criterios de Nueva York modificados para el diagnóstico de EA. Los pacientes también debían presentar una respuesta inadecuada o intolerancia a dos o más AINEs. En el periodo doble ciego, los pacientes recibieron 50 mg semanales de etanercept o placebo durante 12 semanas. La variable primaria de eficacia (ASAS 40) se definió como mejoría del 40% en al menos tres de los cuatro parámetros de ASAS y ausencia de deterioro en el parámetro restante. Al periodo doble ciego le siguió un periodo abierto en el que todos los pacientes recibieron 50 mg semanales de etanercept durante un periodo de hasta 92 semanas adicionales. Mediante resonancia magnética (IRM) se obtuvieron imágenes de la articulación sacroilíaca y la columna vertebral con el fin de evaluar la inflamación, en la visita de inicio y en las semanas 12 y 104.
Comparado con placebo, el tratamiento con etanercept dio como resultado mejorías estadísticamente significativas en las respuestas ASAS 40, ASAS 20 y ASAS 5/6. También se observó una mejoría significativa en las respuestas ASAS remisión parcial y BASDAI 50. En la tabla siguiente figuran los resultados de la semana 12.
Respuesta de eficacia en el ensayo de SpAax-nr controlado con placebo: porcentaje de pacientes que alcanzaron las variables
|
Repuestas clínicas doble ciego en la semana 12 |
Placebo n = entre 106 y 109* |
Etanercept n = entre 103 y 105* |
|
ASAS** 40 |
15,7 |
32,4b |
|
ASAS 20 |
36,1 |
52,4c |
|
ASAS 5/6 |
10,4 |
33,0a |
|
ASAS remisión parcial |
11,9 |
24,8c |
|
BASDAI*** 50 |
23,9 |
43,8b |
*Algunos pacientes no proporcionaron datos completos para todas las variables **ASAS=Sociedad Internacional de Evaluación de las Espondiloartritis ***Índice de Bath de Actividad de la Enfermedad de la Espondilitis Anquilosante a: p < 0,001, b: < 0,01 y c: < 0,05, respectivamente entre etanercept y placebo
En la semana 12 se produjo una mejoría estadísticamente significativa en la puntuación SPARCC (Consorcio de Investigación de la Espondiloartritis de Canadá) para la articulación sacroilíaca, determinada mediante IRM, en los pacientes que recibían etanercept. El cambio promedio ajustado desde la visita de inicio fue de 3,8 para los pacientes tratados con etanercept (n = 95) frente a 0,8 para los pacientes tratados con placebo (n = 105) (p < 0,001). En la semana 104, el cambio promedio desde la visita de inicio en la puntuación SPARCC determinada mediante IRM para los pacientes tratados con etanercept fue de 4,64 para la articulación sacroilíaca (n=153) y 1,40 para la columna vertebral (n=154).
Comparado con placebo, etanercept mostró una mejoría, desde la visita de inicio hasta la semana 12, estadística y significativamente mayor en la mayoría de las evaluaciones de calidad de vida relacionada con la salud y de la función física, incluyendo el BASFI (Índice Funcional de Bath de la Espondilitis Anquilosante), la puntuación de estado de salud global del cuestionario EuroQol 5D y la puntuación del componente físico del cuestionario SF-36.
Las respuestas clínicas entre los pacientes con SpAax-nr que recibieron etanercept fueron evidentes en la primera visita (2 semanas) y se mantuvieron a lo largo de los 2 años de tratamiento. La mejoría en la calidad de vida relacionada con la salud y de la función física también se mantuvo a lo largo de los 2 años de tratamiento. Los datos a los 2 años no revelaron nuevos hallazgos sobre la seguridad. En la semana 104,8 los pacientes evolucionaron a una puntuación bilateral de grado 2 por rayos X en columna de acuerdo al sistema de graduación propuesto por los criterios de Nueva York modificados, indicadivo de espondiloartropatía axial.
Pacientes adultos con psoriasis en placas
Se recomienda el uso de etanercept en la población de pacientes definida en la sección 4.1. En la población de estudio, los pacientes que “no han respondido a” se definen como los que presentan una respuesta insuficiente (PASI < 50 o PGA menos que bueno), o un empeoramiento de la enfermedad durante el tratamiento, y que han recibido una dosis adecuada durante un periodo de tiempo lo suficientemente largo como para evaluar la respuesta a al menos cada una de las 3 principales terapias sistémicas disponibles.
No se ha evaluado la eficacia de etanercept frente a otras terapias sistémicas en pacientes con psoriasis de moderada a grave (que responden a otras terapias sistémicas) en ensayos que comparen directamente etanercept con otras terapias sistémicas. En cambio, se evaluó la eficacia y seguridad de etanercept en cuatro ensayos aleatorizados, doble ciego y controlados con placebo. La variable primaria de eficacia en los cuatro ensayos fue la proporción de pacientes en cada grupo de tratamiento que alcanzaron el PASI 75 (esto es, al menos un 75% de mejoría en la Puntuación de Área de Psoriasis e Índice de Gravedad desde la visita de inicio) a las 12 semanas.
El ensayo 1 fue un ensayo en fase 2 en pacientes con psoriasis en placas activa, pero clínicamente controlada, en los que la superficie corporal afectada era > 10% y tenían una edad > 18 años. Se aleatorizaron 112 pacientes que recibieron una dosis de 25 mg de etanercept (n = 57) o placebo (n = 55) dos veces a la semana durante 24 semanas.
El ensayo 2 evaluó 652 pacientes con psoriasis en placas crónica, utilizando los mismos criterios de inclusión que el ensayo 1 con la adición de una puntuación mínima del Área de Psoriasis e Índice de Gravedad (PASI) de 10 en la visita de selección. Se administró etanercept a dosis de 25 mg una vez a la semana, 25 mg dos veces a la semana o 50 mg dos veces a la semana durante 6 meses consecutivos. Durante las primeras 12 semanas del periodo de tratamiento doble ciego, los pacientes recibieron placebo o una de las tres dosis de etanercept antes mencionadas. Después de 12 semanas de tratamiento, los pacientes del grupo placebo comenzaron el tratamiento ciego con etanercept (25 mg dos veces a la semana); los pacientes de los grupos de tratamiento con fármaco activo continuaron tratados hasta la semana 24 con la dosis a la que inicialmente fueron aleatorizados.
El ensayo 3 evaluó 583 pacientes y tuvo los mismos criterios de inclusión que el ensayo 2. Los pacientes en este ensayo recibieron una dosis de 25 mg o 50 mg de etanercept, o placebo dos veces a la semana durante 12 semanas; posteriormente todos los pacientes del ensayo pasaron a una fase abierta en la que recibieron 25 mg de etanercept dos veces a la semana durante 24 semanas adicionales.
El ensayo 4 evaluó 142 pacientes y tuvo los mismos criterios de inclusión que los ensayos 2 y 3. Los pacientes en este ensayo recibieron en la fase abierta una dosis de 50 mg de etanercept o placebo una vez a la semana, durante 12 semanas; posteriormente todos los pacientes del ensayo pasaron a una fase abierta en la que recibieron 50 mg de etanercept una vez a la semana durante 12 semanas adicionales.
En el ensayo 1, el grupo tratado con etanercept tuvo una proporción de pacientes con una respuesta PASI 75 significativamente mayor en la semana 12 (30%) en comparación con el grupo tratado con placebo (2%) (p < 0,0001). A las 24 semanas, el 56% de los pacientes del grupo tratado con etanercept había alcanzado el PASI 75 en comparación con el 5% de los pacientes tratados con placebo. A continuación se muestran los resultados de los ensayos 2, 3 y 4.
Respuestas de pacientes con psoriasis en los ensayos 2, 3 y 4
|
Respuest a (%) |
Ensayo 2 |
Ensayo 3 |
Ensayo 4 | ||||||||
|
Place bo |
Etanercept |
Place bo |
Etanercept |
Place bo |
Etanercept | ||||||
|
25 mg Bisemanales |
50 mg Bisemanales |
25 mg Biseman ales |
50 mg Biseman ales |
50 mg Seman ales |
50 mg Seman ales | ||||||
|
n = 166 |
n = 162 |
n = 162 |
n = 164 |
n = 164 |
n = 193 |
n = 196 |
n = 196 |
n = 46 |
n = 96 |
n = 90 | |
|
sem. 12 |
sem. 12 |
sem. 24a |
sem. 12 |
sem. 24a |
sem. 12 |
sem. 12 |
sem. 12 |
sem. 12 |
sem. 1 2 |
sem. 2 4a | |
|
PASI 50 |
14 |
58* |
70 |
74* |
77 |
9 |
64* |
77* |
9 |
69* |
83 |
|
PASI 75 |
4 |
34* |
44 |
49* |
59 |
3 |
34* |
49* |
2 |
38* |
71 |
|
DSGAb, aclarami ento o casi aclarami ento |
5 |
34* |
39 |
49* |
55 |
4 |
39* |
57* |
4 |
39* |
64 |
* p < 0,0001 comparado con placebo
a No se realizaron comparaciones estadísticas frente a placebo en la semana 24 de los ensayos 2 y 4 porque el grupo placebo original comenzó recibiendo 25 mg administrados dos veces a la semana o 50 mg semanales de etanercept desde la semana 13 a la semana 24.
b Evaluación Global Estática Dermatológica. Aclaramiento o casi aclaramiento definido como 0 o 1 sobre una escala de 0 a 5.
Entre los pacientes con psoriasis en placas que recibieron etanercept, respuestas significativas respecto a placebo fueron evidentes en el momento de la primera visita (2 semanas) y se mantuvieron a lo largo de las 24 semanas de terapia.
El ensayo 2 tuvo también un periodo de retirada del fármaco durante el cual a los pacientes que alcanzaron una mejoría de PASI de al menos un 50% en la semana 24 se les suspendió el tratamiento. Durante el periodo sin tratamiento, se evaluó la incidencia de rebrotes (PASI > 150% desde la visita de inicio) y el tiempo hasta la recaída (definida como una pérdida de al menos la mitad de la mejoría alcanzada entre la visita de inicio y la semana 24). Durante el periodo de retirada, los síntomas de psoriasis volvieron gradualmente con una media de recurrencia de la enfermedad de 3 meses. No se observó ningún efecto adverso grave relativo a la psoriasis ni empeoramiento de la enfermedad. Se observaron indicios que permiten avalar el beneficio del retratamiento con etanercept en pacientes que inicialmente respondieron al tratamiento.
En el ensayo 3, la mayoría de los pacientes (77%) que fueron aleatorizados inicialmente a recibir 50 mg dos veces por semana y a los que se les redujo su dosis de etanercept en la semana 12 a 25 mg dos veces a la semana mantuvieron su respuesta PASI 75 a lo largo de la semana 36. En los pacientes que recibieron 25 mg dos veces a la semana a lo largo del ensayo, la respuesta PASI 75 continuó mejorando entre las semanas 12 a 36.
En el ensayo 4, el grupo tratado con etanercept tuvo una proporción superior de pacientes con PASI 75 en la semana 12 (38%) en comparación con el grupo tratado con placebo (2%) (p < 0,0001). Para pacientes que recibieron 50 mg una vez a la semana a lo largo del ensayo, las respuestas de eficacia siguieron mejorando y el 71% alcanzaron el PASI 75 en la semana 24.
En los ensayos abiertos a largo plazo (de hasta 34 meses) en los que se administró etanercept sin interrupción, las respuestas clínicas fueron mantenidas y la seguridad fue comparable a la observada en ensayos a corto plazo.
Un análisis de los datos de los ensayos clínicos no reveló ninguna característica basal de la enfermedad que ayudara a los médicos a seleccionar la opción de dosificación más apropiada (intermitente o continua). En consecuencia, la elección de la terapia intermitente o continua deberá basarse en el juicio del médico y las necesidades individuales del paciente.
Anticuerpos frente a etanercept
Se detectaron anticuerpos frente a etanercept en el suero de algunos sujetos tratados con etanercept. Estos anticuerpos eran generalmente no neutralizantes y transitorios. No parece que exista relación entre el desarrollo de anticuerpos y la respuesta clínica o los efectos adversos.
5.2 Propiedades farmacocinéticas
Los valores séricos de etanercept se determinaron por un método de inmunoensayo enzimático ligado a enzimas (ELISA), este método puede detectar productos de degradación de reactivos de ELISA así como el compuesto patrón.
Absorción
Etanercept se absorbe lentamente desde el sitio de inyección subcutánea, alcanzando una concentración máxima aproximadamente 48 horas después de una dosis única. La biodisponibilidad absoluta es del 76%. Con dosis administradas dos veces a la semana, se prevé que las concentraciones en el estado de equilibrio estacionario sean aproximadamente dos veces más elevadas que las observadas después de dosis únicas. Después de una dosis subcutánea única de 25 mg de etanercept, la concentración sérica máxima media observada en voluntarios sanos fue de 1,65 ± 0,66 pg/ml, y el área bajo la curva (AUC) fue de 235 ± 96,6 pg * h/ml.
Alcanzado el estado estacionario, las medias de los perfiles de concentración sérica en los pacientes con artritis reumatoide tratados fueron Cmax de 2,4 mg/l frente a 2,6 mg/l, Cmin de 1,2 mg/l vs 1,4 mg/l y el área bajo la curva (AUC) parcial de 297 mg * h/l vs 316 mg * h/l para 50 mg de etanercept una vez a la semana (n = 21) vs 25 mg de etanercept dos veces a la semana (n = 16), respectivamente. En un ensayo abierto, cruzado, dos brazos de tratamiento, de dosis única, en voluntarios sanos, etanercept administrado como una inyección única de 50 mg/ml resultó ser bioequivalente a dos inyecciones simultáneas de 25 mg/ml.
En un análisis farmacocinético poblacional realizado en pacientes con espondilitis anquilosante, las AUCs en estado de estacionario de etanercept fueron de 466 qg * h/ml y 474 qg * h/ml, en el caso de 50 mg de etanercept administrado una vez a la semana (n = 154) y 25 mg de etanercept administrados dos veces a la semana (n = 148), respectivamente.
Distribución
Para describir la curva concentración - tiempo de etanercept, se requiere una curva biexponencial. El volumen central de distribución de etanercept es 7,6 l, mientras que el volumen de distribución en el estado estacionario es de 10,4 l.
Eliminación
Etanercept se elimina lentamente del organismo. La semivida es larga, aproximadamente 70 horas. El aclaramiento en pacientes con artritis reumatoide es de aproximadamente 0,066 l/h, algo inferior al valor de 0,11 l/h observado en voluntarios sanos. Además, la farmacocinética de etanercept en pacientes con artritis reumatoide, espondilitis anquilosante y psoriasis en placas es similar.
Aparentemente, no existe diferencia farmacocinética entre hombres y mujeres.
Linealidad
La proporcionalidad de la dosis no ha sido formalmente evaluada, pero no hay saturación aparente del aclaramiento a lo largo del rango de dosis.
Poblaciones especiales
Insuficiencia renal
Aunque tras la administración de etanercept marcado radiactivamente a pacientes y voluntarios hay eliminación de radiactividad en orina, en pacientes con insuficiencia renal aguda no se observó un aumento de las concentraciones de etanercept. La presencia de insuficiencia renal no requiere un cambio en la dosificación.
Insuficiencia hepática
En pacientes con insuficiencia hepática aguda no se observó un aumento de las concentraciones de etanercept. La presencia de insuficiencia hepática no requiere un cambio en la dosificación.
Pacientes de edad avanzada
El impacto de la edad avanzada en la farmacocinética se ha estudiado en un análisis de las concentraciones séricas de etanercept en esta población. El aclaramiento y volumen estimados, en pacientes entre 65 y 87 años, fueron similares a los de los pacientes menores de 65 años de edad.
5.3 Datos preclínicos sobre seguridad
En los estudios toxicológicos con etanercept, no se observó toxicidad dependiente de la dosis o en el órgano diana. A partir de una batería de estudios in vitro e in vivo se llegó a la conclusión de que etanercept no era genotóxico. Debido al desarrollo de anticuerpos neutralizantes en roedores, no se realizaron estudios de carcinogenicidad ni valoraciones estándar de la fertilidad y toxicidad postnatal con etanercept.
Etanercept no induce letalidad o signos notables de toxicidad en el ratón o en la rata después de una dosis única subcutánea de 2.000 mg/kg o después de una dosis única intravenosa de 1.000 mg/kg. Etanercept no muestra toxicidad dosis limitante u órgano específica en el mono cynomolgus después de administraciones subcutáneas, dos veces en semana durante 4 o 26 semanas consecutivas a una dosis (15 mg/kg) que resulta en un área bajo curva (AUC) basada en concentraciones séricas del fármaco que fueron unas 27 veces mayores que las que se obtienen en humanos a la dosis recomendada de 25 mg.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Sacarosa Cloruro sódico
Fosfato sódico monobásico monohidrato Fosfato sódico dibásico heptahidrato Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
30 meses.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Mantener las jeringas y las plumas precargadas en el embalaje exterior para protegerlas de la luz.
Benepali puede ser conservado a una temperatura máxima de 25°C durante un único periodo de hasta 4 semanas; tras el cual, el medicamento no puede ser refrigerado de nuevo. Benepali se debe desechar si no ha sido usado en las 4 semanas siguientes a su retirada de la nevera.
6.5 Naturaleza y contenido del envase
50 mg de solución inyectable en jeringa precargada
Jeringa de vidrio transparente (tipo I), provista de una aguja de acero inoxidable con un capuchón de goma y de un émbolo de plástico que contiene 0,98 ml de solución.
Benepali está disponible en envases que contienen 4 jeringas precargadas y envases múltiples que contienen 12 jeringas precargadas (3 envases de 4). Puede que solamente estén comercializados algunos tamaños de envases.
50 mg de solución inyectable en pluma precargada
La pluma precargada contiene una jeringa precargada de Benepali. La jeringa en el interior de la pluma está fabricada de vidrio transparente de tipo I y está provista de una aguja de acero inoxidable de calibre 27 con un capuchón de goma y un émbolo de plástico.
Benepali está disponible en envases que contienen 4 plumas precargadas y envases múltiples que contienen 12 plumas precargadas (3 envases de 4). Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
50 mg de solución inyectable en jeringa precargada
Antes de administrar la inyección, se debe esperar hasta que la jeringa precargada de Benepali, para un solo uso, alcance la temperatura ambiente (aproximadamente 30 minutos). El capuchón de la aguja no debe retirarse mientras se espera a que la jeringa precargada alcance la temperatura ambiente. La solución debe ser entre transparente y ligeramente opalescente, incolora o de color amarillo pálido y puede contener pequeñas partículas de proteína translúcidas o blancas.
En la sección 7, “Instrucciones de uso”, del prospecto, se incluyen instrucciones detalladas para la administración.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
50 mg de solución inyectable en pluma precargada
Antes de administrar la inyección, se debe esperar hasta que las plumas precargadas de Benepali, para un solo uso, alcancen la temperatura ambiente (aproximadamente 30 minutos). El capuchón de la aguja no se debe retirar mientras se espera a que la pluma precargada alcance la temperatura ambiente. Cuando se mire a través de la ventana de inspección, la solución debe ser entre transparente y ligeramente opalescente, incolora o de color amarillo pálido y puede contener pequeñas partículas de proteína translúcidas o blancas.
En la sección 7, “Instrucciones de uso”, del prospecto, se incluyen instrucciones detalladas para la administración.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Samsung Bioepis UK Limited
3000 Hillswood Drive
Chertsey
Surrey KT16 0RS
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1074/001
EU/1/15/1074/002
EU/1/15/1074/003
EU/1/15/1074/004
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización 14/enero/2016
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICOY FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricantedel principio activo biológico
Biogen (Denmark) Manufacturing ApS
Biogen Allé 1
3400 Hillerod
Dinamarca
Nombre y dirección del fabricante responsable de la liberación de los lotes
Biogen (Denmark) Manufacturing ApS
Biogen Allé 1
3400 Hillerod
Dinamarca
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva
información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Medidas adicionales de minimización de riesgos
1. Antes del lanzamiento en cada país miembro, el TAC acordará con la autoridad competente de dicho país el material informativo final que se entregará a los profesionales sanitarios encargados de recetar el producto. Dicho material contendrá instrucciones acerca del uso correcto y seguro de la pluma precargada/las jeringas precargadas. También les informará de que el producto no es para el uso pediátrico e incluirá una Tarjeta de Alerta para el Paciente que se debe entregar a los pacientes que usen Benepali.
2. El material informativo para los profesionales sanitarios debe contener los siguientes elementos fundamentales:
• Una guía didáctica para facilitar el entrenamiento de los pacientes en el uso seguro de la pluma precargada/las jeringas precargadas
• Un dispositivo de demostración sin aguja
• Material para recordar a los profesionales sanitarios que Benepali no es para uso pediátrico
• Material instructivo para compartirlo con los pacientes.
3. La Tarjeta de Información para el Paciente debe contener los siguientes elementos fundamentales para los pacientes tratados con Benepali:
• El riesgo de infecciones oportunistas y tuberculosis (TB)
• El riesgo de insuficiencia cardíaca congestiva (ICC)
• Benepali no se debe usar en niños
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Benepali 50 mg solución inyectable en jeringa precargada Etanercept
Cada jeringa precargada contiene 50 mg de etanercept en 1 ml.
Excipientes:
Sacarosa, cloruro sódico, fosfato sódico monobásico monohidrato, fosfato sódico dibásico heptahidrato y agua para preparaciones inyectables.
Solución inyectable en jeringa precargada 4 jeringas precargadas
Leer el prospecto antes de utilizar este medicamento.
Vía subcutánea
Antes del uso sacar la jeringa de la nevera y dejarla a temperatura ambiente durante 30 minutos. Tirar para abrirla
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar las jeringas precargadas en el embalaje exterior para protegerlas de la luz.
Consulte el prospecto para información adicional sobre otras formas de conservación del medicamento.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Samsung Bioepis UK Limited 3000 Hillswood Drive Chertsey
Surrey KT16 0RS Reino Unido
EU/1/15/1074/001
Benepali 50 mg solución inyectable en jeringa precargada Etanercept
Cada jeringa precargada contiene 50 mg de etanercept en 1 ml.
Excipientes:
Sacarosa, cloruro sódico, fosfato sódico monobásico monohidrato, fosfato sódico dibásico heptahidrato y agua para preparaciones inyectables.
Solución inyectable en jeringa precargada
Envase múltiple: 12 jeringas precargadas (3 envases de 4)
Leer el prospecto antes de utilizar este medicamento.
Vía subcutánea
Antes del uso sacar la jeringa de la nevera y dejarla a temperatura ambiente durante 30 minutos.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar las jeringas precargadas en el embalaje exterior para protegerlas de la luz.
Consulte el prospecto para información adicional sobre otras formas de conservación del medicamento.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Samsung Bioepis UK Limited 3000 Hillswood Drive Chertsey
Surrey KT16 0RS Reino Unido
EU/1/15/1074/003
Benepali 50 mg
Benepali 50 mg solución inyectable en jeringa precargada Etanercept
Cada jeringa precargada contiene 50 mg de etanercept en 1 ml.
Excipientes:
Sacarosa, cloruro sódico, fosfato sódico monobásico monohidrato, fosfato sódico dibásico heptahidrato y agua para preparaciones inyectables.
Solución inyectable en jeringa precargada 4 jeringas precargadas
Las unidades del envase múltiple no se pueden vender por separado
Leer el prospecto antes de utilizar este medicamento.
Vía subcutánea
Antes del uso sacar la jeringa de la nevera y dejarla a temperatura ambiente durante 30 minutos. Tirar para abrirla
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar las jeringas precargadas en el embalaje exterior para protegerlas de la luz.
Consulte el prospecto para información adicional sobre otras formas de conservación del medicamento.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Samsung Bioepis UK Limited 3000 Hillswood Drive Chertsey
Surrey KT16 0RS Reino Unido
EU/1/15/1074/003
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA (JERINGA PRECARGADA)_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Benepali 50 mg solución inyectable Etanercept
Vía subcutánea <SC>
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD:
4. NÚMERO DE LOTE
Lote:
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 ml
6. OTROS
Benepali 50 mg solución inyectable en pluma precargada Etanercept
Cada pluma precargada contiene 50 mg de etanercept en 1 ml.
Excipientes:
Sacarosa, cloruro sódico, fosfato sódico monobásico monohidrato, fosfato sódico dibásico heptahidrato y agua para preparaciones inyectables.
Solución inyectable en pluma precargada 4 plumas precargadas
Leer el prospecto antes de utilizar este medicamento.
Vía subcutánea
Antes del uso sacar la pluma precargada de la nevera y dejarla a temperatura ambiente durante 30 minutos.
Tirar para abrirla
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar las plumas precargadas en el embalaje exterior para protegerlas de la luz.
Consulte el prospecto para información adicional sobre otras formas de conservación del medicamento.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Samsung Bioepis UK Limited 3000 Hillswood Drive Chertsey
Surrey KT16 0RS Reino Unido
EU/1/15/1074/002
Lote:
Benepali 50 mg solución inyectable en pluma precargada Etanercept
Cada pluma precargada contiene 50 mg de etanercept en 1 ml.
Excipientes:
Sacarosa, cloruro sódico, fosfato sódico monobásico monohidrato, fosfato sódico dibásico heptahidrato y agua para preparaciones inyectables.
Solución inyectable en pluma precargada
Envase múltiple: 12 plumas precargadas (3 envases de 4)
Leer el prospecto antes de utilizar este medicamento.
Vía subcutánea
Antes del uso sacar la pluma precargada de la nevera y dejarla a temperatura ambiente durante 30 minutos.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar las plumas precargadas en el embalaje exterior para protegerlas de la luz.
Consulte el prospecto para información adicional sobre otras formas de conservación del medicamento.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Samsung Bioepis UK Limited 3000 Hillswood Drive Chertsey
Surrey KT16 0RS Reino Unido
EU/1/15/1074/004
Lote:
Benepali 50 mg solución inyectable en pluma precargada Etanercept
Cada pluma precargada contiene 50 mg de etanercept en 1 ml.
Excipientes:
Sacarosa, cloruro sódico, fosfato sódico monobásico monohidrato, fosfato sódico dibásico heptahidrato y agua para preparaciones inyectables.
Solución inyectable en pluma precargada 4 plumas precargadas
Las unidades del envase múltiple no se pueden vender por separado
Leer el prospecto antes de utilizar este medicamento.
Vía subcutánea
Antes del uso sacar la pluma precargada de la nevera y dejarla a temperatura ambiente durante 30 minutos.
Tirar para abrirla
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar las plumas precargadas en el embalaje exterior para protegerlas de la luz.
Consulte el prospecto para información adicional sobre otras formas de conservación del medicamento.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Samsung Bioepis UK Limited 3000 Hillswood Drive Chertsey
Surrey KT16 0RS Reino Unido
EU/1/15/1074/004
Lote:
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA (PLUMA PRECARGADA)_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Benepali 50 mg solución inyectable en pluma precargada Etanercept
Vía subcutánea <SC>
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD:
4. NÚMERO DE LOTE
Lote:
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 ml
6. OTROS
Tarjeta de Información para el Paciente Benepali Etanercept
Esa tarjeta contiene información importante sobre seguridad que usted debe tener en cuenta antes y durante el tratamiento con Benepali. Si no comprende esta información pídale a su médico que se la explique. Este medicamento es para pacientes mayores de 18 años.
• Muestre esta tarjeta a cualquier médico implicado en su tratamiento.
Uso en niños y adolescentes (menores de 18 años de edad)
Benepali no está indicado para su uso en niños o adolescentes. Consulte a su médico si tiene alguna pregunta al respecto.
Infecciones
Benepali puede incrementar el riesgo de padecer infecciones que pueden llegar a ser graves.
• No use Benepali si tiene una infección. Si no está seguro, consulte a su médico.
• Si desarrolla síntomas que sugieren una infección, como fiebre, tos persistente, pérdida de peso o apatía, debe buscar atención sanitaria de urgencia inmediatamente.
• Se debe evaluar si padece tuberculosis (TB). Solicite a su médico que registre las fechas y los resultados siguientes de su última prueba de la TB:
Prueba:_Prueba:_
Fecha:_Fecha:_
Resultados:_Resultados:_
• Solicite a su médico que documente los demás medicamentos que usted esté tomando que puedan incrementar su riesgo de padecer una infección.
Insuficiencia cardíaca congestiva
• Si padece insuficiencia cardíaca congestiva y piensa que sus síntomas (p. ej., falta de aliento o hinchazón de los pies) están empeorando debe buscar atención sanitaria de urgencia inmediatamente.
Información adicional (completar)
Nombre del paciente:_
Nombre del médico:_
N.° de teléfono del médico:_
• Lleve esta tarjeta consigo durante los 2 meses posteriores a la última dosis de Benepali ya que durante este tiempo pueden producirse efectos adversos.
B. PROSPECTO
Prospecto: información para el usuario Benepali 50 mg solución inyectable en jeringa precargada
etanercept
'VEste medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Su médico además le dará una Tarjeta de Alerta para el Paciente, la cual contiene información
de seguridad importante que usted necesita conocer antes y durante el tratamiento con Benepali.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas
aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Benepali y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Benepali
3. Cómo usar Benepali
4. Posibles efectos adversos
5. Conservación de Benepali
6. Contenido del envase e información adicional
7. Instrucciones de uso (ver al dorso)
1. Qué es Benepali y para qué se utiliza
Benepali es un medicamento que se fabrica a partir de dos proteínas humanas. Bloquea la actividad de otra proteína, que se encuentra en el organismo, que produce inflamación. Benepali actúa reduciendo la inflamación asociada a ciertas enfermedades. Benepali contiene el principio activo etanercept.
Benepali puede utilizarse, en adultos de edad igual o superior a 18 años, para:
• el tratamiento de la artritis reumatoide moderada o grave;
• artritis psoriásica;
• espondiloartritis axial grave, incluida la espondilitis anquilosante;
• psoriasis moderada o grave.
Habitualmente, dependiendo de cada caso, Benepali se usa cuando otros tratamientos no han sido lo suficientemente eficaces o no son apropiados para usted.
En el tratamiento de la artritis reumatoide, Benepali se utiliza normalmente en combinación con metotrexato, aunque también puede utilizarse como único medicamento, en el caso de que el tratamiento con metotrexato no sea apropiado para usted. Benepali puede ralentizar el daño causado por la artritis reumatoide en sus articulaciones y mejorar su capacidad para realizar las actividades diarias, tanto si se utiliza solo o en combinación con metotrexato.
En el caso de los pacientes que presentan artritis psoriásica con afectación múltiple de las articulaciones, Benepali puede mejorar su capacidad para realizar las actividades normales diarias.
En el caso de los pacientes que presentan articulaciones simétricas múltiples, hinchadas o dolorosas (por ejemplo, en manos, muñecas y pies), Benepali puede retrasar el progreso del daño estructural de dichas articulaciones causado por la enfermedad.
2. Qué necesita saber antes de empezar a usar Benepali
No use Benepali
• si es alérgico a etanercept o a alguno de los demás componentes de Benepali (incluidos en la sección 6);
• si tiene riesgo de desarrollar una infección grave de la sangre denominada sepsis. Si no está seguro, consulte a su médico;
• si padece una infección de cualquier tipo. Si no está seguro, consulte a su médico.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Benepali.
• Reacciones alérgicas: Si experimenta reacciones alérgicas, tales como opresión torácica, respiración jadeante, vértigo o erupción, no inyecte más Benepali y póngase inmediatamente en contacto con su médico.
• Infecciones/cirugía: Si desarrolla una nueva infección o está a punto de someterse a una intervención de cirugía mayor, su médico podría estar interesado en controlar el tratamiento con Benepali.
• Infecciones/diabetes: Informe a su médico si tiene historial de infecciones recurrentes o si padece diabetes u otros trastornos que aumenten el riesgo de infección.
• Infecciones/monitorización: Informe a su médico de cualquier viaje reciente fuera de la región europea. Si desarrolla síntomas de una infección tales como fiebre, escalofríos o tos, notifíqueselo a su médico inmediatamente. Su médico debe decidir si continuar monitorizándole para ver la presencia de infecciones después de que usted deje el tratamiento con Benepali.
• Tuberculosis: Ya que se han notificado casos de tuberculosis en pacientes tratados con Benepali, su médico examinará los signos y síntomas de tuberculosis antes de empezar con Benepali. Esto puede incluir una historia médica minuciosa, radiografía torácica y una prueba de tuberculosis. La realización de estos análisis debe ser registrada en la Tarjeta de Alerta para el Paciente. Es muy importante que le diga a su médico si ha tenido tuberculosis, o si ha estado en contacto directo con alguien que ha tenido tuberculosis. Si los síntomas de tuberculosis (tales como tos persistente, pérdida de peso, apatía, fiebre moderada), o alguna otra infección aparece durante o después del tratamiento, informe a su médico inmediatamente.
• Hepatitis B: Informe a su médico si tiene o ha tenido hepatitis B alguna vez. Su médico debe hacerle la prueba de la hepatitis B antes de que usted comience el tratamiento con Benepali. El tratamiento con Benepali puede reactivar la hepatitis B en pacientes que hayan estado previamente infectados por el virus de la hepatitis B. Si esto ocurre, debe dejar de usar Benepali.
• Hepatitis C: Informe a su médico si tiene hepatitis C. Su médico puede querer monitorizar el tratamiento con Benepali en el caso de que la infección empeore.
• Trastornos de la sangre: Informe inmediatamente a su médico si tiene signos o síntomas tales como, fiebre persistente, dolor de garganta, hematomas, sangrado o palidez. Tales síntomas pueden indicar la existencia de un problema sanguíneo grave que haga necesaria la interrupción del tratamiento con Benepali.
• Trastornos del sistema nervioso y de la visión: Informe a su médico si presenta esclerosis múltiple, neuritis óptica (inflamación de los nervios ópticos) o mielitis transversa (inflamación de la médula espinal). Su médico decidirá si Benepali es un tratamiento adecuado.
• Insuficiencia cardiaca congestiva: Informe a su médico si tiene un historial de insuficiencia cardiaca congestiva, porque Benepali necesita ser utilizado con precaución en esas circunstancias.
• Cáncer: Informe a su médico si usted tiene o ha tenido linfoma (un tipo de cáncer sanguíneo) o cualquier otro cáncer antes de que se le administre Benepali. Los pacientes con artritis reumatoide grave, que han tenido la enfermedad durante mucho tiempo, pueden correr un riesgo mayor que el promedio de desarrollar un linfoma. Algunos pacientes adolescentes y niños que han recibido etanercept u otros medicamentos que funcionan de la misma manera que etanercept han desarrollado cánceres, incluyendo tipos inusuales, que algunas veces tuvieron como desenlace la muerte. Algunos pacientes que reciben Benepali han desarrollado cánceres de piel. Informe a su médico si usted desarrolla cualquier cambio en el aspecto de la piel o crecimientos en la piel.
• Varicela: Informe a su médico si usted está expuesto a la varicela mientras utiliza Benepali. Su médico determinará si es apropiado el tratamiento preventivo para la varicela.
• Alcoholismo: Benepali no debe usarse para el tratamiento de hepatitis relacionada con alcoholismo. Por favor, informe a su médico tiene un historial de alcoholismo.
• Granulomatosis de Wegener: No se recomienda Benepali para el tratamiento de la granulomatosis de Wegener, una enfermedad inflamatoria rara. Si tiene granulomatosis de Wegener, coméntelo con su médico.
• Medicamentos antidiabéticos: Informe a su médico si tiene diabetes o está tomando medicamentos para tratar la diabetes. Su médico puede decidir si usted necesita menos medicamento antidiabético mientras toma Benepali.
• Vacunas: Algunas vacunas, como la vacuna de la polio oral, no se deben administrar mientras se está utilizando Benepali. Consulte con su médico antes de utilizar cualquier vacuna.
Niños y adolescentes
El uso de Benepali no está indicado en niños y adolescentes menores de 18 años.
Benepali solo está disponible como jeringa precargada de 50 mg o como pluma recargada de 50 mg, y estas presentaciones no están indicadas para el uso en niños o adolescentes.
Uso de Benepali con otros medicamentos
No use Benepali con medicamentos que contengan el principio activo anakinra o abatacept.
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento (incluyendo sulfasalazina), incluso aquellos no prescritos por su médico.
Embarazo y lactancia
No se recomienda el uso de Benepali durante el embarazo. Consulte a su médico si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada.
Si ha recibido Benepali durante el embarazo, su bebé puede presentar un mayor riesgo de contraer una infección. Además, en un estudio se observaron más defectos de nacimiento cuando la madre había recibido etanercept durante el embarazo, en comparación con las madres que no habían recibido etanercept ni otros medicamentos similares (antagonistas del TNF), pero no hubo ningún patrón en los tipos de defectos de nacimiento notificados. Antes de que el bebé reciba alguna vacuna, es importante que informe a los médicos del bebé y a otros profesionales sanitarios acerca del uso de Benepali durante el embarazo (para más información, ver sección 2, "Vacunaciones").
Las mujeres que estén utilizando Benepali no deben dar el pecho, ya que Benepali pasa a la leche materna.
Conducción y uso de máquinas
No se dispone de información que indique que el uso de Benepali influya sobre a la capacidad de conducir y utilizar máquinas.
3. Cómo usar Benepali
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Si estima que la acción de Benepali es demasiado fuerte o débil, comuníqueselo a su médico o farmacéutico.
Dosis para pacientes adultos (con edad igual o superior a 18 años)
Artritis reumatoide, artritis psoriásica y espondiloartritis axial, incluida la espondilitis anquilosante La dosis habitual es de 50 mg administrados una vez a la semana, en forma de inyección bajo la piel. Sin embargo, su médico puede determinar una frecuencia alternativa a la que inyectar Benepali.
Psoriasis en placas
La dosis habitual es de 50 mg una vez a la semana.
Alternativamente, pueden administrarse 50 mg dos veces a la semana durante un máximo de 12 semanas, seguido por 50 mg una vez a la semana.
Su médico decidirá cuánto tiempo debe tomar Benepali y si necesita una repetición del tratamiento en función de su respuesta. Si Benepali no tiene efecto sobre su enfermedad después de 12 semanas, su médico puede indicarle que deje de usar este medicamento.
Forma y vía de administración
Benepali se administra mediante una inyección bajo la piel (mediante inyección subcutánea).
Benepali se puede administrar con o sin alimentos o bebidas.
En la sección 7, “Instrucciones de uso”, se incluyen instrucciones detalladas para la inyección de Benepali. La solución de Benepali no debe mezclarse con ningún otro medicamento.
Para que le ayude a recordar, puede ser útil anotar en un diario qué día(s) de la semana debe utilizar Benepali.
Si usa más Benepali del que debe
Si usa más Benepali del que debiera (bien por inyectar una cantidad elevada en una única ocasión o bien por usarlo con mucha frecuencia), debería hablar con un médico o farmacéutico inmediatamente. Lleve siempre consigo el estuche del medicamento aunque esté vacío.
Si olvidó inyectarse Benepali
Si se le olvida una dosis, debería inyectarla tan pronto como usted lo recuerde, a no ser que la próxima dosis esté programada para el día siguiente, en cuyo caso deberá omitir la dosis olvidada. A continuación, continúe inyectando el medicamento en el(los) día(s) habitual(es). Si no lo recuerda hasta el día en que debe administrarse la dosis siguiente, no se inyecte una dosis doble (dos dosis en el mismo día) para compensar la dosis olvidada.
Si interrumpe el tratamiento con Benepali
Sus síntomas pueden volver tras la interrupción del tratamiento.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Reacciones alérgicas
Si observa alguna de las siguientes reacciones, no se inyecte más Benepali. Informe a su médico inmediatamente o acuda al Servicio de Urgencias del hospital más cercano.
• Dificultad para tragar o respirar
• Hinchazón de la cara, garganta, manos y pies
• Sensación de nerviosismo o ansiedad, palpitaciones, enrojecimiento súbito de la piel y/o sensación de calor
• Erupción grave, picor o urticaria (ronchas prominentes de la piel, enrojecidas o pálidas, acompañadas a menudo de picor)
Las reacciones alérgicas graves son raras. Sin embargo, cualquiera de los síntomas anteriores, puede ser indicio de una reacción alérgica a Benepali, por lo que usted debe buscar atención sanitaria de urgencia inmediatamente.
Efectos adversos graves
Si usted nota alguno de los efectos siguientes, puede necesitar atención médica de urgencia.
• Signos de infecciones graves, tales como fiebre alta que puede ir acompañada de tos, falta de aliento, escalofrío, debilidad, o de una zona dolorida, sensible, enrojecida y con sensación de calor en la piel o articulaciones;
• Signos de trastornos sanguíneos, tales como hemorragia, hematomas o palidez;
• Signos de trastornos del sistema nervioso, tales como entumecimiento u hormigueo, alteraciones de la visión, dolor ocular o aparición de debilidad en un brazo o pierna;
• Signos de insuficiencia cardíaca o empeoramiento de la insuficiencia cardiaca, tales como fatiga o falta de aliento con la actividad, hinchazón de los tobillos, sensación de plenitud en el cuello o en el abdomen, falta de aliento durante la noche o tos, color azulado de las uñas o alrededor de los labios;
• Signos de cáncer: el cáncer puede afectar a cualquier parte del cuerpo incluyendo la piel y la sangre, y los posibles signos dependerán del tipo y localización del cáncer. Estos signos pueden ser entre otros pérdida de peso, fiebre, hinchazón (con o sin dolor), tos persistente, presencia de bultos o engrasamientos en la piel;
• Signos de reacciones autoinmunes (en las que se desarrollan anticuerpos que pueden dañar tejidos normales del cuerpo) tales como dolor, picor, debilidad y respiración, pensamiento, sensación, o visión anormal;
• Signos de lupus o síndrome tipo lupus tales como cambios de peso, erupción persistente, fiebre, dolor de los músculos o articulaciones o cansancio;
• Signos de inflamación de los vasos sanguíneos tales como dolor, fiebre, enrojecimiento o calor de la piel, o picor.
Estos efectos adversos son raros o poco frecuentes, pero son estados graves (algunos de ellos en raras ocasiones pueden ser mortales). Si se produce cualquiera de ellos, informe a su médico inmediatamente o acuda al Servicio de Urgencias del hospital más cercano.
A continuación se listan los efectos adversos conocidos de Benepali, agrupados por orden decreciente de frecuencia:
• Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
Infecciones (incluyendo resfriado, sinusitis, bronquitis, infecciones del tracto urinario e infecciones de la piel); reacciones en el lugar de inyección (incluyendo hemorragia, hematoma, enrojecimiento, picor, dolor e hinchazón).
Reacciones en el lugar de inyección (no se producen con tanta frecuencia después del primer mes de tratamiento).
Algunos pacientes han desarrollado reacción en el sitio de inyección utilizado anteriormente.
• Frecuentes (pueden afectar hasta 1 de cada 10 personas):
Reacciones alérgicas; fiebre; picores; anticuerpos dirigidos contra los tejidos normales (formación de autoanticuerpos).
• Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
Infecciones graves (incluyendo neumonía, infecciones no superficiales de la piel, infecciones de las articulaciones, infección de la sangre e infecciones generalizadas); bajo número de plaquetas; cáncer de piel (excluyendo melanoma); hinchazón localizada de la piel (angioedema); urticaria (ronchas prominentes de la piel, enrojecidas o pálidas, acompañadas a menudo de picor); inflamación ocular; psoriasis (nueva o empeoramiento); erupción; inflamación o cicatrización de los pulmones; inflamación de los vasos sanguíneos afectando múltiples órganos.
• Raros (pueden afectar hasta 1 de cada 1.000 personas):
Reacciones alérgicas graves (incluyendo hinchazón localizada grave de la piel y respiración jadeante); linfoma (un tipo de cáncer sanguíneo); melanoma (un tipo de cáncer de piel); de forma combinada bajo recuento de glóbulos rojos, glóbulos blancos y plaquetas; trastornos del sistema nervioso (con debilidad muscular grave y signos y síntomas similares a los de la esclerosis múltiple o inflamación de los nervios ópticos o de la médula espinal); tuberculosis; insuficiencia cardiaca congestiva; convulsiones; lupus o síndrome tipo lupus (los síntomas pueden incluir erupción persistente, fiebre, dolor de las articulaciones y cansancio); bajo recuento de glóbulos rojos, bajo recuento de glóbulos blancos, bajo recuento de neutrófilos (un tipo de glóbulos blancos); aumento de las enzimas hepáticas; erupción cutánea, que puede conducir a la formación grave de ampollas y a que se pele la piel; inflamación del hígado causada por el sistema inmunológico (hepatitis autoinmune); trastorno inmunológico que puede afectar a los pulmones, la piel y los ganglios linfáticos (sarcoidosis).
• Muy raros (pueden afectar hasta 1 de cada 10.000 personas):
Insuficiencia de la médula ósea para producir células sanguíneas cruciales.
• Frecuencia no conocida (no puede estimarse a partir de los datos disponibles):
Leucemia (cáncer que afecta a la sangre y médula ósea); carcinoma de células de Merkel (un tipo de cáncer de piel); activación excesiva de glóbulos blancos asociada con la inflamación (síndrome de activación de macrófagos); reactivación de hepatitis B (una infección del hígado); empeoramiento de una enfermedad llamada dermatomiositis (inflamación y debilidad de los músculos acompañada de erupción cutánea).
Efectos adversos en niños y adolescentes
El uso de Benepali no está indicado en niños y adolescentes menores de 18 años. Los efectos adversos observados en niños y adolescentes, así como sus frecuencias, son similares a los anteriormente descritos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Benepali
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y la jeringa precargada después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C). No congelar.
Conservar las jeringas precargadas en el embalaje exterior para protegerlas de la luz.
Después de retirar la jeringa de la nevera, espere aproximadamente 30 minutos para que la solución de Benepali en la jeringa alcance la temperatura ambiente. No la caliente de ninguna otra forma. A continuación, se recomienda el uso inmediato.
Benepali se puede conservar fuera de la nevera a una temperatura máxima de 25°C, y durante un único periodo de hasta 4 semanas; tras el cual, el medicamento no se puede refrigerar de nuevo. Benepali se debe desechar si no ha sido usado en las 4 semanas siguientes a su retirada de la nevera. Es recomendable que anote la fecha en la que Benepali se ha retirado de la nevera y la fecha a partir de la cual Benepali se debe desechar (no superior a 4 semanas desde la retirada del envase de la nevera).
Observe la solución en la jeringa. Debe ser transparente o ligeramente opalescente, incolora o de color amarillo pálido y puede contener pequeñas partículas de proteínas blancas o casi transparentes.
Este es el aspecto normal de Benepali. No utilice la solución si está más amarillenta o turbia, o si presenta partículas diferentes a las arriba descritas. Si le preocupa el aspecto de la solución, póngase en contacto con su farmacéutico para solicitarle cualquier ayuda que pueda necesitar.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Benepali
- El principio activo de Benepali es etanercept. Cada jeringa precargada contiene 1,0 ml de solución con 50 mg de etanercept.
- Los demás componentes son sacarosa, cloruro sódico, fosfato sódico monobásico monohidrato y fosfato sódico dibásico heptahidrato y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Benepali se presenta como una jeringa precargada, que contiene una solución inyectable transparente, incolora o de color amarillo pálido.
Benepali está disponible en envases que contienen 4 jeringas precargadas y envase múltiple que contienen 3 envases con 4 jeringas precargadas cada uno. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Samsung Bioepis UK Limited 3000 Hillswood Drive Chertsey
Surrey KT16 0RS Reino Unido
Responsable de la fabricación
Biogen (Denmark) Manufacturing ApS Biogen Allé 1 3400 Hillerod Dinamarca
medicamento dirigiéndose al representante local del
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Biogen Belgium NV/S.A Tél/Tel: + 32 (0)2 808 5947
Bt^rapnn
Biogen Idec Limited (UK)
Ten.: + 359 249 176 81
Ceská republika
Biogen (Czech Republic) s.r.o.
Tel: + 420 228 884 152
Danmark
Biogen (Denmark) A/S Tlf: + 45 78 79 37 53
Deutschland
Biogen GmbH
Tel: + 49 (0)30 223 864 72
Eesti
Biogen Idec Limited (UK)
Tel: + 372 6 68 30 56
EXláda
Biogen Idec Limited (UK)
Tr(k: + 30 211 176 8555
España
Biogen Spain, S.L.
Tel: + 34 931 790 519
France
Biogen France SAS Tél: + 33 (0)1 776 968 14
Hrvatska
Biogen Idec Limited (UK) Tel: + 385 (0)1 777 64 37
Ireland
Biogen Idec (Ireland) Ltd. Tel: +353 (0)1 513 33 33
Ísland
Biogen Idec Limited (UK) Sími: + 354 800 9836
Italia
Biogen Italia s.r.l.
Tel: + 39 (0)6 899 701 50
Lietuva
Biogen Idec Limited (UK)
Tel: +370 52 14 02 60
Luxembourg/Luxemburg
Biogen Belgium NV/SA Tél/Tel: +35 227 772 038
Magyarország
Biogen Hungary Kft.
Tel.: + 36 (0)6 1 848 04 64
Malta
Biogen Idec Limited (UK)
Tel: + 356 27 78 15 79
Nederland
Biogen Netherlands B.V.
Tel: + 31 (0)20 808 02 70
Norge
Biogen Norway AS Tlf: + 47 21 93 95 87
Osterreich
Biogen Austria GmbH Tel: + 43 (0)1 267 51 42
Polska
Biogen Poland Sp. z o.o.
Tel.: + 48 22 116 86 94
Portugal
Biogen Portugal Sociedade Farmacéutica,
Unipessoal, Lda
Tel: + 351 308 800 792
Romania
Biogen Idec Limited (UK)
Tel: + 40 377 881 045
Slovenija
Biogen Pharma d.o.o.
Tel: + 386 (0)1 888 81 07
Slovenská republika
Biogen Slovakia s.r.o.
Tel: + 421 (0)2 333 257 10
Suomi/Finland
Biogen Finland Oy Puh/Tel: + 358 (0)9 427 041 08
Kúrcpog
Biogen Idee Limited (UK) Tr(k: + 357 22 00 04 93
Sverige
Biogen Sweden AB Tel: +46 (0)8 525 038 36
Latvija
Biogen Idee Limited (UK) Tel: + 371 66 16 40 32
United Kingdom
Biogen Idee Limited Tel: +44 (0)20 360 886 22
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Instrucciones de uso
7.
Lea las Instrucciones de uso antes de empezar a usar Benepali y cada vez que se lo receten de nuevo. Pueden contener información nueva.
• No intente administrarse una inyección hasta que su médico o enfermero(a) le hayan enseñado cómo hacerlo.
Una jeringa precargada para un solo uso contiene una dosis de 50 mg de Benepali.
Encuentre una superficie bien iluminada y limpia y reúna los componentes que necesite:
Una jeringa precargada de Benepali nueva
o No agite la jeringa precargada. El estuche no incluye:
• 1 toallita con alcohol

• Recipiente para desechar los objetos punzocortantes

A. Antes de comenzar
1. Inspeccione la jeringa precargada:
Compruebe la fecha de caducidad en la etiqueta de la jeringa precargada.
• No use la jeringa precargada después de la fecha de caducidad.
• No use la jeringa precargada si se ha caído sobre una superficie dura. Es posible que los componentes internos se hayan roto.
• No use la jeringa precargada si no tiene el capuchón de la aguja puesto o si no está firmemente ajustado.
2. Compruebe la solución:
Observe el medicamento en el interior de la jeringa precargada.
El medicamento debe ser transparente o ligeramente opalescente, incoloro o de color amarillo
pálido y puede contener pequeñas partículas de proteínas blancas o casi transparentes.
• No utilice la solución si está más amarillenta o turbia, o si presenta partículas diferentes a las arriba descritas.
3. Espere hasta que el medicamento alcance la temperatura ambiente:
Saque una de las jeringas precargadas de la nevera y déjela a temperatura ambiente durante al menos 30 minutos antes de inyectar la solución.
Esto hace que la inyección sea más fácil y cómoda para usted.
• No retire el capuchón de la aguja hasta que esté preparado para la inyección.
• No utilice fuentes de calor como un microondas o agua caliente para calentar Benepali.
4. Elija un lugar de inyección:
La jeringa precargada de Benepali está prevista para la inyección subcutánea. Se debe inyectar en el muslo, el abdomen o en la parte superior posterior del brazo (ver la imagen a la izquierda).
Debe utilizarse un lugar diferente para cada nueva inyección.
Si se inyecta en el abdomen escoja un sitio que esté al menos a 5 cm del ombligo.
• No administre la inyección en áreas de piel enrojecidas, endurecidas, contusionadas o sensibles.
• Evite las áreas con cicatrices o estrías.
• Si usted tiene psoriasis, no inyecte el medicamento en ninguna roncha de la piel abultada, gruesa, enrojecida o escamosa, ni en lesiones.
B. Pasos de la inyección
Paso 1:
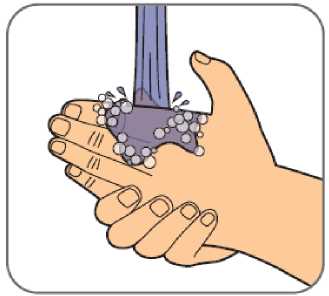
Lávese las manos con agua y jabón.
Limpie el lugar de inyección con una toallita de algodón impregnada en alcohol.
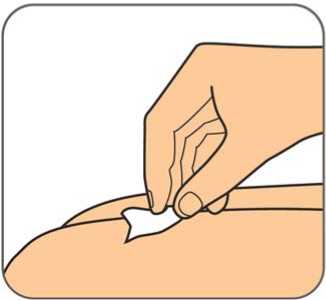
Paso 3:
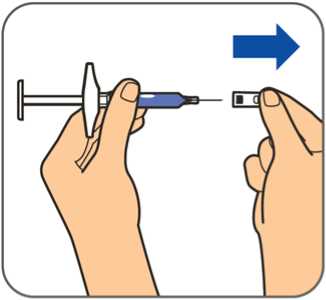
Paso 4:
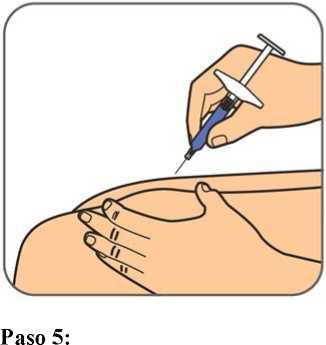
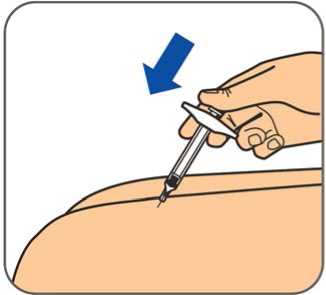
Consulte "Elija un lugar de inyección" para saber cómo elegir el lugar de la inyección.
• No toque de nuevo esta zona antes de haberse puesto la inyección.
Quite el capuchón de la aguja tirando de él en línea recta y elimínelo en la basura o en el recipiente para objetos punzocortantes.
Consulte las indicaciones para elegir un lugar para la inyección en ‘Elija un lugar de inyección’.
• No retuerza ni doble el capuchón de la aguja al quitarlo porque podría dañar la aguja.
• No toque el vástago de émbolo cuando quite el capuchón de la aguja.
• Nunca coloque de nuevo el capuchón.
Pellizque con suavidad la piel limpia para hacer un pliegue. Mantenga la jeringa precargada inclinada 45 grados con respecto a la piel. Con un movimiento rápido y corto empuje la aguja hasta que penetre por completo en la piel.
Puede soltar el pliegue de piel cuando la aguja esté totalmente introducida.
Empuje lentamente el émbolo para inyectar toda la solución de Benepali.
Cuando la jeringa esté vacía, extraiga la aguja de la piel en el mismo ángulo en que la insertó.
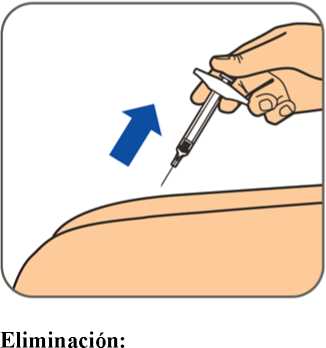
• Nunca cubra de nuevo la aguja con el capuchón. Podría lesionarse por punción.
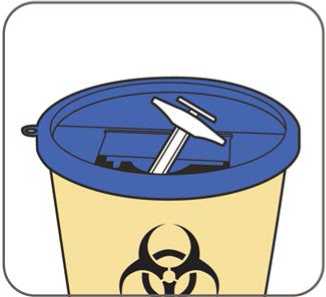
Deseche la jeringa completa en un recipiente para objetos punzocortantes autorizado.
Consulte a su médico cómo eliminar correctamente un recipiente para objetos punzocortantes lleno. Puede adquirir los recipientes para objetos punzocortantes en su farmacia.
• No tire el recipiente para objetos punzocortantes en la basura doméstica.
• No lo recicle.
• No reutilice la jeringa precargada de Benepali.
• Mantenga siempre este contenedor fuera de la vista y del alcance de los niños.
C. Cuidados en el lugar de la inyección
Si se produce un sangrado en el lugar de la inyección presione la zona con una gasa.
• No friccione el lugar de la inyección.
Si fuera necesario, puede cubrir el lugar de la inyección con un apósito.
Prospecto: información para el usuario Benepali 50 mg solución inyectable en pluma precargada
etanercept
'VEste medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Su médico además le dará una Tarjeta de Alerta para el Paciente, la cual contiene información
de seguridad importante que usted necesita conocer antes y durante el tratamiento con Benepali.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas
aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Benepali y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Benepali
3. Cómo usar Benepali
4. Posibles efectos adversos
5. Conservación de Benepali
6. Contenido del envase e información adicional
7. Instrucciones de uso (ver al dorso)
1. Qué es Benepali y para qué se utiliza
Benepali es un medicamento que se fabrica a partir de dos proteínas humanas. Bloquea la actividad de otra proteína, que se encuentra en el organismo, que produce inflamación. Benepali actúa reduciendo la inflamación asociada a ciertas enfermedades. Benepali contiene el principio activo etanercept.
Benepali puede utilizarse, en adultos de edad igual o superior a 18 años, para:
• el tratamiento de la artritis reumatoide moderada o grave;
• artritis psoriásica;
• espondiloartritis axial grave, incluida la espondilitis anquilosante;
• psoriasis moderada o grave.
Habitualmente, dependiendo de cada caso, Benepali se usa cuando otros tratamientos no han sido lo suficientemente eficaces o no son apropiados para usted.
En el tratamiento de la artritis reumatoide, Benepali se utiliza normalmente en combinación con metotrexato, aunque también puede utilizarse como único medicamento, en el caso de que el tratamiento con metotrexato no sea apropiado para usted. Benepali puede ralentizar el daño causado por la artritis reumatoide en sus articulaciones y mejorar su capacidad para realizar las actividades diarias, tanto si se utiliza solo o en combinación con metotrexato.
En el caso de los pacientes que presentan artritis psoriásica con afectación múltiple de las articulaciones, Benepali puede mejorar su capacidad para realizar las actividades normales diarias.
En el caso de los pacientes que presentan articulaciones simétricas múltiples, hinchadas o dolorosas (por ejemplo, en manos, muñecas y pies), Benepali puede retrasar el progreso del daño estructural de dichas articulaciones causado por la enfermedad.
2. Qué necesita saber antes de empezar a usar Benepali
No use Benepali
• si es alérgico a etanercept o a alguno de los demás componentes de Benepali (incluidos en la sección 6);
• si tiene riesgo de desarrollar una infección grave de la sangre denominada sepsis. Si no está seguro, consulte a su médico;
• si padece una infección de cualquier tipo. Si no está seguro, consulte a su médico.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Benepali.
• Reacciones alérgicas: Si experimenta reacciones alérgicas, tales como opresión torácica, respiración jadeante, vértigo o erupción, no inyecte más Benepali y póngase inmediatamente en contacto con su médico.
• Infecciones/cirugía: Si desarrolla una nueva infección o está a punto de someterse a una intervención de cirugía mayor, su médico podría estar interesado en controlar el tratamiento con Benepali.
• Infecciones/diabetes: Informe a su médico si tiene historial de infecciones recurrentes o si padece diabetes u otros trastornos que aumenten el riesgo de infección.
• Infecciones/monitorización: Informe a su médico de cualquier viaje reciente fuera de la región europea. Si desarrolla síntomas de una infección tales como fiebre, escalofríos o tos, notifíqueselo a su médico inmediatamente. Su médico debe decidir si continuar monitorizándole para ver la presencia de infecciones después de que usted deje el tratamiento con Benepali.
• Tuberculosis: Ya que se han notificado casos de tuberculosis en pacientes tratados con Benepali, su médico examinará los signos y síntomas de tuberculosis antes de empezar con Benepali. Esto puede incluir una historia médica minuciosa, radiografía torácica y una prueba de tuberculosis. La realización de estos análisis debe ser registrada en la Tarjeta de Alerta para el Paciente. Es muy importante que le diga a su médico si ha tenido tuberculosis, o si ha estado en contacto directo con alguien que ha tenido tuberculosis. Si los síntomas de tuberculosis (tales como tos persistente, pérdida de peso, apatía, fiebre moderada), o alguna otra infección aparece durante o después del tratamiento, informe a su médico inmediatamente.
• Hepatitis B: Informe a su médico si tiene o ha tenido hepatitis B alguna vez. Su médico debe hacerle la prueba de la hepatitis B antes de que usted comience el tratamiento con Benepali. El tratamiento con Benepali puede reactivar la hepatitis B en pacientes que hayan estado previamente infectados por el virus de la hepatitis B. Si esto ocurre, debe dejar de usar Benepali.
• Hepatitis C: Informe a su médico si tiene hepatitis C. Su médico puede querer monitorizar el tratamiento con Benepali en el caso de que la infección empeore.
• Trastornos de la sangre: Informe inmediatamente a su médico si tiene signos o síntomas tales como, fiebre persistente, dolor de garganta, hematomas, sangrado o palidez. Tales síntomas pueden indicar la existencia de un problema sanguíneo grave que haga necesaria la interrupción del tratamiento con Benepali.
• Trastornos del sistema nervioso y de la visión: Informe a su médico si presenta esclerosis múltiple, neuritis óptica (inflamación de los nervios ópticos) o mielitis transversa (inflamación de la médula espinal). Su médico decidirá si Benepali es un tratamiento adecuado.
• Insuficiencia cardiaca congestiva: Informe a su médico si tiene un historial de insuficiencia cardiaca congestiva, porque Benepali necesita ser utilizado con precaución en esas circunstancias.
• Cáncer: Informe a su médico si usted tiene o ha tenido linfoma (un tipo de cáncer sanguíneo) o cualquier otro cáncer antes de que se le administre Benepali. Los pacientes con artritis reumatoide grave, que han tenido la enfermedad durante mucho tiempo, pueden correr un riesgo mayor que el promedio de desarrollar un linfoma. Algunos pacientes adolescentes y niños que han recibido etanercept u otros medicamentos que funcionan de la misma manera que etanercept han desarrollado cánceres, incluyendo tipos inusuales, que algunas veces tuvieron como desenlace la muerte. Algunos pacientes que reciben Benepali han desarrollado cánceres de piel. Informe a su médico si usted desarrolla cualquier cambio en el aspecto de la piel o crecimientos en la piel.
• Varicela: Informe a su médico si usted está expuesto a la varicela mientras utiliza Benepali. Su médico determinará si es apropiado el tratamiento preventivo para la varicela.
• Alcoholismo: Benepali no debe usarse para el tratamiento de hepatitis relacionada con alcoholismo. Por favor, informe a su médico tiene un historial de alcoholismo.
• Granulomatosis de Wegener: No se recomienda Benepali para el tratamiento de la granulomatosis de Wegener, una enfermedad inflamatoria rara. Si tiene granulomatosis de Wegener, coméntelo con su médico.
• Medicamentos antidiabéticos: Informe a su médico si tiene diabetes o está tomando medicamentos para tratar la diabetes. Su médico puede decidir si usted necesita menos medicamento antidiabético mientras toma Benepali.
• Vacunas: Algunas vacunas, como la vacuna de la polio oral, no se deben administrar mientras se está utilizando Benepali. Consulte con su médico antes de utilizar cualquier vacuna.
Niños y adolescentes
El uso de Benepali no está indicado en niños y adolescentes menores de 18 años.
Benepali solo está disponible como jeringa precargada de 50 mg o como pluma recargada de 50 mg, y estas presentaciones no están indicadas para el uso en niños o adolescentes.
Uso de Benepali con otros medicamentos
No use Benepali con medicamentos que contengan el principio activo anakinra o abatacept.
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento (incluyendo sulfasalazina), incluso aquellos no prescritos por su médico.
Embarazo y lactancia
No se recomienda el uso de Benepali durante el embarazo. Consulte a su médico si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada.
Si ha recibido Benepali durante el embarazo, su bebé puede presentar un mayor riesgo de contraer una infección. Además, en un estudio se observaron más defectos de nacimiento cuando la madre había recibido etanercept durante el embarazo, en comparación con las madres que no habían recibido etanercept ni otros medicamentos similares (antagonistas del TNF), pero no hubo ningún patrón en los tipos de defectos de nacimiento notificados. Antes de que el bebé reciba alguna vacuna, es importante que informe a los médicos del bebé y a otros profesionales sanitarios acerca del uso de Benepali durante el embarazo (para más información, ver sección 2, "Vacunaciones").
Las mujeres que estén utilizando Benepali no deben dar el pecho, ya que Benepali pasa a la leche materna.
Conducción y uso de máquinas
No se dispone de información que indique que el uso de Benepali influya sobre a la capacidad de conducir y utilizar máquinas.
3. Cómo usar Benepali
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Si estima que la acción de Benepali es demasiado fuerte o débil, comuníqueselo a su médico o farmacéutico.
Dosis para pacientes adultos (con edad igual o superior a 18 años)
Artritis reumatoide, artritis psoriásica y espondiloartritis axial, incluida la espondilitis anquilosante La dosis habitual es de 50 mg administrados una vez a la semana, en forma de inyección bajo la piel. Sin embargo, su médico puede determinar una frecuencia alternativa a la que inyectar Benepali.
Psoriasis en placas
La dosis habitual es de 50 mg una vez a la semana.
Alternativamente, pueden administrarse 50 mg dos veces a la semana durante un máximo de 12 semanas, seguido por 50 mg una vez a la semana.
Su médico decidirá cuánto tiempo debe tomar Benepali y si necesita una repetición del tratamiento en función de su respuesta. Si Benepali no tiene efecto sobre su enfermedad después de 12 semanas, su médico puede indicarle que deje de usar este medicamento.
Forma y vía de administración
Benepali se administra mediante una inyección bajo la piel (mediante inyección subcutánea).
Benepali se puede administrar con o sin alimentos o bebidas.
En la sección 7, “Instrucciones de uso”, se incluyen instrucciones detalladas para la inyección de Benepali. La solución de Benepali no debe mezclarse con ningún otro medicamento.
Para que le ayude a recordar, puede ser útil anotar en un diario qué día(s) de la semana debe utilizar Benepali.
Si usa más Benepali del que debe
Si usa más Benepali del que debiera (bien por inyectar una cantidad elevada en una única ocasión o bien por usarlo con mucha frecuencia), debería hablar con un médico o farmacéutico inmediatamente. Lleve siempre consigo el estuche del medicamento aunque esté vacío.
Si olvidó inyectarse Benepali
Si se le olvida una dosis, debería inyectarla tan pronto como usted lo recuerde, a no ser que la próxima dosis esté programada para el día siguiente, en cuyo caso deberá omitir la dosis olvidada. A continuación, continúe inyectando el medicamento en el(los) día(s) habitual(es). Si no lo recuerda hasta el día en que debe administrarse la dosis siguiente, no se inyecte una dosis doble (dos dosis en el mismo día) para compensar la dosis olvidada.
Si interrumpe el tratamiento con Benepali
Sus síntomas pueden volver tras la interrupción del tratamiento.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Reacciones alérgicas
Si observa alguna de las siguientes reacciones, no se inyecte más Benepali. Informe a su médico inmediatamente o acuda al Servicio de Urgencias del hospital más cercano.
• Dificultad para tragar o respirar
• Hinchazón de la cara, garganta, manos y pies
• Sensación de nerviosismo o ansiedad, palpitaciones, enrojecimiento súbito de la piel y/o sensación de calor
• Erupción grave, picor o urticaria (ronchas prominentes de la piel, enrojecidas o pálidas, acompañadas a menudo de picor)
Las reacciones alérgicas graves son raras. Sin embargo, cualquiera de los síntomas anteriores, puede ser indicio de una reacción alérgica a Benepali, por lo que usted debe buscar atención sanitaria de urgencia inmediatamente.
Efectos adversos graves
Si usted nota alguno de los efectos siguientes, puede necesitar atención médica de urgencia.
• Signos de infecciones graves, tales como fiebre alta que puede ir acompañada de tos, falta de aliento, escalofrío, debilidad, o de una zona dolorida, sensible, enrojecida y con sensación de calor en la piel o articulaciones;
• Signos de trastornos sanguíneos, tales como hemorragia, hematomas o palidez;
• Signos de trastornos del sistema nervioso, tales como entumecimiento u hormigueo, alteraciones de la visión, dolor ocular o aparición de debilidad en un brazo o pierna;
• Signos de insuficiencia cardíaca o empeoramiento de la insuficiencia cardiaca, tales como fatiga o falta de aliento con la actividad, hinchazón de los tobillos, sensación de plenitud en el cuello o en el abdomen, falta de aliento durante la noche o tos, color azulado de las uñas o alrededor de los labios;
• Signos de cáncer: el cáncer puede afectar a cualquier parte del cuerpo incluyendo la piel y la sangre, y los posibles signos dependerán del tipo y localización del cáncer. Estos signos pueden ser entre otros pérdida de peso, fiebre, hinchazón (con o sin dolor), tos persistente, presencia de bultos o engrosamientos en la piel;
• Signos de reacciones autoinmunes (en las que se desarrollan anticuerpos que pueden dañar tejidos normales del cuerpo) tales como dolor, picor, debilidad y respiración, pensamiento, sensación, o visión anormal;
• Signos de lupus o síndrome tipo lupus tales como cambios de peso, erupción persistente, fiebre, dolor de los músculos o articulaciones o cansancio;
• Signos de inflamación de los vasos sanguíneos tales como dolor, fiebre, enrojecimiento o calor de la piel, o picor.
Estos efectos adversos son raros o poco frecuentes, pero son estados graves (algunos de ellos en raras ocasiones pueden ser mortales). Si se produce cualquiera de ellos, informe a su médico inmediatamente o acuda al Servicio de Urgencias del hospital más cercano.
A continuación se listan los efectos adversos conocidos de Benepali, agrupados por orden decreciente de frecuencia:
• Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
Infecciones (incluyendo resfriado, sinusitis, bronquitis, infecciones del tracto urinario e infecciones de la piel); reacciones en el lugar de inyección (incluyendo hemorragia, hematoma, enrojecimiento, picor, dolor e hinchazón).
Reacciones en el lugar de inyección (no se producen con tanta frecuencia después del primer mes de tratamiento).
Algunos pacientes han desarrollado reacción en el sitio de inyección utilizado anteriormente.
• Frecuentes (pueden afectar hasta 1 de cada 10 personas):
Reacciones alérgicas; fiebre; picores; anticuerpos dirigidos contra los tejidos normales (formación de autoanticuerpos).
• Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
Infecciones graves (incluyendo neumonía, infecciones no superficiales de la piel, infecciones de las articulaciones, infección de la sangre e infecciones generalizadas); bajo número de plaquetas; cáncer de piel (excluyendo melanoma); hinchazón localizada de la piel (angioedema); urticaria (ronchas prominentes de la piel, enrojecidas o pálidas, acompañadas a menudo de picor); inflamación ocular; psoriasis (nueva o empeoramiento); erupción; inflamación o cicatrización de los pulmones; inflamación de los vasos sanguíneos afectando múltiples órganos.
• Raros (pueden afectar hasta 1 de cada 1.000 personas):
Reacciones alérgicas graves (incluyendo hinchazón localizada grave de la piel y respiración jadeante); linfoma (un tipo de cáncer sanguíneo); melanoma (un tipo de cáncer de piel); de forma combinada bajo recuento de glóbulos rojos, glóbulos blancos y plaquetas; trastornos del sistema nervioso (con debilidad muscular grave y signos y síntomas similares a los de la esclerosis múltiple o inflamación de los nervios ópticos o de la médula espinal); tuberculosis; insuficiencia cardiaca congestiva; convulsiones; lupus o síndrome tipo lupus (los síntomas pueden incluir erupción persistente, fiebre, dolor de las articulaciones y cansancio); bajo recuento de glóbulos rojos, bajo recuento de glóbulos blancos, bajo recuento de neutrófilos (un tipo de glóbulos blancos); aumento de las enzimas hepáticas; erupción cutánea, que puede conducir a la formación grave de ampollas y a que se pele la piel; inflamación del hígado causada por el sistema inmunológico (hepatitis autoinmune); trastorno inmunológico que puede afectar a los pulmones, la piel y los ganglios linfáticos (sarcoidosis).
• Muy raros (pueden afectar hasta 1 de cada 10.000 personas):
Insuficiencia de la médula ósea para producir células sanguíneas cruciales.
• Frecuencia no conocida (no puede estimarse a partir de los datos disponibles):
Leucemia (cáncer que afecta a la sangre y médula ósea); carcinoma de células de Merkel (un tipo de cáncer de piel); activación excesiva de glóbulos blancos asociada con la inflamación (síndrome de activación de macrófagos); reactivación de hepatitis B (una infección del hígado); empeoramiento de una enfermedad llamada dermatomiositis (inflamación y debilidad de los músculos acompañada de erupción cutánea).
Efectos adversos en niños y adolescentes
El uso de Benepali no está indicado en niños y adolescentes menores de 18 años. Los efectos adversos observados en niños y adolescentes, así como sus frecuencias, son similares a los anteriormente descritos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Benepali
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y la pluma precargada después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C). No congelar.
Conservar las plumas precargadas en el embalaje exterior para protegerlas de la luz.
Después de retirar la pluma precargada de la nevera, espere aproximadamente 30 minutos para que la solución de Benepali en la pluma alcance la temperatura ambiente. No la caliente de ninguna otra forma. A continuación, se recomienda el uso inmediato.
Benepali se puede conservar fuera de la nevera a una temperatura máxima de 25°C, y durante un único periodo de hasta 4 semanas; tras el cual, el medicamento no se puede refrigerar de nuevo. Benepali se debe desechar si no ha sido usado en las 4 semanas siguientes a su retirada de la nevera. Es recomendable que anote la fecha en la que Benepali se ha retirado de la nevera y la fecha a partir de la cual Benepali se debe desechar (no superior a 4 semanas desde la retirada del envase de la nevera).
Compruebe la solución en la pluma mire a través de la ventana de inspección. La solución debe ser transparente o ligeramente opalescente, incolora o de color amarillo pálido y puede contener pequeñas partículas de proteínas blancas o casi transparentes.
Este es el aspecto normal de Benepali. No utilice la solución si está más amarillenta o turbia, o si presenta partículas diferentes a las arriba descritas. Si le preocupa el aspecto de la solución, póngase en contacto con su farmacéutico para solicitarle cualquier ayuda que pueda necesitar.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Benepali
- El principio activo de Benepali es etanercept. Cada pluma precargada contiene 50 mg de etanercept.
- Los demás componentes son sacarosa, cloruro sódico, fosfato sódico monobásico monohidrato y fosfato sódico dibásico heptahidrato y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Benepali se presenta como una solución inyectable en una pluma precargada (solución inyectable). La pluma contiene una solución inyectable transparente, incolora o de color amarillo pálido.
Benepali está disponible en envases que contienen 4 plumas precargadas y envase múltiple que contienen 3 envases con 4 plumas precargadas cada uno. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Samsung Bioepis UK Limited 3000 Hillswood Drive Chertsey
Surrey KT16 0RS Reino Unido
Responsable de la fabricación
Biogen (Denmark) Manufacturing ApS Biogen Allé 1 3400 Hillerod
Dinamarca
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Biogen Belgium NV/S.A Tél/Tel: + 32 (0)2 808 5947 |
Lietuva Biogen Idec Limited (UK) Tel: +370 52 14 02 60 |
|
Etnrapun Biogen Idec Limited (UK) Ten.: + 359 249 176 81 |
Luxembourg/Luxemburg Biogen Belgium NV/SA Tél/Tel: +35 227 772 038 |
|
Ceská republika Biogen (Czech Republic) s.r.o. Tel: + 420 228 884 152 |
Magyarország Biogen Hungary Kft. Tel.: + 36 (0)6 1 848 04 64 |
|
Danmark Biogen (Denmark) A/S Tlf: + 45 78 79 37 53 |
Malta Biogen Idec Limited (UK) Tel: + 356 27 78 15 79 |
|
Deutschland Biogen GmbH Tel: + 49 (0)30 223 864 72 |
Nederland Biogen Netherlands B.V. Tel: + 31 (0)20 808 02 70 |
|
Eesti Biogen Idec Limited (UK) Tel: + 372 6 68 30 56 |
Norge Biogen Norway AS Tlf: + 47 21 93 95 87 |
|
EXláda Biogen Idec Limited (UK) TpA,: + 30 211 176 8555 |
Osterreich Biogen Austria GmbH Tel: + 43 (0)1 267 51 42 |
|
España Biogen Spain, S.L. Tel: + 34 931 790 519 |
Polska Biogen Poland Sp. z o.o. Tel.: + 48 22 116 86 94 |
|
France Biogen France SAS Tél: + 33 (0)1 776 968 14 |
Portugal Biogen Portugal Sociedade Farmacéutica, Unipessoal, Lda Tel: + 351 308 800 792 |
|
Hrvatska Biogen Idec Limited (UK) Tel: + 385 (0)1 777 64 37 |
Romania Biogen Idec Limited (UK) Tel: + 40 377 881 045 |
|
Ireland Biogen Idec (Ireland) Ltd. Tel: +353 (0)1 513 33 33 |
Slovenija Biogen Pharma d.o.o. Tel: + 386 (0)1 888 81 07 |
|
Ísland Biogen Idec Limited (UK) Sími: + 354 800 9836 Italia Biogen Italia s.r.l. Tel: + 39 (0)6 899 701 50 |
Slovenská republika Biogen Slovakia s.r.o. Tel: + 421 (0)2 333 257 10 Suomi/Finland Biogen Finland Oy Puh/Tel: + 358 (0)9 427 041 08 |
Italia
Biogen Italia s.r.l.
Tel: + 39 (0)6 899 701 50
Kúrcpog
Biogen Idee Limited (UK) Tr(k: + 357 22 00 04 93
Sverige
Biogen Sweden AB Tel: +46 (0)8 525 038 36
Latvija
Biogen Idee Limited (UK) Tel: + 371 66 16 40 32
United Kingdom
Biogen Idee Limited Tel: +44 (0)20 360 886 22
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Instrucciones de uso
7.
Lea las Instrucciones de uso antes de empezar a usar Benepali y cada vez que se lo receten de nuevo. Pueden contener información nueva.
• No intente administrarse una inyección hasta que su médico o enfermero(a) le hayan enseñado cómo hacerlo.
Una pluma precargada para un solo uso contiene una dosis de 50 mg de Benepali.
Encuentre una superficie bien iluminada y limpia y reúna los componentes que necesite:
Una pluma precargada de Benepali nueva

Tapa de la aguja Ventana de inspección
o No agite la pluma precargada.
El estuche no incluye:
• 1 toallita con alcohol
toallita
con
alcohol

• Recipiente para desechar los objetos punzocortantes
A. Antes de comenzar
1. Inspeccione la pluma precargada:
Compruebe la fecha de caducidad en la etiqueta de la pluma precargada.
• No use la pluma precargada después de la fecha de caducidad.
• No use la pluma precargada si se ha caído sobre una superficie dura. Es posible que los componentes internos se hayan roto.
• No use la pluma precargada si no tiene la tapa de la aguja puesta o si no está firmemente ajustada.
2. Compruebe la solución:
Observe el medicamento a través de la ventana de inspección.
El medicamento debe ser transparente o ligeramente opalescente, incoloro o de color amarillo pálido y puede contener pequeñas partículas de proteínas blancas o casi transparentes.
• No utilice la solución si está más amarillenta o turbia, o si presenta partículas diferentes a las arriba descritas.
3. Espere hasta que el medicamento alcance la temperatura ambiente:
Saque una de las plumas precargadas del envase guardado en la nevera y déjela a temperatura ambiente durante al menos 30 minutos antes de inyectar la solución.
Esto hace que la inyección sea más fácil y cómoda para usted.
• No retire la tapa de la aguja hasta que esté preparado para la inyección.
• No utilice fuentes de calor como un microondas o agua caliente para calentar Benepali.
4. Elija un lugar de inyección:
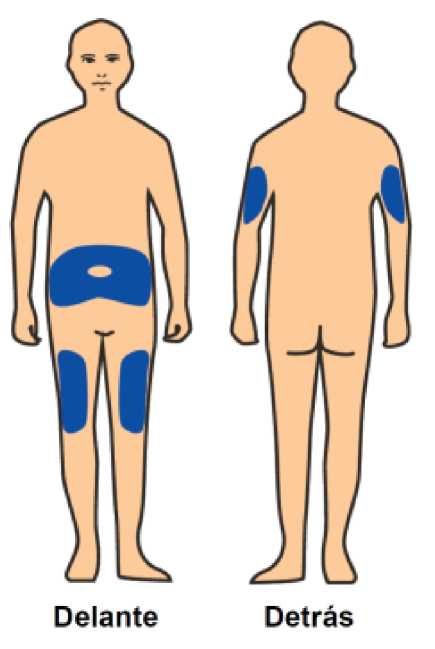
La pluma precargada de Benepali está prevista para la inyección subcutánea. Se debe inyectar en el muslo, el abdomen o en la parte superior posterior del brazo (ver la imagen a la izquierda).
Debe utilizarse un lugar diferente para cada nueva inyección.
Si se inyecta en el abdomen escoja un sitio que esté al menos a 5 cm del ombligo.
• No administre la inyección en áreas de piel enrojecidas, endurecidas, contusionadas o sensibles.
• Evite las áreas con cicatrices o estrías.
• Si usted tiene psoriasis, no inyecte el medicamento en ninguna roncha de la piel abultada, gruesa, enrojecida o escamosa, ni en lesiones.
B. Pasos de la inyección
Paso 1:
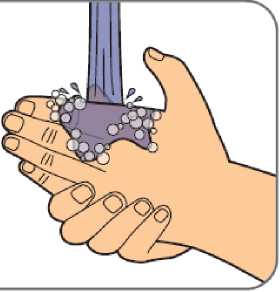
Lávese las manos con agua y jabón.
Limpie el lugar de inyección con una toallita de algodón impregnada en alcohol.
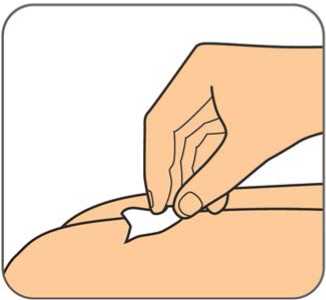
Paso 3:
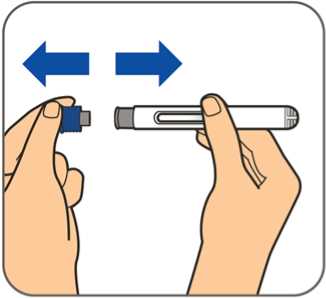
Paso 4:
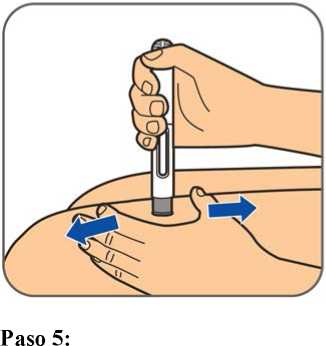
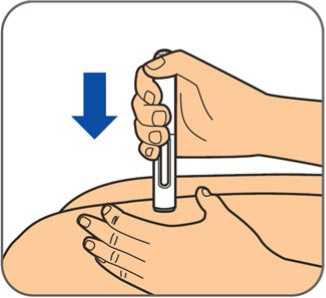
Consulte "Elija un lugar de inyección" para saber cómo elegir el lugar de la inyección.
• No toque de nuevo esta zona antes de haberse puesto la inyección.
Retire la tapa de la aguja tirando en línea recta y deséchela en la basura o en el recipiente para objetos punzocortantes.
• No retuerza ni curve la tapa de la aguja cuando la quite porque podría dañar la aguja. No vuelva a colocar la tapa sobre la aguja.
• Nunca cubra de nuevo la aguja con la tapa.
Estire con suavidad la piel limpia. Coloque la pluma precargada en un ángulo de aproximadamente 90 grados con respecto a la piel.
• No pellizque la piel.
• Al estirar la piel se crea una superficie firme.
Empuje firmemente la pluma precargada hacia abajo en el lugar de la inyección para comenzar la inyección.
El dispositivo hará clic cuando comience la inyección.
Siga manteniendo la pluma precargada firmemente presionada sobre el lugar de la inyección.
El dispositivo hará clic por segunda vez.
Después del segundo clic cuente lentamente hasta 15 para asegurarse de que la inyección se ha completado.
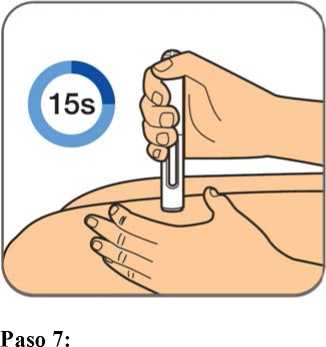
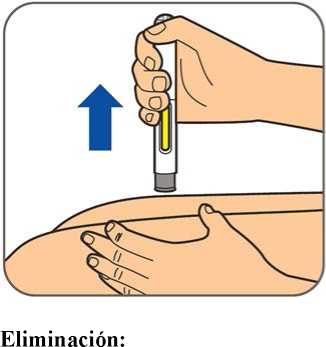
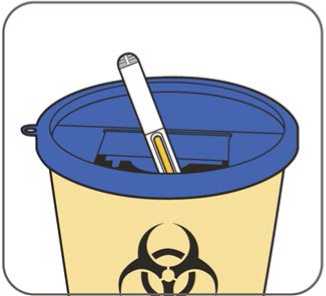
• No deje de ejercer presión sobre el lugar de la inyección hasta que la inyección se haya completado.
• No retire la pluma precargada durante la inyección.
Retire la pluma vacía de la piel.
El protector de la aguja la cubrirá por completo.
Compruebe el vástago de émbolo amarillo en la ventana para confirmar que se ha administrado la dosis completa.
Deseche la pluma vacía en un recipiente para objetos punzocortantes autorizado.
Consulte a su médico cómo eliminar correctamente un recipiente para objetos punzocortantes lleno.
Puede adquirir los recipientes para objetos punzocortantes en su farmacia.
• No tire el recipiente para objetos punzocortantes en la basura doméstica.
• No lo recicle.
• Mantenga siempre este contenedor fuera de la vista y del alcance de los niños.
C. Cuidados en el lugar de la inyección
Si se produce un sangrado en el lugar de la inyección presione la zona con una gasa. • No friccione el lugar de la inyección.
Si fuera necesario, puede cubrir el lugar de la inyección con un apósito.
74