Axura 5Mg+10 Mg+15 Mg+20 Mg Comprimidos Recubiertos Con Pelicula
ANEXO I
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Axura 10 mg comprimidos recubiertos con película.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimidos recubiertos con película.
Los comprimidos recubiertos con película tienen un color de amarillo pálido a amarillo, forma ovalada con una línea de rotura con grabado “1 0” en una cara y “M M” en la otra cara.
El comprimido se puede partir en dosis iguales.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
4.2 Posología y forma de administración Posología
El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el diagnóstico y tratamiento de la demencia de Alzheimer. El tratamiento se debe iniciar únicamente si se dispone de un cuidador que monitorice regularmente la toma del fármaco por parte del paciente. Se debe realizar el diagnóstico siguiendo las directrices actuales. La tolerabilidad y la dosis de memantina se deben reevaluar de forma regular, preferiblemente dentro de los 3 meses posteriores al inicio del tratamiento. Por lo tanto el beneficio clínico de memantina y la tolerabilidad del paciente al tratamiento se deben reevaluar de forma regular de acuerdo a las directrices clínicas vigentes. El tratamiento de mantenimiento puede continuarse mientras el beneficio terapéutico sea favorable y el paciente tolere el tratamiento con memantina. La interrupción del tratamiento con memantina debería considerarse cuando ya no se evidencie su efecto terapéutico o si el paciente no tolera el tratamiento.
Adultos:
Escalado de dosis
La dosis máxima diaria es de 20 mg al día. Para reducir el riesgo de efectos adversos, esta dosis de mantenimiento debe alcanzarse mediante un escalado de dosis durante las 3 primeras semanas de tratamiento en el que se incremente 5 mg por semana de la siguiente forma:
Semana 1 (día 1-7):
El paciente debe tomar la mitad de un comprimido recubierto con película de 10 mg (5 mg) al día durante 7 días.
Semana 2 (día 8-14):
El paciente debe tomar un comprimido recubierto con película de 10 mg (10 mg) al día durante 7 días.
Semana 3 (día 15- 21):
El paciente debe tomar un comprimido recubierto con película de 10 mg y medio (15 mg) al día durante 7 días.
A partir de la semana 4:
El paciente debe tomar dos comprimidos recubiertos con película de 10 mg (20 mg) al día.
Dosis de mantenimiento
La dosis recomendada de mantenimiento es de 20 mg al día.
Pacientes de edad avanzada: Basándose en estudios clínicos, la dosis recomendada para los pacientes mayores de 65 años es de 20 mg al día (dos comprimidos de 10 mg administrados una vez al día), tal como se ha descrito anteriormente.
Insuficiencia renal: En pacientes con función renal levemente afectada (aclaramiento de creatinina de 50 - 80 ml/min), no es necesario ajustar la dosis. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina de 30 - 49 ml/min), la dosis diaria debe ser de10 mg al día. Si se tolera bien después de, al menos 7 días de tratamiento, la dosis podría aumentarse hasta 20 mg/día de acuerdo con el esquema de titulación estándar. En pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5-29 ml/min.) la dosis diaria debe ser de 10 mg al día.
Insuficiencia hepática: En pacientes con insuficiencia hepática leve o moderada (Child-Pugh A y Child-Pugh B) no es necesario ajustar la dosis. No existen datos disponibles sobre el uso de memantina en pacientes con insuficiencia hepática grave. No se recomienda la administración de Axura en pacientes con insuficiencia hepática grave.
Niños y adolescentes: No se recomienda el uso de Axura en niños menores de 18 años debido a una falta de datos de seguridad y eficacia.
Forma de administración
Axura debe administrarse una vez al día, siempre a la misma hora. Los comprimidos recubiertos con película pueden tomarse con o sin alimentos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda precaución en el tratamiento de pacientes con epilepsia, antecedentes de crisis convulsivas o en pacientes con factores de riesgo para padecer epilepsia.
Se debe evitar la administración concomitante de antagonistas del N-metil-D-aspartato (NMDA) como la amantadina, la ketamina y el dextrometorfano. Estos compuestos actúan sobre el mismo sistema receptor que memantina y, por lo tanto, las reacciones adversas (principalmente las relacionadas con el sistema nervioso central [SNC]) pueden ser más frecuentes o más intensas (ver sección 4.5).
Todos aquellos factores que aumenten el pH urinario (ver sección 5.2 “Eliminación”) pueden requerir una monitorización rigurosa del paciente. Entre estos factores se incluyen cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o una ingesta masiva de tampones gástricos alcalinizantes. Asimismo, el pH urinario puede estar elevado en estados de acidosis tubular renal (ATR) o infecciones graves del tracto urinario por bacterias del género Proteus.
En la mayoría de los ensayos clínicos, se excluyeron aquellos pacientes con antecedentes de infarto de miocardio reciente, enfermedad cardíaca congestiva (NYHA III-IV) o hipertensión no controlada.
Como consecuencia, los datos en estos pacientes son limitados y los pacientes que presenten estas condiciones deben supervisarse cuidadosamente.
4.5 Interacción con otros medicamentos y otras formas de interacción
Debido a los efectos farmacológicos y al mecanismo de acción de la memantina, pueden producirse las siguientes interacciones:
• El mecanismo de acción sugiere que los efectos de la L-dopa, los agonistas dopaminérgicos y los anticolinérgicos pueden aumentar con el tratamiento concomitante de antagonistas del NMDA como memantina. Se pueden reducir los efectos de los barbitúricos y de los neurolépticos. La administración concomitante de memantina y agentes antiespasmódicos, como el dantroleno o el baclofeno, puede modificar sus efectos y hacer necesario un ajuste de la dosis.
• Se debe evitar el uso concomitante de memantina y amantadina, por el riesgo de psicosis farmacotóxica. Los dos compuestos están químicamente relacionados con los antagonistas del NMDA. Esto mismo podría aplicarse para la ketamina y el dextrometorfano (ver sección 4.4). También hay un caso clínico publicado sobre el posible riesgo de la combinación de memantina y fenitoína.
• Otros principios activos, como cimetidina, ranitidina, procainamida, quinidina, quinina y nicotina, que utilizan el mismo sistema de transporte catiónico renal que la amantadina, posiblemente también interaccionen con la memantina lo que conlleva un riesgo potencial de aumento de los niveles plasmáticos.
• Cuando se co-administra memantina junto con hidroclorotiazida (HCT) o con cualquier combinación con HCT existe la posibilidad de que se produzca una disminución en los niveles séricos de la HCT.
• En la experiencia post-comercialización, se ha informado de casos aislados de incremento del cociente internacional normalizado (INR), en pacientes tratados concomitantemente con warfarina. Aunque no se ha establecido relación causal, es aconsejable realizar una monitorización estrecha del tiempo de protrombina o INR, en pacientes tratados concomitantemente con anticoagulantes orales.
En estudios farmacocinéticos (FC) a dosis únicas realizados en sujetos jóvenes sanos, no se han observado interacciones relevantes principio activo-principio activo entre memantina y gliburida/metformina o donepezilo.
En un ensayo clínico realizado en sujetos jóvenes sanos, no se han observado efectos relevantes de memantina sobre la farmacocinética de la galantamina.
Memantina no inhibió las isoformas CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, la flavina monooxigenasa, la epóxido hidrolasa o la sulfonación in vitro.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos clínicos sobre la utilización de memantina durante el embarazo. Estudios con animales indican un riesgo potencial de disminución del crecimiento intrauterino con niveles de exposición idénticos o ligeramente más altos que los niveles de exposición en humanos (ver sección 5.3). No se conoce el riesgo potencial para humanos. Memantina no debe utilizarse durante el embarazo excepto que sea considerado claramente necesario.
Lactancia
Se desconoce si memantina se excreta por la leche materna pero, teniendo en cuenta la lipofilia del principio activo, es probable que así sea. Las mujeres que tomen memantina deben suspender la lactancia materna.
Fertilidad
No se notificaron con memantina efectos adversos de fertilidad ni en hombres ni en mujeres.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La enfermedad de Alzheimer de moderada a grave afecta normalmente la capacidad de conducción y compromete la capacidad para utilizar máquinas. Además, Axura presenta una influencia de leve a moderada sobre la capacidad de para conducir y utilizar máquinas, de forma que se debe advertir especialmente a los pacientes ambulatorios para que tomen las precauciones adecuadas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los ensayos clínicos en pacientes con demencia de leve a grave, en los que se incluyeron 1784 pacientes tratados con Axura y 1595 pacientes tratados con placebo, la incidencia global de reacciones adversas con Axura no difirió de la de aquellos tratados con placebo; las reacciones adversas fueron, por lo general, de leves a moderados en gravedad. Las reacciones adversas con mayor frecuencia de aparición que se observaron con una incidencia superior en el grupo de Axura respecto al grupo placebo fueron vértigo (6,3% frente a 5,6%, respectivamente), dolor de cabeza (5,2% frente a 3,9%), estreñimiento (4,6% frente a 2,6%), somnolencia (3,4% frente a 2,2%) e hipertensión (4.1% frente a 2.8%).
Las reacciones adversas enumeradas en la siguiente tabla proceden de los ensayos clínicos realizados con Axura y la experiencia postcomercialización., Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Lista tabulada de reacciones adversas
Las reacciones adversas se categorizan conforme al sistema de clasificación por órganos, usando la siguiente convención: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
|
SISTEMA DE CLASIFICACIÓN POR ÓRGANOS |
FRECUENCIA |
REACCIONES ADVERSAS | |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones fúngicas | |
|
Trastornos del sistema inmunológico |
Frecuentes |
Hipersensibilidad al medicamento | |
|
Trastornos psiquiátricos |
Frecuentes Poco frecuentes Poco frecuentes |
Somnolencia Confusión Alucinaciones1 | |
|
Frecuencia conocida |
no |
Reacciones psicóticas2 | |
|
Trastornos del sistema nervioso |
Frecuentes Frecuentes Poco frecuentes Muy raras |
Vértigo Alteración del equilibrio Alteración de la marcha Convulsiones | |
|
Trastornos cardiacos |
Poco frecuentes |
Insuficiencia cardíaca | |
|
Trastornos vasculares |
Frecuentes Poco frecuentes |
Hipertensión Trombosis venosa/tromboembolismo | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
disnea | |
|
Trastornos gastrointestinales |
Frecuentes Poco frecuentes |
Estreñimiento Vómitos | |
|
Frecuencia conocida |
no |
Pancreatitis2 | |
|
Trastornos hepatobiliares |
Frecuentes |
Pruebas de función hepática elevadas | |
|
Frecuencia |
no |
Hepatitis |
|
conocida | ||
|
Trastornos generales y alteraciones en el lugar |
Frecuentes |
Dolor de cabeza |
|
de administración |
Poco frecuentes |
Fatiga |
'Las alucinaciones se han observado principalmente en pacientes con enfermedad de Alzheimer grave. 2
Se han notificado casos aislados en la experiencia post-comercialización.
La enfermedad de Alzheimer ha sido asociada con depresión, ideación suicida y suicidio. En la experiencia post-comercialización, se ha notificado la aparición de éstos acontecimientos en pacientes tratados con Axura.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Solo se dispone de experiencia limitada en casos de sobredosis de los ensayos clínicos y de la experiencia post-comercialización.
Síntomas: Sobredosis relativamente altas (200 mg y 105 mg/día durante 3 días respectivamente) se han asociado únicamente con síntomas como cansancio, debilidad y/o diarrea. o han sido asintomáticas. En casos de sobredosis por debajo de 140 mg o dosis no conocida aparecieron en los pacientes síntomas a nivel del sistema nervioso central (confusión, adormecimiento, somnolencia, vértigo, agitación, agresividad, alucinaciones y alteraciones de la marcha) y/o de origen gastrointestinal (vómitos y diarreas).
En el caso más extremo de sobredosis, el paciente sobrevivió a la ingesta oral de un total de 2000 mg de memantina con efectos a nivel del sistema nervioso central (coma durante 10 días, y posterior diplopía y agitación). El paciente recibió tratamiento sintomático y plasmaféresis, recuperándose sin secuelas permanentes.
En otro caso de sobredosis grave, el paciente también sobrevivió y se recuperó. Dicho paciente había recibido 400 mg de memantina por vía oral, y experimentó síntomas a nivel del sistema nervioso central tales como inquietud, psicosis, alucinaciones visuales, proconvulsividad, somnolencia, estupor e inconsciencia.
Tratamiento: En caso de sobredosis, el tratamiento debe ser sintomático. No existe antídoto específico para la intoxicación o sobredosis. Se deben utilizar procedimientos clínicos estándar para la eliminación del principio activo de forma apropiada, por ej.: lavado gástrico, carbón activado (interrupción de la recirculación enterohepática potencial), acidificación de la orina, diuresis forzada.
En caso de aparición de signos y síntomas de sobrestimulación general del sistema nervioso central (SNC), se debe considerar llevar a cabo un tratamiento clínico sintomático cuidadoso.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros fármacos anti-demencia, código ATC: N06DX01.
Existe una evidencia cada vez más clara de que el mal funcionamiento de la neurotransmisión glutamatérgica, en particular en los receptores NMDA, contribuye tanto a la expresión de los síntomas como a la progresión de la enfermedad hacia demencia neurodegenerativa.
Memantina es un antagonista no competitivo de los receptores NMDA, de afinidad moderada y voltaje dependiente. Modula los efectos de los niveles tónicos de glutamato elevados patológicamente que pueden ocasionar disfunción neuronal.
Ensayos clínicos
Un ensayo pivotal de monoterapia en pacientes que padecían enfermedad de Alzheimer de moderada a grave (puntuación total en el miniexamen cognoscitivo (MMSE, mini mental state examination) al inicio del estudio 3 - 14) incluyó un total de 252 pacientes. El estudio mostró los efectos beneficiosos del tratamiento con memantina respecto al tratamiento con placebo después de 6 meses (análisis de casos observados para el estudio CIBIC-plus (siglas en inglés que corresponden a la escala de impresión de cambio basada en la entrevista del médico mas los comentarios del cuidador): p=0,025; ADCS-ADLsev (siglas en inglés que corresponden al estudio cooperativo de la enfermedad de Alzheimer - actividades de la vida diaria): p=0,003; SIB (siglas en inglés que corresponden a la batería de deterioro grave): p=0,002).
Un estudio pivotal de memantina en monoterapia en el tratamiento de la enfermedad de Alzheimer de leve a moderada (puntuación total MMSE al inicio del estudio de 10 a 22) incluyó a 403 pacientes.
Los pacientes tratados con memantina mostraron un efecto superior a placebo estadísticamente significativo, en las variables principales: ADAS-cog (siglas en inglés que corresponden a la escala de evaluación de la enfermedad de Alzheimer-subescala cognitiva) (p=0,003) y CIBIC-plus (p=0,004) en la semana 24 LOCF (siglas en inglés que corresponden al método de arrastre de la última observación realizada). En otro ensayo de monoterapia en enfermedad de Alzheimer de leve a moderada se aleatorizaron un total de 470 pacientes (puntuación total MMSE al inicio del estudio de 11 - 23). En el análisis primario definido prospectivamente no se encontró diferencia estadísticamente significativa en las variables primarias de eficacia en la semana 24.
Un meta-análisis de los pacientes con enfermedad de Alzheimer de moderada a grave (puntuación total MMSE < 20) de seis estudios en fase III, controlados con placebo en estudios a 6 meses (incluyendo estudios de monoterapia y estudios con pacientes con una dosis estable de un inhibidor de la acetilcolinesterasa), mostró que había un efecto estadísticamente significativo a favor del tratamiento con memantina en las áreas cognitiva, global y funcional. Cuando los pacientes fueron identificados con un empeoramiento conjunto en las tres áreas, los resultados mostraron un efecto estadísticamente significativo de memantina en la prevención del empeoramiento, el doble de los pacientes tratados con placebo en comparación con los pacientes tratados con memantina mostraron empeoramiento en las tres áreas (21% frente 11%, p<0,0001).
5.2 Propiedades farmacocinéticas
Absorción: Memantina tiene una biodisponibilidad absoluta de aproximadamente el 100%. La t^ está entre 3 y 8 horas. No hay indicios de la influencia de alimentos en la absorción de memantina.
Distribución: Las dosis diarias de 20 mg producen concentraciones plasmáticas constantes de memantina que oscilan entre 70 y 150 ng/ml (0,5 - 1 pmol) con importantes variaciones interindividuales. Cuando se administraron dosis diarias de 5 a 30 mg, se obtuvo un índice medio de líquido cefalorraquídeo (LCR)/suero de 0,52. El volumen de distribución es de aproximadamente 10 l/kg. Alrededor del 45% de memantina se une a proteínas plasmáticas.
Biotransformación: En el hombre, aproximadamente el 80% del material circulante relacionado con memantina está presente como compuesto inalterado. Los principales metabolitos en humanos son N-3,5-dimetil-gludantano, la mezcla isomérica de 4- y 6-hidroxi-memantina y 1-nitroso-3,5-dimetil-adamantano. Ninguno de estos metabolitos muestra actividad antagonista NMDA. No se ha detectado in vitro metabolismo catalizado por citocromo P 450.
En un estudio con 14C-memantina administrado vía oral, se recuperó una media del 84% de la dosis dentro de los 20 días, excretándose más del 99% por vía renal.
Eliminación: Memantina se elimina de manera monoexponencial con una t/2 terminal de 60 a 100 horas. En voluntarios con función renal normal, el aclaramiento total (Cltot) asciende a 170 ml/min/1,73 m2 y parte del aclaramiento total renal se logra por secreción tubular.
La función renal también incluye la reabsorción tubular, probablemente mediada por proteínas transportadoras de cationes. La tasa de eliminación renal de la memantina en condiciones de orina alcalina puede reducirse en un factor entre 7 y 9 (ver sección 4.4). La alcalinización de la orina se puede producir por cambios drásticos en la dieta, por ejemplo, de carnívora a vegetariana, o por una ingesta masiva de tampones gástricos alcalinizantes.
Linealidad: Los estudios en voluntarios han demostrado una farmacocinética lineal en el intervalo de dosis de 10 a 40 mg.
Relación farmacocinética/farmacodinámica: A una dosis de memantina de 20 mg al día los niveles en LCR concuerdan con el valor ki (ki = constante de inhibición) de memantina, que es de 0,5 pmol en la corteza frontal humana.
5.3 Datos preclínicos sobre seguridad
En estudios a corto plazo en ratas, memantina, al igual que otros antagonistas del NMDA, indujo vacuolización neuronal y necrosis (lesiones de Olney) únicamente tras dosis que producían picos muy altos de concentraciones séricas. La ataxia y otros signos preclínicos precedieron a la vacuolización y a la necrosis. Como estos efectos no se observaron en roedores ni en no roedores en estudios a largo plazo, se desconoce la importancia clínica de estos hallazgos.
Se observaron cambios oculares en estudios de toxicidad de dosis repetidas en roedores y perros, pero no en monos. Los exámenes específicos oftalmoscópicos realizados en estudios clínicos con memantina no revelaron cambios oculares.
En roedores se observó fosfolipidosis en macrófagos pulmonares producido por la acumulación de memantina en lisosomas. Este efecto se ha observado en otros principios activos con propiedades anfifílicas catiónicas. Existe una posible relación entre esta acumulación y la vacuolización observada en los pulmones. Este efecto se observó solamente en roedores a dosis altas. Se desconoce la importancia clínica de estos hallazgos.
No se observó genotoxicidad en los ensayos estándar realizados con memantina. No hubo evidencias de carcinogenicidad en los estudios en ratones y ratas hasta su muerte. Memantina no resultó teratogénica ni en ratas ni en conejos, incluso a dosis tóxicas para la madre y no se observó ningún efecto adverso de memantina sobre la fertilidad. En ratas, se observó una reducción del crecimiento fetal a niveles de exposición idénticos o ligeramente más altos que los niveles de exposición humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido:
Celulosa microcristalina Croscarmelosa sódica Sílice coloidal anhidra Estearato de magnesio
Cubierta del comprimido: Hipromelosa
Macrogol 400 Dióxido de titanio (E 171)
Óxido de hierro amarillo (E 172)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
4 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Los envases de blisters contienen 7, 10, 14 ó 20 comprimidos por cada tira de blister (Alu/PP). Los envases se presentan en tamaños de 14, 28, 30, 42, 50, 56, 98, 100, 112 y envase múltiple con 840 (20 x 42), 980 (10 x 98) ,1000 (20 x 50) comprimidos.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/001
EU/1/02/218/002
EU/1/02/218/003
EU/1/02/218/007
EU/1/02/218/008
EU/1/02/218/009
EU/1/02/218/010
EU/1/02/218/012
EU/1/02/218/013
EU/1/02/218/014
EU/1/02/218/015
EU/1/02/218/030
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 17 mayo 2002
Fecha de la última renovación: 17 mayo 2007
10. FECHA DE LA REVISIÓN DEL TEXTO
MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Axura 5 mg/pulsación, solución oral
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada pulsación del dosificador (una pulsación) libera 0,5 ml de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
Excipientes: Cada mililitro de solución contiene 100 mg de sorbitol E 420 y 0,5 mg potasio, ver sección 4.4.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución oral.
La solución es transparente y de incolora a ligeramente amarillenta.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
4.2 Posología y forma de administración Posología
El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el diagnóstico y tratamiento de la demencia de Alzheimer. El tratamiento se debe iniciar únicamente si se dispone de un cuidador que monitorice regularmente la toma del fármaco por parte del paciente. Se debe realizar el diagnóstico siguiendo las directrices actuales. La tolerabilidad y la dosis de memantina deben reevaluarse de forma regular, preferiblemente dentro de los 3 meses posteriores al inicio del tratamiento. Por lo tanto el beneficio clínico de memantina y la tolerancia del paciente al tratamiento deben reevaluarse de forma regular de acuerdo a las directrices clínicas vigentes. El tratamiento de mantenimiento puede continuarse mientras el beneficio terapéutico sea favorable y el paciente tolere el tratamiento con memantina. La discontinuación de memantina debería considerarse cuando ya no se evidencie su efecto terapéutico o si el paciente no tolera el tratamiento.
Adultos:
Escalado de dosis:
La dosis máxima diaria es de 20 mg una vez al día. Para reducir el riesgo de efectos adversos, esta dosis de mantenimiento debe alcanzarse mediante un escalado de dosis durante las 3 primeras semanas de tratamiento en el que se incremente 5 mg por semana de la siguiente forma:
Semana 1 (día 1-7):
El paciente debe tomar 0,5 ml de solución (5 mg), equivalente a una pulsación al día durante 7 días. Semana 2 (día 8-14):
El paciente debe tomar 1 ml de solución (10 mg), equivalente a dos pulsaciones al día durante 7 días. Semana 3 (día 15-21):
El paciente debe tomar 1,5 ml de solución (15 mg), equivalente a tres pulsaciones al día durante 7 días. A partir de la semana 4:
El paciente debe tomar 2 ml de solución (20 mg), equivalente a cuatro pulsaciones una vez al día. Dosis de mantenimiento:
La dosis recomendada de mantenimiento es de 20 mg (2 ml de solución, equivalente a cuatro pulsaciones) al día.
Pacientes de edad avanzada: Basándose en estudios clínicos, la dosis recomendada para los pacientes mayores de 65 años es de 20 mg al día (2 ml de solución, equivalente a cuatro pulsaciones), tal como se ha descrito anteriormente.
Insuficiencia renal: En pacientes con función renal levemente afectada (aclaramiento de creatinina 50-80 ml/min.), no es necesario ajustar la dosis. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina de 30-49 ml/min, la dosis diaria debe ser de 10 mg (1 ml de solución, equivalente a dos pulsaciones). Si se tolera bien después de, al menos 7 días de tratamiento, la dosis podría aumentarse hasta 20 mg/día de acuerdo con el esquema de titulación estándar. En pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5-29 ml/min.) la dosis diaria debe ser de 10 mg (1 ml de solución, equivalente a dos pulsaciones) al día.
Insuficiencia hepática: En pacientes con insuficiencia hepática leve o moderada (Child-Pugh A y Child-Pugh B) no es necesario ajustar la dosis. No existen datos disponibles sobre el uso de memantina en pacientes con insuficiencia hepática grave. No se recomienda la administración de Axura a pacientes con insuficiencia hepática.
Niños y adolescentes: No se recomienda el uso de Axura en niños menores de 18 años debido a una falta de datos de seguridad y eficacia.
Forma de administración
Axura debe tomarse una vez al día, a la misma hora cada día. La solución puede tomarse con o sin alimentos. La solución no debe verterse o administrarse dentro de la boca directamente desde el frasco o el dosificador, debe colocarse en una cuchara o dentro de un vaso de agua usando el dosificador.
Para instrucciones detalladas sobre la preparación y el manejo del producto, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda precaución en el tratamiento de pacientes con epilepsia, antecedentes de crisis convulsivas o en pacientes con factores de riesgo para padecer epilepsia.
Se debe evitar la administración concomitante de otros antagonistas de N-metil-D-aspartato (NMDA) como la amantadina, la ketamina y el dextrometorfano. Estos compuestos actúan sobre el mismo sistema receptor que memantina y, por lo tanto, las reacciones adversas (principalmente relacionadas con el sistema nervioso central [SNC]) pueden ser más frecuentes o más intensas (ver sección 4.5).
Todos aquellos factores que aumenten el pH urinario (ver sección 5.2 “Eliminación”) pueden requerir una monitorización rigurosa del paciente. Entre estos factores se incluyen cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o una ingesta masiva de tampones gástricos alcalinizantes. Asimismo, el pH urinario puede estar elevado en estados de acidosis tubular renal (ATR) o infecciones graves del tracto urinario por bacterias del género Proteus.
En la mayoría de los ensayos clínicos, se excluyeron aquellos pacientes con antecedentes de infarto de miocardio reciente, enfermedad cardíaca congestiva (NYHA III-IV) o hipertensión no controlada. Como consecuencia, los datos en éstos pacientes son limitados y los pacientes que presentan estas condiciones deben supervisarse cuidadosamente.
Excipientes: La solución oral contiene sorbitol. Los pacientes con intolerancia hereditaria a la fructosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Debido a los efectos farmacológicos y al mecanismo de acción de la memantina, pueden producirse las siguientes interacciones:
• El mecanismo de acción sugiere que los efectos de la L-dopa, los agonistas dopaminérgicos y los anticolinérgicos pueden aumentar con el tratamiento concomitante de antagonistas del NMDA como memantina. Se pueden reducir los efectos de los barbitúricos y de los neurolépticos. La administración concomitante de memantina y agentes antiespasmódicos, como el dantroleno o el baclofeno, puede modificar sus efectos y hacer necesario un ajuste de la dosis.
• Se debe evitar el uso concomitante de memantina y amantadina, por el riesgo de psicosis farmacotóxica. Los dos compuestos están químicamente relacionados con los antagonistas del NMDA. Esto mismo podría aplicarse para la ketamina y el dextrometorfano (ver sección 4.4). también hay un caso clínico publicado sobre el posible riesgo de la combinación de memantina y fenitoína.
• Otros principios activos, como cimetidina, ranitidina, procainamida, quinidina, quinina y nicotina, que utilizan el mismo sistema de transporte catiónico renal que la amantadina, posiblemente también interaccionen con la memantina lo que conlleva un riesgo potencial de aumento de los niveles plasmáticos.
• Cuando se co-administra memantina junto con hidroclorotiazida (HCT) o con cualquier combinación con HCT existe la posibilidad de que se produzca una disminución en los niveles séricos de la HCT.
• En la experiencia post-comercialización, se ha informado de casos aislados de incremento del cociente internacional normalizado (INR), en pacientes tratados concomitantemente con warfarina. Aunque no se ha establecido relación causal, es aconsejable realizar una monitorización estrecha del tiempo de protrombina o INR, en pacientes tratados concomitantemente con anticoagulantes orales.
En estudios farmacocinéticos (FC) a dosis únicas realizados en sujetos jóvenes sanos, no se han observado interacciones relevantes fármaco-fármaco entre memantina y gliburida/metformina o donepezilo.
En un ensayo clínico realizado en sujetos jóvenes sanos, no se han observado efectos relevantes de memantina sobre la farmacocinética de la galantamina.
Memantina no inhibió las isoformas CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, la flavina monooxigenasa, la epóxido hidrolasa o la sulfonación in vitro.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos clínicos sobre la utilización de memantina durante el embarazo. Estudios con animales indican un riesgo potencial de disminución del crecimiento intrauterino con niveles de exposición idénticos o ligeramente más altos que los niveles de exposición en humanos (ver sección 5.3). No se conoce el riesgo potencial para humanos. Memantina no debe utilizarse durante el embarazo excepto que sea considerado claramente necesario.
Lactacia
Se desconoce si memantina se excreta por la leche materna pero, teniendo en cuenta la lipofilia del principio activo, es probable que así sea. Las mujeres que tomen memantina deben suspender la lactancia materna.
Fertilidad
No se notificaron con memantina efectos adversos de fertilidad ni en hombres ni en mujeres.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La enfermedad de Alzheimer de moderada a grave afecta normalmente la capacidad de conducción y compromete la capacidad para utilizar máquinas. Además, Axura presenta una influencia de leve a moderada sobre la capacidad de para conducir y utilizar máquinas, de forma que se debe advertir especialmente a los pacientes ambulatorios para que tomen las precauciones adecuadas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los ensayos clínicos en pacientes con demencia de leve a grave, en los que se incluyeron 1784 pacientes tratados con Axura y 1595 pacientes tratados con placebo, la incidencia global de reacciones adversas con Axura no difirió de la de aquellos tratados con placebo; las reacciones adversas fueron, por lo general, de leves a moderadas en gravedad. Las reacciones adversas con mayor frecuencia de aparición que se observaron con una incidencia superior en el grupo de Axura respecto al grupo placebo fueron vértigo (6,3% frente a 5,6%, respectivamente), dolor de cabeza (5,2% frente a 3,9%), estreñimiento (4,6% frente a 2,6%), somnolencia (3,4% frente a 2,2%) e hipertensión (4.1% frente a 2.8%).
Las reacciones adversas al medicamento enumeradas en la siguiente tabla proceden de los ensayos clínicos realizados con Axura y la experiencia postcomercialización. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Lista tabulada de reacciones adversas Las reacciones adversas se categorizan conforme al sistema de clasificación por órganos, usando la siguiente convención: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
SISTEMA DE CLASIFICACIÓN POR ÓRGANOS |
FRECUENCIA |
REACCIONES ADVERSAS |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones fúngicas |
|
Trastornos del sistema inmunológico |
Frecuentes |
Hipersensibilidad al medicamento |
|
Trastornos psiquiátricos |
Frecuentes |
Somnolencia |
|
Poco frecuentes |
Confusión | |
|
Poco frecuentes |
Alucinaciones1 | |
|
Frecuencia no conocida |
Reacciones psicóticas2 | |
|
Trastornos del sistema nervioso |
Frecuentes |
Vértigo |
|
Frecuentes Poco frecuentes |
Alteración del equilibrio Alteración de la marcha | |
|
Muy raras |
Convulsiones | |
|
Trastornos cardiacos |
Poco frecuentes |
Insuficiencia cardíaca |
|
Trastornos vasculares |
Frecuentes |
Hipertensión |
|
Poco frecuentes |
Trombosis venosa/tromboembolismo | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
Disnea |
|
Trastornos gastrointestinales |
Frecuentes |
Estreñimiento |
|
Poco frecuentes |
Vómitos | |
|
Frecuencia no conocida |
Pancreatitis2 | |
|
Trastornos hepatobiliares |
Frecuentes |
Pruebas de función hepática elevadas |
|
Frecuencia no conocida |
Hepatitis | |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuentes |
Dolor de cabeza |
|
Poco frecuentes |
Fatiga |
'Las alucinaciones se han observado principalmente en pacientes con enfermedad de Alzheimer grave. 2Se han notificado casos aislados en la experiencia post-comercialización.
La enfermedad de Alzheimer ha sido asociada con depresión, ideación suicida y suicidio. En la experiencia post-comercialización, se ha notificado la aparición de éstos acontecimientos en pacientes tratados con Axura.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Solo se dispone de experiencia limitada en casos de sobredosis de los ensayos clínicos y de la experiencia post-comercialización.
Síntomas: Sobredosis relativamente altas (200 mg y 105 mg/día durante 3 días respectivamente) se han asociado únicamente con síntomas como cansancio, debilidad y/o diarrea o han sido asintomáticas. En casos de sobredosis por debajo de 140 mg o dosis no conocida aparecieron en los pacientes síntomas a nivel del sistema nervioso central (confusión, adormecimiento, somnolencia, vértigo, agitación, agresividad, alucinaciones y alteraciones de la marcha) y/o de origen gastrointestinal (vómitos y diarrea).
En el caso más extremo de sobredosis, el paciente sobrevivió a la ingesta oral de un total de 2000 mg de memantina con efectos a nivel del sistema nervioso central (coma durante 10 días, y posterior diplopía y agitación). El paciente recibió tratamiento sintomático y plasmaféresis, recuperándose sin secuelas permanentes.
En otro caso de sobredosis grave, el paciente también sobrevivió y se recuperó. Dicho paciente había recibido 400 mg de memantina por vía oral, y experimentó síntomas a nivel del sistema nervioso central tales como inquietud, psicosis, alucinaciones visuales, proconvulsividad, somnolencia, estupor e inconsciencia.
Tratamiento: En caso de sobredosis, el tratamiento debe ser sintomático. No existe antídoto específico para la intoxicación o sobredosis. Se deben utilizar procedimientos estándar clínicos para la extracción del principio activo de forma apropiada, por ej.: lavado gástrico, carbón activado (interrupción de la recirculación enterohepática potencial), acidificación de la orina, diuresis forzada.
En caso de aparición de signos y síntomas de sobrestimulación general del sistema nervioso central (SNC), se debe considerar llevar a cabo un tratamiento clínico sintomático cuidadoso.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros fármacos anti-demencia, código ATC: N06DX01.
Existe una evidencia cada vez más clara de que el mal funcionamiento de la neurotransmisión glutamatérgica, en particular en los receptores NMDA, contribuye tanto a la expresión de los síntomas como a la progresión de la enfermedad hacia demencia neurodegenerativa.
Memantina es un antagonista no competitivo de los receptores NMDA, de afinidad moderada y voltaje dependiente. Modula los efectos de los niveles tónicos de glutamato elevados patológicamente que pueden ocasionar disfunción neuronal.
Ensayos clínicos: Un ensayo pivotal de monoterapia en pacientes que padecían enfermedad de Alzheimer de moderada a grave (puntuación total en el miniexamen cognoscitivo (MMSE, mini mental state examination) al inicio del estudio 3-14) incluyó un total de 252 pacientes. El estudio mostró los efectos beneficiosos del tratamiento con memantina respecto al tratamiento con placebo después de 6 meses (análisis de casos observados para el estudio CIBIC-plus (siglas en inglés que corresponden a la escala de impresión de cambio basada en la entrevista del médico más los comentarios del cuidador): p=0,025; ADCS-ADLsev (siglas en inglés que corresponden al estudio cooperativo de la enfermedad de Alzheimer - actividades de la vida diaria): p=0,003; SIB (siglas en inglés que corresponden a la batería de deterioro grave): p=0,002).
Un estudio pivotal de memantina en monoterapia en el tratamiento de la enfermedad de Alzheimer de leve a moderada (puntuación total MMSE al inicio del estudio de 10 a 22) incluyó a 403 pacientes.
Los pacientes tratados con memantina mostraron un efecto superior a placebo estadísticamente significativo, en las variables principales: ADAS-cog (siglas en inglés que corresponden a la parte cognitiva de la escala de valoración de Alzheimer-subescala cognitiva) (p=0,003) y CIBIC-plus (p=0,004) en la semana 24 LOCF (siglas en inglés que corresponden al método de arrastre de la última observación realizada). En otro ensayo de monoterapia en enfermedad de Alzheimer de leve a moderada se aleatorizaron un total de 470 pacientes (puntuación total MMSE al inicio del estudio de 11-23). En el análisis primario definido prospectivamente no se encontró diferencia estadísticamente significativa en las variables primarias de eficacia en la semana 24.
Un meta-análisis de los pacientes con enfermedad de Alzheimer de moderada a grave (puntuación total MMSE <20) de seis estudios en fase III, controlados con placebo en estudios a 6 meses (incluyendo estudios de monoterapia y estudios con pacientes con una dosis estable de un inhibidor de la acetilcolinesterasa), mostró que había un efecto estadísticamente significativo a favor del tratamiento con memantina en las áreas cognitiva, global y funcional. Cuando los pacientes fueron identificados con un empeoramiento conjunto en las tres áreas, los resultados mostraron un efecto estadísticamente significativo de memantina en la prevención del empeoramiento, el doble de los pacientes tratados con placebo en comparación con los pacientes tratados con memantina mostraron empeoramiento en las tres áreas (21% frente 11%, p<0,0001).
5.2 Propiedades farmacocinéticas
Absorción: Memantina tiene una biodisponibilidad absoluta de aproximadamente el 100%. La tmáx está entre 3 y 8 horas. No hay indicios de la influencia de alimentos en la absorción de memantina.
Distribución: Las dosis diarias de 20 mg producen concentraciones plasmáticas constantes de memantina que oscilan entre 70 y 150 ng/ml (0,5-1 pmol) con importantes variaciones interindividuales. Cuando se administraron dosis diarias de 5 a 30 mg, se obtuvo un índice medio de líquido cefalorraquídeo (LCR)/suero de 0,52. El volumen de distribución es de aproximadamente 10 l/kg. Alrededor del 45% de memantina se une a proteínas plasmáticas.
Biotransformación: En el hombre, aproximadamente el 80% del material circulante relacionado con memantina está presente como compuesto inalterado. Los principales metabolitos en humanos son N-3,5-dimetil-gludantano, la mezcla isomérica de 4- y 6-hidroxi-memantina y 1-nitroso-3,5-dimetil-adamantano. Ninguno de estos metabolitos muestra actividad antagonista NMDA. No se ha detectado in vitro metabolismo catalizado por citocromo P 450.
En un estudio con 14C-memantina administrado vía oral, se recuperó una media del 84% de la dosis dentro de los 20 días, excretándose más del 99% por vía renal.
Eliminación: Memantina se elimina de manera monoexponencial con una t./2 terminal de 60 a 100 horas. En voluntarios con función renal normal, el aclaramiento total (Cltot) asciende a 170 ml/min/1,73 m2 y parte del aclaramiento total renal se logra por secreción tubular.
La función renal también incluye la reabsorción tubular, probablemente mediada por proteínas transportadoras de cationes. La tasa de eliminación renal de la memantina en condiciones de orina alcalina puede reducirse en un factor entre 7 y 9 (ver sección 4.4). La alcalinización de la orina se puede producir por cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o por una ingesta masiva de tampones gástricos alcalinizantes.
Linealidad: Los estudios en voluntarios han demostrado una farmacocinética lineal en el intervalo de dosis de 10 a 40 mg.
Relación farmacocinética/farmacodinámica: A una dosis de memantina de 20 mg al día los niveles en LCR concuerdan con el valor ki (ki = constante de inhibición) de memantina, que es de 0,5 pmol en la corteza frontal humana.
5.3 Datos preclínicos sobre seguridad
En estudios a corto plazo en ratas, memantina al igual que otros antagonistas del NMDA indujo vacuolización neuronal y necrosis (lesiones de Olney) únicamente tras dosis que producían picos muy altos de concentraciones séricas. La ataxia y otros signos preclínicos precedieron a la vacuolización y a la necrosis. Como estos efectos no se observaron en roedores ni en no roedores en estudios a largo plazo, se desconoce la importancia clínica de estos hallazgos.
Se observaron cambios oculares en estudios de toxicidad de dosis repetidas en roedores y perros, pero no en monos. Los exámenes específicos oftalmoscópicos realizados en estudios clínicos con memantina no revelaron cambios oculares.
En roedores se observó fosfolipidosis en macrófagos pulmonares producido por la acumulación de memantina en lisosomas. Este efecto se ha observado en otros principios activos con propiedades anfifílicas catiónicas. Existe una posible relación entre esta acumulación y la vacuolización observada en los pulmones. Este efecto se observó solamente en roedores a dosis altas. Se desconoce la importancia clínica de estos hallazgos.
No se observó genotoxicidad en los ensayos estándar realizados con memantina. No hubo evidencias de carcinogenicidad en los estudios en ratones y ratas hasta su muerte. Memantina no resultó teratogénica ni en ratas ni en conejos, incluso a dosis tóxicas para la madre y no se observó ningún efecto adverso de memantina sobre la fertilidad. En ratas, se observó una reducción del crecimiento fetal a niveles de exposición idénticos o ligeramente más altos que los niveles de exposición humana.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Sorbato potásico Sorbitol E 420 Agua purificada
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
4 años.
Una vez abierto, el contenido del frasco debe ser utilizado en 3 meses.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
El frasco con el dosificador montado debe guardarse y transportarse únicamente en posición vertical.
6.5 Naturaleza y contenido del envase
Frascos de vidrio de color ámbar (Hidrolítico de Clase III) que contienen 50, 100 ml ó envase múltiple con 500ml (10 x 50 ml) de solución.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
Antes del primer uso, el dosificador debe enroscarse en el frasco. Para sacar el tapón de rosca del frasco debe girarse en el sentido contrario a las agujas del reloj y desenroscarse completamente (fig.l).
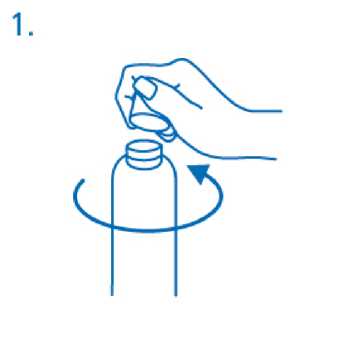
Montaje del dosificador en el frasco:
El dosificador debe sacarse de la bolsa de plástico (fig.2) y colocarse encima del frasco, introduciendo hacia abajo el tubo de plástico dentro del frasco con cuidado. El dosificador debe mantenerse en el cuello del frasco y girarse en el sentido de las agujas del reloj hasta que esté unido firmemente (fig.3). Para el uso deseado, el dosificador solo debe enroscarse una vez al iniciar el uso y nunca debe desenroscarse.
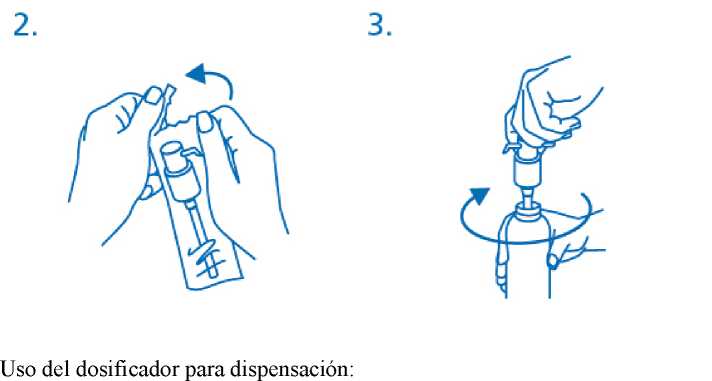
El cabezal del dosifícador tiene dos posiciones y se gira fácilmente - dirección contraria al sentido de las agujas del reloj (posición abierta) y dirección en el sentido de las agujas del reloj (posición cerrada). El cabezal del dosificador no debe pulsarse mientras esté en la posición cerrada. La solución debe dispensarse por tanto en la posición abierta. Para ello, el cabezal del dosificador debe girarse un octavo de giro en la dirección que indica la flecha, hasta encontrar resistencia (fig.4).
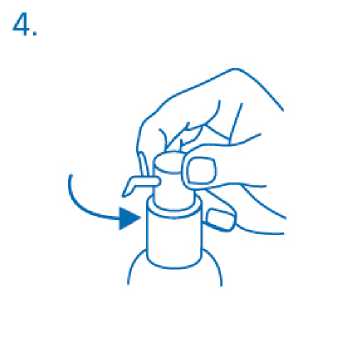
El dosificador está entonces listo para su uso.
Preparación del dosificador:
Cuando se utiliza por primera vez, el dosificador no dispensa la cantidad correcta de solución oral. Por tanto debe prepararse (cebarse) pulsando el cabezal del dosificador hacia abajo completamente durante cinco veces sucesivas (fig.5).
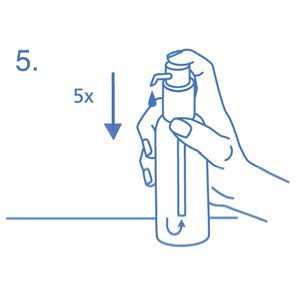
La solución así dispensada debe desecharse. La siguiente vez que el cabezal del dosificador se pulsa hacia abajo completamente (equivalente a una pulsación), ya dispensa la dosis correcta (1 pulsación es equivalente a 0,5 ml de solución oral y contiene alrededor de 5 mg del principio activo clorhidrato de memantina; fig.6).
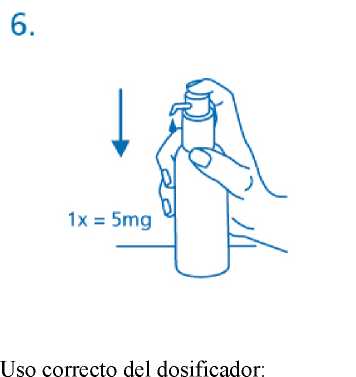
El frasco debe colocarse en una superficie plana, horizontal, por ejemplo encima de una mesa, y solo debe usarse en posición vertical. Debe colocarse un vaso con un poco de agua o una cuchara debajo de la boquilla y el cabezal del dosificador debe pulsarse hacia abajo firmemente pero tranquilamente y de forma sostenida (no demasiado despacio) hasta el final (fig.7, fig.8).
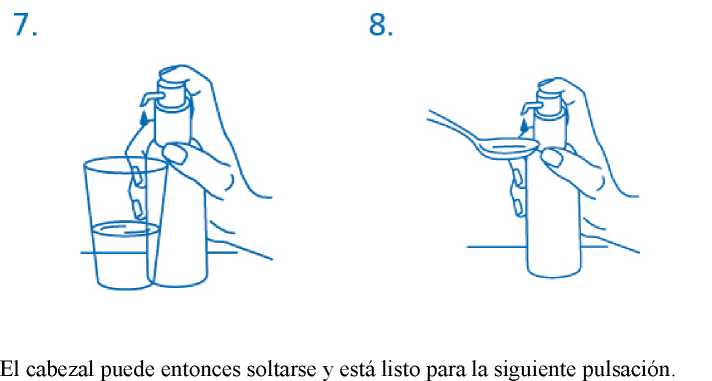
El dosificador debe usarse únicamente con solución de clorhidrato de memantina en el frasco proporcionado, no para otros productos o envases. Si el dosificador no funciona correctamente como se describe durante su uso y de acuerdo a las instrucciones, el paciente debería consultar a su médico o a un farmacéutico. El dosificador debe cerrarse después de su uso.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/005
EU/1/02/218/006
EU/1/02/218/011
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 17 mayo 2002 Fecha de la última renovación: 17 mayo 2007
10. FECHA DE LA REVISIÓN DEL TEXTO
{MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
NOMBRE DEL MEDICAMENTO
1.
Axura 5 mg comprimidos recubiertos con película. Axura 10 mg comprimidos recubiertos con película. Axura 15 mg comprimidos recubiertos con película. Axura 20 mg comprimidos recubiertos con película.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 5 mg de clorhidrato de memantina, que equivalen a 4,15 mg de memantina.
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
Cada comprimido recubierto con película contiene 15 mg de clorhidrato de memantina, que equivalen a 12,46 mg de memantina.
Cada comprimido recubierto con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina
Para consultar la lista completa de excipientes, ver la sección 6.1.
3. FORMA FARMACÉUTICA
Comprimidos recubiertos con película
Los comprimidos recubiertos con película de 5 mg tienen un color de blanco a blanquecino y son alargados y fusiformes con el número “5” impreso en una cara y “MEM” en la otra.
Los comprimidos recubiertos con película de 10 mg tienen un color de amarillo pálido a amarillo, forma ovalada con una línea de rotura con grabado “1 0” en una cara y “M M” en la otra cara.
El comprimido se puede dividir en mitades iguales.
Los comprimidos recubiertos con película de 15 mg tienen un color de naranja pálido a naranja grisáceo, son fusiformes y presentan el número “15” impreso en una cara y “MEM” en la otra.
Los comprimidos recubiertos con película de 20 mg tienen un color de rojo pálido a rojo grisáceo y son fusiformes con el número “20” impreso en una cara y “MEM” en la otra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
4.2 Posología y forma de administración Posología
El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el diagnóstico y tratamiento de la demencia de Alzheimer. El tratamiento se debe iniciar únicamente si se dispone de un cuidador que monitorice regularmente la toma del fármaco por parte del paciente. Se debe realizar el diagnóstico siguiendo las directrices actuales. La tolerabilidad y la dosis de memantina deben reevaluarse de forma regular, preferiblemente dentro de los 3 meses posteriores al inicio del tratamiento. Por lo tanto el beneficio clínico de memantina y la tolerancia del paciente al tratamiento deben reevaluarse de forma regular de acuerdo a las directrices clínicas vigentes. El tratamiento de mantenimiento puede continuarse mientras el beneficio terapéutico sea favorable y el paciente tolere el tratamiento con memantina. La discontinuación de memantina debería considerarse cuando ya no se evidencie su efecto terapéutico o si el paciente no tolera el tratamiento.
Adultos:
Escalado de dosis La dosis recomendada de inicio es de 5 mg al día que se incrementa de forma gradual durante las primeras 4 semanas de tratamiento alcanzando la dosis recomendada de mantenimiento de la siguiente manera:
Semana 1 (día 1-7):
El paciente debe tomar un comprimido recubierto con película de 5 mg al día (de blanco a blanquecino, alargado y fusiforme) durante 7 días.
Semana 2 (día 8-14):
El paciente debe tomar un comprimido recubierto con película de 10 mg al día (de amarillo pálido a amarillo, forma ovalada) durante 7 días.
Semana 3 (día 15-21):
El paciente debe tomar un comprimido recubierto con película de 15 mg al día (de naranja pálido a naranja grisáceo, fusiformes) durante 7 días.
Semana 4 (día 22-28):
El paciente debe tomar un comprimido recubierto con película de 20 mg al día (de rojo pálido a rojo grisáceo, fusiforme) durante 7 días.
Dosis de mantenimiento
La dosis recomendada de mantenimiento es de 20 mg al día.
Pacientes de edad avanzada: Basándose en estudios clínicos, la dosis recomendada para los pacientes mayores de 65 años es de 20 mg al día (20 mg una vez al día), tal como se ha descrito anteriormente.
Insuficiencia renal: En pacientes con función renal levemente afectada (aclaramiento de creatinina de 50 - 80 ml/min), no es necesario ajustar la dosis. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina de 30 - 49 ml/min), la dosis diaria debe ser de10 mg al día. Si se tolera bien después de, al menos 7 días de tratamiento, la dosis podría aumentarse hasta 20 mg/día de acuerdo con el esquema de titulación estándar. En pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5-29 ml/min.) la dosis diaria debe ser de 10 mg al día.
Insuficiencia hepática: En pacientes con insuficiencia hepática leve o moderada (Child-Pugh A y Child-Pugh B) no es necesario ajustar la dosis. No existen datos disponibles sobre el uso de memantina en pacientes con insuficiencia hepática grave. No se recomienda la administración de Axura a pacientes con insuficiencia hepática.
Niños y adolescentes: No se recomienda el uso de Axura en niños menores de 18 años debido a una falta de datos de seguridad y eficacia.
Forma de administración
Axura debe administrarse una vez al día, siempre a la misma hora. Los comprimidos recubiertos con película pueden tomarse con o sin alimentos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda precaución en el tratamiento de pacientes con epilepsia, antecedentes de crisis convulsivas o en pacientes con factores de riesgo para padecer epilepsia.
Se debe evitar la administración concomitante de antagonistas del N-metil-D-aspartato (NMDA) como la amantadina, la ketamina y el dextrometorfano. Estos compuestos actúan sobre el mismo sistema receptor que memantina y, por lo tanto, las reacciones adversas (principalmente las relacionadas con el sistema nervioso central [SNC] pueden ser más frecuentes o más intensas (ver sección 4.5).
Todos aquellos factores que aumenten el pH urinario (ver sección 5.2 “Eliminación”) pueden requerir una monitorización rigurosa del paciente. Entre estos factores se incluyen cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o una ingesta masiva de tampones gástricos alcalinizantes. Asimismo, el pH urinario puede estar elevado en estados de acidosis tubular renal (ATR) o infecciones graves del tracto urinario por bacterias del género Proteus.
En la mayoría de los ensayos clínicos, se excluyeron aquellos pacientes con antecedentes de infarto de miocardio reciente, enfermedad cardíaca congestiva (NYHA III-IV) o hipertensión no controlada. Como consecuencia, los datos en estos pacientes son limitados y los pacientes que presenten estas condiciones deben supervisarse cuidadosamente.
4.5 Interacción con otros medicamentos y otras formas de interacción
Debido a los efectos farmacológicos y al mecanismo de acción de la memantina, pueden producirse las siguientes interacciones:
• El mecanismo de acción sugiere que los efectos de la L-dopa, los agonistas dopaminérgicos y los anticolinérgicos pueden aumentar con el tratamiento concomitante de antagonistas del NMDA como memantina. Se pueden reducir los efectos de los barbitúricos y de los neurolépticos. La administración concomitante de memantina y agentes antiespasmódicos, como el dantroleno o el baclofeno, puede modificar sus efectos y hacer necesario un ajuste de la dosis.
• Se debe evitar el uso concomitante de memantina y amantadina, por el riesgo de psicosis farmacotóxica. Los dos compuestos están químicamente relacionados con los antagonistas del NMDA. Esto mismo podría aplicarse para la ketamina y el dextrometorfano (ver sección 4.4). También hay un caso clínico publicado sobre el posible riesgo de la combinación de memantina y fenitoína.
• Otros principios activos , como cimetidina, ranitidina, procainamida, quinidina, quinina y nicotina, que utilizan el mismo sistema de transporte catiónico renal que la amantadina, posiblemente también interaccionen con la memantina lo que conlleva un riesgo potencial de aumento de los niveles plasmáticos.
• Cuando se co-administra memantina junto con hidroclorotiazida (HCT) o con cualquier combinación con HCT existe la posibilidad de que se produzca una disminución en los niveles séricos de la HCT.
• En la experiencia post-comercialización, se ha informado de casos aislados de incremento del cociente internacional normalizado (INR), en pacientes tratados concomitantemente con warfarina. Aunque no se ha establecido relación causal, es aconsejable realizar una monitorización estrecha del tiempo de protrombina o INR, en pacientes tratados concomitantemente con anticoagulantes orales.
En estudios farmacocinéticos (FC) a dosis únicas realizados en sujetos jóvenes sanos, no se han observado interacciones relevantes principio activo-principio activo entre memantina y gliburida/metformina o donepezilo.
En un ensayo clínico realizado en sujetos jóvenes sanos, no se han observado efectos relevantes de memantina sobre la farmacocinética de la galantamina.
Memantina no inhibió las isoformas CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, la flavina monooxigenasa, la epóxido hidrolasa o la sulfonación in vitro.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos clínicos sobre la utilización de memantina durante el embarazo. Estudios con animales indican un riesgo potencial de disminución del crecimiento intrauterino con niveles de exposición idénticos o ligeramente más altos que los niveles de exposición en humanos (ver sección 5.3). No se conoce el riesgo potencial para humanos. Memantina no debe utilizarse durante el embarazo excepto que sea considerado claramente necesario.
Lactancia
Se desconoce si memantina se excreta por la leche materna pero, teniendo en cuenta la lipofilia del principio activo, es probable que así sea. Las mujeres que tomen memantina deben suspender la lactancia materna.
Fertilidad
No se notificaron con memantina efectos adversos de fertilidad ni en hombres ni en mujeres.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La enfermedad de Alzheimer de moderada a grave afecta normalmente la capacidad de conducción y compromete la capacidad para utilizar máquinas. Además, Axura presenta una influencia de leve a moderada sobre la capacidad de para conducir y utilizar máquinas, de forma que se debe advertir especialmente a los pacientes ambulatorios para que tomen las precauciones adecuadas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los ensayos clínicos en pacientes con demencia de leve a grave, en los que se incluyeron 1784 pacientes tratados con Axura y 1595 pacientes tratados con placebo, la incidencia global de reacciones adversas con Axura no difirió de la de aquellos tratados con placebo; las reacciones adversas fueron, por lo general, de leves a moderados en gravedad. Las reacciones adversas con mayor frecuencia de aparición que se observaron con una incidencia superior en el grupo de Axura respecto al grupo placebo fueron vértigo (6,3% frente a 5,6%, respectivamente), dolor de cabeza (5,2% frente a 3,9%), estreñimiento (4,6% frente a 2,6%), somnolencia (3,4% frente a 2,2%) e hipertensión (4.1% frente a 2.8%).
Las reacciones adversas enumeradas en la siguiente tabla proceden de los ensayos clínicos realizados con Axura y la experiencia postcomercialización., Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Lista tabulada de reacciones adversas Las reacciones adversas se categorizan conforme al sistema de clasificación por órganos, usando la siguiente convención: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
SISTEMA DE CLASIFICACIÓN POR ÓRGANOS |
FRECUENCIA |
REACCIONES ADVERSAS |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones fúngicas |
|
Trastornos del sistema inmunológico |
Frecuentes |
Hipersensibilidad al medicamento |
|
Trastornos psiquiátricos |
Frecuentes Poco frecuentes Poco frecuentes Frecuencia no conocida |
Somnolencia Confusión Alucinaciones 1 Reacciones psicóticas2 |
|
Trastornos del sistema nervioso |
Frecuentes Frecuentes Poco frecuentes Muy raras |
Vértigo Alteración del equilibrio Alteración de la marcha Convulsiones |
|
Trastornos cardiacos |
Poco frecuentes |
Insuficiencia cardíaca |
|
Trastornos vasculares |
Frecuentes Poco frecuentes |
Hipertensión Trombosis venosa/tromboembolismo |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
disnea |
|
Trastornos gastrointestinales |
Frecuentes Poco frecuentes Frecuencia no conocida |
Estreñimiento Vómitos Pancreatitis2 |
|
Trastornos hepatobiliares Frecuentes Pruebas de función hepática elevadas Frecuencia no Hepatitis conocida | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuentes Poco frecuentes |
Dolor de cabeza Fatiga |
'Las alucinaciones se han observado principalmente en pacientes con enfermedad de Alzheimer grave. 2Se han notificado casos aislados en la experiencia post-comercialización.
La enfermedad de Alzheimer ha sido asociada con depresión, ideación suicida y suicidio. En la experiencia post-comercialización, se ha notificado la aparición de éstos acontecimientos en pacientes tratados con Axura.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Solo se dispone de experiencia limitada en casos de sobredosis de los ensayos clínicos y de la experiencia post-comercialización.
Síntomas: Sobredosis relativamente altas (200 mg y 105 mg/día durante 3 días respectivamente) se han asociado únicamente con síntomas como cansancio, debilidad y/o diarrea. o han sido asintomáticas. En casos de sobredosis por debajo de 140 mg o dosis no conocida aparecieron en los pacientes síntomas a nivel del sistema nervioso central (confusión, adormecimiento, somnolencia, vértigo, agitación, agresividad, alucinaciones y alteraciones de la marcha) y/o de origen gastrointestinal (vómitos y diarreas).
En el caso más extremo de sobredosis, el paciente sobrevivió a la ingesta oral de un total de 2000 mg de memantina con efectos a nivel del sistema nervioso central (coma durante 10 días, y posterior diplopía y agitación). El paciente recibió tratamiento sintomático y plasmaféresis, recuperándose sin secuelas permanentes.
En otro caso de sobredosis grave, el paciente también sobrevivió y se recuperó. Dicho paciente había recibido 400 mg de mamantina por vía oral, y experimentó síntomas a nivel del sistema nervioso central tales como inquietud, psicosis, alucinaciones visuales, proconvulsividad, somnolencia, estupor e inconsciencia.
Tratamiento: En caso de sobredosis, el tratamiento debe ser sintomático. No existe antídoto específico para la intoxicación o sobredosis. Se deben utilizar procedimientos clínicos estándar para la eliminación del principio activo de forma apropiada, por ej.: lavado gástrico, carbón activado (interrupción de la recirculación enterohepática potencial), acidificación de la orina, diuresis forzada.
En caso de aparición de signos y síntomas de sobrestimulación general del Sistema Nervioso Central (SNC), se debe considerar llevar a cabo un tratamiento clínico sintomático cuidadoso.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros fármacos anti-demencia, código ATC: N06DX01.
Existe una evidencia cada vez más clara de que el mal funcionamiento de la neurotransmisión glutamatérgica, en particular en los receptores NMDA, contribuye tanto a la expresión de los síntomas como a la progresión de la enfermedad hacia demencia neurodegenerativa.
Memantina es un antagonista no competitivo de los receptores NMDA, de afinidad moderada y voltaje dependiente. Modula los efectos de los niveles tónicos de glutamato elevados patológicamente que pueden ocasionar disfunción neuronal.
Ensayos clínicos
Un ensayo pivotal de monoterapia en pacientes que padecían enfermedad de Alzheimer de moderada a grave (puntuación total en el miniexamen cognoscitivo (MMSE, mini mental state examination) al inicio del estudio 3 - 14) incluyó un total de 252 pacientes. El estudio mostró los efectos beneficiosos del tratamiento con memantina respecto al tratamiento con placebo después de 6 meses (análisis de casos observados para el estudio CIBIC-plus (siglas en inglés que corresponden a la escala de impresión de cambio basada en la entrevista del médico mas los comentarios del cuidador): p=0,025; ADCS-ADLsev (siglas en inglés que corresponden al estudio cooperativo de la enfermedad de Alzheimer - actividades de la vida diaria): p=0,003; SIB (siglas en inglés que corresponden a la batería de deterioro grave): p=0,002).
Un estudio pivotal de memantina en monoterapia en el tratamiento de la enfermedad de Alzheimer de leve a moderada (puntuación total MMSE al inicio del estudio de 10 a 22) incluyó a 403 pacientes.
Los pacientes tratados con memantina mostraron un efecto superior a placebo estadísticamente significativo, en las variables principales: ADAS-cog (siglas en inglés que corresponden a la escala de evaluación de la enfermedad de Alzheimer-subescala cognitiva) (p=0,003) y CIBIC-plus (p=0,004) en la semana 24 LOCF (siglas en inglés que corresponden al método de arrastre de la última observación realizada). En otro ensayo de monoterapia en enfermedad de Alzheimer de leve a moderada se aleatorizaron un total de 470 pacientes (puntuación total MMSE al inicio del estudio de 11 - 23). En el análisis primario definido prospectivamente no se encontró diferencia estadísticamente significativa en las variables primarias de eficacia en la semana 24.
Un meta-análisis de los pacientes con enfermedad de Alzheimer de moderada a grave (puntuación total MMSE < 20) de seis estudios en fase III, controlados con placebo en estudios a 6 meses (incluyendo estudios de monoterapia y estudios con pacientes con una dosis estable de un inhibidor de la acetilcolinesterasa), mostró que había un efecto estadísticamente significativo a favor del tratamiento con memantina en las áreas cognitiva, global y funcional. Cuando los pacientes fueron identificados con un empeoramiento conjunto en las tres áreas, los resultados mostraron un efecto estadísticamente significativo de memantina en la prevención del empeoramiento, el doble de los pacientes tratados con placebo en comparación con los pacientes tratados con memantina mostraron empeoramiento en las tres áreas (21% frente 11%, p<0,0001).
5.2 Propiedades farmacocinéticas
Absorción: Memantina tiene una biodisponibilidad absoluta de aproximadamente el 100%. La tmáx está entre 3 y 8 horas. No hay indicios de la influencia de alimentos en la absorción de memantina.
Distribución: Las dosis diarias de 20 mg producen concentraciones plasmáticas constantes de memantina que oscilan entre 70 y 150 ng/ml (0,5 - 1 pmol) con importantes variaciones interindividuales. Cuando se administraron dosis diarias de 5 a 30 mg, se obtuvo un índice medio de líquido cefalorraquídeo (LCR)/suero de 0,52. El volumen de distribución es de aproximadamente 10 l/kg. Alrededor del 45% de memantina se une a proteínas plasmáticas.
Biotransformación: En el hombre, aproximadamente el 80% del material circulante relacionado con memantina está presente como compuesto inalterado. Los principales metabolitos en humanos son N-3,5-dimetil-gludantano, la mezcla isomérica de 4- y 6-hidroxi-memantina y 1-nitroso-3,5-dimetil-adamantano. Ninguno de estos metabolitos muestra actividad antagonista NMDA. No se ha detectado in vitro metabolismo catalizado por citocromo P 450.
En un estudio con 14C-memantina administrado vía oral, se recuperó una media del 84% de la dosis dentro de los 20 días, excretándose más del 99% por vía renal.
Eliminación: Memantina se elimina de manera monoexponencial con una t/2 terminal de 60 a 100 horas. En voluntarios con función renal normal, el aclaramiento total (Cltot) asciende a 170 ml/min/1,73 m2 y parte del aclaramiento total renal se logra por secreción tubular.
La función renal también incluye la reabsorción tubular, probablemente mediada por proteínas transportadoras de cationes. La tasa de eliminación renal de la memantina en condiciones de orina alcalina puede reducirse en un factor entre 7 y 9 (ver sección 4.4). La alcalinización de la orina se puede producir por cambios drásticos en la dieta, por ejemplo, de carnívora a vegetariana, o por una ingesta masiva de tampones gástricos alcalinizantes.
Linealidad: Los estudios en voluntarios han demostrado una farmacocinética lineal en el intervalo de dosis de 10 a 40 mg.
Relación farmacocinética/farmacodinámica: A una dosis de memantina de 20 mg al día los niveles en LCR concuerdan con el valor ki (ki = constante de inhibición) de memantina, que es de 0,5 qmol en la corteza frontal humana.
5.3 Datos preclínicos sobre seguridad
En estudios a corto plazo en ratas, memantina, al igual que otros antagonistas del NMDA, indujo vacuolización neuronal y necrosis (lesiones de Olney) únicamente tras dosis que producían picos muy altos de concentraciones séricas. La ataxia y otros signos preclínicos precedieron a la vacuolización y a la necrosis. Como estos efectos no se observaron en roedores ni en no roedores en estudios a largo plazo, se desconoce la importancia clínica de estos hallazgos.
Se observaron cambios oculares en estudios de toxicidad de dosis repetidas en roedores y perros, pero no en monos. Los exámenes específicos oftalmoscópicos realizados en estudios clínicos con memantina no revelaron cambios oculares.
En roedores se observó fosfolipidosis en macrófagos pulmonares producido por la acumulación de memantina en lisosomas. Este efecto se ha observado en otros principios activos con propiedades anfifílicas catiónicas. Existe una posible relación entre esta acumulación y la vacuolización observada en los pulmones. Este efecto se observó solamente en roedores a dosis altas. Se desconoce la importancia clínica de estos hallazgos.
No se observó genotoxicidad en los ensayos estándar realizados con memantina. No hubo evidencias de carcinogenicidad en los estudios en ratones y ratas hasta su muerte. Memantina no resultó teratogénica ni en ratas ni en conejos, incluso a dosis tóxicas para la madre y no se observó ningún efecto adverso de memantina sobre la fertilidad. En ratas, se observó una reducción del crecimiento fetal a niveles de exposición idénticos o ligeramente más altos que los niveles de exposición humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo de los comprimidos recubiertos con película de 5/10/15/20 mg:
Celulosa microcristalina
Croscarmelosa sódica
Sílice coloidal anhidra
Estearato de magnesio
Cubierta de los comprimidos recubiertos con película de 5/10/15/20 mg:
Hipromelosa
Macrogol 400
Dióxido de titanio (E 171)
Adicional en los comprimidos recubiertos con película de 10 mg Óxido de hierro amarillo (E 172)
Adicional en los comprimidos recubiertos con película de 15/20 mg Óxido de hierro amarillo y rojo (E172)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
4 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Cada envase contiene 28 comprimidos recubiertos con película en 4 blisteres de PVDC/PE/PVC/Al o blisteres de PP/Al con 7 comprimidos recubiertos con película de 5 mg, 7 comprimidos recubiertos con película de 10 mg, 7 comprimidos recubiertos con película de 15 mg y 7 comprimidos recubiertos con película de 20 mg.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/016
EU/1/02/218/023
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 17 mayo 2002 Fecha de la última renovación: 17 mayo 2007
10. FECHA DE LA REVISIÓN DEL TEXTO
MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Axura 20 mg comprimidos recubiertos con película.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimidos recubiertos con película.
Los comprimidos recubiertos con película tienen un color de rojo pálido a rojo grisáceo y son fusiformes con el número “20”impreso en una cara y “MEM” en la otra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
4.2 Posología y forma de administración Posología
El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el diagnóstico y tratamiento de la demencia de Alzheimer. El tratamiento se debe iniciar únicamente si se dispone de un cuidador que monitorice regularmente la toma del fármaco por parte del paciente. Se debe realizar el diagnóstico siguiendo las directrices actuales. La tolerabilidad y la dosis de memantina deben reevaluarse de forma regular, preferiblemente dentro de los 3 meses posteriores al inicio del tratamiento. Por lo tanto el beneficio clínico de memantina y la tolerancia del paciente al tratamiento deben reevaluarse de forma regular de acuerdo a las directrices clínicas vigentes. El tratamiento de mantenimiento puede continuarse mientras el beneficio terapéutico sea favorable y el paciente tolere el tratamiento con memantina. La discontinuación de memantina debería considerarse cuando ya no se evidencie su efecto terapéutico o si el paciente no tolera el tratamiento.
Adultos:
Escalado de dosis La máxima dosis diaria es de 20 mg al día. Para reducir el riesgo de efectos adversos, esta dosis de mantenimiento debe alcanzarse mediante un escalado de dosis de 5 mg durante las 3 primeras semanas de tratamiento de la siguiente manera. Para el ajuste están disponibles comprimidos de otras dosis.
Semana 1 (día 1-7):
El paciente debe tomar un comprimido recubierto con película de 5 mg al día durante 7 días.
Semana 2 (día 8-14):
El paciente debe tomar un comprimido recubierto con película de 10 mg al día durante 7 días.
Semana 3 (día 15-21):
El paciente debe tomar un comprimido recubierto con película de 15 mg al día durante 7 días.
A partir de la semana 4:
El paciente debe tomar un comprimido recubierto con película de 20 mg al día.
Dosis de mantenimiento
La dosis recomendada de mantenimiento es de 20 mg al día.
Pacientes de edad avanzada: Basándose en estudios clínicos, la dosis recomendada para los pacientes mayores de 65 años es de 20 mg al día, tal como se ha descrito anteriormente.
Insuficiencia renal: En pacientes con función renal levemente afectada (aclaramiento de creatinina de 50 - 80 ml/min), no es necesario ajustar la dosis. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina de 30 - 49 ml/min), la dosis diaria debe ser de10 mg al día. Si se tolera bien después de, al menos 7 días de tratamiento, la dosis podría aumentarse hasta 20 mg/día de acuerdo con el esquema de titulación estándar. En pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5-29 ml/min.) la dosis diaria debe ser de 10 mg al día.
Insuficiencia hepática: En pacientes con insuficiencia hepática leve o moderada (Child-Pugh A y Child-Pugh B) no es necesario ajustar la dosis. No existen datos disponibles sobre el uso de memantina en pacientes con insuficiencia hepática grave. No se recomienda la administración de Axura a pacientes con insuficiencia hepática grave.
Niños y adolescentes: No se recomienda el uso de Axura en niños menores de 18 años debido a una falta de datos de seguridad y eficacia.
Forma de administración
Axura debe administrarse una vez al día, siempre a la misma hora. Los comprimidos recubiertos con película pueden tomarse con o sin alimentos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda precaución en el tratamiento de pacientes con epilepsia, antecedentes de crisis convulsivas o en pacientes con factores de riesgo para padecer epilepsia.
Se debe evitar la administración concomitante de antagonistas del N-metil-D-aspartato (NMDA) como la amantadina, la ketamina y el dextrometorfano. Estos compuestos actúan sobre el mismo sistema receptor que memantina y, por lo tanto, las reacciones adversas (principalmente las relacionadas con el sistema nervioso central [SNC]) pueden ser más frecuentes o más intensas (ver sección 4.5).
Todos aquellos factores que aumenten el pH urinario (ver sección 5.2 “Eliminación”) pueden requerir una monitorización rigurosa del paciente. Entre estos factores se incluyen cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o una ingesta masiva de tampones gástricos alcalinizantes. Asimismo, el pH urinario puede estar elevado en estados de acidosis tubular renal (ATR) o infecciones graves del tracto urinario por bacterias del género Proteus.
En la mayoría de los ensayos clínicos, se excluyeron aquellos pacientes con antecedentes de infarto de miocardio reciente, enfermedad cardíaca congestiva (NYHA III-IV) o hipertensión no controlada. Como consecuencia, los datos en estos pacientes son limitados y los pacientes que presenten estas condiciones deben supervisarse cuidadosamente.
4.5 Interacción con otros medicamentos y otras formas de interacción
Debido a los efectos farmacológicos y al mecanismo de acción de la memantina, pueden producirse las siguientes interacciones:
• El mecanismo de acción sugiere que los efectos de la L-dopa, los agonistas dopaminérgicos y los anticolinérgicos pueden aumentar con el tratamiento concomitante de antagonistas del NMDA como memantina. Se pueden reducir los efectos de los barbitúricos y de los neurolépticos. La administración concomitante de memantina y agentes antiespasmódicos, como el dantroleno o el baclofeno, puede modificar sus efectos y hacer necesario un ajuste de la dosis.
• Se debe evitar el uso concomitante de memantina y amantadina, por el riesgo de psicosis farmacotóxica. Los dos compuestos están químicamente relacionados con los antagonistas del NMDA. Esto mismo podría aplicarse para la ketamina y el dextrometorfano (ver sección 4.4). También hay un caso clínico publicado sobre el posible riesgo de la combinación de memantina y fenitoína.
• Otros principios activos, como cimetidina, ranitidina, procainamida, quinidina, quinina y nicotina, que utilizan el mismo sistema de transporte catiónico renal que la amantadina, posiblemente también interaccionen con la memantina lo que conlleva un riesgo potencial de aumento de los niveles plasmáticos.
• Cuando se co-administra memantina junto con hidroclorotiazida (HCT) o con cualquier combinación con HCT existe la posibilidad de que se produzca una disminución en los niveles séricos de la HCT.
• En la experiencia post-comercialización, se ha informado de casos aislados de incremento del cociente internacional normalizado (INR), en pacientes tratados concomitantemente con warfarina. Aunque no se ha establecido relación causal, es aconsejable realizar una monitorización estrecha del tiempo de protrombina o INR, en pacientes tratados concomitantemente con anticoagulantes orales.
En estudios farmacocinéticos (FC) a dosis únicas realizados en sujetos jóvenes sanos, no se han observado interacciones relevantes principio activo-principio activo entre memantina y gliburida/metformina o donepezilo.
En un ensayo clínico realizado en sujetos jóvenes sanos, no se han observado efectos relevantes de memantina sobre la farmacocinética de la galantamina.
Memantina no inhibió las isoformas CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, la flavina monooxigenasa, la epóxido hidrolasa o la sulfonación in vitro.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos clínicos sobre la utilización de memantina durante el embarazo. Estudios con animales indican un riesgo potencial de disminución del crecimiento intrauterino con niveles de exposición idénticos o ligeramente más altos que los niveles de exposición en humanos (ver sección 5.3). No se conoce el riesgo potencial para humanos. Memantina no debe utilizarse durante el embarazo excepto que sea considerado claramente necesario.
Lactancia
Se desconoce si memantina se excreta por la leche materna pero, teniendo en cuenta la lipofilia del principio activo, es probable que así sea. Las mujeres que tomen memantina deben suspender la lactancia materna.
Fertilidad
No se notificaron con memantina efectos adversos de fertilidad ni en hombres ni en mujeres.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La enfermedad de Alzheimer de moderada a grave afecta normalmente la capacidad de conducción y compromete la capacidad para utilizar máquinas. Además, Axura presenta una influencia de leve a moderada sobre la capacidad de para conducir y utilizar máquinas, de forma que se debe advertir especialmente a los pacientes ambulatorios para que tomen las precauciones adecuadas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los ensayos clínicos en pacientes con demencia de leve a grave, en los que se incluyeron 1784 pacientes tratados con Axura y 1595 pacientes tratados con placebo, la incidencia global de reacciones adversas con Axura no difirió de la de aquellos tratados con placebo; las reacciones adversas fueron, por lo general, de leves a moderados en gravedad. Las reacciones adversas con mayor frecuencia de aparición que se observaron con una incidencia superior en el grupo de Axura respecto al grupo placebo fueron vértigo (6,3% frente a 5,6%, respectivamente), dolor de cabeza (5,2% frente a 3,9%), estreñimiento (4,6% frente a 2,6%), somnolencia (3,4% frente a 2,2%) e hipertensión (4.1% frente a 2.8%).
Las reacciones adversas enumeradas en la siguiente tabla proceden de los ensayos clínicos realizados con Axura y la experiencia postcomercialización. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Lista tabulada de reacciones adversas Las reacciones adversas se categorizan conforme al sistema de clasificación por órganos, usando la siguiente convención: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
SISTEMA DE CLASIFICACIÓN POR ÓRGANOS |
FRECUENCIA |
REACCIONES ADVERSAS | |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones fúngicas | |
|
Trastornos del sistema inmunológico |
Frecuentes |
Hipersensibilidad al medicamento | |
|
Trastornos psiquiátricos |
Frecuentes Poco frecuentes Poco frecuentes |
Somnolencia Confusión Alucinaciones 1 | |
|
Frecuencia conocida |
no |
Reacciones psicóticas2 | |
|
Trastornos del sistema nervioso |
Frecuentes Frecuentes Poco frecuentes Muy raras |
Vértigo Alteración del equilibrio Alteración de la marcha Convulsiones | |
|
Trastornos cardiacos |
Poco frecuentes |
Insuficiencia cardíaca | |
|
Trastornos vasculares |
Frecuentes Poco frecuentes |
Hipertensión Trombosis venosa/tromboembolismo | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
disnea | |
|
Trastornos gastrointestinales |
Frecuentes Poco frecuentes |
Estreñimiento Vómitos | |
|
Frecuencia conocida |
no |
Pancreatitis2 | |
|
Trastornos hepatobiliares |
Frecuentes |
Pruebas de función hepática elevadas | |
|
Frecuencia conocida |
no |
Hepatitis | |
|
Trastornos generales y alteraciones en el lugar |
Frecuentes |
Dolor de cabeza | |
|
de administración |
Poco frecuentes |
Fatiga |
1
Las alucinaciones se han observado principalmente en pacientes con enfermedad de Alzheimer grave.
Se han notificado casos aislados en la experiencia post-comercialización.
La enfermedad de Alzheimer ha sido asociada con depresión, ideación suicida y suicidio. En la experiencia post-comercialización, se ha notificado la aparición de éstos acontecimientos en pacientes tratados con Axura.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Solo se dispone de experiencia limitada en casos de sobredosis de los ensayos clínicos y de la experiencia post-comercialización.
Síntomas: Sobredosis relativamente altas (200 mg y 105 mg/día durante 3 días respectivamente) se han asociado únicamente con síntomas como cansancio, debilidad y/o diarrea. o han sido asintomáticas. En casos de sobredosis por debajo de 140 mg o dosis no conocida aparecieron en los pacientes síntomas a nivel del sistema nervioso central (confusión, adormecimiento, somnolencia, vértigo, agitación, agresividad, alucinaciones y alteraciones de la marcha) y/o de origen gastrointestinal (vómitos y diarreas).
En el caso más extremo de sobredosis, el paciente sobrevivió a la ingesta oral de un total de 2000 mg de memantina con efectos a nivel del sistema nervioso central (coma durante 10 días, y posterior diplopía y agitación). El paciente recibió tratamiento sintomático y plasmaféresis, recuperándose sin secuelas permanentes.
En otro caso de sobredosis grave, el paciente también sobrevivió y se recuperó. Dicho paciente había recibido 400 mg de memantina por vía oral, y experimentó síntomas a nivel del sistema nervioso central tales como inquietud, psicosis, alucinaciones visuales, proconvulsividad, somnolencia, estupor e inconsciencia.
Tratamiento: En caso de sobredosis, el tratamiento debe ser sintomático. No existe antídoto específico para la intoxicación o sobredosis. Se deben utilizar procedimientos clínicos estándar para la eliminación del principio activo de forma apropiada, por ej.: lavado gástrico, carbón activado (interrupción de la recirculación enterohepática potencial), acidificación de la orina, diuresis forzada.
En caso de aparición de signos y síntomas de sobrestimulación general del sistema nervioso central (SNC), se debe considerar llevar a cabo un tratamiento clínico sintomático cuidadoso.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros fármacos anti-demencia, código ATC: N06DX01.
Existe una evidencia cada vez más clara de que el mal funcionamiento de la neurotransmisión glutamatérgica, en particular en los receptores NMDA, contribuye tanto a la expresión de los síntomas como a la progresión de la enfermedad hacia demencia neurodegenerativa.
Memantina es un antagonista no competitivo de los receptores NMDA, de afinidad moderada y voltaje dependiente. Modula los efectos de los niveles tónicos de glutamato elevados patológicamente que pueden ocasionar disfunción neuronal.
Ensayos clínicos
Un ensayo pivotal de monoterapia en pacientes que padecían enfermedad de Alzheimer de moderada a grave (puntuación total en el miniexamen cognoscitivo (MMSE, mini mental state examination) al inicio del estudio 3 - 14) incluyó un total de 252 pacientes. El estudio mostró los efectos beneficiosos del tratamiento con memantina respecto al tratamiento con placebo después de 6 meses (análisis de casos observados para el estudio CIBIC-plus (siglas en inglés que corresponden a la escala de impresión de cambio basada en la entrevista del médico mas los comentarios del cuidador): p=0,025; ADCS-ADLsev (siglas en inglés que corresponden al estudio cooperativo de la enfermedad de Alzheimer - actividades de la vida diaria): p=0,003; SIB (siglas en inglés que corresponden a la batería de deterioro grave): p=0,002).
Un estudio pivotal de memantina en monoterapia en el tratamiento de la enfermedad de Alzheimer de leve a moderada (puntuación total MMSE al inicio del estudio de 10 a 22) incluyó a 403 pacientes.
Los pacientes tratados con memantina mostraron un efecto superior a placebo estadísticamente significativo, en las variables principales: ADAS-cog (siglas en inglés que corresponden a la escala de evaluación de la enfermedad de Alzheimer-subescala cognitiva) (p=0,003) y CIBIC-plus (p=0,004) en la semana 24 LOCF (siglas en inglés que corresponden al método de arrastre de la última observación realizada). En otro ensayo de monoterapia en enfermedad de Alzheimer de leve a moderada se aleatorizaron un total de 470 pacientes (puntuación total MMSE al inicio del estudio de 11 - 23). En el análisis primario definido prospectivamente no se encontró diferencia estadísiticamente significativa en las variables primarias de eficacia en la semana 24.
Un meta-análisis de los pacientes con enfermedad de Alzheimer de moderada a grave (puntuación total MMSE < 20) de seis estudios en fase III, controlados con placebo en estudios a 6 meses (incluyendo estudios de monoterapia y estudios con pacientes con una dosis estable de un inhibidor de la acetilcolinesterasa), mostró que había un efecto estadísticamente significativo a favor del tratamiento con memantina en las áreas cognitiva, global y funcional. Cuando los pacientes fueron identificados con un empeoramiento conjunto en las tres áreas, los resultados mostraron un efecto estadísticamente significativo de memantina en la prevención del empeoramiento, el doble de los pacientes tratados con placebo en comparación con los pacientes tratados con memantina mostraron empeoramiento en las tres áreas (21% frente 11%, p<0,0001).
5.2 Propiedades farmacocinéticas
Absorción: Memantina tiene una biodisponibilidad absoluta de aproximadamente el 100%. La t^ está entre 3 y 8 horas. No hay indicios de la influencia de alimentos en la absorción de memantina.
Distribución: Las dosis diarias de 20 mg producen concentraciones plasmáticas constantes de memantina que oscilan entre 70 y 150 ng/ml (0,5 - 1 pmol) con importantes variaciones interindividuales. Cuando se administraron dosis diarias de 5 a 30 mg, se obtuvo un índice medio de líquido cefalorraquídeo (LCR)/suero de 0,52. El volumen de distribución es de aproximadamente 10 l/kg. Alrededor del 45% de memantina se une a proteínas plasmáticas.
Biotransformación: En el hombre, aproximadamente el 80% del material circulante relacionado con memantina está presente como compuesto inalterado. Los principales metabolitos en humanos son N-3,5-dimetil-gludantano, la mezcla isomérica de 4- y 6-hidroxi-memantina y 1-nitroso-3,5-dimetil-adamantano. Ninguno de estos metabolitos muestra actividad antagonista NMDA. No se ha detectado in vitro metabolismo catalizado por citocromo P 450.
En un estudio con 14C-memantina administrado vía oral, se recuperó una media del 84% de la dosis dentro de los 20 días, excretándose más del 99% por vía renal.
Eliminación: Memantina se elimina de manera monoexponencial con una t./2 terminal de 60 a 100 horas. En voluntarios con función renal normal, el aclaramiento total (Cltot) asciende a 170 ml/min/1,73 m2 y parte del aclaramiento total renal se logra por secreción tubular.
La función renal también incluye la reabsorción tubular, probablemente mediada por proteínas transportadoras de cationes. La tasa de eliminación renal de la memantina en condiciones de orina alcalina puede reducirse en un factor entre 7 y 9 (ver sección 4.4). La alcalinización de la orina se puede producir por cambios drásticos en la dieta, por ejemplo, de carnívora a vegetariana, o por una ingesta masiva de tampones gástricos alcalinizantes.
Linealidad: Los estudios en voluntarios han demostrado una farmacocinética lineal en el intervalo de dosis de 10 a 40 mg.
Relación farmacocinética/farmacodinámica: A una dosis de memantina de 20 mg al día los niveles en LCR concuerdan con el valor ki (ki = constante de inhibición) de memantina, que es de 0,5 pmol en la corteza frontal humana.
5.3 Datos preclínicos sobre seguridad
En estudios a corto plazo en ratas, memantina, al igual que otros antagonistas del NMDA, indujo vacuolización neuronal y necrosis (lesiones de Olney) únicamente tras dosis que producían picos muy altos de concentraciones séricas. La ataxia y otros signos preclínicos precedieron a la vacuolización y a la necrosis. Como estos efectos no se observaron en roedores ni en no roedores en estudios a largo plazo, se desconoce la importancia clínica de estos hallazgos.
Se observaron cambios oculares en estudios de toxicidad de dosis repetidas en roedores y perros, pero no en monos. Los exámenes específicos oftalmoscópicos realizados en estudios clínicos con memantina no revelaron cambios oculares.
En roedores se observó fosfolipidosis en macrófagos pulmonares producido por la acumulación de memantina en lisosomas. Este efecto se ha observado en otros principios activos con propiedades anfifílicas catiónicas. Existe una posible relación entre esta acumulación y la vacuolización observada en los pulmones. Este efecto se observó solamente en roedores a dosis altas. Se desconoce la importancia clínica de estos hallazgos.
No se observó genotoxicidad en los ensayos estándar realizados con memantina. No hubo evidencias de carcinogenicidad en los estudios en ratones y ratas hasta su muerte. Memantina no resultó teratogénica ni en ratas ni en conejos, incluso a dosis tóxicas para la madre y no se observó ningún efecto adverso de memantina sobre la fertilidad. En ratas, se observó una reducción del crecimiento fetal a niveles de exposición idénticos o ligeramente más altos que los niveles de exposición humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido:
Celulosa microcristalina Croscarmelosa sódica Sílice coloidal anhidra Estearato de magnesio
Cubierta del comprimido: Hipromelosa Macrogol 400 Dióxido de titanio (E171)
Óxido de hierro amarillo y rojo (E172)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 4 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Los envases de blisteres contienen 14 comprimidos recubiertos con película por cada tira de blister de Alu/PVDC/PE/PVC o Alu/PP. Los envases se presentan en tamaños de 14, 28, 42, 56, 98 o envase múltiple con 840 (20 x 42) comprimidos recubiertos con película.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/017
EU/1/02/218/018
EU/1/02/218/019
EU/1/02/218/020
EU/1/02/218/021
EU/1/02/218/022
EU/1/02/218/024
EU/1/02/218/025
EU/1/02/218/026
EU/1/02/218/027
EU/1/02/218/028
EU/1/02/218/029
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 17 mayo 2002 Fecha de la última renovación: 17 mayo 2007
10. FECHA DE LA REVISIÓN DEL TEXTO
MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES RELATIVAS AL USO SEGURO Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricantc(s) rcsponsablc(s) de la liberación de los lotes
Merz Pharma GmbH & Co. KGaA Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Informes Periódicos de Seguridad (IPSs)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR ENVASE PARA EL BLISTER
1. NOMBRE DEL MEDICAMENTO
Axura 10 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Comprimidos recubiertos con película.
14 comprimidos recubiertos con película 28 comprimidos recubiertos con película 30 comprimidos recubiertos con película 42 comprimidos recubiertos con película 50 comprimidos recubiertos con película 56 comprimidos recubiertos con película 98 comprimidos recubiertos con película 100 comprimidos recubiertos con película 112 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/012 14 comprimidos recubiertos con película. EU/1/02/218/007 28 comprimidos recubiertos con película. EU/1/02/218/001 30 comprimidos recubiertos con película. EU/1/02/218/013 42 comprimidos recubiertos con película. EU/1/02/218/002 50 comprimidos recubiertos con película. EU/1/02/218/008 56 comprimidos recubiertos con película. EU/1/02/218/014 98 comprimidos recubiertos con película EU/1/02/218/003 100 comprimidos recubiertos con película. EU/1/02/218/009 112 comprimidos recubiertos con película.
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Axura 10 mg comprimidos
EMBALAJE PARA 42, 50 Y 98 COMPRIMIDOS QUE ACTÚA COMO ENVASE INTERMEDIO / DENTRO DE UN ENVASE MÚLTIPLE (SIN “BLUE BOX”)
1. NOMBRE DEL MEDICAMENTO
Axura 10 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Comprimidos recubiertos con película. 42 comprimidos recubiertos con película.
Forma parte de un envase múltiple de 20 envases, cada uno de los cuales contiene 42 comprimidos recubiertos. No pueden venderse por separado.
Comprimidos recubiertos con película. 50 comprimidos recubiertos con película.
Forma parte de un envase múltiple de 20 envases, cada uno de los cuales contiene 50 comprimidos recubiertos. No pueden venderse por separado.
Comprimidos recubiertos con película. 98 comprimidos recubiertos con película.
Forma parte de un envase múltiple de 10 envases, cada uno de los cuales contiene 98 comprimidos recubiertos.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/010 1000 comprimidos recubiertos con película (20 x 50) EU/1/02/218/015 980 comprimidos recubiertos con película (10 x 98) EU/1/02/218/030 840 comprimidos recubiertos con película (20 x 42)
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Axura 10 mg comprimidos
ETIQUETA DE LA ENVOLTURA EXTERIOR DEL ENVASE MÚLTIPLE (20 x 42 COMPREMIDOS, 20 X 50 COMPRIMIDOS Y 10 X 98 COMPRIMIDOS) ENVUELTO EN UNA LÁMINA (INCLUYENDO “BLUE BOX”)_
1. NOMBRE DEL MEDICAMENTO
Axura 10 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Envase múltiple formado
por 20 envases, cada uno de los cuales contiene 42 comprimidos recubiertos con película.
por 20 envases, cada uno de los cuales contiene 50 comprimidos recubiertos con película.
por 10 envases, cada uno de los cuales contiene 98 comprimidos recubiertos con película.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar éste medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO
CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/010 1000comprimidos recubiertos con película (20 x 50) EU/1/02/218/015 980comprimidos recubiertos con película (10 x 98) EU/1/02/218/030 840comprimidos recubiertos con película (20 x 42)
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
INFORMACIÓN MÍNIMA A INCLUIR EN BLISTERES O TIRAS DE BLISTER PARA COMPRIMIDOS
1. NOMBRE DEL MEDICAMENTO
Axura 10 mg comprimidos recubiertos con película Clorhidrato de memantina
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH
3. FECHA DE CADUCIDAD
CAD {MM/AAAA} Ver el margen.
4. NÚMERO DE LOTE
Lote {número} Ver el margen.
5. OTROS
EMBALAJE Y ETIQUETA PARA FRASCOS
1. NOMBRE DEL MEDICAMENTO
Axura 5 mg/pulsación solución oral clorhidrato de memantina.
2. PRINCIPIO(S) ACTIVO(S)
Una pulsación del dosificador libera 0,5 ml de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
3. LISTA DE EXCIPIENTES
La solución también contiene sorbato potásico y sorbitol E 420. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución oral. 50 ml.
100 ml.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar este medicamento. Una vez al día.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/005 50 ml. EU/1/02/218/006 100 ml.
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Axura 5 mg/pulsación solución
EMBALAJE Y ETIQUETA PARA FRASCOS DE 50 ml COMO ENVASE INTERMEDIO / COMPONENTE DE UN ENVASE MÚLTIPLE (SIN “BLUE BOX”)_
1. NOMBRE DEL MEDICAMENTO
Axura 5 mg/pulsación solución oral clorhidrato de memantina.
2. PRINCIPIO(S) ACTIVO(S)
Una pulsación del dosificador libera 0,5 ml de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
3. LISTA DE EXCIPIENTES
La solución también contiene sorbato potásico y sorbitol E 420. Para mayor información, consultar el prospecto
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución oral. 50 ml
Componente de un envase múltiple formado por 10 envases, conteniendo cada uno un frasco de 50 ml de solución oral. No pueden venderse por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar este medicamento. Una vez al día.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/011 500ml (10 x 50ml)
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Axura 5 mg/pulsación solución
ETIQUETA DE LA ENVOLTURA EXTERIOR DEL ENVASE MÚLTIPLE (10 x 50 ml) ENVUELTO EN UNA LÁMINA (INCLUYENDO LA “BLUE BOX”)
1. NOMBRE DEL MEDICAMENTO
Axura 5 mg/pulsación solución oral clorhidrato de memantina.
2. PRINCIPIO(S) ACTIVO(S)
Una pulsación del dosificador libera 0,5 ml) de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
3. LISTA DE EXCIPIENTES
La solución también contiene sorbato potásico y sorbitol E 420. Para mayor información, consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución oral.
Envase múltiple de 500 ml, formado por 10 envases, conteniendo cada uno un frasco de 50 ml de solución oral.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar este medicamento Una vez al día.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
Una vez abierto, utilizar dentro de los 3 meses siguientes a su apertura.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/011 500ml (10 x 50ml)
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
EMBALAJE DE 28 COMPRIMIDOS - ENVASE DE TRATAMIENTO DE INICIO -PROGRAMA DE 4 SEMANAS DE TRATAMIENTO
1. NOMBRE DEL MEDICAMENTO
Axura 5 mg Comprimidos recubiertos con película Axura 10 mg Comprimidos recubiertos con película Axura 15 mg Comprimidos recubiertos con película Axura 20 mg Comprimidos recubiertos con película
Clorhidrato de memantina
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 5 mg de clorhidrato de memantina, que equivalen a 4,15 mg de memantina.
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
Cada comprimido recubierto con película contiene 15 mg de clorhidrato de memantina, que equivalen a 12,46 mg de memantina.
Cada comprimido recubierto con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Cada envase con 28 comprimidos recubiertos con película para un programa de 4 semanas de tratamiento contiene:
7 x Axura® 5 mg 7 x Axura® 10 mg 7 x Axura® 15 mg 7 x Axura® 20 mg
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar este medicamento.
UNA VEZ AL DÍA
Para continuar con el tratamiento, consulte con su médico o farmacéutico.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/016 28 comprimidos recubiertos con película EU/1/02/218/023 28 comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Axura 5 mg, 10 mg, 15 mg, 20 mg comprimidos.
1. NOMBRE DEL MEDICAMENTO
Axura® 5 mg, Axura® 10 mg Axura® 15 mg Axura® 20 mg
2. PRINCIPIO(S) ACTIVO(S)
Clorhidrato de memantina
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
7 comprimidos recubiertos con película de Axura® 5 mg 7 comprimidos recubiertos con película de Axura® 10 mg 7 comprimidos recubiertos con película de Axura® 15 mg 7 comprimidos recubiertos con película de Axura® 20 mg
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Un comprimido al día
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
Semana 1, 2, 3, 4
Día 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28,
16. INFORMACIÓN EN BRAILLE
1. NOMBRE DEL MEDICAMENTO
Axura® 5mg,
Axura® 10 mg Axura® 15 mg Axura® 20 mg
Comprimidos recubiertos con película
2. PRINCIPIO(S) ACTIVO(S)
Clorhidrato de memantina
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Cada envase con 28 comprimidos recubiertos con película para un programa de 4 semanas de tratamiento contiene:
7 x Axura® 5 mg 7 x Axura® 10 mg 7 x Axura® 15 mg 7 x Axura® 20 mg
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
UNA VEZ AL DÍA
Para continuar con el tratamiento, consulte con su médico o farmacéutico.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/YYYY}
9 CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO
UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/016 28 comprimidos recubiertos con película EU/1/02/218/023 28 comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote {number}
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
1. NOMBRE DEL MEDICAMENTO
Axura® 5 mg, Axura® 10 mg, Axura® 15 mg, Axura® 20 mg Clorhidrato de memantina
2. NOMBRE DEL TITULAR DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH
3. FECHA DE CADUCIDAD
CAD {MM/YYYY} Ver la marca impresa
4. NÚMERO DE LOTE
Lote {number}
Ver la marca impresa
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Axura 20 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Comprimidos recubiertos con película.
14 comprimidos recubiertos con película. 28 comprimidos recubiertos con película. 42 comprimidos recubiertos con película. 56 comprimidos recubiertos con película. 98 comprimidos recubiertos con película.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar este medicamento. Una vez al día
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/017 14 Comprimidos recubiertos con película EU/1/02/218/018 28 Comprimidos recubiertos con película EU/1/02/218/019 42 Comprimidos recubiertos con película EU/1/02/218/020 56 Comprimidos recubiertos con película EU/1/02/218/021 98 Comprimidos recubiertos con película EU/1/02/218/024 14 Comprimidos recubiertos con película EU/1/02/218/025 28 Comprimidos recubiertos con película EU/1/02/218/026 42 Comprimidos recubiertos con película EU/1/02/218/027 56 Comprimidos recubiertos con película EU/1/02/218/028 98 Comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Axura 20 mg comprimidos
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
EMBALAJE PARA EL ENVASE INTERMEDIO DE 42 COMPRIMIDOS / QUE FORMA PARTE DE UN ENVASE MÚLTIPLE (SIN “BLUE BOX”)
1. NOMBRE DEL MEDICAMENTO
Axura 20 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubiertos con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Comprimidos recubiertos con película. 42 comprimidos recubiertos con película.
Parte de un envase múltiple de 20 envases, cada uno contiene 42 comprimidos recubiertos con película. No pueden venderse por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar este medicamento. Una diaria
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/022 840 (20 x 42) Comprimidos recubiertos con película EU/1/02/218/029 840 (20 x 42) Comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Axura 20 mg comprimidos
1. NOMBRE DEL MEDICAMENTO
Axura 20 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Envase múltiple de 840 comprimidos recubiertos con película formado por 20 envases que contienen cada uno 42 comprimidos recubiertos con película.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral. Leer el prospecto antes de utilizar este medicamento. Una vez al día
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Merz Pharmaceuticals GmbH Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/218/022 840 (20 x 42) Comprimidos recubiertos con película EU/1/02/218/029 840 (20 x 42) Comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS BLISTER PARA COMPRIMIDOS
1. NOMBRE DEL MEDICAMENTO
Axura 20 mg comprimidos recubiertos con película Clorhidrato de memantina
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharmaceuticals GmbH
3. FECHA DE CADUCIDAD
CAD {MM/AAAA} Ver el margen.
4. NÚMERO DE LOTE
Lote {número} Ver el margen.
5. OTROS
Lun ^ Mar ^ Mie^ Jue
Vie
Sab ^ Dom
B. PROSPECTO
Prospecto: información para el usuario
Axura 10 mg comprimidos recubiertos con película
Clorhidrato de memantina
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Axura y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Axura
3. Cómo tomar Axura
4. Posibles efectos adversos
5. Conservación de Axura
6. Contenido del envase e información adicional
1. Qué es Axura y para qué se utiliza
Cómo actúa Axura
Axura contiene el principio activo clorhidrato de memantina.
Axura pertenece a un grupo de medicamentos conocidos como medicamentos anti-demencia.
La pérdida de memoria en la enfermedad de Alzheimer se debe a una alteración en las señales del cerebro. El cerebro contiene los llamados receptores N-metil-D-aspartato (NMDA) que participan en la transmisión de señales nerviosas importantes en el aprendizaje y la memoria. Axura pertenece al grupo de medicamentos llamados antagonistas de los receptores NMDA. Axura actúa sobre estos receptores mejorando la transmisión de las señales nerviosas y la memoria.
Para que se utiliza Axura:
Axura se utiliza en el tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
2. Qué necesita saber antes de empezar a tomarAxura No tome Axura
- si es alérgico (hipersensible) al clorhidrato de memantina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Axura
- si tiene antecedentes de crisis epilépticas (convulsiones) .
- si ha sufrido recientemente un infarto de miocardio (ataque al corazón), si sufre enfermedad cardíaca congestiva o si tiene hipertensión no controlada (tensión arterial elevada).
En las situaciones anteriores, el tratamiento debe ser supervisado cuidadosamente y el médico debe reevaluar el beneficio clínico de Axura regularmente.
Si padece insuficiencia renal (problemas de riñón) su médico debe controlar atentamente la función renal y si es necesario, adaptar las dosis de memantina.
Se debe evitar el uso de memantina junto con otros medicamentos como amantadina (para el tratamiento del Parkinson), ketamina (fármaco generalmente usado para producir anestesia), dextrometorfano (fármaco para el tratamiento de la tos) y otros antagonistas del NMDA.
No se recomienda el uso de Axura en niños y adolescentes menores de 18 años.
Toma de Axura con otros medicamentos
Comunique a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
En concreto, la administración de Axura puede producir cambios en los efectos de los siguientes medicamentos, por lo que puede que su médico necesite ajustar las dosis:
amantadina, ketamina, dextrometorfano. dantroleno, baclofeno.
cimetidina, ranitidina, procainamida, quinidina, quinina, nicotina. hidroclorotiazida (o cualquier combinación con hidroclorotiazida).
anticolinérgicos (sustancias generalmente utilizadas para tratar alteraciones del movimiento o espasmos intestinales).
anticonvulsivantes (sustancias utilizadas para prevenir y eliminar las convulsiones). barbitúricos (sustancias generalmente utilizadas para inducir el sueño). agonistas dopaminérgicos (sustancias como L-dopa, bromocriptina). neurolépticos (sustancias utilizadas en el tratamiento de enfermedades mentales). anticoagulantes orales.
Si ingresa en un hospital, informe a su médico que está tomando Axura.
Toma de Axura con alimentos y bebidas
Debe informar a su médico si ha cambiado recientemente o tiene la intención de cambiar su dieta de manera sustancial (por ejemplo de dieta normal a dieta vegetariana estricta) o si padece acidosis tubular renal (ATR, exceso de sustancias productoras de ácido en la sangre debido a una disfunción renal [problema de riñón]) o infecciones graves del tracto urinario (conducto de la orina), ya que su médico puede tener que ajustar la dosis del medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo: No se recomienda el uso de memantina en mujeres embarazadas.
Lactancia: Las mujeres que toman Axura deben suspender la lactancia natural.
Conducción y uso de máquinas:
Su médico le informará de si su enfermedad le permite conducir y usar máquinas con seguridad. Asimismo, Axura puede alterar su capacidad de reacción, por lo que la conducción o el manejo de máquinas pueden resultar inapropiados.
3. Cómo Tomar Axura
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda pregunte a su médico o farmacéutico.
Posología
La dosis recomendada de Axura en pacientes adultos y pacientes de edad avanzada es de 20 mg administrados una vez al día. Para reducir el riesgo de efectos adversos, esta dosis se alcanza gradualmente siguiendo el siguiente esquema diario:
|
semana 1 |
medio comprimido de 10 mg |
|
semana 2 |
un comprimido de 10 mg |
|
semana 3 |
un comprimido y medio de 10 mg |
|
semana 4 y siguientes |
dos comprimidos de 10 mg una vez al día |
La dosis normal de inicio es de medio comprimido una vez al día (1 x 5mg) la primera semana. Se aumenta un comprimido al día (1 x 10 mg) la segunda semana y a 1 comprimido y medio una vez al día en la tercera semana. De la cuarta semana en adelante, la dosis normal es de 2 comprimidos administrados una vez al día (1 x 20 mg).
Posología para pacientes con insuficiencia renal
Si padece problemas de riñón, su médico decidirá la dosis apropiada para su condición. En este caso, su médico debe controlar periódicamente su función renal.
Administración
Axura debe administrarse por vía oral una vez al día. Para sacar el máximo provecho de su medicación, deberá tomarla todos los días y a la misma hora. Los comprimidos se deben tragar con un poco de agua. Los comprimidos se pueden tomar con o sin alimentos.
Duración del tratamiento
Continúe tomando Axura mientras sea beneficioso para usted. El médico debe evaluarlos efectos de su tratamiento periódicamente.
Si toma más Axura del que debiera
- En general, tomar una cantidad excesiva de Axura no debería provocarle ningún daño. Puede experimentar un aumento de los síntomas descritos en la sección 4 “Posibles efectos adversos”.
- Si toma una sobredosis de Axura, póngase en contacto con su médico o pida consejo médico, ya que podría necesitar atención médica.
Si olvidó tomar Axura
- Si se da cuenta de que ha olvidado tomar su dosis de Axura, espere y tome la siguiente dosis a la hora habitual.
- No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento , pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
En general los efectos adversos se clasifican de leves a moderados.
Frecuentes (que afecta a entre 1 y 10 de cada 100pacientes):
• Dolor de cabeza, somnolencia, estreñimiento, pruebas de la función del hígado elevadas, vértigo, alteración del equilibrio, falta de aliento, tensión alta e hipersensibilidad al medicamento.
Poco frecuentes (que afecta a entre 1 y 10 de cada 1000 pacientes):
• Cansancio, infecciones por hongos, confusión, alucinaciones, vómitos, alteración de la marcha, insuficiencia cardíaca y formación de coágulos en el sistema venoso (trombosis/tromboembolismo venoso)
Muy raros (afectan a menos de 1 de cada 10.000personas):
• Convulsiones.
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• Inflamación del páncreas, hepatitis (inflamación del hígado) y reacciones psicóticas.
La enfermedad de Alzheimer se ha relacionado con depresión, ideación suicida y suicidio. Se ha informado de la aparición de éstos acontecimientos en pacientes tratados con Axura.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V.
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Axura
Mantener fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el cartón y en el blister después de CAD. La fecha de caducidad es el último día del mes que se indica.
No se precisan condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los
medicamentos que no necesita en el Punto SIGRE Qd de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Axura
El principio activo es clorhidrato de memantina. Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina que equivalen a 8,31 mg de memantina.
Los demás componentes son celulosa microcristalina, croscarmelosa sódica, sílice coloidal anhidra,y estearato de magnesio, en el núcleo del comprimido; e hipromelosa, dióxido de titanio (E 171), macrogol 400 y óxido de hierro amarillo (E 172) en la cubierta del comprimido.
Aspecto del producto y contenido del envase
Axura se presenta en forma de comprimidos recubiertos con película de color de amarillo pálido a amarillo, forma ovalada con una línea de rotura con grabado “1 0” en una cara y “M M” en la otra cara.
Axura comprimidos se presenta en envases de 14 comprimidos, 28 comprimidos, 30 comprimidos, 42 comprimidos, 50 comprimidos, 56 comprimidos, 98 comprimidos, 100 comprimidos, 112 comprimidos o envase múltiple con 840 (20 x42) comprimidos, 980 (10x98) comprimidos y 1000 (20x50) comprimidos.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Merz Pharmaceuticals GmbH,
Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania.
Responsable de la fabricación
Merz Pharma GmbH + Co. KGaA Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania.
medicamento dirigiéndose al representante local del
Lietuva
H. Abbe Pharma GmbH Tel.: +370 52 711710
Luxembourg/Luxemburg
Hanff s.á r.l. et cie, s.e.c.s.
Tél: +352 45 07 07-1
Magyarország
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Malta
Clinipharm Co. Ltd Tel: +356 21 43 74 15
Nederland
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Norge
Merz Pharmaceuticals GmbH Tlf: +49 (0)69 1503 - 0
Osterreich
Merz Pharma Austria GmbH Tel: +43 1 869 16 04-0
Polska
Natur Produkt Zdrovit Sp. z.o.o. Tel: +48 22 56 98 200
Pueden solicitar más información respecto a este titular de la autorización de comercialización
Belgique/Belgie/Belgien
Merz Pharmaceuticals GmbH Tél/Tel: +49 (0)69 1503 - 0
Bt^rapnn
Merz Pharmaceuticals GmbH Tel.: +49 (0)69 1503 - 0
Ceská republika
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Danmark
Merz Pharmaceuticals GmbH Tlf: +49 (0)69 1503 - 0
Deutschland
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Eesti
H. Abbe Pharma GmbH Tel.: +372 6 460980
EXXáóa
Merz Pharmaceuticals GmbH Tr(k: +49 (0)69 1503 - 0
España
Merz Pharma España S.L.
Tel: +34 91 657 47 84
|
France Merz Pharmaceuticals GmbH Tél: +49 (0)69 1503 - 0 |
Portugal Merz Pharma España S.L. Tel: +34 91 657 47 84 |
|
Hrvatska Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Romania Merz Pharmaceuticals GmbH Tel.: +49 (0)69 1503 - 0 |
|
Ireland Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Slovenija Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Ísland Merz Pharmaceuticals GmbH Sími.: +49 (0)69 1503 - 0 |
Slovenská republika Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Italia Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Suomi/Finland Merz Pharmaceuticals GmbH Puh/Tel: +49 (0)69 1503 - 0 |
|
Kúnpoq Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Sverige Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Latvija H. Abbe Pharma GmbH Tel.: +371 67 103203 |
United Kingdom Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea
de Medicamentos: http://www.ema.europa.eu.
Prospecto: información para el usuario
Axura 5 mg/pulsación solución oral
Clorhidrato de memantina
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Axura y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Axura
3. Cómo tomar Axura
4. Posibles efectos adversos
5. Conservación de Axura
6. Contenido del envase e información adicional
1. Qué es Axura y para qué se utiliza
Cómo actúa Axura
Axura contiene el principio activo clorhidrato de memantina.
Axura pertenece a un grupo de medicamentos conocidos como medicamentos anti-demencia.
La pérdida de memoria en la enfermedad de Alzheimer se debe a una alteración en las señales del cerebro. El cerebro contiene los llamados receptores N-metil-D aspartato (NMDA) que participan en la transmisión de señales nerviosas importantes en el aprendizaje y la memoria. Axura pertenece al grupo de medicamentos llamados antagonistas de los receptores NMDA. Axura actúa sobre éstos receptores mejorando la transmisión de las señales nerviosas y la memoria.
Para que se utiliza Axura
Axura se utiliza en el tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
2. Qué necesita saber antes de empezar a tomarAxura
No tome Axura
- si es alérgico (hipersensible) al clorhidrato de memantina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Axura
- si tiene antecedentes de crisis epilépticas (convulsiones)
- si ha sufrido recientemente un infarto de miocardio (ataque al corazón), si sufre enfermedad cardiaca congestiva o si tiene hipertensión no controlada (tensión arterial elevada).
- En las situaciones anteriores, el tratamiento debe ser supervisado cuidadosamente y el médico debe reevaluar el beneficio clínico de Axura regularmente.
Si padece insuficiencia renal (problema de riñón), su médico debe controlar atentamente la función
renal y si es necesario, adaptar las dosis de memantina.
Se debe evitar el uso de memantina junto con otros medicamentos como amantadina (para el tratamiento del Parkinson), ketamina (fármaco generalmente usado para producir anestesia), dextrometorfano (fármaco para el tratamiento de la tos) y otros antagonistas del NMDA.
No se recomienda el uso de Axura en niños y adolescentes menores de 18 años.
Toma de Axura con otros medicamentos
Comunique a su médico o farmacéutico si está utilizando o ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
En concreto, la administración de Axura puede producir cambios en los efectos de los siguientes medicamentos y es posible que, por lo que puede que su médico necesite ajustar la dosis:
amantadina, ketamina, dextrometorfano. dantroleno, baclofeno.
cimetidina, ranitidina, procainamida, quinidina, quinina, nicotina. hidroclorotiazida (o cualquier combinación con hidroclorotiazida).
anticolinérgicos (sustancias generalmente utilizadas para tratar alteraciones del movimiento o espasmos intestinales).
anticonvulsivantes (sustancias utilizadas para prevenir y eliminar las convulsiones) barbitúricos (sustancias generalmente utilizadas para inducir el sueño) agonistas dopaminérgicos (sustancias como L-dopa, bromocriptina) neurolépticos (sustancias utilizadas en el tratamiento de enfermedades mentales). anticoagulantes orales.
Si ingresa en un hospital, informe a su médico que está tomando Axura.
Toma de Axura con alimentos y bebidas
Debe informar a su médico si ha cambiado recientemente o tiene la intención de cambiar su dieta de manera sustancial (por ejemplo de dieta normal a dieta vegetariana estricta) o si padece acidosis tubular renal (ATR, exceso de sustancias productoras de ácido en la sangre debido a una disfunción renal [problema de riñón]) o infecciones graves del tracto urinario (conducto de la orina), ya que su médico puede tener que ajustar la dosis del medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo: No se recomienda el uso de memantina en mujeres embarazadas.
Lactancia: Las mujeres que toman Axura deben suspender la lactancia natural.
Conducción y uso de máquinas
Su médico le informará de si su enfermedad le permite conducir y usar máquinas con seguridad. Asimismo, Axura puede alterar su capacidad de reacción, por lo que la conducción o el manejo de máquinas pueden resultar inapropiados.
Axura contiene sorbitol
Este medicamento contiene sorbitol. Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar éste medicamento. Su médico le aconsejará lo más adecuado.
Además éste medicamento contiene potasio, menos de 1 mmol (39 mg) por dosis, es decir, esencialmente libre de potasio.
3. Cómo tomar Axura
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda pregunte a su médico o farmacéutico
Posología
Una pulsación contiene 5 mg de clorhidrato de memantina.
La dosis recomendada de Axura en pacientes adultos y pacientes de edad avanzada es de cuatro pulsaciones, equivalentes a 20 mg al día.
Para reducir el riesgo de efectos adversos, esta dosis se alcanza gradualmente siguiendo el siguiente esquema diario:
|
semana 1 |
una pulsación. |
|
semana 2 |
dos pulsaciones |
|
semana 3 |
tres pulsaciones. |
|
semana 4 y siguientes |
cuatro pulsaciones. |
La dosis habitual de inicio es de una pulsación (1 x 5 mg) una vez al día la primera semana. Esta dosis se aumenta a dos pulsaciones una vez al día la segunda semana (1 x 10 mg) y a 3 pulsaciones (1 x 15 mg) una vez al día la tercera semana. Desde la cuarta semana, la dosis recomendada es de 4 pulsaciones una vez al día (1x 20 mg).
Posología para pacientes con función renal reducida
Si padece problemas de riñón, su médico decidirá la dosis apropiada para su condición. En este caso, su médico debe controlar periódicamente su función renal.
Administración
Axura debe administrarse por vía oral una vez al día. Para sacar el máximo provecho de su medicación, deberá tomarla todos los días y a la misma hora. La solución se debe tomar con un poco de agua. La solución se puede tomar con o sin alimentos.
Para instrucciones detalladas sobre la preparación y manejo del producto ver el final de este prospecto. Duración del tratamiento
Continúe tomando Axura mientras le beneficie. El médico debe evaluar su tratamiento periódicamente.
Si toma más Axura del que debiera
- En general, tomar una cantidad excesiva de Axura no debe provocarle ningún daño. Puede experimentar un aumento de los síntomas descritos en la sección 4 “Posibles efectos adversos”.
- Si toma una sobredosis de Axura, póngase en contacto con su médico o pida consejo médico, ya que podría necesitar atención médica.
Si olvidó tomar Axura
- Si se da cuenta de que ha olvidado tomar su dosis de Axura, espere y tome la siguiente dosis a la hora habitual.
- No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
En general los efectos adversos se clasifican de leves a moderados.
Frecuentes (que afecta a entre 1 y 10 de cada 100pacientes):
• Dolor de cabeza, somnolencia, estreñimiento, pruebas de la función del hígado elevadas, vértigo, alteración del equilibrio, falta de aliento, tensión alta e hipersensibilidad al medicamento.
Poco frecuentes (que afecta a entre 1 y 10 de cada 1.000 pacientes) :
• Cansancio, infecciones por hongos, confusión, alucinaciones, vómitos, alteración de la marcha, insuficiencia cardíaca y formación de coágulos en el sistema venoso (trombosis/tromboembolismo venoso)
Muy raros (que afecta a menos de 1 de cada 10.000personas):
• Convulsiones.
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• Inflamación del páncreas, hepatitis (inflamación del hígado) y reacciones psicóticas.
La enfermedad de Alzheimer se ha relacionado con depresión, ideación suicida y suicidio. Se ha informado de la aparición de éstos acontecimientos en pacientes tratados con Axura.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Axura
Mantener fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el cartón y en la etiqueta del frasco después de CAD. La fecha de caducidad es el último día del mes que se indica
No conservar a temperatura superior a 30°C.
Una vez abierto, el contenido del frasco debe ser utilizado en 3 meses.
El frasco que tiene la bomba montada tiene que conservarse y transportarse únicamente en posición vertical.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los
medicamentos que no necesita en el Punto SIGRE Qd de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Axura
El principio activo es clorhidrato de memantina.
Cada pulsación del dosificador libera 0,5 ml de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
Los demás componentes son sorbato potásico, sorbitol E 420 y agua purificada.
Aspecto del producto y contenido del envase
Axura, solución oral, es una solución transparente, de incolora a ligeramente amarillenta.
Axura, solución oral, se presenta en frascos de 50 ml, 100 ml ó envase múltiple con 500ml (10 x 50 ml).
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Merz Pharmaceuticals GmbH,
Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
Responsable de la fabricación
Merz Pharma GmbH + Co. KGaA Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania
medicamento dirigiéndose al representante local del
Lietuva
H. Abbe Pharma GmbH Tel.: +370 52 711710
Luxembourg/Luxemburg
Hanff s.á r.l. et cie, s.e.c.s.
Tél: +352 45 07 07-1
Magyarország
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Malta
Clinipharm Co. Ltd Tel: +356 21 43 74 15
Nederland
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Norge
Merz Pharmaceuticals GmbH Tlf: +49 (0)69 1503 - 0
Osterreich
Merz Pharma Austria GmbH Tel: +43 1 869 16 04-0
Polska
Natur Produkt Zdrovit Sp. z.o.o. Tel: +48 22 56 98 200
Pueden solicitar más información respecto a este titular de la autorización de comercialización.
Belgique/Belgie/Belgien
Merz Pharmaceuticals GmbH Tél/Tel: +49 (0)69 1503 - 0
Bt^rapnn
Merz Pharmaceuticals GmbH Tel.: +49 (0)69 1503 - 0
Ceská republika
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Danmark
Merz Pharmaceuticals GmbH Tlf: +49 (0)69 1503 - 0
Deutschland
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Eesti
H. Abbe Pharma GmbH Tel.: +372 6 460980
ELXáóa
Merz Pharmaceuticals GmbH T^k: +49 (0)69 1503 - 0
España
Merz Pharma España S.L.
Tel: +34 91 657 47 84
France
Merz Pharmaceuticals GmbH Tél: +49 (0)69 1503 - 0
Hrvatska
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Ireland
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Ísland
Merz Pharmaceuticals GmbH Sími.: +49 (0)69 1503 - 0
Italia
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Kúrcpog
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Latvija
H. Abbe Pharma GmbH Tel.: +371 67 103203
Portugal
Merz Pharma España S.L. Tel: +34 91 657 47 84
Romania
Merz Pharmaceuticals GmbH Tel.: +49 (0)69 1503 - 0
Slovenija
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Slovenská republika
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Suomi/Finland
Merz Pharmaceuticals GmbH Puh/Tel: +49 (0)69 1503 - 0
Sverige
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
United Kingdom
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Fecha de la última revisión de este prospecto: (MM/AAAA}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Instrucciones para el uso correcto del dosificador
La solución no debe verterse o dispensarse dentro de la boca directamente desde el frasco o el dosificador. Medir la dosis en una cuchara o dentro de un vaso de agua usando el dosificador.
Sacar el tapón de rosca del frasco:
El tapón debe girarse en el sentido contrario a las agujas del reloj, desenroscarse completamente y sacarse (fig.1).

Montaje del dosificador en el frasco:
Sacar el dosificador de la bolsa de plástico (fig.2) y colocarlo encima del frasco. Introducir hacia abajo el tubo de plástico cuidadosamente dentro del frasco. Mantener el dosificador en el cuello del frasco y girar en el sentido de las agujas del reloj hasta que esté unido firmemente (fig.3). El dosificador solo debe enroscarse una vez al iniciar el uso y nunca debe desenroscarse.

El cabezal del dosificador tiene dos posiciones y se gira fácilmente -dirección contraria al sentido de las agujas del reloj para abrir -dirección en el sentido de las agujas del reloj para cerrar
El cabezal del dosificador no debe pulsarse hacia abajo mientras esté en la posición cerrada. La solución solo puede dispensarse en la posición abierta. Para abrir, girar el cabezal del dosificador en la dirección que indica la flecha hasta que no se pueda más (alrededor de un octavo de giro, fig.4). El dosificador está entonces listo para su uso.

Cuando se utiliza por primera vez, el dosificador no dispensa la cantidad correcta de solución oral. Por tanto debe prepararse (cebarse) pulsando el cabezal del dosificador hacia abajo completamente durante cinco veces seguidas (fig.5).

La solución así dispensada debe desecharse. La siguiente vez que el cabezal del dosificador se pulsa hacia abajo completamente (equivalente a una pulsación), ya dispensa la dosis correcta (fig.6).

Colocar el frasco en una superficie plana, horizontal, por ejemplo encima de una mesa, y solo debe usarse en posición vertical. Colocar un vaso con un poco de agua o una cuchara debajo de la boquilla. Pulsar el cabezal del dosificador hacia abajo firmemente pero tranquilamente y de forma sostenida-no
demasiado despacio (fig.7, fíg.8).

El dosificador debe solo usarse con Axura solución en frasco proporcionado, no para otros productos o envases. Si el dosificador no funciona correctamente, consulte a su médico o farmacéutico. Cierre el dosificador después de usar Axura.
Prospecto: información para el usuario
Axura 5 mg comprimidos recubiertos con película Axura 10 mg comprimidos recubiertos con película Axura 15 mg comprimidos recubiertos con película Axura 20 mg comprimidos recubiertos con película Clorhidrato de memantina
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Axura y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Axura
3. Cómo tomar Axura
4. Posibles efectos adversos
5. Conservación de Axura
6. Contenido del envase e información adicional
1. Qué es Axura y para qué se utiliza
Cómo actúa Axura
Axura contiene el principio activo clorhidrato de memantina.
Axura pertenece a un grupo de medicamentos conocidos como medicamentos anti-demencia.
La pérdida de memoria en la enfermedad de Alzheimer se debe a una alteración en las señales del cerebro. El cerebro contiene los llamados receptores N-metil-D aspartato (NMDA) que participan en la transmisión de señales nerviosas importantes en el aprendizaje y la memoria. Axura pertenece al grupo de medicamentos llamados antagonistas de los receptores NMDA. Axura actúa sobre estos receptores mejorando la transmisión de las señales nerviosas y la memoria.
Para que se utiliza Axura
Axura se utiliza en el tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
2. Qué necesita saber antes de empezar a tomar Axura No tome Axura
- si es alérgico (hipersensible) al clorhidrato de memantina o a cualquiera de los demás componentes de los comprimidos de Axura (ver sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Axura
- si tiene antecedentes de crisis epilépticas (convulsiones).
- si ha sufrido recientemente un infarto de miocardio (ataque al corazón), si sufre enfermedad cardíaca congestiva o si tiene hipertensión no controlada (tensión arterial elevada).
En las situaciones anteriores, el tratamiento debe ser supervisado cuidadosamente y el médico debe reevaluar el beneficio clínico de Axura regularmente.
Si padece una insuficiencia renal (problema de riñón), su médico debe controlar atentamente la función renal y si es necesario, adaptar las dosis de memantina.
Se debe evitar el uso de memantina junto con otros medicamentos como amantadina (para el tratamiento del Parkinson), ketamina (fármaco generalmente usado para producir anestesia), dextrometorfano (fármaco para el tratamiento de la tos) y otros antagonistas del NMDA.
No se recomienda el uso de Axura en niños y adolescentes menores de 18 años.
Toma de Axura con otros medicamentos Comunique a su médico o farmacéutico si está utilizando o ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
En concreto, la administración de Axura puede producir cambios en los efectos de los siguientes medicamentos, por lo que puede que su médico necesite ajustar la dosis:
amantadina, ketamina, dextrometorfano. dantroleno, baclofeno.
cimetidina, ranitidina, procainamida, quinidina, quinina, nicotina. hidroclorotiazida (o cualquier combinación con hidroclorotiazida).
anticolinérgicos (sustancias generalmente utilizadas para tratar alteraciones del movimiento o espasmos intestinales).
anticonvulsivantes (sustancias utilizadas para prevenir y eliminar las convulsiones) barbitúricos (sustancias generalmente utilizadas para inducir el sueño) agonistas dopaminérgicos (sustancias como L-dopa, bromocriptina) neurolépticos (sustancias utilizadas en el tratamiento de enfermedades mentales). anticoagulantes orales.
Si ingresa en un hospital, informe a su médico que está tomando Axura.
Toma de Axura con alimentos y bebidas
Debe informar a su médico si ha cambiado recientemente o tiene la intención de cambiar su dieta de manera sustancial (por ejemplo de dieta normal a dieta vegetariana estricta) o si padece acidosis tubular renal (ATR, exceso de sustancias productoras de ácido en la sangre debido a una disfunción renal [problema de riñón]) o infecciones graves del tracto urinario (conducto de la orina), ya que su médico puede tener que ajustar la dosis del medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo: No se recomienda el uso de memantina en mujeres embarazadas.
Lactancia: Las mujeres que toman Axura deben suspender la lactancia natural.
Conducción y uso de máquinas
Su médico le informará de si su enfermedad le permite conducir y usar máquinas con seguridad. Asimismo, Axura puede alterar su capacidad de reacción, por lo que la conducción o el manejo de máquinas pueden resultar inapropiados.
3. Cómo tomar Axura
El envase con el tratamiento de inicio de Axura sólo debe usarse al principio del tratamiento con Axura.
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda pregunte a su médico o farmacéutico
Posología
La dosis recomendada es de 20 mg al día, que se alcanza mediante incrementos graduales de la dosis de Axura durante las primeras 3 semanas de tratamiento. El esquema de tratamiento también se indica en el envase de tratamiento de inicio. Tome un comprimido una vez al día.
Semana 1 (día 1-7)
Tome un comprimido de 5 mg una vez al día (de blanco a blanquecino, fusiforme) durante 7 días. Semana 2 (día 8-14)
Tome un comprimido de 10 mg una vez al día (de amarillo pálido a amarillo, forma ovalada) durante 7 días.
Semana 3 (día 15-21)
Tome un comprimido de 15 mg una vez al día (de naranja pálido a naranja grisáceo y fusiforme) durante 7 días.
Semana 4 (día 22-28)
Tome un comprimido de 20 mg una vez al día (de rojo pálido a rojo grisáceo y fusiforme) durante 7 días.
|
semana 1 |
comprimido de 5 mg |
|
semana 2 |
comprimido de 10 mg |
|
semana 3 |
comprimido de 15 mg |
|
semana 4 y siguientes |
comprimido de 20 mg una vez al día |
Dosis de mantenimiento
La dosis diaria recomendada es de 20 mg una vez al día.
Para continuar el tratamiento consulte a su médico.
Posología para pacientes con insuficiencia renal
Si padece problemas de riñón, su médico decidirá la dosis apropiada para su condición. En este caso, su médico debe controlar periódicamente su función renal.
Administración
Axura debe administrarse por vía oral una vez al día. Para sacar el máximo provecho de su medicación, deberá tomarla todos los días y a la misma hora. Los comprimidos se deben tragar con un poco de agua. Los comprimidos se pueden tomar con o sin alimentos.
Duración del tratamiento
Continúe tomando Axura mientras sea beneficioso para usted.. El médico debe evaluarlos efectos de su tratamiento periódicamente.
Si toma más Axura del que debiera
- En general, tomar una cantidad excesiva de Axura no debería provocarle ningún daño. Puede experimentar un aumento de los síntomas descritos en la sección 4 “Posibles efectos adversos”.
- Si toma una sobredosis de Axura, póngase en contacto con su médico o pida consejo médico, ya que podría necesitar atención médica.
Si olvidó tomar Axura
Si se da cuenta de que ha olvidado tomar su dosis de Axura, espere y tome la siguiente dosis a la hora habitual.
- No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
En general los efectos adversos se clasifican de leves a moderados.
Frecuentes (que afecta a entre 1 y 10 de cada 100pacientes):
• Dolor de cabeza, somnolencia, estreñimiento, pruebas de la función del hígado elevadas, vértigo, alteración del equilibrio, falta de aliento, tensión alta e hipersensibilidad al medicamento.
•.
Poco frecuentes (que afecta a entre 1 y 10 de cada 1000 pacientes) :
• Cansancio, infecciones por hongos, confusión, alucinaciones, vómitos, alteración de la marcha, insuficiencia cardíaca y formación de coágulos en el sistema venoso (trombosis/tromboembolismo venoso)
Muy raros (que afecta a menos de 1 de cada 10.000personas):
• Convulsiones.
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• Inflamación del páncreas, hepatitis (inflamación del hígado) y reacciones psicóticas.
La enfermedad de Alzheimer se ha relacionado con depresión, ideación suicida y suicidio. Se ha informado de la aparición de éstos acontecimientos en pacientes tratados con Axura.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Axura
Mantener fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el cartón y en el blister después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de almacenamiento.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los
medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Axura
El principio activo es clorhidrato de memantina. Cada comprimido contiene 5/10/15/20 mg de clorhidrato de memantina, que equivalen a 4,15/8,31/12,46/16,62 mg de memantina.
Los demás componentes de Axura comprimidos recubiertos con película de 5/10/15 y 20 mg son celulosa microcristalina, croscarmelosa sódica, sílice coloidal anhidra, estearato de magnesio en el núcleo del comprimido; e hipromelosa, macrogol 400, dióxido de titanio (E 171) y además, óxido de hierro amarillo (E 172) para Axura 10 mg comprimidos recubiertos con película y para Axura 15 mg y Axura 20 mg comprimidos recubiertos con película, óxido de hierro amarillo y rojo (E 172) en la película de recubrimiento.
Aspecto del producto y contenido del envase
Axura 5 mg comprimidos recubiertos con película tienen un color de blanco a blanquecino y son de fusiformes con el número “5” impreso en una cara y “MEM” en la otra.
Axura 10 mg comprimidos recubiertos con película tienen un color de amarillo pálido a amarillo, forma ovalada con una línea de rotura con grabado “1 0” en una cara y “M M” en la otra cara. amarillo.
El comprimido se puede dividir en mitades iguales.
Axura 15 mg comprimidos recubiertos con película tienen un color de naranja pálido a naranja grisáceo y son de fusiformes con el número “15” impreso en una cara y “MEM” en la otra.
Axura 20 mg comprimidos recubiertos con película de 20 mg tienen un color de rojo pálido a rojo grisáceo y son de fusiformes con el número “20” impreso en una cara y “MEM” en la otra.
Cada envase de tratamiento de inicio contiene 28 comprimidos con 7 comprimidos de Axura 5 mg, 7 comprimidos de Axura 10 mg, 7 comprimidos de Axura 15 mg y 7 comprimidos de Axura 20 mg.
Titular de la autorización de comercialización y responsable de la fabricación
Merz Pharmaceuticals GmbH,
Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania.
Responsable de la fabricación
Merz Pharma GmbH + Co. KGaA Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización
Belgique/Belgie/Belgien
Merz Pharmaceuticals GmbH Tél/Tel: +49 (0)69 1503 - 0
Bt^rapnn
Merz Pharmaceuticals GmbH Tel.: +49 (0)69 1503 - 0
Ceská republika
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Lietuva
H. Abbe Pharma GmbH Tel.: +370 52 711710
Luxembourg/Luxemburg
Hanff s.á r.l. et cie, s.e.c.s. Tél: +352 45 07 07-1
Magyarország
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
|
Danmark Merz Pharmaceuticals GmbH Tlf: +49 (0)69 1503 - 0 |
Malta Clinipharm Co. Ltd Tel: +356 21 43 74 15 |
|
Deutschland Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Nederland Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Eesti H. Abbe Pharma GmbH Tel.: +372 6 460980 |
Norge Merz Pharmaceuticals GmbH Tlf: +49 (0)69 1503 - 0 |
|
ELXáóa Merz Pharmaceuticals GmbH T^: +49 (0)69 1503 - 0 |
Osterreich Merz Pharma Austria GmbH Tel: +43 1 869 16 04-0 |
|
España Merz Pharma España S.L. Tel: +34 91 657 47 84 |
Polska Natur Produkt Zdrovit Sp. z.o.o. Tel: +48 22 56 98 200 |
|
France Merz Pharmaceuticals GmbH Tél: +49 (0)69 1503 - 0 |
Portugal Merz Pharma España S.L. Tel: +34 91 657 47 84 |
|
Hrvatska Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Romania Merz Pharmaceuticals GmbH Tel.: +49 (0)69 1503 - 0 |
|
Ireland Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Slovenija Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Ísland Merz Pharmaceuticals GmbH Sími.: +49 (0)69 1503 - 0 |
Slovenská republika Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Italia Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Suomi/Finland Merz Pharmaceuticals GmbH Puh/Tel: +49 (0)69 1503 - 0 |
|
Kúnpoq Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Sverige Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Latvija H. Abbe Pharma GmbH Tel.: +371 67 103203 |
United Kingdom Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea
de Medicamentos: http://www.ema.europa.eu.
Prospecto: información para el usuario
Axura 20 mg comprimidos recubiertos con película
Clorhidrato de memantina
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Axura y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Axura
3. Cómo tomar Axura
4. Posibles efectos adversos
5. Conservación de Axura
6. Contenido del envase e información adicional
1. Qué es Axura y para qué se utiliza
Cómo actúa Axura
Axura contiene el principio activo clorhidrato de memantina.
Axura pertenece a un grupo de medicamentos conocidos como medicamentos anti-demencia.
La pérdida de memoria en la enfermedad de Alzheimer se debe a una alteración en las señales del cerebro. El cerebro contiene los llamados receptores N-metil-D aspartato (NMDA) que participan en la transmisión de señales nerviosas importantes en el aprendizaje y la memoria. Axura pertenece al grupo de medicamentos llamados antagonistas de los receptores NMDA. Axura actúa sobre estos receptores mejorando la transmisión de las señales nerviosas y la memoria.
Para que se utiliza Axura
Axura se utiliza en el tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
2. Qué necesita saber antes de empezara tomar Axura No tome Axura
- si es alérgico (hipersensible) al clorhidrato de memantina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Axura
- si tiene antecedentes de crisis epilépticas (convulsiones)
- si ha sufrido recientemente un infarto de miocardio (ataque al corazón), si sufre enfermedad cardíaca congestiva o si tiene hipertensión no controlada (tensión arterial elevada).
En las situaciones anteriores, el tratamiento debe ser supervisado cuidadosamente y el médico debe reevaluar el beneficio clínico de Axura regularmente.
Si padece una insuficiencia renal (problema de riñon), su médico debe controlar atentamente la función renal y si es necesario, adaptar las dosis de memantina.
Se debe evitar el uso de memantina junto con otros medicamentos como amantadina (para el tratamiento del Parkinson), ketamina (fármaco generalmente usado para producir anestesia), dextrometorfano (fármaco para el tratamiento de la tos) y otros antagonistas del NMDA.
No se recomienda el uso de Axura en niños y adolescentes menores de 18 años.
Toma de Axura con otros medicamentos
Comunique a su médico o farmacéutico si está utilizando o ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
En concreto, la administración de Axura puede producir cambios en los efectos de los siguientes medicamentos, por lo que puede que su médico necesite ajustar la dosis:
amantadina, ketamina, dextrometorfano. dantroleno, baclofeno.
cimetidina, ranitidina, procainamida, quinidina, quinina, nicotina. hidroclorotiazida (o cualquier combinación con hidroclorotiazida).
anticolinérgicos (sustancias generalmente utilizadas para tratar alteraciones del movimiento o espasmos intestinales).
anticonvulsivantes (sustancias utilizadas para prevenir y eliminar las convulsiones) barbitúricos (sustancias generalmente utilizadas para inducir el sueño) agonistas dopaminérgicos (sustancias como L-dopa, bromocriptina) neurolépticos (sustancias utilizadas en el tratamiento de enfermedades mentales). anticoagulantes orales.
Si ingresa en un hospital, informe a su médico que está tomando Axura.
Toma de Axura con alimentos y bebidas
Debe informar a su médico si ha cambiado recientemente o tiene la intención de cambiar su dieta de manera sustancial (por ejemplo de dieta normal a dieta vegetariana estricta) o si padece acidosis tubular renal (ATR, exceso de sustancias productoras de ácido en la sangre debido a una disfunción renal [problema de riñón]) o infecciones graves del tracto urinario (conducto de la orina), ya que su médico puede tener que ajustar la dosis del medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo:No se recomienda el uso de memantina en mujeres embarazadas.
Lactancia: Las mujeres que toman Axura deben suspender la lactancia natural.
Conducción y uso de máquinas
Su médico le informará de si su enfermedad le permite conducir y usar máquinas con seguridad. Asimismo, Axura puede alterar su capacidad de reacción, por lo que la conducción o el manejo de máquinas pueden resultar inapropiados.
3. Cómo tomar Axura
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda pregunte a su médico o farmacéutico
Posología
La dosis recomendada de Axura en pacientes adultos y pacientes de edad avanzada es de 20 mg administrados una vez al día.
Para reducir el riesgo de aparición de efectos adversos, esta dosis ha de alcanzarse de manera gradual siguiendo un esquema de tratamiento diario. Para ajustar la dosis existen comprimidos con diferentes dosis.
Al inicio del tratamiento empezará a tomar Axura 5 mg comprimidos recubiertos una vez al día. Esta dosis se incrementará de forma semanal en 5 mg hasta alcanzar la dosis recomendada (de mantenimiento). La dosis recomendada de mantenimiento es de 20 mg una vez al día, que se alcanza al comienzo de la cuarta semana.
Posología para pacientes con insuficiencia renal
Si padece problemas de riñón, su médico decidirá la dosis apropiada para su condición. En este caso, su médico debe controlar periódicamente su función renal.
Administración
Axura debe administrarse por vía oral una vez al día. Para sacar el máximo provecho de su medicación, deberá tomarla todos los días y a la misma hora. Los comprimidos se deben tragar con un poco de agua. Los comprimidos se pueden tomar con o sin alimentos.
Duración del tratamiento
Continúe tomando Axura mientras sea beneficioso para usted.. El médico debe evaluarlos efectos de su tratamiento periódicamente.
Si toma más Axura del que debiera
- En general, tomar una cantidad excesiva de Axura no debería provocarle ningún daño. Puede experimentar un aumento de los síntomas descritos en la sección 4 “Posibles efectos adversos”.
- Si toma una sobredosis de Axura, póngase en contacto con su médico o pida consejo médico, ya que podría necesitar atención médica.
Si olvidó tomar Axura
- Si se da cuenta de que ha olvidado tomar su dosis de Axura, espere y tome la siguiente dosis a la hora habitual.
- No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
En general los efectos adversos se clasifican de leves a moderados.
Frecuentes (que afecta a entre 1 y 10 de cada 100pacientes):
• Dolor de cabeza, somnolencia, estreñimiento, pruebas de la función del hígado elevadas, vértigo, alteración del equilibrio, falta de aliento, tensión alta e hipersensibilidad al medicamento.
• y tensión alta.
Poco frecuentes (que afecta a entre 1 y 10 de cada 1000 pacientes) :
• Cansancio, infecciones por hongos, confusión, alucinaciones, vómitos, alteración de la marcha, insuficiencia cardíaca y formación de coágulos en el sistema venoso (trombosis/tromboembolismo venoso)
Muy raros (que afecta a menos de 1 de cada 10.000personas):
• Convulsiones.
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• Inflamación del páncreas, hepatitis (inflamación del hígado) y reacciones psicóticas.
La enfermedad de Alzheimer se ha relacionado con depresión, ideación suicida y suicidio. Se ha informado de la aparición de éstos acontecimientos en pacientes tratados con Axura.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Axura
Mantener fuera de la vista y del alcance de los niños.
No utilice Axura después de la fecha de caducidad que aparece en el cartón y en el blister después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de almacenamiento.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los
medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Axura
El principio activo es clorhidrato de memantina. Cada comprimido contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
Los demás componentes son celulosa microcristalina, croscarmelosa sódica, sílice coloidal anhídrida, estearato de magnesio en el núcleo; e hipromelosa, macrogol 400, dióxido de titanio (E171) y óxido de hierro amarillo y rojo (E 172) en la película de recubrimiento.
Aspecto del producto y contenido del envase
Axura 20 mg comprimidos recubiertos con película tienen un color de rojo pálido a rojo grisáceo y son fusiformes con el número “20” impreso en una cara y “MEM” en la otra.
Axura comprimidos recubiertos con película están disponibles en envases de blisteres de 14, 28, 42, 56, 98 o envase múltiple con 840 (20 x 42) comprimidos.
Puede que no todos los envases estén comercializados.
Titular de la autorización de comercialización y responsable de la fabricación
Merz Pharmaceuticals GmbH,
Eckenheimer Landstr. 100 D-60318 Frankfurt/Main Alemania.
Responsable de la fabricación
Merz Pharma GmbH + Co. KGaA Eckenheimer Landstr. 100
D-60318 Frankfurt/Main Alemania.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización
|
Belgique/Belgie/Belgien Merz Pharmaceuticals GmbH Tél/Tel: +49 (0)69 1503 - 0 |
Lietuva H. Abbe Pharma GmbH Tel.: +370 52 711710 |
|
Bt^rapnn Merz Pharmaceuticals GmbH Tel.: +49 (0)69 1503 - 0 |
Luxembourg/Luxemburg Hanff s.á r.l. et cie, s.e.c.s. Tél: +352 45 07 07-1 |
|
Ceská republika Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Magyarország Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Danmark Merz Pharmaceuticals GmbH Tlf: +49 (0)69 1503 - 0 |
Malta Clinipharm Co. Ltd Tel: +356 21 43 74 15 |
|
Deutschland Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Nederland Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Eesti H. Abbe Pharma GmbH Tel.: +372 6 460980 |
Norge Merz Pharmaceuticals GmbH Tlf: +49 (0)69 1503 - 0 |
|
EkXáda Merz Pharmaceuticals GmbH Tqk: +49 (0)69 1503 - 0 |
Osterreich Merz Pharma Austria GmbH Tel: +43 1 869 16 04-0 |
|
España Merz Pharma España S.L. Tel: +34 91 657 47 84 |
Polska Natur Produkt Zdrovit Sp. z.o.o. Tel: +48 22 56 98 200 |
|
France Merz Pharmaceuticals GmbH Tél: +49 (0)69 1503 - 0 |
Portugal Merz Pharma España S.L. Tel: +34 91 657 47 84 |
|
Hrvatska Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Romania Merz Pharmaceuticals GmbH Tel.: +49 (0)69 1503 - 0 |
|
Ireland Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Slovenija Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
|
Ísland Merz Pharmaceuticals GmbH Sími.: +49 (0)69 1503 - 0 |
Slovenská republika Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0 |
Italia
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Kúrcpog
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Latvija
H. Abbe Pharma GmbH Tel.: +371 67 103203
Suomi/Finland
Merz Pharmaceuticals GmbH Puh/Tel: +49 (0)69 1503 - 0
Sverige
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
United Kingdom
Merz Pharmaceuticals GmbH Tel: +49 (0)69 1503 - 0
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
97