Atrovent Nasal 0,30 Mg/Ml Solucion Para Pulverizacion Nasal
"I
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Atrovent Nasal 0,30 mg/ml solución para pulverización nasal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de solución contiene 0,31 mg de bromuro de ipratropio monohidratado (equivalentes a 0,30 mg de bromuro de ipratropio anhidro).
Una pulverización libera 21,7 mcg de bromuro de ipratropio monohidratado equivalentes a 21 mcg de bromuro de ipratropio anhidro.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Solución para nebulización
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Atrovent Nasal está indicado en el alivio sintomático de la rinorrea en la rinitis alérgica y no alérgica.
4.2 Posología y forma de administración
Adultos y adolescentes mayores de 12 años
2 pulverizaciones en cada fosa nasal (42 mcg/fosa nasal), 2-3 veces al día.
Niños de 6 a 12 años
2 pulverizaciones en cada fosa nasal (42 mcg/fosa nasal), 2 veces al día.
La dosis óptima puede variar según la respuesta individual de cada paciente.
4.3 Contraindicaciones
Atrovent nasal está contraindicado en pacientes con hipersensibilidad conocida a sustancias análogas a la atropina o a cualquier otro componente del preparado.
4.4 Advertencias y precauciones especiales de empleo
Tras la administración de Atrovent, pueden ocurrir reacciones de hipersensibilidad inmediata, tal y como demostraron los casos raros de urticaria, angioedema, erupción cutánea, broncospasmo, edema orofaríngeo y anafilaxia.
Se han comunicado casos aislados de complicaciones oculares (por ejemplo midriasis, presión intraocular aumentada, glaucoma de ángulo estrecho, dolor ocular) por pulverización en los ojos de un aerosol de bromuro de ipratropio sólo o en combinación con un agonista P2 adrenérgico.
Un dolor o molestia ocular, visión borrosa, halos visuales o imágenes coloreadas, junto con enrojecimiento ocular por congestión de la conjuntiva y edema de la córnea, pueden constituir signos de glaucoma agudo de ángulo estrecho. Deberá indicarse al paciente que, en caso de observar cualquier combinación de estos
ÍTTI
síntomas, debe consultar inmediatamente al especialista, el cual instaurará un tratamiento con gotas mióticas si lo considera necesario.
Así pues, es preciso instruir a los pacientes sobre la administración correcta de Atrovent nasal.
Atrovent nasal debe utilizarse con precaución en pacientes con predisposición al glaucoma de ángulo estrecho, o con obstrucción pre-existente del tracto urinario de salida (tales como hiperplasia prostática u obstrucción del cuello de la vejiga).
Los pacientes con fibrosis quística pueden ser más propensos a los trastornos de la motilidad intestinal.
Atrovent nasal contiene cloruro de benzalconio que puede causar irritación de la mucosa nasal.
4.5 Interacción con otros medicamentos y otras formas de interacción
Atrovent nasal pasa a la circulación sistémica sólo en una proporción mínima; sin embargo, existe la posibilidad de interacción aditiva con otros medicamentos anticolinérgicos administrados conjuntamente, incluyendo aerosoles de bromuro de ipratropio para inhalación oral.
No se ha descrito que el uso concomitante de Atrovent nasal con otros fármacos, que habitualmente se prescriben para la rinitis perenne, tales como antihistamínicos, descongestivos o esteroides nasales, aumente la incidencia de efectos secundarios.
4.6 Fertilidad, embarazo y lactancia
No se ha establecido la seguridad de Atrovent nasal durante el embarazo. En caso de sospecha o confirmación de embarazo, deben valorarse los beneficios del tratamiento frente a los posibles riesgos para el feto. Los estudios en ratas, ratones y conejos no mostraron efectos embriotóxicos ni teratogénicos, después de la inhalación de dosis considerablemente superiores a las recomendadas en el ser humano.
Se desconoce si el bromuro de ipratropio se excreta en la leche humana. A pesar de que los cationes cuaternarios no liposolubles pasan a la lecha materna, es improbable que el bromuro de ipratropio pase al lactante en cantidades importantes, especialmente cuando se administra por vía nasal. Sin embargo, debido a que muchos fármacos se excretan en la leche humana, se debe administrar con precaución a las mujeres en período de lactancia.
Los estudios preclínicos realizados con bromuro de ipratropio no mostraron ningún efecto adverso sobre la fertilidad (ver sección Datos preclínicos sobre seguridad). No se dispone de datos clínicos sobre fertilidad para el bromuro de ipratropio.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se dispone de estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se advierte que pueden aparecer efectos adversos como mareos, dificultades en la acomodación visual, midriasis y visión borrosa durante el tratamiento con Atrovent nasal. Por tanto, se recomienda precaución en la conducción y el uso de máquinas. Si los pacientes experimentan estos efectos deberían evitar realizar actividades potencialmente peligrosas como la conducción o la utilización de máquinas.
4.8 Reacciones adversas
Muchas de las reacciones adversas listadas a continuación son debidas a las propiedades anticolinérgicas de Atrovent nasal. Al igual que con cualquier tratamiento tópico, con el uso de Atrovent nasal puede aparecer irritación local. Las reacciones adversas se han recopilado de los ensayos clínicos y de la farmacovigilancia después de la autorización de comercialización del medicamento.
Las reacciones adversas más frecuentes reportadas en los estudios clínicos fueron epistaxis, sequedad nasal, dolor de cabeza, molestias nasales e irritación de garganta.
Las reacciones adversas han sido clasificadas en apartados de frecuencias utilizando el siguiente convenio:
*2
Jll^a
Muy frecuentes (> 1/10); frecuentes (>1/100, <1/10); poco frecuentes (> 1/1.000, <1/100); raras (> 1/10.000, <1/1.000); muy raras (<1/10.000).
Tabla de reacciones adversas
Trastornos en el sistema inmunológico:
Poco frecuentes: Reacciones anafilácticas e hipersensibilidad.
Trastornos del sistema nervioso:
Frecuentes: Dolor de cabeza.
Poco frecuentes: Mareo.
Trastornos oculares.
Poco frecuentes: Glaucoma, presión intraocular aumentada, dolor ocular, midriasis, trastorno de la acomodación visual, visión borrosa, halos visuales, hiperemia conjuntival y edema de córnea.
Trastornos cardiacos:
Poco frecuentes: Taquicardia supraventricular, fibrilación auricular, aumento de la frecuencia cardiaca Raros: Palpitaciones.
Trastornos respiratorios, torácicos y mediastínicos:
Frecuentes: Epistaxis, sequedad nasal, irritación de garganta, molestias nasales.
Poco frecuentes: Garganta seca, broncoespasmo, laringoespasmo, edema faríngeo.
Trastornos gastrointestinales:
Poco frecuentes: Sequedad de boca, náuseas, trastornos de la motilidad gastrointestinal, edema de boca, estomatitis.
Trastornos de la piel y del tejido subcutáneo:
Poco frecuentes: Erupción cutánea, angioedema.
Raros: Prurito, urticaria.
Trastornos renales y urinarios:
Poco frecuentes: Retención urinaria.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
No se han descrito síntomas específicos de una sobredosificación. Debido al amplio margen terapéutico y a la administración tópica de Atrovent nasal, no son de esperar síntomas anticolinérgicos graves. Pueden producirse manifestaciones sistémicas menores de la actividad anticolinérgica, incluyendo sequedad de boca, trastornos de la acomodación visual y aumento de la frecuencia cardíaca.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otras preparaciones nasales, código ATC: R01AX
ÍTTI
El bromuro de ipratropio es un fármaco anticolinérgico, derivado amonio cuaternario de la atropina. Administrado por vía nasal posee una acción bloqueadora parasimpática localizada, reduciendo la hipersecreción acuosa de las glándulas mucosas de la nariz.
Los ensayos de provocación nasal en pacientes con rinitis perenne (n = 44) realizados con el preparado, mostraron un aumento dosis-dependiente de la inhibición de la secreción nasal inducida por metacolina, con un inicio de la acción a los 15 minutos. La duración del efecto fue también dosis dependiente. Ensayos clínicos controlados demostraron que el bromuro de ipratropio nasal es eficaz para controlar la gravedad y duración de la rinorrea, en pacientes con rinitis perenne alérgica y no alérgica. En un estudio de 8 semanas de duración con pacientes adultos con rinitis alérgica, dosis de hasta 168 mcg/fosa nasal dos veces al día fueron bien toleradas y mostraron eficacia con un comienzo más rápido.
Dos ensayos controlados con placebo, en los cuales se administró Atrovent nasal, dos veces al día en adultos y en niños, en pacientes con rinitis perenne alérgica y no alérgica, mostraron que a la dosis de 42 mcg por fosa nasal, fue más eficaz en los pacientes con rinitis perenne no alérgica que alérgica.
La administración de bromuro de ipratropio por vía nasal no tuvo efectos marcados sobre el sentido del olfato, transporte mucociliar nasal, frecuencia del movimiento ciliar o capacidad acondicionadora de aire de la nariz.
5.2 Propiedades farmacocinéticas
Absorción
El ipratropio es una amina cuaternaria que pasa en muy pequeña cantidad a la circulación sistémica a partir de la mucosa nasal.
La absorción sistémica de ipratropio no se alteró por inflamación de la mucosa nasal después de la inducción experimental de un resfriado, según se estimó a partir de datos de excreción renal de ipratropio durante 24 horas.
Asumiendo el valor bibliográfico del 50% de la dosis excretada en la orina después de la administración intravenosa, la estimación de biodisponibilidad del ipratropio tras la administración nasal es menor del 20%.
Distribución
Los parámetros farmacocinéticos básicos se calcularon a partir de los niveles plasmáticos después de la administración intravenosa. Se observó un descenso bifásico rápido del ipratropio en plasma.
El fármaco se une en baja proporción (menos del 20%) a las proteínas plasmáticas. La amina cuaternaria del ipratropio no atraviesa la barrera hematoencefálica
El volumen aparente de distribución en estado estacionario (Vdss) es aproximadamente de 176 litros (~
2,4 litros/kg).
Metabolismo o Biotransformación
El aclaramiento total del principio activo es de 2,3 litros/minuto y el aclaramiento renal es de
0,9 litros/minuto. Tras la administración intravenosa, aproximadamente el 60% de la dosis es metabolizada,
la mayor proporción probablemente sea en el hígado por oxidación.
Eliminación
La vida media de la fase de eliminación terminal fue de aproximadamente 1,6 horas.
Después de una dosis única o de la administración de cuatro dosis diarias, de un 6 a un 8% del ipratropio se excretó en forma no modificada en voluntarios sanos o infectados experimentalmente.
ÍTTI
Después de la administración crónica en pacientes con rinitis, la cantidad de fármaco no modificado excretado en la orina en un período de 24 horas, en el estado de equilibrio, fue del 4-6% de la dosis.
En un estudio de balance de excreción renal acumulativa (6 días) de la radioactividad relacionada con el medicamento (incluido el producto inicial y sus metabolitos) representó el 72,1% tras administración intravenosa, el 9,3% tras administración oral y el 3,2% tras la inhalación. La radioactividad total excretada por vía fecal fue del 6,3% tras administración intravenosa, 88,5% tras administración oral y 69,4% tras administración por vía inhalatoria. Por tanto, la excreción dominante del medicamento marcado radioactivamente ocurre por vía renal. Los principales metabolitos detectados en la orina se unen débilmente al receptor muscarínico y pueden considerarse ineficaces.
5.3 Datos preclínicos sobre seguridad
Se ha investigado la tolerabilidad local y sistémica del bromuro de ipratropio en distintas especies animales y varias vías de administración.
Se evaluó la toxicidad aguda por inhalación, intravenosa y oral en roedores y otras especies no roedoras.
El valor de DL50 oral fue de 1585 mg/kg en ratones, 1925 mg/kg en ratas y 1920 mg/kg en conejos. La DL50 intravenosa fue de 13,6 mg/kg en ratones, 15,8 mg/kg en ratas y 18,2 mg/kg en perros. La baja toxicidad oral comparada con la mayor toxicidad intravenosa refleja la escasa absorción gastrointestinal del bromuro de ipratropio. Los signos clínicos observados incluyen midriasis, sequedad de la mucosa nasal, disnea, temblor, espasmos y/o taquicardia.
Se realizaron estudios de toxicidad en dosis repetidas en ratas, conejos, perros y monos Rhesus. En estudios de administración por inhalación de 6 meses de duración en ratas, perros y monos Rhesus el nivel de dosis sin efecto (NOAEL) fue de 0,38 mg/kg/día, 0,18 mg/kg/día y 0,8 mg/kg/día, respectivamente. Se observó sequedad de la mucosa oral y taquicardia en perros. No se observaron lesiones histopatológicas relacionadas con la sustancia en el sistema broncopulmonar u otros órganos. En ratas, el NOAEL después de la administración oral durante 18 meses fue de 0,5 mg/kg/día. Estudios de toxicidad en dosis repetidas en ratas de 6 meses de duración y en perros durante 3 meses con otras formulaciones (formulación intranasal, con propelente alternativo HFA 134a y con una formulación en polvo con lactosa) no revelaron información adicional al perfil toxicológico del bromuro de ipratropio. La administración intranasal en perros, durante un período de 6 meses, reveló un nivel de dosis sin efecto superior a 0,20 mg/kg/día y confirmaron los estudios anteriores con administración intranasal durante 13 semanas. Los estudios de toxicidad en dosis repetida con la formulación de HFA 134a y con la formulación de CFC muestran perfiles toxicológicos similares.
Se administró a ratas una solución acuosa de bromuro de ipratropio por inhalación (0,05 mg/kg en una dosis única durante 4 horas) y fue bien tolerada localmente. El bromuro de ipratropio presentó buena tolerabilidad a nivel local en los estudios de toxicidad a dosis repetidas.
No se produjeron reacciones de anafilaxia activas ni reacciones anafilácticas cutáneas pasivas en cobayas. Las pruebas de mutagenicidad "in vitro" e "in vivo" no indicaron potencial mutagénico. Tampoco se observaron efectos tumorigénicos ni cancerogénicos en estudios a largo plazo en ratones y ratas.
Se realizaron estudios para investigar la posible influencia del bromuro de ipratropio en la fertilidad, embriofetotoxicidad y desarrollo peri y postnatal en ratones, ratas y conejos. Dosis elevadas por vía oral de 1000 mg/kg/día en ratas y 125 mg/kg/día en conejos fueron maternotóxicos para ambas especies y embriofetotóxicos en ratas, donde se produjo una disminución del peso del feto. No se observaron malformaciones relacionadas con el tratamiento. Las dosis más elevadas técnicamente posibles por inhalación del aerosol dosificador, 1,5 mg/kg/día en ratas y 1,8 mg/kg/día en conejos, no mostraron efectos adversos sobre la reproducción.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de sodio Cloruro de benzalconio Edetato de disodio Agua purificada
Para el ajuste del pH se utilizan ácido clorhídrico e hidróxido de sodio.
6.2 Incompatibilidades No se han descrito.
6.3 Periodo de validez
2 años
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Atrovent nasal se presenta en un envase de vidrio conteniendo 15 ml (180 pulverizaciones) de una solución acuosa transparente incolora, ajustada al pH óptimo de 4,0-5,0. Incluye una válvula dosificadora que se activa manualmente, liberando 70 mcl/pulverización.
6.6 Precauciones especiales de eliminación y otras manipulaciones
1) Retirar el capuchón protector.
2) Antes de utilizar el pulverizador por primera vez, presionar repetidamente (aproximadamente 7 veces) hasta que se libere la primera nebulización (ver figura 1). Para activar la bomba, coger el frasco con los dedos pulgar, índice y medio.
Asegurarse de que el frasco se dirige hacia arriba y se encuentra lejos de los ojos. Presionar con el pulgar firme y rápidamente el frasco (figura 1). La bomba estará ahora lista para el uso.
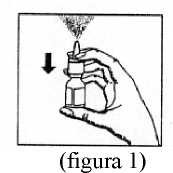
Si la bomba no ha sido utilizada durante más de 24 horas, deberá activarse de nuevo con 1 ó 2 pulverizaciones.
3) Antes de utilizar el pulverizador nasal, sonarse la nariz para limpiar las fosas nasales.
4) Cerrar una de las fosas nasales, colocando suavemente un dedo contra el ala de la nariz e inclinar ligeramente la cabeza hacia adelante. Con el frasco cogido como se indica en la figura 1, insertar el aplicador nasal del mismo en la otra fosa nasal (ver figura 2). Dirigir el aplicador hacia la parte posterior y

!**■
"I
ÍITI
extema de la nariz.
(figura 2)
5) Activar la bomba una sola vez, presionando firme y rápidamente hacia arriba con el pulgar. Después de cada pulverización, aspirar profundamente y espirar por la boca.
6) Después de la pulverización y retirada del aplicador, inclinar la cabeza hacia atrás durante unos segundos para permitir que la pulverización difunda sobre la parte posterior de la nariz.
7) Aplicar otra pulverización en la misma fosa nasal siguiendo el mismo procedimiento.
8) Aplicar dos pulverizaciones en la otra fosa nasal siguiendo las mismas instrucciones.
9) Volver a colocar el capuchón protector después de la utilización.
®
Si Atrovent nasal se ha pulverizado accidentalmente sobre los ojos, lavarlos inmediatamente con agua fría.
Si el aplicador nasal se obstruye, retirar el capuchón protector. Colocar el aplicador nasal bajo el grifo de agua caliente durante aproximadamente un minuto. Secar el aplicador nasal, activar la bomba (operación 2) y colocar de nuevo el capuchón protector.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim España, S.A.
Prat de la Riba, 50
08174 Sant Cugat del Valles (Barcelona)
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
61.848
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 05 de mayo de 1998 Fecha de la renovación de la autorización: 29 de agosto de 2008
10. FECHA DE LA REVISIÓN DEL TEXTO
Julio 2013
7 de 7