Atrovent Monodosis 500 Mcg/ 2Ml Solucion Para Inhalacion Por Nebulizador
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Atrovent Monodosis 500 microgramos/2ml solución para inhalación por nebulizador
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un envase monodosis (2 ml) contiene 522 microgramos de bromuro de ipratropio monohidratado (equivalente a 500 microgramos de bromuro de ipratropio anhidro).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Solución para inhalación por nebulizador.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento del broncoespasmo asociado a enfermedades pulmonares obstructivas crónicas en adultos y niños mayores de 12 años.
Atrovent puede ser administrado, junto con beta-adrenérgicos, en el tratamiento del broncoespasmo agudo asociado a enfermedades pulmonares obstructivas crónicas u obstrucción reversible de las vías aéreas, en aquellos casos en que la monoterapia con beta-adrenérgicos no proporcione una broncodilatación óptima.
4.2 Posología y forma de administración
La administración de la solución Atrovent se debe adaptar a las necesidades individuales de cada paciente; los pacientes deben estar bajo supervisión médica durante el tratamiento. Se aconseja no superar la dosis diaria recomendada tanto para el tratamiento agudo como el de mantenimiento.
Debe aconsejarse al paciente que consulte al médico siempre que no consiga una mejoría significativa o que su estado empeore, con el fin de determinar un nuevo programa terapéutico. Asimismo, el paciente deberá consultar al médico sin tardanza en caso de disnea aguda o de disnea (dificultad para respirar) que se agrave rápidamente.
Se recomienda la siguiente pauta de dosificación:
Adultos y niños mayores de 12 años Tratamiento de mantenimiento 1 envase monodosis, 3-4 veces al día.
Ataques agudos
En aquellos casos, en que la monoterapia con beta-adrenérgicos, no proporcione una broncodilatación óptima, Atrovent puede ser administrado en asociación con un beta-adrenérgico inhalado, la dosis del cual será establecida por el médico.
La dosis de Atrovent, en este caso, es de un envase monodosis; se pueden administrar dosis repetidas hasta la estabilización del paciente.
Por lo general, no debe rebasarse la dosis diaria recomendada durante el tratamiento. Las dosis diarias de más de 2 mg deben administrarse exclusivamente bajo supervisión médica.
4.3 Contraindicaciones
Atrovent está contraindicado en pacientes con hipersensibilidad conocida a la atropina, o a sus derivados (como la sustancia activa bromuro de ipratropio) o a alguno de los excipientes incluidos en la seccion 6.1 No está indicado como monofármaco en el tratamiento inicial de episodios agudos de broncoespasmo donde se requiera una respuesta rápida.
4.4 Advertencias y precauciones especiales de empleo
Hipersensibilidad
En casos excepcionales se pueden producir reacciones de hipersensibilidad inmediata después de la administración de Atrovent, tales como urticaria, angioedema, erupción cutánea, broncoespasmo y edema orofaríngeo y anafilaxia.
Broncoespasmo paradójico
Al igual que con otros fármacos administrados por vía inhalatoria, Atrovent puede causar broncoespasmo paradójico que puede ser potencialmente mortal. En caso de producirse un broncoespasmo paradójico, se debe interrumpir el tratamiento con Atrovent de inmediato y sustituir por un tratamiento alternativo.
Complicaciones oculares
Atrovent debe ser administrado con precaución en pacientes con predisposición al glaucoma de ángulo estrecho.
Se han producido casos aislados de complicaciones oculares (como por ejemplo midriasis, presión intraocular aumentada, glaucoma de ángulo estrecho y dolor ocular) cuando el bromuro de ipratropio, solo o combinado con agonistas beta-adrenérgicos, ha penetrado en los ojos por aplicación inadecuada.
El dolor o malestar ocular, la visión borrosa, los halos visuales y las imágenes coloreadas en asociación con enrojecimiento de ojos debido a congestión de la conjuntiva y edema de la córnea pueden ser signos de glaucoma agudo de ángulo cerrado. Si aparece alguna combinación de estos síntomas, se debe iniciar un tratamiento con un colirio miótico y consultar al médico inmediatamente.
Los pacientes han de ser instruidos sobre la correcta administración de Atrovent monodosis. Se debe evitar la nebulización del producto sobre los ojos, por lo que se recomienda utilizar boquilla o máscara nasofacial. Los pacientes con predisposición a sufrir glaucoma deben ser advertidos especialmente de que se protejan los ojos.
Efectos renales y urinarios
Atrovent debe ser administrado con precaución en pacientes con obstrucción pre-existente del tracto urinario de salida (tales como hiperplasia prostática u obstrucción del cuello de la vejiga).
Trastornos la motilidad gastrointestinal
Los pacientes con fibrosis quística pueden ser más propensos a trastornos de la motilidad gastrointestinal.
4.5 Interacción con otros medicamentos y otras formas de interacción
La administración concomitante crónica de Atrovent inhalado con otros fármacos anticolinérgicos no se ha estudiado. Por lo tanto, la administración concomitante crónica de Atrovent con otros fármacos anticolinérgicos no se recomienda.
Los beta-adrenérgicos y derivados de la xantina pueden potenciar el efecto broncodilatador. Atrovent puede acentuar los efectos anticolinérgicos de otros fármacos.
Atrovent se puede administrar conjuntamente con otros fármacos comúnmente utilizados en el tratamiento de la enfermedad pulmonar obstructiva crónica y la obstrucción reversible de las vías respiratorias, incluyendo broncodilatadores simpaticomiméticos, metilxantinas, esteroides y cromoglicato disódico, sin aparición de interacciones que hagan necesario un ajuste de dosis.
La administración simultánea de bromuro de ipratropio nebulizado y betamiméticos puede incrementar el riesgo de glaucoma agudo en pacientes con historial de glaucoma de ángulo estrecho (ver sección 4.4).
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
A pesar de que en los estudios preclínicos no se ha demostrado ningún riesgo, no se ha establecido su seguridad durante el embarazo. Por ello, deben observarse las precauciones habituales en el uso de medicamentos en este período, especialmente durante los 3 primeros meses.
4.6.2 Lactancia
Se desconoce si bromuro de ipratropio se excreta o no en la leche maternapero es improbable que pueda ser ingerido por el lactante en cantidades significativas, especialmente porque el preparado se administra por vía inhalatoria. Sin embargo, se debe administrar con precaución a las mujeres en época de lactancia.
4.6.3 Fertilidad
No se dispone de datos clínicos sobre fertilidad para el bromuro de ipratropio.
Los estudios preclínicos realizados con bromuro de ipratropio no mostraron ningún efecto adverso sobre la fertilidad (ver sección Datos preclínicos sobre seguridad).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se dispone de estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se advierte que pueden aparecer efectos adversos como mareos, dificultades en la acomodación visual, midriasis y visión borrosa durante el tratamiento con Atrovent. Por tanto, se recomienda precaución en la conducción y el uso de máquinas.
4.8 Reacciones adversas
Muchas de las reacciones adversas listadas a continuación son debidas a las propiedades anticolinérgicas de Atrovent. Al igual que con cualquier tratamiento por inhalación, con el uso de Atrovent pueden aparecer síntomas de irritación local. Las reacciones adversas se han recopilado de los ensayos clínicos y de la farmacovigilancia después de la autorización de comercialización del medicamento.
Las reacciones adversas más frecuentes reportadas en los estudios clínicos fueron cefalea, tos, faringitis, sequedad de boca, trastornos de la motilidad gastrointestinal (incluyendo estreñimiento, diarrea y vómitos), náuseas y mareos.
Las reacciones adversas han sido clasificadas en apartados de frecuencias utilizando el siguiente convenio: Muy frecuentes (> 1/10); frecuentes (>1/100, <1/10); poco frecuentes (> 1/1.000, <1/100); raras (> 1/10.000, <1/1.000); muy raras (<1/10.000).
Tabla de reacciones adversas
Trastornos del sistema inmunitario
Poco frecuentes: hipersensibilidad y reacción anafiláctica.
Trastornos del sistema nervioso
Frecuentes: dolor de cabeza y mareo.
Trastornos oculares
Poco frecuentes: visión borrosa, midriasis, aumento de la presión intraocular, glaucoma, dolor ocular, halos visuales, hiperemia conjuntival y edema de córnea.
Raras: trastorno de la acomodación.
Trastornos cardíacos
Poco frecuentes: palpitaciones y taquicardia supraventricular.
Raras: fibrilación auricular y aumento de la frecuencia cardíaca.
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes: irritación de garganta, tos.
Raras: broncoespasmo, broncoespasmo paradójico, laringoespasmo, edema faríngeo y sequedad de la garganta.
Trastornos gastrointestinales
Frecuentes: sequedad de boca, náuseas y trastornos de la motilidad gastrointestinal.
Poco frecuentes: diarrea, estreñimiento, vómitos, estomatitis y edema bucal.
Trastornos del tejido de la piel y subcutáneos
Poco frecuentes: erupción, prurito y angioedema.
Raras: urticaria.
Trastornos renales y urinarios
Poco frecuentes: retención urinaria.
Además, en raras ocasiones también se han observado: temblores, sabor metálico o desagradable, congestión nasal, insomnio, cansancio o debilidad no habitual e hipotensión
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
No se han descrito manifestaciones específicas de sobredosificación. Debido al amplio margen terapéutico de Atrovent y a la administración inhalatoria del preparado, no es de esperar la aparición de síntomas anticolinérgicos serios. En caso de producirse manifestaciones sistémicas anticolinérgicas menores, como sequedad de boca, trastornos de la acomodación visual y taquicardia, el tratamiento debería ser sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: anticolinérgicos, código ATC: R03BB
Bromuro de ipratropio es una sal de amonio cuaternario con propiedades anticolinérgicas (parasimpaticolíticas). En los estudios preclínicos inhibe los reflejos mediatizados vagalmente por antagonización de la acción de la acetilcolina, el transmisor liberado de los nervios vagales.
Los anticolinérgicos impiden el aumento de la concentración intracelular de Ca++ provocado por la interacción de la acetilcolina con el receptor muscarínico del músculo liso bronquial. La liberación de Ca++ se produce mediante el sistema transmisor secundario formado por IP3 (inositol trifostato) y DAG (diacilglicerol).
La broncodilatación subsiguiente a la inhalación de Atrovent es principalmente un efecto localizado en los pulmones, no sistémico.
En estudios controlados de 90 días de duración con Atrovent monodosis 500 microgramos/2 ml solución para inhalación por nebulizador se produjeron mejorías significativas en la función pulmonar en pacientes con broncoespasmo asociado a enfermedad pulmonar obstructiva crónica (bronquitis crónica y enfisema) al cabo de 15 minutos, alcanzando un máximo a las 1-2 horas, y persistiendo en la mayoría de los pacientes hasta 4 - 6 horas.
La experiencia clínica y preclínica indica que Atrovent no perjudica la secreción mucosa de las vías respiratorias, el aclaramiento mucociliar o el intercambio gaseoso.
Aunque los datos son limitados, en 10 estudios realizados en 282 niños menores de 6 años, Atrovent sólo o en asociación con un beta-adrenérgico, parece mostrar un efecto terapéutico en el tratamiento del broncoespasmo asociado a bronquiolitis viral y displasia broncopulmonar en lactantes y niños de corta edad.
5.2 Propiedades farmacocinéticas
5.2.1 Absorción
El principio activo se absorbe muy rápidamente después de la inhalación oral. Las concentraciones plasmáticas máximas se alcanzan sólo unos minutos después de la inhalación. La biodisponibilidad sistémica estimada después de la inhalación fue del 7% de la dosis.
5.2.2 Distribución
Los parámetros farmacocinéticos básicos se calcularon a partir de los datos del nivel plasmático después de la administración i.v. El ipratropio sufre un rápido descenso bifásico en plasma.
El fármaco se une en baja proporción (menos del 20%) a las proteínas plasmáticas. La amina cuaternaria del ipratropio no atraviesa la barrera hematoencefálica.
El volumen aparente de distribución en estado estacionario (Vdss)) es aproximadamente 176 L (~ 2,4 L/kg).
5.2.3 Metabolismo o Biotransformación
Los principales metabolitos hallados en la orina se unen débilmente al receptor muscarínico. El aclaramiento total del principio activo es de 2,3 litros/minuto. Aproximadamente el 40% del aclaramiento es renal (0,9 litros/minuto) y el 60% no renal, principalmente hepático.
5.2.4 Eliminación
La vida media de la fase de eliminación terminal fue de aprox. 1,6 horas. La vida media de eliminación del fármaco y sus metabolitos fue de 3,6 horas, determinada por radiomarcaje.
En un estudio de balance de excreción, la excreción renal acumulada (6 días) de radioactividad relacionada con el fármaco (incluido el producto inicial y sus metabolitos) representó el 72,1% tras administración intravenosa, el 9,3% tras administración oral y el 3,2% tras la inhalación. La radioactividad total excretada por vía fecal fue del 6,3% tras administración intravenosa, 88,5% tras administración oral y 69,4% tras administración por vía inhalatoria. La excreción de radioactividad relacionada con el fármaco tras la administración intravenosa se produce principalmente por vía renal.
5.3 Datos preclínicos sobre seguridad
Se ha investigado la tolerabilidad local y sistémica del bromuro de ipratropio en distintas especies animales y varias vías de administración.
Se evaluó la toxicidad aguda por inhalación, intravenosa y oral en roedores y otras especies no roedoras.
El valor de DL50 oral fue de 1585 mg/kg en ratones, 1925 mg/kg en ratas y 1920 mg/kg en conejos. La DL50 intravenosa fue de 13,6 mg/kg en ratones, 15,8 mg/kg en ratas y 18,2 mg/kg en perros. La baja toxicidad oral comparada con la mayor toxicidad intravenosa refleja la escasa absorción gastrointestinal del bromuro de ipratropio. Los signos clínicos observados incluyen midriasis, sequedad de la mucosa nasal, disnea, temblor, espasmos y/o taquicardia.
Se realizaron estudios de toxicidad en dosis repetidas en ratas, conejos, perros y monos Rhesus. En estudios de administración por inhalación de 6 meses de duración en ratas, perros y monos Rhesus el nivel de dosis sin efecto (NOAEL) fue de 0,38 mg/kg/día, 0,18 mg/kg/día y 0,8 mg/kg/día, respectivamente. Se observó sequedad de la mucosa oral y taquicardia en perros. No se observaron lesiones histopatológicas relacionadas con la sustancia en el sistema broncopulmonar u otros órganos. En ratas, el NOAEL después de la administración oral durante 18 meses fue de 0,5 mg/kg/día. Estudios de toxicidad en dosis repetidas en ratas de 6 meses de duración y en perros durante 3 meses con otras formulaciones (formulación intranasal, con propelente alternativo HFA 134a y con una formulación en polvo con lactosa) no revelaron información adicional al perfil toxicológico del bromuro de ipratropio. La administración intranasal en perros, durante un período de 6 meses, reveló un nivel de dosis sin efecto superior a 0,20 mg/kg/día y confirmaron los estudios anteriores con administración intranasal durante 13 semanas. Los estudios de toxicidad en dosis repetida con la formulación de HFA 134a y con la formulación de CFC muestran perfiles toxicológicos similares.
Se administró a ratas una solución acuosa de bromuro de ipratropio por inhalación (0,05 mg/kg en una dosis única durante 4 horas) y fue bien tolerada localmente. El bromuro de ipratropio presentó buena tolerabilidad a nivel local en los estudios de toxicidad a dosis repetidas.
No se produjeron reacciones de anafilaxia activas ni reacciones anafilácticas cutáneas pasivas en cobayas.
Las pruebas de mutagenicidad "in vitro" e "in vivo" no indicaron potencial mutagénico. Tampoco se observaron efectos tumorigénicos ni cancerogénicos en estudios a largo plazo en ratones y ratas.
Se realizaron estudios para investigar la posible influencia del bromuro de ipratropio en la fertilidad, embriofetotoxicidad y desarrollo peri y postnatal en ratones, ratas y conejos. Dosis elevadas por vía oral de 1000 mg/kg/día en ratas y 125 mg/kg/día en conejos fueron maternotóxicos para ambas especies y embriofetotóxicos en ratas, donde se produjo una disminución del peso del feto. No se observaron malformaciones relacionadas con el tratamiento. Las dosis más elevadas técnicamente posibles por inhalación del aerosol dosificador, 1,5 mg/kg/día en ratas y 1,8 mg/kg/día en conejos, no mostraron efectos adversos sobre la reproducción.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de sodio Ácido clorhídrico Agua purificada
6.2 Incompatibilidades
Las soluciones para inhalar de Atrovent y de cromoglicato disódico que contengan como conservante cloruro de benzalconio, no se deben administrar simultáneamente en el mismo nebulizador, por riesgo de precipitación.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original.
6.5 Naturaleza y contenido del envase
Cajas con 20 envases monodosis de polietileno de baja densidad
6.6 Precauciones especiales de eliminación y otras manipulaciones
Para asegurar la correcta administración, lea atentamente las instrucciones de uso.
Instrucciones para la correcta administración del preparado:
La solución de Atrovent monodosis puede inhalarse utilizando dispositivos nebulizadores adecuados de tipo ultrasónico, eléctrico, manual (por ej. Bird, De Vilbiss, Pari), o con respiración asistida a presión positiva intermitente. Si se dispone de suministro de oxígeno en la pared, debe administrarse la solución con un flujo de 6-8 litros por minuto.
Se recomienda que el tamaño de partícula de la solución nebulizada esté comprendido entre 1 y 10 micras aunque aproximadamente el 50% de la masa del aerosol debe estar contenido en partículas inferiores a 5 micras.
En caso necesario la solución puede diluirse en suero fisiológico.
]£
Normas para el uso de los envases monodosis:
Los envases monodosis deben ser utilizados solamente para su inhalación con dispositivos nebulizadores adecuados y no deben administrarse por vía oral.
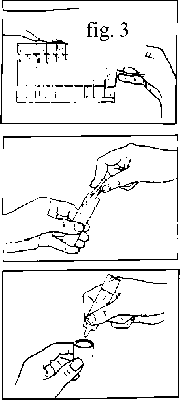
1. Preparar el nebulizador para la inhalación según las instrucciones del fabricante o del médico.
2. Separar un envase monodosis (véase fig. 1).
3. Hacer girar la porción superior hasta que se desprenda (véase fig. 2).
4. Vaciar, presionando el contenido del envase monodosis, en el depósito del nebulizador (véase fig. 3).
5. Montar el nebulizador e inhalar siguiendo las instrucciones.
6. Después de la inhalación, extraer la solución restante del depósito del nebulizador y limpiarlo.
Como los envases monodosis no contienen conservantes es importante que su contenido se utilice inmediatamente después de la apertura del envase, para evitar la contaminación microbiana. Deben desecharse los envases monodosis parcialmente utilizados, abiertos o dañados.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim España, S.A.
Prat de la Riba, 50
08174 Sant Cugat del Valles (Barcelona)
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
61.184
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 05 de diciembre de 1996 Fecha de la renovación de la autorización: 29 de agosto de 2008
10. FECHA DE LA REVISIÓN DEL TEXTO
Enero 2016
3E
¡y
taños
8 de 8