Atrovent 20 Microgramos Solucion Para Inhalacion En Envase A Presion
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Atrovent 20 microgramos solución para inhalación en envase a presión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada inhalación contiene 21 microgramos de bromuro de ipratropio monohidratado (equivalentes a 20 microgramos de bromuro de ipratropio anhidro)
Excipientes: cada pulverización contiene 0,0084 g de etanol.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Solución para inhalación en envase a presión.
Es una solución para inhalación en envase a presión, sin propelentes clorofluorocarbonados (CFC).
Los propelentes clorofluorocarbonados pueden dañar la capa de ozono de la atmósfera. Atrovent 20 microgramos solución para inhalación en envase a presión carece de este tipo de propelentes y sólo contiene el propelente no clorofluorocarbonado HFA 134a, que no contribuye al agotamiento de la capa de ozono.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de mantenimiento del broncoespasmo asociado a enfermedades pulmonares obstructivas crónicas.
4.2 Posología y forma de administración
La dosificación debe ajustarse de manera individual. Para los adultos y niños mayores de 6 años se recomienda el siguiente esquema de dosificación:
2 inhalaciones (equivalente a 40 microgramos de bromuro de ipratropio anhidro), 4 veces al día.
Dado que la necesidad de dosis cada vez mayores sugiere que pueda ser necesaria una modalidad de tratamiento adicional, por lo general, no debe rebasarse una dosis diaria total de 12 inhalaciones (equivalente a 240 microgramos de bromuro de ipratropio anhidro).
Debido a que no existe información suficiente sobre el uso de Atrovent en niños, únicamente debe administrarse a los niños bajo recomendación médica y bajo la supervisión de un adulto.
Debe aconsejarse al paciente que consulte al médico siempre que no consiga una mejoría significativa o que su estado empeore, con el fin de determinar un nuevo programa terapéutico. Asimismo, el paciente deberá consultar al médico sin tardanza en caso de disnea aguda o de disnea que se agrave rápidamente.
4.3 Contraindicaciones
Atrovent está contraindicado en pacientes con hipersensibilidad conocida a la atropina, o sus derivados (p. ej. tiotropio), o a cualquier otro componente del producto.
No está indicado como monofármaco en el tratamiento inicial de episodios agudos de broncoespasmo, donde se requiera una respuesta rápida.
4.4 Advertencias y precauciones especiales de empleo
En casos raros se pueden producir reacciones de hipersensibilidad inmediata después de la administración de Atrovent, tales como urticaria, angioedema, erupción cutánea, broncoespasmo, edema orofaríngeo y anafilaxia.
Es posible que algunos pacientes puedan notar alguna sensación o sabor diferente, con respecto a la formulación que anteriormente utilizaban. Estos cambios no afectan a la seguridad y eficacia del producto, que ha demostrado ser intercambiable con la formulación anterior.
Los pacientes con fibrosis quística pueden ser más propensos a trastornos de la motilidad gastrointestinal.
Atrovent debe ser administrado con precaución en pacientes con predisposición al glaucoma de ángulo estrecho o con obstrucción pre-existente del tracto urinario de salida (tales como hiperplasia prostática u obstrucción del cuello de la vejiga.
Se han producido casos aislados de complicaciones oculares (como por ejemplo midriasis, presión intraocular aumentada, glaucoma de ángulo estrecho y dolor ocular) cuando el bromuro de ipratropio ha penetrado en los ojos por aplicación inadecuada de una solución para inhalación que contiene este principio activo sólo o en asociación con un agonista adrenérgico beta 2. Por lo tanto, los pacientes deben ser instruidos sobre la correcta utilización de la solución para inhalación.
El dolor o malestar ocular, la visión borrosa, los halos visuales o imágenes coloreadas en asociación con enrojecimiento de ojos debido a congestión de la conjuntiva o edema de la córnea, pueden ser signos de glaucoma agudo de ángulo estrecho. Si aparece alguna combinación de estos síntomas, se debe iniciar un tratamiento con un colirio miótico y consultar al médico inmediatamente.
Debe tenerse cuidado de que la pulverización no penetre en el ojo. El riesgo de que esto ocurra es limitado, dado que la inhalación se produce con una boquilla y está controlada manualmente.
Este medicamento contiene un 15% de etanol en el producto final. Cada pulverización contiene 0,0084 g de etanol, lo que puede ser causa de riesgo en niños, mujeres embarazadas y pacientes con enfermedad hepática, alcoholismo, epilepsia, daños o lesiones cerebrales. Puede modificar o potenciar el efecto de otros medicamentos.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los beta-adrenérgicos y derivados de la xantina pueden potenciar el efecto broncodilatador. Atrovent puede acentuar los efectos anticolinérgicos de otros fármacos.
Atrovent se puede administrar conjuntamente con otros fármacos comúnmente utilizados en el tratamiento de la enfermedad pulmonar obstructiva crónica, incluyendo broncodilatadores simpaticomiméticos, metilxantinas, esteroides y cromoglicato disódico, sin aparición de interacciones perjudiciales.
4.6 Fertilidad, embarazo y lactancia
No se ha establecido la seguridad de Atrovent durante el embarazo. Debe valorarse el beneficio de la utilización de Atrovent durante el embarazo o en caso de sospecha de embarazo, frente a los posibles riesgos para el feto. Los estudios preclínicos no han mostrado efectos embriotóxicos ni teratogénicos después de la administración inhalatoria o intranasal, a dosis considerablemente superiores a las recomendadas en humanos.
Se desconoce si Atrovent se excreta o no en la leche materna. Aunque los cationes cuaternarios no liposolubles pasan a la leche materna, es improbable que Atrovent pueda ser ingerido por el lactante en cantidades significativas, especialmente porque el preparado se administra por vía inhalatoria. Sin embargo, debido a que muchos fármacos se excretan en la leche materna, se debe administrar con precaución a mujeres en período de lactancia.
Los estudios preclínicos realizados con bromuro de ipratropio no mostraron ningún efecto adverso sobre la fertilidad (ver sección Datos preclínicos sobre seguridad). No se dispone de datos clínicos sobre fertilidad para el bromuro de ipratropio.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se dispone de estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se advierte que pueden aparecer efectos adversos como mareos, dificultades en la acomodación visual, midriasis y visión borrosa durante el tratamiento con Atrovent. Por tanto, se recomienda precaución en la conducción y el uso de máquinas. Si los pacientes experimentan estos efectos deberían evitar realizar actividades potencialmente peligrosas como la conducción o la utilización de máquinas.
4.8 Reacciones adversas
Muchas de las reacciones adversas listadas a continuación son debidas a las propiedades anticolinérgicas de Atrovent. Al igual que con cualquier tratamiento por inhalación, con el uso de Atrovent pueden aparecer síntomas de irritación local. Las reacciones adversas se han recopilado de los ensayos clínicos y de la farmacovigilancia después de la autorización de comercialización del medicamento.
Las reacciones adversas más frecuentes reportadas en los estudios clínicos fueron cefalea, tos, faringitis, sequedad de boca, trastornos de la motilidad gastrointestinal (incluyendo estreñimiento, diarrea y vómitos), náuseas y mareos.
Las reacciones adversas han sido clasificadas en apartados de frecuencias utilizando el siguiente convenio: Muy frecuentes (3 1/10); frecuentes (31/100, <1/10); poco frecuentes (3 1/1.000, <1/100); raras (3 1/10.000, <1/1.000); muy raras (<1/10.000).
Tabla de reacciones adversas
Trastornos del sistema inmunitario
Poco frecuentes: hipersensibilidad y reacción anafiláctica.
Trastornos del sistema nervioso
Frecuentes: dolor de cabeza y mareo
Trastornos oculares
Poco frecuentes: visión borrosa, midriasis, aumento de la presión intraocular, glaucoma, dolor ocular, halos visuales, hiperemia conjuntival y edema de córnea.
Raras: trastorno de la acomodación.
Trastornos cardíacos
Poco frecuentes: Palpitaciones, taquicardia supraventricular.
Raras:, fibrilación auricular y aumento de la frecuencia cardíaca.
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes: irritación de garganta, tos.
Raras: broncoespasmo, broncoespasmo paradójico, laringoespasmo, edema faríngeo y sequedad de la garganta.
Trastornos gastrointestinales
Frecuentes: sequedad de boca, náuseas y trastornos de la motilidad gastrointestinal. .
Poco frecuentes: diarrea, estreñimiento, vómitos, estomatitis y edema bucal.
Trastornos del tejido de la piel y subcutáneos
Poco frecuentes: erupción, prurito y angioedema.
Raras: urticaria.
Trastornos renales y urinarios
Poco frecuentes: retención urinaria
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
No se han descrito síntomas específicos de sobredosificación. Debido al amplio margen terapéutico de Atrovent y a la administración tópica del preparado, no es de esperar la aparición de síntomas anticolinérgicos importantes. Pueden producirse manifestaciones sistémicas anticolinérgicas menores, tales como sequedad de boca, trastornos de la acomodación visual y taquicardia.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Anticolinérgicos, código ATC: R03 BB
Los ensayos de comparación entre las formulaciones HFA y CFC, de hasta 3 meses, realizados con adultos y niños asmáticos y pacientes con EPOC, han demostrado que ambas formulaciones son terapéuticamente equivalentes.
Bromuro de ipratropio es una sal de amonio cuaternaria con propiedades anticolinérgicas (parasimpaticolíticas). En los estudios preclínicos inhibe los reflejos mediatizados vagalmente por antagonización de la acción de la acetilcolina, el transmisor liberado de los nervios vagales.
Los anticolinérgicos impiden el aumento de la concentración intracelular de Ca++ provocado por la interacción de la acetilcolina con el receptor muscarínico del músculo liso bronquial. La liberación de Ca++ se produce mediante el sistema transmisor secundario formado por IP3 (inositol trifosfato) y DAG (diacilglicerol).
La broncodilatación subsiguiente a la inhalación de Atrovent es principalmente un efecto localizado en los pulmones, no sistémico.
En estudios controlados de 90 días de duración se produjeron mejorías significativas en la función pulmonar al cabo de 15 minutos en pacientes con broncoespasmo asociado a enfermedad pulmonar obstructiva crónica (bronquitis crónica y enfisema), alcanzando un máximo a las 1-2 horas, y persistiendo en la mayoría de los pacientes hasta 4-6 horas.
En estudios controlados de 90 días de duración en pacientes con broncoespasmo asociado a asma, se produjeron mejorías significativas en la función pulmonar (incrementos del 15% o más del FEVi) en el 51% de los pacientes.
La experiencia clínica y preclínica indica que Atrovent no perjudica la secreción mucosa de las vías respiratorias, el aclaramiento mucociliar o el intercambio gaseoso.
5.2 Propiedades farmacocinéticas
Absorción
El efecto terapéutico de Atrovent se produce por acción local sobre las vías respiratorias. La broncodilatación y la farmacocinética sistémica no se producen en paralelo.
Tras la administración inhalatoria, en función de la formulación y la técnica de inhalación, se depositan generalmente en el pulmón proporciones del 10 al 30% de una dosis. La mayor parte de la dosis es deglutida y pasa al tracto gastrointestinal.
La porción de dosis depositada en los pulmones alcanza rápidamente la circulación (en unos minutos).
La excreción renal acumulada (0-24 h) del producto inicial es aproximadamente del 46% de la dosis administrada por vía intravenosa, por debajo del 1% de la dosis administrada oralmente y aproximadamente entre el 3 y el 13% de la dosis inhalada. Según estos datos, la biodisponibilidad sistémica total de las dosis orales o inhaladas de bromuro de ipratropio se estima en el 2% y entre el 7 y 28%, respectivamente. Considerando estos datos, las proporciones de dosis de bromuro de ipratropio tragadas no contribuyen significativamente a la exposición sistémica.
Distribución
Los parámetros cinéticos que describen la disposición del ipratropio se calcularon a partir de concentraciones plasmáticas después de administración i.v.
Se observa un descenso bifásico rápido en las concentraciones plasmáticas.
El fármaco se liga mínimamente a proteínas plasmáticas (menos de un 20%). La amina cuaternaria del ipratropio no atraviesa la barrera hematoencefálica.
El volumen aparente de distribución en estado estacionario (Vdss) es aproximadamente 176 L (~ 2,4 L/kg). Metabolismo o Biotransformación
El aclaramiento total del ipratropio es de 2,3 l/min y el aclaramiento renal es de 0,9 L/min. Tras la administración intravenosa, aproximadamente el 60% de la dosis es metabolizada, la mayor proporción probablemente sea en el hígado por oxidación.
Eliminación
Tras la inhalación de bromuro de ipratropio con propelente HFA 134a, la excreción renal acumulada durante 24 horas fue aproximadamente del 12%.
La vida media de la fase de eliminación terminal es de aproximadamente 1,6 horas.
En un estudio de balance de excreción, la excreción renal acumulada (6 días) de radioactividad relacionada con el fármaco (incluido el producto inicial y sus metabolitos) representó el 72,1% tras administración intravenosa, el 9,3% tras administración oral y el 3,2% tras la inhalación. La radioactividad total excretada por vía fecal fue del 6,3% tras administración intravenosa, 88,5% tras administración oral y 69,4% tras administración por vía inhalatoria. La excreción de radioactividad relacionada con el fármaco tras la administración intravenosa se produce principalmente por vía renal. La vida media de eliminación de radioactiviadad relacionada con el fármaco (incluidos sus metabolitos) es de 3,6 horas. Los principales metabolitos detectados en la orina se unen débilmente al receptor muscarínico y pueden considerarse ineficaces.
5.3 Datos preclínicos sobre seguridad
Se ha investigado la tolerabilidad local y sistémica del bromuro de ipratropio en distintas especies animales y varias vías de administración.
Se evaluó la toxicidad aguda por inhalación, intravenosa y oral en roedores y otras especies no roedoras.
El valor de DL50 oral fue de 1585 mg/kg en ratones, 1925 mg/kg en ratas y 1920 mg/kg en conejos. La DL50 intravenosa fue de 13,6 mg/kg en ratones, 15,8 mg/kg en ratas y 18,2 mg/kg en perros. La baja toxicidad oral comparada con la mayor toxicidad intravenosa refleja la escasa absorción gastrointestinal del bromuro de ipratropio. Los signos clínicos observados incluyen midriasis, sequedad de la mucosa nasal, disnea, temblor, espasmos y/o taquicardia.
Se realizaron estudios de toxicidad en dosis repetidas en ratas, conejos, perros y monos Rhesus. En estudios de administración por inhalación de 6 meses de duración en ratas, perros y monos Rhesus el nivel de dosis sin efecto (NOAEL) fue de 0,38 mg/kg/día, 0,18 mg/kg/día y 0,8 mg/kg/día, respectivamente. Se observó sequedad de la mucosa oral y taquicardia en perros. No se observaron lesiones histopatológicas relacionadas con la sustancia en el sistema broncopulmonar u otros órganos. En ratas, el NOAEL después de la administración oral durante 18 meses fue de 0,5 mg/kg/día. Estudios de toxicidad en dosis repetidas en ratas de 6 meses de duración y en perros durante 3 meses con otras formulaciones (formulación intranasal, con propelente alternativo HFA 134a y con una formulación en polvo con lactosa) no revelaron información adicional al perfil toxicológico del bromuro de ipratropio. La administración intranasal en perros, durante un período de 6 meses, reveló un nivel de dosis sin efecto superior a 0,20 mg/kg/día y confirmaron los estudios anteriores con administración intranasal durante 13 semanas. Los estudios de toxicidad en dosis repetida con la formulación de HFA 134a y con la formulación de CFC muestran perfiles toxicológicos similares.
Se administró a ratas una solución acuosa de bromuro de ipratropio por inhalación (0,05 mg/kg en una dosis única durante 4 horas) y fue bien tolerada localmente. El bromuro de ipratropio presentó buena tolerabilidad a nivel local en los estudios de toxicidad a dosis repetidas.
No se produjeron reacciones de anafilaxia activas ni reacciones anafilácticas cutáneas pasivas en cobayas. Las pruebas de mutagenicidad "in vitro" e "in vivo" no indicaron potencial mutagénico. Tampoco se observaron efectos tumorigénicos ni cancerogénicos en estudios a largo plazo en ratones y ratas.

Se realizaron estudios para investigar la posible influencia del bromuro de ipratropio en la fertilidad, embriofetotoxicidad y desarrollo peri y postnatal en ratones, ratas y conejos. Dosis elevadas por vía oral de 1000 mg/kg/día en ratas y 125 mg/kg/día en conejos fueron maternotóxicos para ambas especies y
embriofetotóxicos en ratas, donde se produjo una disminución del peso del feto. No se observaron malformaciones relacionadas con el tratamiento. Las dosis más elevadas técnicamente posibles por
inhalación del aerosol dosificador, 1,5 mg/kg/día en ratas y 1,8 mg/kg/día en conejos, no mostraron efectos adversos sobre la reproducción.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
1.1.1.2 - tetrafluoroetano (HFA 134a),
Etanol absoluto
Ácido cítrico anhidro Agua purificada.
6.2 Incompatibilidades
No se han descrito.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
El envase presurizado no debe ser perforado ni expuesto a temperaturas superiores a 50°C.
6.5 Naturaleza y contenido del envase
Atrovent es una solución transparente e incolora envasada en un frasco metálico conteniendo 10 ml (aproximadamente 200 pulverizaciones), con válvula dosificadora.
6.6 Precauciones especiales de eliminación y otras manipulaciones Instrucciones para la correcta administración del preparado:
Para asegurar la correcta administración, lea atentamente las instrucciones de uso.
El manejo correcto de la solución para inhalación es decisivo para el éxito del tratamiento.
Antes de la primera utilización de cada envase se accionará 1 ó 2 veces el aparato dosificador después de haberlo agitado.
Antes de cada uso se observarán las siguientes pautas:
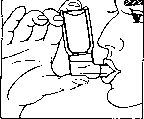
(% 1)
1) Retirar el capuchón protector.
Agencia esparto» óe medicamentos y jroouctcs saltaros
2) Realizar una espiración profunda.
3) Coger el inhalador con la mano en la forma que se indica en la figura 1 y apretar firmemente la boquilla con los labios. La flecha y la base del recipiente deben dirigirse hacia arriba.
4) Realizar una inspiración lo más enérgica posible y al mismo tiempo presionar con fuerza sobre la base del recipiente, con lo que se libera una pulverización de solución para inhalación. Contener la respiración durante algunos segundos, retirar luego la boquilla y espirar lentamente. Si no es posible una inspiración profunda a causa de disnea grave, es posible entonces facilitar la respiración y la posterior aplicación correcta aplicando una pulverización de la solución en la cavidad bucal.
5) Una vez usado, volver a colocar el capuchón protector.
6) En caso de no haber utilizado el inhalador durante un período de 3 días, se tendrá que accionar la válvula una vez más.
Como el recipiente no es transparente, es imposible ver cuándo está vacío.
El envase proporcionará 200 dosis. Cuando se han utilizado todas, puede que parezca que el envase contenga todavía una pequeña cantidad de líquido. Aún así, se debe sustituir, ya que es posible que no se alcance la dosis correcta de tratamiento.
La dosis de tratamiento disponible en el envase se puede determinar de la siguiente manera:
Agitando el envase se podrá observar si todavía contiene producto. Alternativamente, separar el envase de la boquilla de plástico e introducirlo en un recipiente con agua. El contenido del envase se puede estimar por observación de su posición dentro del agua (figura 2).
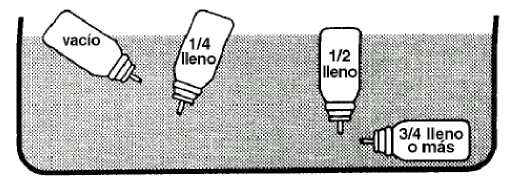
(fig. 2)
Limpie la boquilla una vez por semana. Es importante manterner la boquilla siempre limpia para asegurar que el medicamento no se acumula y bloquea el spray.
Para lavarla, retire el capuchón protector y el envase del inhalador. Limpie pasando agua caliente a través del inhalador hasta la eliminación de cualquier resto de medicamento o suciedad visibles. (figura 3).
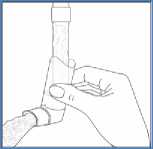
(fig. 3)
Después de limpiar el inhalador, sacudir el agua y dejar secar al aire sin utilizar ningún sistema de calefacción. Una vez la boquilla está seca, colocar de nuevo el envase y el capuchón protector.
ADVERTENCIA: La boquilla de plástico se ha diseñado especialmente para su utilización con Atrovent, con el fin de asegurar que siempre se obtiene la cantidad correcta del preparado. La boquilla nunca se debe utilizar con otra solución para inhalación en envase a presión, ni tampoco Atrovent 20 microgramos solución para inhalación en envase a presión se debe utilizar con otra boquilla distinta a la que se proporciona con el producto.
Instrucciones para la correcta manipulación:
Se trata de un envase a presión, por lo que no debe ser forzado ni expuesto a temperaturas superiores a 50 °C.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim España, S.A.
Prat de la Riba, 50
08174 Sant Cugat del Valles (Barcelona)
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
54.674
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 21.09.1979
Fecha de la renovación de la autorización: 29.08.2008
10. FECHA DE LA REVISIÓN DEL TEXTO
JULIO 2013
20100724
9 de 9