Atozet 10 Mg/20 Mg Comprimidos Recubiertos Con Pelicula
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
ATOZET 10 mg/10 mg comprimidos recubiertos con película ATOZET 10 mg/20 mg comprimidos recubiertos con película ATOZET 10 mg/40 mg comprimidos recubiertos con película ATOZET 10 mg/80 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 10 mg de ezetimiba (ezetimibe) y 10, 20, 40 u 80 mg de atorvastatina (como atorvastatina cálcica trihidrato) (atorvastatin).
Excipientes con efecto conocido:
Cada comprimido recubierto con película de 10 mg/10 mg contiene 153 mg de lactosa.
Cada comprimido recubierto con película de 10 mg/20 mg contiene 179 mg de lactosa.
Cada comprimido recubierto con película de 10 mg/40 mg contiene 230 mg de lactosa.
Cada comprimido recubierto con película de 10 mg/80 mg contiene 334 mg de lactosa.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA Comprimido recubierto con película
Comprimido de 10 mg/10 mg: Con forma de cápsula, biconvexo, de color blanco a color hueso, recubierto con película, con un tamaño de 12,74 mm x 5, 10 mm, grabado en una cara con el código “257”. Comprimido de 10 mg/20 mg: Con forma de cápsula, biconvexo, de color blanco a color hueso, recubierto con película, con un tamaño de 14,48 mm x 5,79 mm, grabado en una cara con el código “333”. Comprimido de 10 mg/40 mg: Con forma de cápsula, biconvexo, de color blanco a color hueso, recubierto con película, con un tamaño de 16,38 mm x 6,27 mm, grabado en una cara con el código “337”. Comprimido de 10 mg/80 mg: Con forma de cápsula, biconvexo, de color blanco a color hueso, recubierto con película, con un tamaño de 19,05 mm x 7,94 mm, grabado en una cara con el código “357”.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Prevención de acontecimientos cardiovasculares
ATOZET está indicado para reducir el riesgo de acontecimientos cardiovasculares (ver sección 5.1) en pacientes con cardiopatía coronaria (CC) y antecedentes de síndrome coronario agudo (SCA), estén o no previamente tratados con una estatina.
Hipercolesterolemia
ATOZET está indicado como tratamiento complementario a la dieta en pacientes adultos con hipercolesterolemia primaria (familiar heterocigota y no familiar) o hiperlipidemia mixta cuando el uso de un producto en combinación se considera adecuado
• pacientes no controlados adecuadamente con una estatina sola
• pacientes ya tratados con una estatina y ezetimiba
Hipercolesterolemia familiar homocigota (HoFH)
ATOZET está indicado como tratamiento complementario a la dieta en pacientes adultos con HoFH. Los pacientes también pueden recibir tratamientos complementarios (p. ej., aféresis de lipoproteínas de baja densidad [LDL]).
4.2 Posología y forma de administración
Posología
Hipercolesterolemia y/o cardiopatía coronaria (con antecedentes de SCA)
El paciente debe haber iniciado con anterioridad una dieta hipolipemiante adecuada, que debe mantener durante el tratamiento con ATOZET.
El intervalo de dosis de ATOZET oscila entre 10/10 mg/día y 10/80 mg/día. La dosis habitual es 10/10 mg una vez al día. Al iniciar el tratamiento o si se requiere un ajuste de dosis, deberán tenerse en cuenta los niveles de colesterol asociado a lipoproteínas de baja densidad (C-LDL) del paciente, el riesgo de cardiopatía coronaria y la respuesta al tratamiento reductor de colesterol que esté recibiendo en ese momento.
La dosis de ATOZET debe individualizarse en base a la eficacia conocida de las diversas dosis de ATOZET (ver sección 5.1, Tabla 3) y la respuesta al tratamiento hipocolesterolemiante que esté recibiendo en ese momento el paciente. Los ajustes de dosis deben realizarse a intervalos de no menos de 4 semanas.
Hipercolesterolemia familiar homocigota
La dosis de ATOZET para los pacientes con HF homocigota es de 10/10 mg a 10/80 mg al día. ATOZET puede utilizarse como tratamiento complementario a otros tratamientos hipolipemiantes (p. ej., aféresis de LDL) en estos pacientes o si estos tratamientos no están disponibles.
Coadministración con secuestrantes de ácidos biliares
La administración de ATOZET debe producirse > 2 horas antes o > 4 horas después de la administración de un secuestrante de ácidos biliares.
Pacientes de edad avanzada
No se precisa ajuste de dosis en pacientes ancianos (ver sección 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de ATOZET en niños (ver sección 5.2). No se dispone de datos.
Pacientes con insuficiencia hepática
ATOZET se debe utilizar con precaución en pacientes con insuficiencia hepática (ver secciones 4.4 y 5.2). ATOZET está contraindicado en pacientes con enfermedad hepática activa (ver sección 4.3).
Pacientes con insuficiencia renal
No se precisa ajuste de dosis en pacientes con insuficiencia renal (ver sección 5.2).
Forma de administración
ATOZET se administra por vía oral. ATOZET se puede administrar como una dosis única en cualquier momento del día, con o sin alimentos.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1.
El tratamiento con ATOZET está contraindicado durante el embarazo y la lactancia, así como en mujeres potencialmente fértiles que no utilicen métodos anticonceptivos adecuados (ver sección 4.6).
ATOZET está contraindicado en pacientes con enfermedad hepática activa o elevaciones persistentes inexplicables de las transaminasas séricas que superen en 3 veces el límite superior de normalidad (LSN).
4.4 Advertencias y precauciones especiales de empleo
Miopatía/rabdomiólisis
En la experiencia postcomercialización con ezetimiba, se han comunicado casos de miopatía y rabdomiólisis. La mayoría de los pacientes que desarrollaron rabdomiólisis estaban tomando una estatina concomitantemente con ezetimiba. Sin embargo, se ha comunicado muy raramente rabdomiólisis con ezetimiba en monoterapia y muy raramente con la adición de ezetimiba a otros fármacos que se sabe que están asociados a un alto riesgo de rabdomiólisis.
ATOZET contiene atorvastatina. Atorvastatina, al igual que otros inhibidores de la HMG-CoA reductasa, puede afectar excepcionalmente al músculo esquelético y provocar mialgia, miositis y miopatía, que pueden progresar a rabdomiólisis, una enfermedad potencialmente mortal que se caracteriza por unos niveles significativamente elevados de creatina cinasa (CK) (>10 veces el límite superior de la normalidad [LSN]), mioglobinemia y mioglobinuria, que puede desembocar en insuficiencia renal.
Antes del tratamiento
ATOZET se debe recetar con precaución en pacientes con factores de predisposición a la rabdomiólisis. Antes del inicio del tratamiento, se deberá medir el nivel de CK en las siguientes situaciones:
• insuficiencia renal
• hipotiroidismo
• antecedentes personales o familiares de trastornos musculares hereditarios
• antecedentes de toxicidad muscular con una estatina o un fibrato
• antecedentes de enfermedad hepática y/o en caso de consumo excesivo de alcohol
• en pacientes de edad avanzada (>70 años), se deberá valorar la necesidad de realizar esta medición, de acuerdo con la presencia de otros factores de predisposición a la rabdomiólisis
• situaciones en las que se pueda producir una aumento de sus concentraciones plasmáticas, como interacciones (ver sección 4.5) y poblaciones especiales, incluidas subpoblaciones genéticas (ver sección 5.2)
En tales circunstancias, se debe considerar el riesgo del tratamiento con respecto al posible beneficio, y se recomienda monitorización clínica.
Si los niveles basales de CK están significativamente elevados (> 5 x LSN), no se debe iniciar el tratamiento.
Medición de la creatina cinasa
La creatina cinasa (CK) no se deberá medir después de un ejercicio físico intenso o en presencia de alguna causa alternativa plausible de aumento de CK, puesto que esto dificulta la interpretación del valor obtenido. Si los niveles basales de CK se encuentran elevados de forma significativa (>5 veces LSN), éstos se deberán volver a medir a los 5-7 días para confirmar los resultados.
Mientras dure el tratamiento
• Se debe indicar a los pacientes que comuniquen inmediatamente los dolores, calambres o debilidad muscular que experimenten, sobre todo si vienen acompañados de malestar general o fiebre.
• Si tales síntomas aparecen mientras el paciente esté recibiendo tratamiento con ATOZET, se deberán medir sus niveles de CK. Si resultan estar significativamente elevados (>5 veces LSN), se debe interrumpir el tratamiento.
• Si los síntomas musculares son graves y provocan molestias diarias, incluso si los niveles de CK se encuentran elevados <5 veces LSN, se deberá considerar la suspensión del tratamiento.
• Si los síntomas se solventan y los valores de CK se normalizan, entonces se puede considerar la reintroducción de ATOZET o la introducción de otro medicamento que contenga una estatina, a la dosis más baja y con estrecha monitorización.
• Se debe suspender el tratamiento con ATOZET si se produce una elevación clínicamente significativa de los niveles de CK (>10 veces LSN), o en caso de que se diagnostique o sospeche una rabdomiólisis.
• Se han notificado, en muy raras ocasiones, casos de miopatía necrosante inmunomediada (MNIM) durante o después del tratamiento con algunas estatinas. Clínicamente, la MNIM se caracteriza por debilidad muscular proximal persistente y elevación de la creatina cinasa sérica, que persisten a pesar de la suspensión del tratamiento con la estatina.
A consecuencia del componente atorvastatina de ATOZET, el riesgo de rabdomiólisis se incrementa cuando ATOZET es administrado de forma simultánea con determinados medicamentos que pueden aumentar la concentración plasmática de atorvastatina, tales como los inhibidores potentes de CYP3A4 o proteínas transportadoras (p. ej., ciclosporina, telitromicina, claritromicina, delavirdina, estiripentol, ketoconazol, voriconazol, itraconazol, posaconazol e inhibidores de la proteasa del VIH, entre ellos ritonavir, lopinavir, atazanavir, indinavir, darunavir, etc.). El riesgo de miopatía también se puede ver incrementado con el uso simultáneo de gemfibrozilo y otros derivados del ácido fíbrico, boceprevir, eritromicina, niacina, telaprevir, o la combinación de tipranavir/ritonavir. Si es posible, se deberán considerar tratamientos alternativos (que no interaccionan) en lugar de estos medicamentos. (Ver sección 4.8).
En los casos en los que sea necesaria la administración conjunta de estos medicamentos con ATOZET, se deberá valorar cuidadosamente el beneficio y el riesgo del tratamiento simultáneo. Cuando los pacientes reciben medicamentos que aumentan la concentración plasmática de atorvastatina, se recomienda el uso de una dosis máxima de ATOZET menor. Asimismo, en el caso de los inhibidores potentes de CYP3A4, se deberá valorar una dosis inicial menor de ATOZET y se recomienda un seguimiento clínico adecuado de estos pacientes (ver sección 4.5).
Atorvastatina no debe administrarse conjuntamente con las formulaciones sistémicas de ácido fusídico o dentro de los 7 días de la interrupción del tratamiento. En pacientes en los que se considera esencial el uso de ácido fusídico sistémico, el tratamiento con estatinas debe interrumpirse durante toda la duración del tratamiento con ácido fusídico. Se han notificado casos de rabdomiólisis (incluyendo algunos casos mortales) en pacientes que recibieron ácido fusídico y estatinas en combinación (ver sección 4.5). Se debe advertir al paciente que acuda inmediatamente al médico si experimenta algún síntoma de debilidad muscular, dolor o sensibilidad.
El tratamiento con estatinas podrá ser reintroducido siete días después de la última dosis de ácido fusídico.
En circunstancias excepcionales, cuando sea necesaria la utilización de ácido fusídico sistémico de acción prolongada, por ejemplo, para el tratamiento de infecciones graves, la administración conjunta de ATOZET y ácido fusídico debe considerarse caso por caso y bajo estrecha supervisión médica.
No se recomienda el uso concomitante de ATOZET y ácido fusídico, por lo tanto, se puede considerar la suspensión temporal del tratamiento con ATOZET durante una terapia con ácido fusídico (ver sección 4.5).
Enzimas hepáticas
En ensayos controlados de coadministración en pacientes tratados con ezetimiba y atorvastatina, se han observado sucesivas elevaciones de las transaminasas (>3 veces el límite superior de normalidad [LSN]) (ver sección 4.8).
Se deben realizar pruebas de función hepática antes de iniciar el tratamiento, y posteriormente con carácter periódico. Los pacientes que desarrollen signos o síntomas que sugieran un daño hepático deberán someterse a pruebas de función hepática. Los pacientes que desarrollen un aumento de los niveles de transaminasas deberán ser controlados hasta que la(s) anomalía(s) se resuelva(n). Si persiste un aumento de las transaminasas mayor de 3 veces el LSN, se recomienda la reducción de la dosis de ATOZET o su retirada.
ATOZET se debe usar con precaución en pacientes que consuman grandes cantidades de alcohol y/o presenten antecedentes de enfermedad hepática.
Insuficiencia hepática
Debido a que se desconocen los efectos de un aumento de exposición a ezetimiba en pacientes con insuficiencia hepática moderada o grave, no se recomienda la administración de ATOZET (ver sección 5.2).
Fibratos
No se ha establecido la seguridad y eficacia de ezetimiba administrada con fibratos; por tanto, no se recomienda la administración conjunta de ATOZET y fibratos (ver sección 4.5).
Ciclosporina
Se deberá tener precaución al iniciar el tratamiento con ATOZET en el caso de tratamiento con ciclosporina. Se deberán monitorizar las concentraciones de ciclosporina en los pacientes que reciben ATOZET y ciclosporina (ver sección 4.5).
Anticoagulantes
Si ATOZET se añade a warfarina, a otro anticoagulante cumarínico o a fluindiona, el cociente internacional normalizado (INR) debe ser vigilado apropiadamente (ver sección 4.5).
Prevención del ictus por reducción activa de los niveles de colesterol (SPARCL)
En un análisis retrospectivo de los subtipos de ictus en pacientes sin cardiopatía coronaria (CC) que habían experimentado un ictus reciente o un ataque isquémico transitorio (AIT) se observó una mayor incidencia de ictus hemorrágico en pacientes que habían iniciado con 80 mg de atorvastatina en comparación con placebo. El aumento del riesgo se notó especialmente en pacientes con antecedentes de ictus hemorrágico o infarto lacunar en el momento de incorporarse al estudio. En el caso de estos pacientes, el balance entre los riesgos y beneficios del tratamiento con atorvastatina 80 mg es incierto, y se debe valorar cuidadosamente el riesgo potencial de ictus hemorrágico antes de iniciar el tratamiento (ver sección 5.1).
Enfermedad pulmonar intersticial
Con algunas estatinas, se han comunicado casos excepcionales de enfermedad pulmonar intersticial, especialmente en tratamiento de larga duración (ver sección 4.8). Las características que aparecen pueden incluir disnea, tos no productiva y deterioro de la salud en general (fatiga, pérdida de peso y fiebre). Si se sospecha que un paciente ha desarrollado enfermedad pulmonar intersticial debe interrumpirse el tratamiento con estatinas.
Diabetes mellitus
Algunas evidencias sugieren que las estatinas aumentan la glucosa en sangre y en algunos pacientes en riesgo de desarrollo de diabetes, pueden producir niveles de hiperglucemia que requieran cuidados diabéticos. Este riesgo, sin embargo, se compensa con la reducción del riesgo vascular asociado a las estatinas, por tanto no debe ser una razón para interrumpir el tratamiento con estatinas. Los pacientes con riesgo (glucemia en ayunas de 5,6 a 6,9 mmol/l, IMC>30 kg/m2, triglicéridos aumentados, hipertensión) deben ser controlados desde el punto de vista clínico y bioquímico de acuerdo con las guías nacionales.
Excipientes
ATOZET contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o problemas de absorción de glucosa-o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Interacciones farmacodinámicas
Atorvastatina, un componente de ATOZET, se metaboliza a través del citocromo P450 3A4 (CYP3A4) y es un sustrato de proteínas transportadoras, p. ej., el transportador de captación en hepatocitos OATP1B1. La administración concomitante de medicamentos inhibidores de CYP3A4 o proteínas transportadoras puede producir un incremento de las concentraciones plasmáticas de atorvastatina y aumentar el riesgo de miopatía. Este riesgo también se puede ver incrementado con la administración concomitante de ATOZET y otros medicamentos que poseen la capacidad de inducir miopatía, como los derivados del ácido fíbrico y ezetimiba (ver sección 4.4).
Interacciones farmacocinéticas
ATOZET
No se ha observado una interacción farmacocinética clínicamente significativa cuando ezetimiba se administró junto con atorvastatina.
Efectos de otros medicamentos sobre ATOZET
Ezetimiba
Antiácidos: la administración concomitante de antiácidos disminuyó la tasa de absorción de ezetimiba pero no tuvo efecto sobre su biodisponibilidad. Esta disminución en la tasa de absorción no se considera clínicamente significativa.
Colestiramina: la administración concomitante de colestiramina disminuyó el área bajo la curva (AUC) media de ezetimiba total (ezetimiba + ezetimiba glucurónido) en aproximadamente un 55%. La reducción adicional de los niveles de colesterol asociado a lipoproteínas de baja densidad (C-LDL) que se consigue al añadir ATOZET al tratamiento con colestiramina puede verse disminuida como consecuencia de esta interacción (ver sección 4.2).
Ciclosporina: en un estudio realizado con ocho pacientes a los que se había realizado un trasplante renal, que tenían un aclaramiento de creatinina de > 50 ml/min y que tomaban una dosis estable de ciclosporina, una dosis única de 10 mg de ezetimiba aumentó 3,4 veces (intervalo de 2,3 a 7,9 veces) el AUC medio de ezetimiba total en comparación con una población control sana, que estaba recibiendo sólo ezetimiba, de otro estudio (n=17). En un estudio diferente, en un paciente trasplantado renal con insuficiencia renal grave que recibía ciclosporina y otros múltiples medicamentos, se demostró una exposición 12 veces mayor a ezetimiba total comparada con controles concurrentes que estaban recibiendo ezetimiba sola. En un estudio
cruzado de dos periodos, en doce individuos sanos, la administración diaria de 20 mg de ezetimiba durante 8 días con una dosis única de 100 mg de ciclosporina en el día 7 provocó un aumento medio del 15% en el AUC de ciclosporina (intervalo de descenso del 10% hasta un aumento del 51%) comparado con una dosis única de 100 mg de ciclosporina sola. No se ha realizado un estudio controlado sobre el efecto de ezetimiba coadministrada en la exposición a ciclosporina en pacientes con trasplante renal. Se deberá tener precaución al iniciar el tratamiento con ATOZET en el caso de tratamiento con ciclosporina. Se deberán monitorizar las concentraciones de ciclosporina en pacientes que reciban ATOZET y ciclosporina (ver sección 4.4).
Fibratos: la administración concomitante de fenofibrato o gemfibrozilo aumentó las concentraciones de ezetimiba total aproximadamente 1,5 y 1,7 veces, respectivamente. Aunque estos incrementos no se consideran clínicamente significativos, no se recomienda la administración conjunta de ATOZET y fibratos (ver sección 4.4).
Atorvastatina
Inhibidores de CYP3A4: se ha visto que los inhibidores potentes de CYP3A4 provocan un aumento notable de las concentraciones de atorvastatina (ver Tabla 1 y la información específica incluida a continuación). Si es posible, se debe evitar la administración concomitante de inhibidores potentes de CYP3A4 (p. ej., ciclosporina, telitromicina, claritromicina, delavirdina, estiripentol, ketoconazol, voriconazol, itraconazol, posaconazol e inhibidores de la proteasa del VIH, incluidos ritonavir, lopinavir, atazanavir, indinavir, darunavir, etc.). En aquellos casos en los que no se pueda evitar la coadministración de estos medicamentos con ATOZET, se deberán considerar una dosis inicial y una dosis máxima de ATOZET menores y se recomienda una adecuada monitorización clínica de los pacientes (ver Tabla 1).
Los inhibidores moderados de CYP3A4 (p. ej., eritromicina, diltiazem, verapamilo y fluconazol) pueden aumentar las concentraciones plasmáticas de atorvastatina (ver Tabla 1). Se ha observado un aumento del riesgo de miopatía asociado al uso de eritromicina en combinación con estatinas. No se han realizado estudios de interacción que evalúen los efectos de amiodarona o verapamilo sobre atorvastatina. Se sabe que tanto amiodarona como verapamilo inhiben la actividad de CYP3A4, y su coadministración con ATOZET puede causar un aumento de la exposición a atorvastatina. Por tanto, se deberá considerar una dosis máxima menor de ATOZET y se recomienda una adecuada monitorización clínica de los pacientes, cuando se utilice de forma simultánea con inhibidores moderados de CYP3A4. Se recomienda una monitorización clínica adecuada tras el inicio del tratamiento con el inhibidor o después del ajuste de su dosis.
Inductores del citocromo P450 3A4: la administración concomitante de atorvastatina e inductores del citocromo P450 3A4 (p. ej., efavirenz, rifampicina o hierba de San Juan) puede producir reducciones variables de las concentraciones plasmáticas de atorvastatina. Debido al mecanismo dual de interacción de rifampicina (inducción del citocromo P450 3A4 e inhibición del transportador de captación hepático OATP1B1), se recomienda administrar al mismo tiempo ATOZET y rifampicina, ya que la administración de atorvastatina posterior a la de rifampicina se ha asociado a una reducción significativa de las concentraciones plasmáticas de atorvastatina. No obstante, se desconoce el efecto de rifampicina sobre las concentraciones de atorvastatina en hepatocitos y si no se puede evitar la administración concomitante, los pacientes deberán ser cuidadosamente monitorizados en relación con la eficacia.
Inhibidores de proteínas transportadoras: los inhibidores de proteínas transportadoras (p. ej. ciclosporina) pueden aumentar la exposición sistémica a atorvastatina (ver Tabla 1). Se desconoce el efecto de la inhibición de los transportadores de captación en hepatocitos sobre las concentraciones de atorvastatina en
estas células. Si no se puede evitar la administración concomitante, se recomienda una reducción de la dosis de ATOZET y la monitorización clínica de la eficacia (ver Tabla 1).
Gemfibrozilo / derivados del ácido fíbrico: el uso de fibratos en monoterapia se asocia ocasionalmente a acontecimientos relacionados con el músculo, incluida la rabdomiólisis. El riesgo de que aparezcan estos acontecimientos se puede ver incrementado con el uso simultáneo de derivados del ácido fíbrico y atorvastatina.
Ezetimiba: el uso de ezetimiba sola se asocia a acontecimientos relacionados con el músculo, incluida la rabdomiólisis. Por tanto, el riesgo de que aparezcan estos acontecimientos puede aumentar con el uso simultáneo de derivados de ezetimiba y atorvastatina. Se recomienda una vigilancia clínica apropiada de estos pacientes.
Colestipol: las concentraciones plasmáticas de atorvastatina y sus metabolitos activos fueron inferiores (en aproximadamente un 25%) cuando se administró colestipol simultáneamente con atorvastatina. No obstante, los efectos sobre los lípidos fueron mayores con la administración conjunta de atorvastatina y colestipol que cuando cada medicamento se administró por separado.
Ácido fusídico: el riesgo de miopatía incluyendo rabdomiólisis puede aumentar tras la administración concomitante de ácido fusídico sistémico con estatinas. El mecanismo de esta interacción (tanto farmacodinámica como farmacocinética, o ambas) aún no se conoce. Se han notificado casos de rabdomiólisis (incluyendo algunos casos mortales) en los pacientes que reciben esta combinación.
Si el tratamiento con ácido fusídico sistémico es necesario, el uso de atorvastatina se debe suspender durante toda la duración del tratamiento con ácido fusídico. Ver también sección 4.4.
Colchicina: aunque no se hayan llevado a cabo estudios de interacción con atorvastatina y colchicina, se han descrito casos de miopatía asociada a la administración conjunta de atorvastatina y colchicina, y se deberá tener precaución al recetar atorvastatina con colchicina.
Boceprevir: la exposición a atorvastatina se vio incrementada cuando se administró junto con boceprevir. Cuando sea necesaria su coadministración con ATOZET, se deberá considerar comenzar el tratamiento con la menor dosis posible de ATOZET, aumentándola hasta obtener el efecto clínico deseado, al tiempo que se vigila la seguridad del paciente, y sin que se supere una dosis diaria de 10/20 mg. En el caso de los pacientes en tratamiento actual con ATOZET, la dosis de ATOZET no deberá sobrepasar una dosis diaria de 10/20 mg durante su administración conjunta con boceprevir.
Efectos de ATOZET sobre la farmacocinética de otros medicamentos
Ezetimiba
En estudios preclínicos, se ha demostrado que ezetimiba no induce las enzimas metabolizadoras de fármacos del citocromo P450. No se han observado interacciones farmacocinéticas clínicamente importantes entre ezetimiba y fármacos que se conoce son metabolizados por los citocromos P450 1A2, 2D6, 2C8, 2C9 y 3A4 o por la N-acetiltransferasa.
Anticoagulantes: en un estudio con veinte adultos varones sanos, la administración simultánea de ezetimiba (10 mg una vez al día) no tuvo un efecto significativo sobre la biodisponibilidad de warfarina ni sobre el tiempo de protrombina. Sin embargo, ha habido informes después de la comercialización de aumentos del cociente internacional normalizado (INR) en pacientes que tomaban ezetimiba con warfarina o fluindiona.
Si ATOZET se añade a warfarina, a otro anticoagulante cumarínico o a fluindiona, el INR debe ser monitorizado adecuadamente (ver sección 4.4).
Atorvastatina
Digoxina: cuando se coadministraron dosis múltiples de digoxina y 10 mg de atorvastatina, la concentración de digoxina en el estado de equilibrio aumentó levemente. Los pacientes tratados con digoxina deben ser monitorizados adecuadamente.
Anticonceptivos orales: la administración conjunta de atorvastatina y un anticonceptivo oral produjo un incremento de las concentraciones plasmáticas de noretisterona y etinilestradiol.
Warfarina: en un estudio clínico con pacientes tratados de manera crónica con warfarina, la administración conjunta de 80 mg al día de atorvastatina y warfarina produjo un leve descenso de unos 1,7 segundos en el tiempo de protrombina durante los 4 primeros días de administración, volviéndose a alcanzar valores normales a los 15 días de iniciado el tratamiento con atorvastatina. A pesar de que únicamente se han notificado casos muy excepcionales de interacciones con anticoagulantes clínicamente significativas, se deberá determinar el tiempo de protrombina antes del inicio del tratamiento con ATOZET en aquellos pacientes que reciban anticoagulantes cumarínicos, y con la suficiente frecuencia durante la fase inicial del tratamiento, con el fin de garantizar que no se produce una alteración significativa del tiempo de protrombina. Una vez que se haya documentado un tiempo de protrombina estable, los tiempos de protrombina se pueden monitorizar en los intervalos recomendados habitualmente en los pacientes tratados con anticoagulantes cumarínicos. Si se modifica la dosis de ATOZET o si se interrumpe el tratamiento, se deberá repetir el mismo procedimiento. El tratamiento con atorvastatina no se ha asociado a hemorragias o cambios en el tiempo de protrombina en pacientes que no toman anticoagulantes.
Tabla 1
Efecto de los medicamentos coadministrados sobre la farmacocinética de atorvastatina
|
Medicamento coadministrado y régimen de administración |
Atorvastatina |
ATOZET | |
|
Dosis (mg) |
Cambio en el AUC& |
Recomendación clínica# | |
|
Tipranavir 500 mg BID/ Ritonavir 200 mg BID, 8 días (días 14 a 21) |
40 mg el día 1, 10 mg el día 20 |
t 9,4 veces |
En los casos en los que sea necesaria la coadministración con ATOZET, no superar la dosis de 10/10 mg al día de ATOZET. Se recomienda la monitorización clínica de estos pacientes. |
|
Ciclosporina 5,2 mg/kg/día, dosis estable |
10 mg QD durante 28 días |
t 8,7 veces | |
|
Lopinavir 400 mg BID/ Ritonavir 100 mg BID, 14 días |
20 mg QD durante 4 días |
t 5,9 veces |
En los casos en los que sea necesaria la coadministración con ATOZET, se recomienda el uso de dosis de mantenimiento de ATOZET inferiores. A dosis de ATOZET que superen 10/20 mg, se recomienda la monitorización clínica de estos pacientes. |
|
Claritromicina 500 mg BID, 9 días |
80 mg QD durante 8 días |
t 4,4 veces | |
|
Saquinavir 400 mg BID/ Ritonavir 300 mg BID desde los días 5-7, aumento de la dosis a 400 mg BID el día 8), días 5-18, 30 min tras la administración de atorvastatina |
40 mg QD durante 4 días |
t 3,9 veces |
En los casos en los que sea necesaria la coadministración con ATOZET, se recomienda el uso de dosis de mantenimiento de ATOZET inferiores. A dosis de ATOZET que superen 10/40 mg, se recomienda la monitorización clínica de estos pacientes. |
|
Darunavir 300 mg BID/ Ritonavir 100 mg BID, 9 días |
10 mg QD durante 4 días |
t 3,3 veces | |
|
Itraconazol 200 mg QD, 4 días |
40 mg DU |
t 3,3 veces | |
|
Fosamprenavir 700 mg BID/ Ritonavir 100 mg BID, 14 días |
10 mg QD durante 4 días |
t 2,5 veces | |
|
Fosamprenavir 1.400 mg BID, 14 días |
10 mg QD durante 4 días |
t 2,3 veces | |
|
Nelfinavir 1.250 mg BID, 14 días |
10 mg QD durante 28 días |
t 1,7 veces A |
Sin recomendaciones específicas. |
|
Zumo de pomelo, 240 ml QD* |
40 mg DU |
t 37% |
No se recomienda la toma simultánea de grandes cantidades de zumo de pomelo y ATOZET. |
|
Diltiazem 240 mg QD, 28 días |
40 mg DU |
t 51% |
Tras el inicio del tratamiento o después del ajuste de dosis de diltiazem, se recomienda la monitorización clínica adecuada de estos pacientes. |
|
Eritromicina 500 mg QID, 7 días |
10 mg DU |
t 33%A |
Se recomienda el uso de una dosis máxima más baja y la |
|
monitorización clínica de estos pacientes. | |||
|
Amlodipino 10 mg, dosis única |
80 mg DU |
T 18% |
Sin recomendaciones específicas. |
|
Cimetidina 300 mg QID, 2 semanas |
10 mg QD durante 4 semanas |
4 inferior al 1%A |
Sin recomendaciones específicas. |
|
Suspensión de antiácidos que contienen hidróxidos de magnesio y aluminio, 30 ml QID, 2 semanas |
10 mg QD durante 4 semanas |
| 35%a |
Sin recomendaciones específicas. |
|
Efavirenz 600 mg QD, 14 días |
10 mg durante 3 días |
4 41% |
Sin recomendaciones específicas. |
|
Rifampicina 600 mg QD, 7 días (coadministrada) |
40 mg DU |
T 30% |
Si no se pude evitar la coadministración, se recomienda la administración simultánea de ATOZETy rifampicina, junto con monitorización clínica. |
|
Rifampicina 600 mg QD, 5 días (dosis separadas) |
40 mg DU |
4 80% | |
|
Gemfibrozilo 600 mg BID, 7 días |
40 mg DU |
T 35% |
No recomendado. |
|
Fenofibrato 160 mg QD, 7 días |
40 mg DU |
T 3% |
No recomendado. |
|
Boceprevir 800 mg TID, 7 días |
40 mg DU |
T 2,3 veces |
Se recomienda el uso de una dosis inicial menor, así como la monitorización clínica de estos pacientes. La dosis de ATOZET no deberá superar una dosis diaria de 10/20 mg durante la coadministración con boceprevir. |
& Los datos facilitados como un cambio de x veces representan un cociente directo entre la
coadministración y la administración de atorvastatina en monoterapia (es decir, 1 vez = sin cambio). Los datos facilitados como cambio porcentual (%) representan la diferencia en % con respecto a atorvastatina sola (es decir, 0% = sin cambio).
# Ver secciones 4.4 y 4.5 para consultar su relevancia clínica.
* Contiene uno o más componentes que inhiben CYP3A4 y puede aumentar las concentraciones plasmáticas de los medicamentos metabolizados por CYP3A4. La toma de un vaso de 240 ml de zumo de pomelo también tuvo como consecuencia una disminución del AUC del 20,4% en el caso del metabolito activo ortohidroxi. La ingesta de grandes cantidades de zumo de pomelo (más de 1,2 l al día
ÍITI
durante 5 días) supuso un aumento de 2,5 veces del AUC de atorvastatina y del producto activo (atorvastatina y sus metabolitos).
A Actividad equivalente total de atorvastatina El aumento se indica como “t” y el descenso como “j”
QD = una vez al día; DU = dosis única; BID = dos veces al día; TID = tres veces al día; QID = cuatro veces al día
Tabla 2
Efecto de atorvastatina sobre la farmacocinética de los medicamentos administrados de forma conjunta
|
Régimen de administración de atorvastatina |
Medicamento coadministrado |
ATOZET | |
|
Medicamento/Dosis (mg) |
Cambio en el AUC& |
Recomendación clínica | |
|
80 mg QD durante 10 días |
Digoxina 0,25 mg QD, 20 días |
t 15% |
Los pacientes que tomen digoxina deberán ser monitorizados adecuadamente. |
|
40 mg QD durante 22 días |
Anticonceptivos orales QD, 2 meses -noretisterona 1 mg -etinilestradiol 35 pg |
t 28% t 19% |
Sin recomendaciones específicas. |
|
80 mg QD durante 15 días |
* Fenazona, 600 mg DU |
t 3% |
Sin recomendaciones específicas. |
|
10 mg QD durante 4 días |
Fosamprenavir 1.400 mg BID, 14 días |
j 27% |
Sin recomendaciones específicas. |
& Los datos facilitados como cambio porcentual (%) representan la diferencia en % con respecto a atorvastatina sola (es decir, 0% = sin cambio)
* La coadministración de dosis múltiples de atorvastatina y fenazona mostró un efecto pequeño, o indetectable, sobre el aclaramiento de fenazona.
El aumento se indica como “t” y la disminución como “j”
QD = una vez al día; DU = dosis única; BID = dos veces al día
4.6 Fertilidad, embarazo y lactancia
Mujeres potencialmente fértiles
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento (ver sección 4.3).
Embarazo
La aterosclerosis es un proceso crónico y generalmente la interrupción de los fármacos hipolipemiantes durante el embarazo podría tener un leve impacto sobre el riesgo a largo plazo asociado a la hipercolesterolemia primaria.
ATOZET
ATOZET está contraindicado durante el embarazo (ver sección 4.3). No se dispone de datos clínicos sobre el uso de ATOZET durante el embarazo.
La administración conjunta de ezetimiba y atorvastatina en ratas gestantes indicó que había un aumento relacionado con la combinación en estudio en el cambio del esqueleto “reducción de la osificación de las esternebras” en el grupo tratado con una dosis alta de ezetimiba/atorvastatina. Este hecho podría estar relacionado con la disminución observada en los pesos corporales de los fetos. En conejas gestantes se
.<ítp.
observó una baja incidencia de deformidades esqueléticas (esternebras fusionadas, vértebras caudales fusionadas y variación asimétrica de las esternebras).
Atorvastatina
No se ha establecido la seguridad de atorvastatina en mujeres embarazadas. No se han llevado a cabo ensayos clínicos controlados con atorvastatina en mujeres embarazadas. Se ha informado raramente de anomalías congénitas tras la exposición intrauterina a inhibidores de la HMG-CoA reductasa. Los estudios en animales han demostrado toxicidad en la reproducción (ver sección 5.3).
Ezetimiba
No se dispone de datos clínicos sobre el uso de ezetimiba durante el embarazo.
Lactancia
ATOZET está contraindicado durante la lactancia. Debido a la posibilidad de que se produzcan reacciones adversas graves, las mujeres que reciben ATOZET no deben dar el pecho. Los estudios realizados en ratas han demostrado que ezetimiba se secreta en la leche materna. En ratas, la concentración plasmática de atorvastatina y sus metabolitos activos es similar a la de la leche. Se desconoce si los principios activos de ATOZET se secretan en la leche materna humana (ver sección 4.3).
Fertilidad
No se han llevado a cabo estudios de fertilidad con ATOZET.
Atorvastatina
En los estudios en animales, atorvastatina no tuvo ningún efecto sobre la fertilidad masculina ni femenina.
Ezetimiba
Ezetimiba no tuvo ningún efecto sobre la fertilidad de ratas macho o hembra.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
ATOZET tiene un efecto inapreciable sobre la capacidad para conducir y utilizar máquinas. No obstante, al conducir o utilizar máquinas, se debe tener en cuenta que se han notificado mareos.
4.8 Reacciones adversas
Resumen del perfil de seguridad
ATOZET (o la coadministración de ezetimiba y atorvastatina equivalente a ATOZET) se ha evaluado con respecto a la seguridad en más de 2.400 pacientes en 7 ensayos clínicos.
Tabla de reacciones adversas
Las frecuencias se definen como: muy frecuentes (>1/10); frecuentes >1/100, <1/10); poco frecuentes (>1/1.000, <1/100); raras (>1/10.000, <1/1.000); y muy raras (<1/10.000).
|
ATOZET | ||
|
Clasificación por órganos y sistemas |
Reacciones adversas |
Frecuencia |
|
Infecciones e infestaciones |
gripe |
Poco frecuentes |
|
Trastornos psiquiátricos |
depresión; insomnio; trastornos del sueño |
Poco frecuentes |
|
Trastornos del sistema nervioso |
mareos; disgeusia; cefalea; parestesia |
Poco frecuentes |
|
Trastornos cardiacos |
bradicardia sinusal |
Poco frecuentes |
|
Trastornos vasculares |
sofocos |
Poco frecuentes |
|
Trastornos respiratorios, torácicos y mediastínicos |
disnea |
Poco frecuentes |
|
Trastornos gastrointestinales |
diarrea |
Frecuentes |
|
molestias abdominales; distensión abdominal; dolor abdominal; dolor en la parte inferior del abdomen; dolor en la parte superior del abdomen; estreñimiento; dispepsia; flatulencia; deposiciones frecuentes; gastritis; náuseas; molestias estomacales |
Poco frecuentes | |
|
Trastornos de la piel y del tejido subcutáneo |
acné; urticaria |
Poco frecuentes |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
mialgia |
Frecuentes |
|
artralgia; dolor de espalda; fatiga muscular; espasmos musculares; debilidad muscular; dolor en las extremidades |
Poco frecuentes | |
|
Trastornos generales y alteraciones en el lugar de administración |
astenia; fatiga; malestar general; edema |
Poco frecuentes |
|
Exploraciones complementarias: |
aumento de ALT y/o AST; aumento de la fosfatasa alcalina, aumento de la creatina cinasa (CK) sanguínea, aumento de la gamma glutamil transferasa; aumento de las enzimas hepáticas; prueba de función hepática anormal; aumento de peso |
Poco frecuentes |
Valores de laboratorio
En ensayos clínicos controlados, la incidencia de elevaciones clínicamente importantes en las transaminasas séricas (ALT y/o AST >3 x LSN, consecutivas) fue del 0,6% para los pacientes tratados con ATOZET. Estas elevaciones fueron generalmente asintomáticas, no asociadas con colestasis, y volvieron a los valores basales espontáneamente o después de discontinuar el tratamiento. (Ver sección 4.4).
Experiencia postcomercialización y en ensayos clínicos
Las siguientes reacciones adversas adicionales han sido notificadas en el uso después de la comercialización con ATOZET o durante los ensayos clínicos o durante su uso después de la comercialización con ezetimiba o atorvastatina:
Infecciones e infestaciones: nasofaringitis
Trastornos de la sangre y del sistema linfático: trombocitopenia
Trastornos del sistema inmunitario: hipersensibilidad, que incluye anafilaxia, angioedema, erupción cutánea y urticaria
Trastornos del metabolismo y la nutrición: disminución del apetito; anorexia; hiperglucemia; hipoglucemia
Trastornos psiquiátricos: pesadillas
Trastornos del sistema nervioso: hipoestesia; amnesia; neuropatía periférica Trastornos oculares: visión borrosa; alteración de la visión Trastornos del oído y del laberinto: acúfenos; pérdida de audición Trastornos vasculares: hipertensión
Trastornos respiratorios, torácicos y mediastínicos: tos; dolor faringolaríngeo; epistaxis
Trastornos gastrointestinales: pancreatitis; reflujo gastroesofágico; eructos; vómitos; boca seca
Trastornos hepatobiliares: hepatitis; colelitiasis; colecistitis; colestasis; insuficiencia hepática mortal y no mortal
Trastornos de la piel y del tejido subcutáneo: alopecia; erupción cutánea; prurito; eritema multiforme; edema angioneurótico; dermatitis bullosa que incluye eritema multiforme, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica
Trastornos musculoesqueléticos y del tejido conectivo: miopatía/rabdomiólisis; dolor de cuello; inflamación articular; miositis; miopatía necrosante inmunomediada (frecuencia no conocida) (ver sección 4.4)
Trastornos del aparato reproductor y de la mama: ginecomastia
Trastornos generales y alteraciones en el lugar de administración: dolor en el pecho; dolor; edema periférico; pirexia
Exploraciones complementarias: análisis de orina positivo para leucocitos
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos: tendonopatía, en ocasiones complicada por una ruptura
Se han notificado los siguientes acontecimientos adversos asociados al uso de algunas estatinas:
• disfunción sexual
• casos excepcionales de enfermedad pulmonar intersticial, especialmente con tratamiento a largo plazo (ver sección 4.4)
• diabetes mellitus: la frecuencia dependerá de la presencia o ausencia de factores de riesgo (glucemia en ayunas >5,6 mmol/l, IMC >30 kg/m2, aumento de los triglicéridos o antecedentes de hipertensión)
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
ATOZET
En caso de producirse sobredosis, deben emplearse medidas sintomáticas y de soporte. Se deberán realizar pruebas de función hepática y controlar los niveles séricos de CK.
Ezetimiba
En ensayos clínicos, la administración de 50 mg/día de ezetimiba a 15 sujetos sanos durante un periodo de hasta 14 días ó 40 mg/día a 18 pacientes con hipercolesterolemia primaria durante un periodo de hasta 56 días fue por lo general bien tolerada. Se han comunicado algunos casos de sobredosis; la mayoría no se han asociado con experiencias adversas. Las reacciones adversas comunicadas no han sido graves. En animales, no se observó toxicidad después de la administración de dosis orales únicas de 5.000 mg/kg de ezetimiba en ratas y ratones y 3.000 mg/kg en perros.
Atorvastatina
Debido a la elevada unión de atorvastatina a las proteínas plasmáticas, no se prevé que la hemodiálisis aumente significativamente el aclaramiento de atorvastatina.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes modificadores de los lípidos, Inhibidores de la HMG-CoA reductasa en combinación con otros fármacos modificadores de los lípidos, Código ATC: C10BA05
ATOZET (ezetimiba/atorvastatina) es un hipolipemiante que inhibe selectivamente la absorción intestinal del colesterol y esteroles vegetales relacionados e inhibe la síntesis endógena del colesterol.
Mecanismo de acción ATOZET
El colesterol plasmático se deriva de la absorción intestinal y de la síntesis endógena. ATOZET contiene ezetimiba y atorvastatina, dos compuestos hipolipemiantes con mecanismos de acción complementarios. ATOZET reduce las cifras elevadas de colesterol total (C-total), C-LDL, apolipoproteína B (Apo B), triglicéridos (TG) y colesterol no asociado a lipoproteínas de alta densidad (C-no HDL) y aumenta el colesterol asociado a lipoproteínas de alta densidad (C-HDL) a través de la doble inhibición de la absorción y la síntesis del colesterol.
Ezetimiba
Ezetimiba inhibe la absorción intestinal del colesterol. Ezetimiba es activo por vía oral y tiene un mecanismo de acción que difiere del de otras clases de reductores del colesterol (p. ej., estatinas, secuestrantes de ácidos biliares [resinas], derivados del ácido fíbrico y estanoles vegetales). La diana molecular de ezetimiba es el transportador de esterol, el Niemann-Pick C1-Like 1 (NPC1L1), responsable de la captación intestinal de colesterol y fitoesteroles.
Ezetimiba se localiza en las microvellosidades del intestino delgado e inhibe la absorción del colesterol, dando lugar a una disminución del transporte de colesterol intestinal al hígado; las estatinas reducen la síntesis del colesterol en el hígado y al unirse estos mecanismos diferentes se produce una reducción complementaria del colesterol. En un ensayo clínico de 2 semanas de duración en 18 pacientes con hipercolesterolemia, ezetimiba inhibió la absorción del colesterol intestinal en un 54%, en comparación con placebo.
Se realizaron una serie de estudios preclínicos para determinar la selectividad de ezetimiba para inhibir la absorción del colesterol. Ezetimiba inhibió la absorción del colesterol marcado con C14 sin que se produjeran efectos sobre la absorción de los triglicéridos, ácidos grasos, ácidos biliares, progesterona, etinilestradiol o las vitaminas liposolubles A y D.
Atorvastatina
Atorvastatina es un inhibidor competitivo selectivo de la HMG-CoA reductasa, la enzima limitante responsable de la conversión de 3-hidroxi-3-metil-glutaril-coenzima A a mevalonato, un precursor de los esteroles, incluido el colesterol. En el hígado, los triglicéridos y el colesterol se incorporan a las lipoproteínas de muy baja densidad (VLDL) y se liberan al plasma para su distribución a los tejidos periféricos. Las lipoproteínas de baja densidad (LDL) se forman a partir de las VLDL y se catabolizan fundamentalmente a través del receptor de alta afinidad para las LDL (receptor de LDL).
Atorvastatina disminuye las concentraciones séricas del colesterol plasmático y de las lipoproteínas inhibiendo la HMG-CoA reductasa y posteriormente la biosíntesis de colesterol en el hígado, e incrementa el número de receptores hepáticos de LDL en la superficie celular para intensificar la captación y el catabolismo de LDL.
Atorvastatina reduce la producción de LDL y el número de partículas de LDL. Atorvastatina produce un incremento profundo y sostenido de la actividad del receptor de LDL que se añade a un cambio beneficioso en la calidad de las partículas de LDL circulantes. Atorvastatina es eficaz a la hora de reducir el C-LDL en
pacientes con hipercolesterolemia familiar homocigota, una población que habitualmente no ha respondido a los medicamentos hipolipemiantes.
En un estudio de dosis respuesta, se ha observado que atorvastatina reduce las concentraciones de C-total (30% - 46%), C-LDL (41% - 61%), apolipoproteína B (34% - 50%) y triglicéridos (14% - 33%), al tiempo que produce aumentos variables de C-HDL y apolipoproteína A1. Estos resultados son aplicables a pacientes con hipercolesterolemia familiar heterocigota, formas no familiares de hipercolesterolemia e hiperlipidemia mixta, incluidos los pacientes con diabetes mellitus no dependiente de insulina.
Eficacia clínica y seguridad
En estudios clínicos controlados, ATOZET redujo significativamente las cifras de C-total, C-LDL, Apo B y TG, e incrementó el C-HDL en pacientes con hipercolesterolemia.
Hipercolesterolemia primaria
En un estudio controlado con placebo, 628 pacientes con hiperlipidemia fueron aleatorizados para recibir placebo, ezetimiba (10 mg), atorvastatina (10 mg, 20 mg, 40 mg u 80 mg) o una combinación de ezetimiba y atorvastatina equivalente a ATOZET (10/10, 10/20, 10/40 y 10/80) durante periodos de hasta 12 semanas.
Los pacientes que recibieron todas las dosis de ATOZET se compararon con los que recibieron todas las dosis de atorvastatina. ATOZET disminuyó el C-total, C-LDL, Apo B, TG y C-no HDL, y el aumento de los niveles de C-HDL fue significativamente mayor con ATOZET que con atorvastatina sola (ver Tabla 3).
Tabla 3
Respuesta a ATOZET en pacientes con hiperlipidemia primaria (Mediaa del cambio porcentual con respecto al valor basal sin tratamientob, a las 12 semanas)
|
Tratamiento (Dosis diaria) |
N |
C-total |
C-LDL |
Apo B |
TGa |
C-HDL |
C-no HDL |
|
Datos combinados (Todas las dosis de ATOZET)c |
255 |
-41 |
-56 |
-45 |
-33 |
+7 |
-52 |
|
Datos combinados (Todas las dosis de atorvastatina)c |
248 |
-32 |
-44 |
-36 |
-24 |
+4 |
-41 |
|
Ezetimiba 10 mg |
65 |
-14 |
-20 |
-15 |
-5 |
+4 |
-18 |
|
Placebo |
60 |
+4 |
+4 |
+3 |
-6 |
+4 |
+4 |
|
ATOZET por dosis 10/10 |
65 |
-38 |
-53 |
-43 |
-31 |
+9 |
-49 |
|
10/20 |
62 |
-39 |
-54 |
-44 |
-30 |
+9 |
-50 |
|
10/40 |
65 |
-42 |
-56 |
-45 |
-34 |
+5 |
-52 |
|
10/80 |
63 |
-46 |
-61 |
-50 |
-40 |
+7 |
-58 |
|
Atorvastatina por dosis | |||||||
|
10 mg |
60 |
-26 |
-37 |
-28 |
-21 |
+6 |
-34 |
|
20 mg |
60 |
-30 |
-42 |
-34 |
-23 |
+4 |
-39 |
|
40 mg |
66 |
-32 |
-45 |
-37 |
-24 |
+4 |
-41 |
|
80 mg |
62 |
-40 |
-54 |
-46 |
-31 |
+3 |
-51 |
a En el caso de los triglicéridos, los datos corresponden a la mediana del cambio porcentual con respecto al valor basal
b Valor basal: sin tratamiento con medicamentos hipolipemiantes
c Todas las dosis de ATOZET agrupadas (10/10-10/80 mg) redujeron significativamente el C-total, C-LDL, Apo B, TG y C-no HDL, e incrementaron significativamente el C-HDL en comparación con todas las dosis de atorvastatina agrupadas (10-80 mg).
En un estudio controlado, el estudio Titration of Atorvastatin Versus Ezetimibe Add-On to Atorvastatin in Patiens with Hypercholesterolaemia (TEMPO), 184 pacientes, con una concentración de C-LDL >2,6 mmol/l y <4,1 mmol/l y un riesgo de moderado a alto de CC, recibieron atorvastatina 20 mg durante un mínimo de 4 semanas antes de la aleatorización. Tras ese periodo, los pacientes que no presentaban unos valores de C-LDL <2,6 mmol/l fueron aleatorizados para recibir la combinación de ezetimiba y atorvastatina (equivalente a ATOZET 10/20) o 40 mg de atorvastatina durante 6 semanas.
ATOZET 10/20 fue significativamente más eficaz que la duplicación de la dosis de atorvastatina a 40 mg, al causar una mayor reducción del C-total (-20% frente a -7%), C-LDL (-31% frente a -11%), Apo B (-21% frente a -8%) y C-no HDL (-27% frente a -10%). Los resultados de C-HDL y TG no fueron significativamente diferentes entre los dos grupos de tratamiento. Asimismo, significativamente más pacientes que recibieron ATOZET 10/20 alcanzaron niveles de C-LDL <2,6 mmol/l en comparación con los que recibieron atorvastatina 40 mg, el 84% frente a 49%.
En un estudio controlado, el estudio Ezetimibe Plus Atorvastatin Versus Atorvastatin Titration in Achieving Lower C-LDL Targets in Hypercholesterolaemic Patients (EZ-PATH), 556 pacientes con riesgo cardiovascular alto que presentaban un nivel de C-LDL >1,8 mmol/l y <4,1 mmol/l recibieron atorvastatina 40 mg durante un mínimo de 4 semanas antes de la aleatorización. Tras ese periodo, los pacientes que no alcanzaron un nivel de C-LDL <1,8 mmol/l fueron aleatorizados para recibir la combinación de ezetimiba y atorvastatina (equivalente a ATOZET 10/40) o atorvastatina 80 mg durante 6 semanas.
ATOZET 10/40 fue significativamente más eficaz que la duplicación de la dosis de atorvastatina a 80 mg produciendo una mayor reducción del C-total (-17% frente a -7%), C-LDL (-27% frente a -11%), Apo B (-18% frente a -8%), TG (-12% frente a -6%), y C-no-HDL (-23% frente a -9%). Los resultados correspondientes a C-HDL no fueron significativamente diferentes entre los dos grupos de tratamiento. Asimismo, significativamente más pacientes que recibieron ATOZET 10/40 alcanzaron una concentración de C-LDL <1,8 mmol/l en comparación con los que recibieron atorvastatina 80 mg, el 74% frente a 32%.
En un estudio de 8 semanas controlado con placebo, 308 pacientes hipercolesterolémicos que recibieron atorvastatina y que no habían alcanzado la concentración objetivo de C-LDL del Programa nacional de educación sobre el colesterol (NCEP) (la concentración objetivo del C-LDL se basa en el valor basal de C-LDL y el riesgo de CC) fueron aleatorizados para recibir ezetimiba 10 mg o placebo, además de su tratamiento habitual con atorvastatina.
Entre los pacientes que no habían alcanzado la concentración objetivo de C-LDL en el momento basal (~83%), significativamente más pacientes que recibieron ezetimiba coadministrada con atorvastatina alcanzaron su objetivo de C-LDL en comparación con los pacientes que recibieron placebo coadministrado con atorvastatina, el 67% frente a 19%. La incorporación de ezetimiba al tratamiento con atorvastatina supuso una disminución significativamente mayor de la concentración de C-LDL en comparación con el tratamiento con placebo añadido a atorvastatina, 25% frente a 4%. La incorporación de ezetimiba al tratamiento con atorvastatina también disminuyó significativamente C-total, Apo B y TG en comparación con el tratamiento con placebo añadido a atorvastatina.
En un estudio en dos fases, controlado, de 12 semanas, 1.539 pacientes con riesgo cardiovascular alto, con un nivel de C-LDL entre 2,6 y 4,1 mmol/l y en tratamiento con 10 mg al día de atorvastatina fueron aleatorizados para recibir: atorvastatina 20 mg, rosuvastatina 10 mg o ATOZET 10/10. Tras 6 semanas de tratamiento (fase I), a los pacientes tratados con atorvastatina 20 mg que no alcanzaron una concentración de C-LDL <2,6 mmol/l se les cambió el tratamiento a atorvastatina 40 mg o ATOZET 10/20 durante 6 semanas (fase II) y a pacientes similares tratados con rosuvastatina 10 mg durante la fase I se les cambió el tratamiento a rosuvastatina 20 mg o ATOZET 10/20. En la Tabla 4 se muestran las reducciones de C-LDL y las comparaciones entre el grupo tratado con ATOZET y otros grupos de tratamiento estudiados.
Tabla 4
Respuesta a ATOZET* en pacientes de alto riesgo con una concentración de C-LDL entre 2,6 y
4,1 mmol/l tratados con 10 mg al día de atorvastatina en el momento basal
Tratamiento_N Cambio porcentual con respecto al valor basalt
|
C-total |
C-LDL |
Apo B |
TG* |
C-HDL |
C-no HDL | ||
|
Fase I Cambio de tratamiento de atorvastatina 10 mg a | |||||||
|
ATOZET 10/10 |
120 |
-13,5 |
-22,2 |
-11,3 |
-6,0 |
+0,6 |
-18,3 |
|
Atorvastatina 20 mg |
480 |
-6,4§ |
-9,5§ |
-6,01 |
-3,9 |
-1,1 |
-8,1 § |
|
Rosuvastatina 10 mg |
939 |
-7,7§ |
-13,0§ |
-6,9# |
-1,1 |
+1,1 |
-10,6§ |
|
Fase II Cambio de tratamiento de atorvastatina 20 mg a | |||||||
|
ATOZET 10/20 |
124 |
-10,7 |
-17,4 |
-9,8 |
-5,9 |
+0,7 |
-15,1 |
|
Atorvastatina 40 mg |
124 |
-3,8 B |
-6,9 B |
-5,4 |
-3,1 |
+1,7 |
-5,8 B |
|
Cambio de tratamiento de rosuvastatina 10 mg a | |||||||
|
ATOZET 10/20 |
231 |
-11,8 |
-17,1 |
-11,9 |
-10,2 |
+0,1 |
-16,2 |
|
Rosuvastatina 20 mg |
205 |
-4,5B |
-7,5 B |
-4,1S |
-3,2b |
+0,8 |
-6,4 B |
* Coadministración de ezetimiba y atorvastatina equivalente a ATOZET 10/10 o ATOZET 10/20 ^Estimadores M (basados en el método de Huber; el IC del 95% y el valor p se obtuvieron a partir del ajuste de un modelo de regresión robusto con términos para el tratamiento y el valor basal)
* Las medias geométricas de los cambios porcentuales de TG con respecto al valor basal se calcularon basándose en la retrotransformación realizada por medio de la potenciación de las medias de los mínimos cuadrados (MC) basadas en el modelo y expresadas como (media geométrica - 1) multiplicada por 100
§ p<0,001 frente a ATOZET 10/10 1 p<0,01 frente a ATOZET 10/10
* p<0,05 frente a ATOZET 10/10
B p<0,001 frente a ATOZET 10/20 B p<0,05 frente a ATOZET 10/20
La Tabla 4 no contiene datos que comparen los efectos de ATOZET 10/10 o 10/20 con dosis superiores a 40 mg de atorvastatina o 20 mg de rosuvastatina.
En un estudio controlado con placebo, el estudio Myocardial Ischaemia Reduction with Aggressive Cholesterol Lowering (MIRACL), los pacientes con síndrome coronario agudo (infarto de miocardio (IM) sin onda Q o angina inestable) fueron aleatorizados para recibir atorvastatina 80 mg/día (n=1.538) o placebo (n=1.548). El tratamiento se inició durante la fase aguda tras la hospitalización y duró 16 semanas. Atorvastatina 80 mg/día proporcionó una reducción del 16% (p=0,048) del riesgo del criterio principal de valoración combinado: muerte por cualquier causa, IM no mortal, paro cardiaco con reanimación o angina de pecho con evidencias de isquemia miocárdica que requirió hospitalización. Esto se debió fundamentalmente a una reducción del 26% de la rehospitalización por angina de pecho con evidencias de isquemia miocárdica (p=0,018).
ATOZET contiene atorvastatina. En un estudio controlado con placebo, el estudio Anglo-Scandinavian Cardiac Outcomes Trial Lipid Lowering Arm (ASCOT-LLA), se evaluó el efecto de atorvastatina 10 mg sobre CC mortal y no mortal en 10.305 pacientes hipertensos, de 40-80 años de edad, con unos niveles de CT <6,5 mmol/l y al menos tres factores de riesgo cardiovascular. Los pacientes fueron sometidos a seguimiento durante una mediana de 3,3 años. Atorvastatina 10 mg redujo significativamente (p<0,001) el riesgo relativo de: CCC mortal más IM no mortal en un 36% (reducción del riesgo absoluto = 1,1%); acontecimientos cardiovasculares totales y procedimientos de revascularización en un 20% (reducción del riesgo absoluto= 1,9%) y acontecimientos coronarios totales en un 29% (reducción del riesgo absoluto=
1,4%).
En un estudio controlado con placebo, el estudio Collaborative Atorvastatina Diabetes Study (CARDS), se evaluó el efecto de atorvastatina 10 mg sobre los criterios de evaluación de la enfermedad cardiovascular en 2.838 pacientes, de 40-75 años de edad, con diabetes tipo 2, que presentaban uno o más factores de riesgo cardiovascular, LDL <4,1 mmol/l y TG <6,8 mmol/l. Los pacientes fueron sometidos a seguimiento durante una mediana de 3,9 años. Atorvastatina 10 mg redujo significativamente (p<0,05): la tasa de acontecimientos cardiovasculares importantes en un 37% (reducción del riesgo absoluto= 3,2%); el riesgo de ictus en un 48% (reducción del riesgo absoluto= 1,3%) y el riesgo de IM en un 42% (reducción del riesgo absoluto= 1,9%).
Prevención de acontecimientos cardiovasculares
En un estudio con ezetimiba/simvastatina, multicéntrico, aleatorizado, doble ciego y con control activo participaron 18.144 pacientes reclutados en los 10 días siguientes a una hospitalización por un síndrome coronario agudo (SCA; infarto agudo de miocardio [IM] o angina inestable [AI]). Se aleatorizó a todos los pacientes en una proporción de 1:1 para recibir ezetimiba/simvastatina 10/40 mg (n=9.067) o simvastatina 40 mg (n=9.077) y seguidos durante una mediana de 6,0 años.
La edad media de los pacientes era de 63,6 años; el 76% eran varones, el 84% eran de raza blanca y el 27% eran diabéticos. El valor medio de C-LDL en el momento que los pacientes presentaron el acontecimiento para ser admitidos en el estudio era de 80 mg/dl (2,1 mmol/l) en los que recibían tratamiento hipolipemiante (n=6.390) y de 101 mg/dl (2,6 mmol/l) en los que no habían recibido tratamiento hipolipemiante previo (n=11.594). Antes de la hospitalización por el acontecimiento de SCA, el 34% de los pacientes recibían tratamiento con estatinas. Al cabo de un año, el C-LDL medio en los pacientes que seguían en tratamiento era de 53,2 mg/dl (1,4 mmol/l) en el grupo de ezetimiba/simvastatina y de
69,9 mg/dl (1,8 mmol/l) en el grupo de simvastatina en monoterapia.
El criterio de valoración principal fue una combinación de muerte cardiovascular, acontecimientos coronarios importantes (definidos como IM no mortal, AI documentada que requirió hospitalización o cualquier procedimiento de revascularización coronaria realizado al menos 30 días después de la asignación del tratamiento aleatorizado) y accidente cerebrovascular no mortal. El estudio demostró que el tratamiento con ezetimiba/simvastatina proporcionó un beneficio mayor en la reducción del criterio de valoración principal compuesto de muerte cardiovascular, acontecimientos coronarios importantes y accidente cerebrovascular no mortal que el tratamiento con simvastatina sola (reducción del riesgo relativo del 6,4%, p=0,016). El criterio de valoración principal se produjo en 2.572 de los 9.067 pacientes del grupo de ezetimiba/simvastatina (tasa de Kaplan-Meier [KM] a los 7 años del 32,72%) y en 2.742 de los 9.077 pacientes del grupo de simvastatina sola (tasa de KM a los 7 años del 34,67%). (Ver Figura 1 y Tabla 5). Cabe esperar que este beneficio incremental sea similar con la administración conjunta de ezetimiba y atorvastatina. La tasa de mortalidad total no cambió en este grupo de pacientes de alto riesgo.
Se observó un beneficio general en todos los tipos de accidente cerebrovascular; sin embargo hubo un pequeño aumento no significativo de la incidencia de accidente cerebrovascular hemorrágico en el grupo de ezetimiba/simvastatina en comparación con el grupo de simvastatina sola. El riesgo de accidente cerebrovascular hemorrágico con ezetimiba administrada conjuntamente con estatinas más potentes no se ha evaluado en estudios de resultados a largo plazo.
Por lo general, el efecto del tratamiento con ezetimiba/simvastatina fue similar a los resultados globales en numerosos subgrupos, definidos en función del sexo, la edad, la raza, antecedentes de diabetes, las concentraciones iniciales de lípidos, el tratamiento previo con estatinas, accidente cerebrovascular previo y la hipertensión.

Figura 1: Efecto de ezetimiba/simvastatina sobre el criterio de valoración principal compuesto de muerte cardiovascular, acontecimiento coronario importante o accidente cerebrovascular no mortal
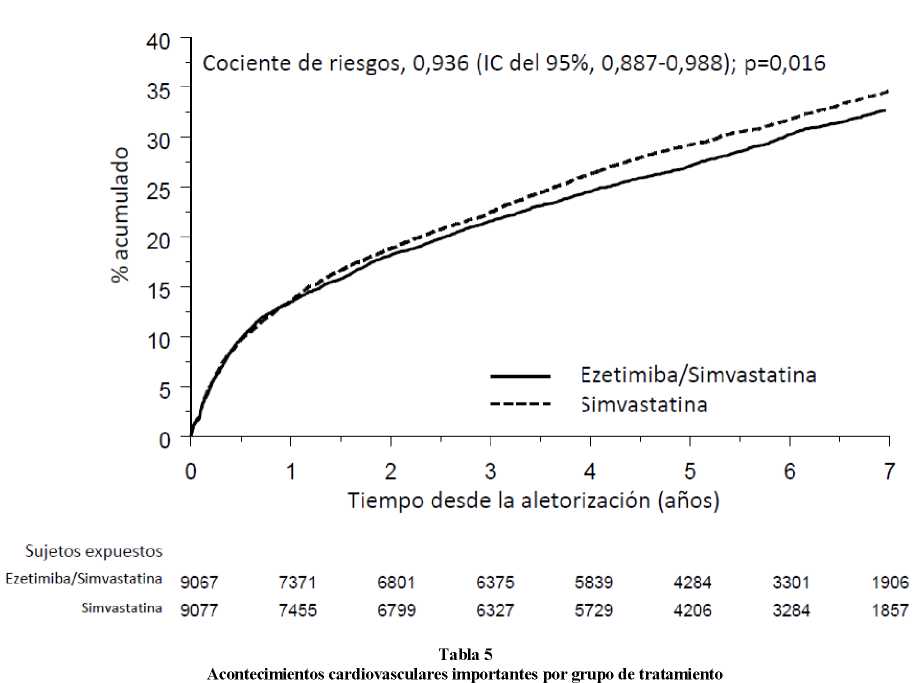
en todos los pacientes aleatorizados en IMPROVE-IT
|
Resultado |
Ezetimiba/Simvastatina 10/40 mg* (N=9.067) n K-M %* |
Simvastatina 40 mg+ (N=9.077) n K-M %* |
Cociente de riesgo (IC del 95%) |
Valor de p |
|
Criterio de valoración principal compuesto de eficacia (muerte cardiovascular, acontecimientos | ||||
|
coronarios importantes y accidente cerebrovascular no mortal) |
2.572 32,72% |
2.742 34,67% |
0,936 (0,887, 0,988) |
0,016 |
Componentes del criterio de valoración principal compuesto y criterios de valoración de eficacia seleccionados (primera aparición de un evento específico en cualquier momento)
|
Muerte cardiovascular |
537 |
6,89% |
538 |
6,84% |
1,000 (0,887, 1,127) |
0,997 |
|
Episodio coronario importante: | ||||||
|
IM no mortal |
945 |
12,77% |
1.083 |
14,41% |
0,871 (0,798, 0,950) |
0,002 |
|
Angina inestable que requiere hospitalización |
156 |
2,06% |
148 |
1,92% |
1,059 (0,846, 1,326) |
0,618 |
|
Revascularización coronaria después de 30 días |
1.690 |
21,84% |
1.793 |
23,36% |
0,947 (0,886, 1,012) |
0,107 |
|
Accidente cerebrovascular no mortal |
245 |
3,49% |
305 |
4,24% |
0,802 (0,678, 0,949) |
0,010 |
* al 6% se les aumenta la dosis a ezetimiba/simvastatina 10/80 mg. t al 27% se les aumenta la dosis a simvastatina 80 mg.
* estimación de Kaplan-Meier a 7 años.
Hipercolesterolemia familiar homocigota (HoFH)
Se llevó a cabo un estudio doble ciego, aleatorizado, de 12 semanas en pacientes con un diagnóstico clínico y/o genotípico de HoFH. Los datos que se analizaron provenían de un subgrupo de pacientes (n=36) que
recibieron atorvastatina 40 mg en el momento basal. El aumento de la dosis de atorvastatina de 40 a 80 mg (n=12) produjo una reducción del C-LDL del 2% con respecto al valor basal, con 40 mg de atorvastatina. La combinación de ezetimiba y atorvastatina equivalente a ATOZET (10/40 y 10/80 agrupados, n=24), produjo una reducción del C-LDL del 19% con respecto al valor basal con 40 mg de atorvastatina. En los pacientes a los que se administró la combinación de ezetimiba y atorvastatina equivalente a ATOZET (10/80, n=12), se produjo una reducción del C-LDL del 25% con respecto al valor basal con 40 mg de atorvastatina.
Tras finalizar el estudio de 12 semanas, a los pacientes elegibles (n=35) que recibieron atorvastatina 40 mg en el momento basal, se les asignó para recibir la combinación de ezetimiba y atorvastatina equivalente a ATOZET 10/40 durante hasta un periodo adicional de 24 meses. Después de un mínimo de 4 semanas de tratamiento, la dosis de atorvastatina pudo duplicarse hasta alcanzar una dosis máxima de 80 mg. Al final de los 24 meses, ATOZET (10/40 y 10/80 agrupados) produjo una reducción del C-LDL que fue coherente con la observada en el estudio de 12 semanas.
La Agencia Europea de Medicamentos ha eximido de la obligación de presentar los resultados de los ensayos realizados con ATOZET en los diferentes grupos de la población pediátrica en los tratamientos de hipercolesterolemia e hiperlipidemia mixta (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
ATOZET
Se ha demostrado que ATOZET es bioequivalente a la coadministración de las dosis correspondientes de los comprimidos de ezetimiba y atorvastatina.
Absorción
ATOZET
Los efectos de una comida rica en grasas sobre la farmacocinética de ezetimiba y atorvastatina cuando se administran como comprimidos de ATOZET son comparables a los descritos para los comprimidos individuales.
Ezetimiba
Después de la administración oral, ezetimiba se absorbe rápidamente y es conjugado intensamente a un glucurónido fenólico farmacológicamente activo (ezetimiba-glucurónido). Las concentraciones plasmáticas máximas (Cmáx) medias se produjeron en el plazo de 1 a 2 horas en el caso de ezetimiba-glucurónido y de 4 a 12 horas en el de ezetimiba. La biodisponibilidad absoluta de ezetimiba no puede determinarse ya que el compuesto es prácticamente insoluble en el medio acuoso adecuado para inyección.
La administración concomitante de alimentos (alimentos con alto contenido graso o sin grasa) no tuvo efecto sobre la biodisponibilidad oral de ezetimiba cuando se administró en forma de comprimidos de 10 mg.
Atorvastatina
Atorvastatina se absorbe rápidamente después de su administración oral; la concentración plasmática máxima (Cmax) se alcanza en el plazo de 1 a 2 horas. El grado de absorción aumenta en proporción a la dosis de atorvastatina. Tras la administración oral, la biodisponibilidad de los comprimidos de atorvastatina recubiertos con película es del 95% al 99% en comparación con la solución oral. La biodisponibilidad absoluta de atorvastatina es de aproximadamente el 12% y la disponibilidad sistémica de la actividad inhibidora de la HMG-CoA reductasa es de aproximadamente el 30%. Esta baja disponibilidad sistémica se atribuye al aclaramiento presistémico en la mucosa gastrointestinal y/o al metabolismo hepático de primer paso.
Distribución
Ezetimiba
Ezetimiba y ezetimiba-glucurónido se unen en un 99,7% y un 88 a 92% a las proteínas plasmáticas humanas, respectivamente.
Atorvastatina
El volumen medio de distribución de atorvastatina es aproximadamente 381 l. Atorvastatina se une a proteínas plasmáticas en >98%.
Biotransformación
Ezetimiba
Ezetimiba se metaboliza principalmente en el intestino delgado y el hígado mediante conjugación glucurónida (una reacción de fase II) con posterior excreción biliar. En todas las especies evaluadas se ha observado un metabolismo oxidativo mínimo (una reacción de fase I). Ezetimiba y ezetimiba-glucurónido son los principales compuestos derivados del fármaco detectados en el plasma, los cuales constituyen aproximadamente del 10 al 20% y del 80 al 90% del fármaco total en plasma, respectivamente. Tanto ezetimiba como ezetimiba-glucurónido se eliminan lentamente del plasma con evidencia de una importante circulación enterohepática. La semivida de ezetimiba y ezetimiba-glucurónido es de aproximadamente 22 horas.
Atorvastatina
Atorvastatina es metabolizada por el citocromo P450 3A4 a derivados orto- y parahidroxilados y a diversos productos de la beta-oxidación. Además de utilizar otras rutas metabólicas, estos productos se metabolizan posteriormente por glucuronidación. In vitro, la inhibición de la HMG-CoA reductasa por parte de los metabolitos orto- y parahidroxilados es equivalente a la de atorvastatina. Aproximadamente el 70% de la actividad inhibitoria circulante de la HMG-CoA reductasa se atribuye a los metabolitos activos.
Eliminación
Ezetimiba
Tras la administración oral de ezetimiba marcado con C14 (20 mg) a humanos, ezetimiba total supuso aproximadamente un 93% de la radiactividad total en el plasma. Aproximadamente un 78% y un 11% de la radiactividad administrada se recuperaron en las heces y la orina, respectivamente, durante un periodo de recogida de 10 días. Después de 48 horas, no hubo niveles detectables de radiactividad en el plasma.
Atorvastatina
Atorvastatina se elimina fundamentalmente por la bilis tras el metabolismo hepático y/o extrahepático. No obstante, el medicamento no parece sufrir una circulación enterohepática significativa. La semivida de eliminación plasmática media de atorvastatina en humanos es de aproximadamente 14 horas. La semivida de la actividad inhibitoria para la HMG-CoA reductasa es de aproximadamente 20-30 horas, debido a la contribución de los metabolitos activos.
Población pediátrica
Ezetimiba
La absorción y el metabolismo de ezetimiba son similares en niños y adolescentes (10 a 18 años) y adultos. Basándose en ezetimiba total, no hay diferencias farmacocinéticas entre adolescentes y adultos. No se dispone de datos farmacocinéticos en la población pediátrica menor de 10 años. La experiencia clínica en pacientes pediátricos y adolescentes (con edades entre 9 y 17 años) se limita a pacientes con HFoH o sitosterolemia.
Atorvastatina
En un estudio abierto de 8 semanas, pacientes pediátricos (de edades comprendidas entre 6 y 17 años) en el estadio 1 de Tanner (N=15) y en el estadio 2 de Tanner (N=24) con hipercolesterolemia familiar heterocigota y una concentración basal de C-LDL > 4 mmol/l fueron tratados con comprimidos masticables de 5 ó 10 mg de atorvastatina o comprimidos recubiertos con película de 10 ó 20 mg de atorvastatina una vez al día, respectivamente. El peso corporal fue la única covariable significativa en el modelo farmacocinético poblacional de atorvastatina. El aclaramiento oral aparente de atorvastatina en los pacientes pediátricos fue similar al de los adultos cuando se extrapoló alométricamente por peso corporal.
Se observaron disminuciones sistemáticas de C-LDL y CT dentro del intervalo de las exposiciones a atorvastatina y o-hidroxiatorvastatina.
Pacientes de edad avanzada
Ezetimiba
Las concentraciones plasmáticas de ezetimiba total fueron unas 2 veces más altas en los pacientes de edad avanzada (>65 años) que en los jóvenes (18 a 45 años). La reducción del C-LDL y el perfil de seguridad son comparables entre pacientes ancianos y jóvenes tratados con ezetimiba.
Atorvastatina
Las concentraciones plasmáticas de atorvastatina y sus metabolitos activos son mayores en los sujetos ancianos sanos que en los adultos jóvenes, mientras que los efectos sobre los lípidos fueron comparables a los observados en las poblaciones de pacientes más jóvenes.
Insuficiencia hepática
Ezetimiba
Después de una dosis única de 10 mg de ezetimiba, el AUC medio de ezetimiba total aumentó en aproximadamente 1,7 veces en pacientes con insuficiencia hepática leve (puntuación Child-Pugh 5 ó 6), en comparación con los sujetos sanos. En un estudio de dosis múltiples durante 14 días (10 mg al día) en pacientes con insuficiencia hepática moderada (puntuación Child-Pugh 7 a 9), el AUC medio de ezetimiba total aumentó aproximadamente 4 veces el día 1 y el día 14 en comparación con los sujetos sanos. No es preciso realizar ajuste de la dosis en los pacientes con insuficiencia hepática leve. Debido a los efectos desconocidos de un aumento de exposición a ezetimiba en pacientes con insuficiencia hepática moderada o grave (puntuación Child-Pugh >9), no se recomienda el uso de ezetimiba en estos pacientes (ver secciones 4.2 y 4.4).
Atorvastatina
Las concentraciones plasmáticas de atorvastatina y sus metabolitos activos se encuentran notablemente incrementadas (aproximadamente 16 veces la Cmax y 11 veces el AUC) en pacientes con hepatopatía alcohólica crónica (Child-Pugh B).
Insuficiencia renal
Ezetimiba
Después de una dosis única de 10 mg de ezetimiba en pacientes con nefropatía grave (n=8; CrCl media < 30 ml/min/1,73 m2), el AUC medio de ezetimiba total aumentó aproximadamente 1,5 veces, en comparación con sujetos sanos (n=9).
Un paciente adicional de este estudio (al que se había realizado un trasplante renal y que recibía múltiples medicamentos, incluida ciclosporina) mostró una exposición a ezetimiba total 12 veces mayor.
Atorvastatina
La enfermedad renal no afecta ni a las concentraciones plasmáticas de atorvastatina y sus metabolitos activos ni a sus efectos sobre los lípidos.
Género
Ezetimiba
Las concentraciones plasmáticas de ezetimiba total son ligeramente mayores (aproximadamente 20%) en mujeres que en hombres. La reducción del C-LDL y el perfil de seguridad son comparables entre hombres y mujeres tratadas con ezetimiba.
Atorvastatina
Las concentraciones de atorvastatina y sus metabolitos activos en mujeres difieren de las observadas en hombres (mujeres: la Cmax es aproximadamente un 20% mayor y el AUC es aproximadamente un 10% inferior). Estas diferencias no tuvieron ninguna relevancia clínica, en consecuencia, no existen diferencias clínicamente significativas respecto a los efectos sobre los lípidos entre hombres y mujeres.
Polimorfismo de SLCO1B1 Atorvastatina
En la captación hepática de todos los inhibidores de la HMG-CoA reductasa, incluida atorvastatina, interviene el trasportador OATP1B1. En pacientes con polimorfismo de SLCO1B1 existe el riesgo de que se produzca un aumento de la exposición a atorvastatina, que puede conducir a un incremento del riesgo de rabdomiólisis (ver sección 4.4). El polimorfismo del gen que codifica el OATP1B1 (SLCO1B1 c.521CC) se asocia a un incremento de 2,4 veces de la exposición a atorvastatina (AUC) con respecto a las personas que no presentan esta variante genotípica (c.521TT). Puede que en estos pacientes también exista un bloqueo genético de la captación hepática de atorvastatina. Se desconocen las posibles consecuencias para la eficacia.
5.2.4 Eliminación
5.3 Datos preclínicos sobre seguridad
ATOZET
En estudios con la combinación de tres meses de duración en ratas y perros con ezetimiba y atorvastatina, los efectos tóxicos observados fueron esencialmente los asociados habitualmente a las estatinas. Los hallazgos histopatológicos del tipo de los observados con estatinas estaban limitados al hígado. Algunos de los efectos tóxicos fueron más pronunciados que los observados durante el tratamiento con estatinas solas, lo que es atribuible a interacciones farmacocinéticas y/o farmacodinámicas tras la coadministración.
La administración conjunta de ezetimiba y atorvastatina en ratas gestantes indicó que había un aumento relacionado con la combinación en estudio en el cambio del esqueleto “reducción de la osificación de las esternebras" en el grupo tratado con una dosis alta (1.000/108,6 mg/kg) de ezetimiba/atorvastatina. Este hecho puede estar relacionado con la disminución observada en los pesos corporales de los fetos. En conejas gestantes se observó una baja incidencia de deformidades esqueléticas (esternebras fusionadas, vértebras caudales fusionadas y variación asimétrica de las esternebras).
En una serie de ensayos in vivo e in vitro, ezetimiba, administrada sola o junto con atorvastatina, no mostró potencial genotóxico.
Ezetimiba
Los estudios en animales sobre la toxicidad crónica de ezetimiba no identificaron órganos diana para los efectos tóxicos. En perros tratados durante cuatro semanas con ezetimiba (> 0,03 mg/kg/día), la concentración de colesterol en la bilis se multiplicó por 2,5 a 3,5. Sin embargo, en un estudio de un año en perros que recibieron dosis de hasta 300 mg/kg/día no se observó aumento de la incidencia de colelitiasis ni otros efectos hepatobiliares. Se desconoce la importancia de estos datos en seres humanos. No puede descartarse un riesgo litogénico asociado al uso terapéutico de ezetimiba.
Las pruebas de carcinogenicidad a largo plazo sobre ezetimiba fueron negativas.
Ezetimiba no presentó efecto sobre la fertilidad de ratas macho o hembra, ni tampoco fue teratógena en ratas o conejos, ni afectó al desarrollo prenatal o posnatal. Ezetimiba cruzó la barrera placentaria en ratas y conejas gestantes a las que se administraron dosis repetidas de 1.000 mg/kg/día.
Atorvastatina
Atorvastatina no mostró potencial mutagénico y clastogénico en una batería de 4 pruebas in vitro y en 1 ensayo in vivo. Atorvastatina no resultó carcinogénica en ratas, pero dosis altas administradas a ratones (que produjeron un AUC0-24h 6-11 veces superior al alcanzado en seres humanos con la dosis más alta recomendada) mostraron adenomas hepatocelulares en machos y carcinomas hepatocelulares en hembras. Hay evidencias, obtenidas de estudios experimentales en animales, de que los inhibidores de la HMG-CoA reductasa pueden afectar al desarrollo de los embriones o fetos. En ratas, conejos y perros, atorvastatina no
tuvo ningún efecto sobre la fertilidad, y tampoco fue teratógeno. Sin embargo, a dosis tóxicas para la madre se observó toxicidad fetal en ratas y conejos. El desarrollo de las crías de las ratas se vio retrasado y se redujo la supervivencia postnatal durante la exposición de las madres a dosis altas de atorvastatina. En ratas, existen pruebas de que atraviesa la placenta. También en ratas, las concentraciones plasmáticas de atorvastatina son similares a las de la leche. Se desconoce si atorvastatina o sus metabolitos se excretan en la leche humana.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido Capa de ezetimiba
Croscarmelosa sódica Lactosa monohidrato Estearato de magnesio Celulosa microcristalina Povidona
Laurilsulfato de sodio
Capa de atorvastatina
Celulosa microcristalina Lactosa monohidrato Hidroxipropilcelulosa Croscarmelosa sódica Polisorbato 80 Carbonato de calcio Estearato de magnesio Sílice coloidal anhidra
Recubrimiento Hipromelosa Macrogol 8000 Dióxido de titanio (E-171)
Talco
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
Conservar en el embalaje original para protegerlo del oxígeno.
6.5 Naturaleza y contenido del envase
ATOZET 10 mg/10 mg, 10 mg/20 mg, 10 mg/40 mg y 10 mg/80 mg
Blísters de aluminio/aluminio depurado con nitrógeno (alveolo de poliamida orientada-aluminio-PVC con cubierta de aluminio) en envases de 10, 30, 90 y 100 comprimidos recubiertos con película.
Blisteres de aluminio/aluminio depurado con nitrógeno (alveolo de poliamida orientada-aluminio-PVC con cubierta de aluminio) de dosis unitarias en envases de 30 x 1 y 45 x 1 comprimidos recubiertos con película.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Ltd Hertford Road, Hoddesdon Hertfordshire EN 11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
ATOZET 10 mg/10 mg: 79.225 ATOZET 10 mg/20 mg: 79.224 ATOZET 10 mg/40 mg: 79.226 ATOZET 10 mg/80 mg: 79.227
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Febrero 2015
10. FECHA DE LA REVISIÓN DEL TEXTO
04/2016
27 de 27