Alimta 500 Mg Polvo Para Concentrado Para Solucion Para Perfusion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
ALIMTA 100 mg polvo para concentrado para solución para perfusión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene 100 mg de pemetrexed (como pemetrexed disódico).
Tras la reconstitución (ver sección 6.6), cada vial contiene 25 mg/ml de pemetrexed.
Excipientes con efecto conocido:
Cada vial contiene aproximadamente 11 mg de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para concentrado para solución para perfusión.
Polvo liofilizado de blanco a amarillo pálido o amarillo verdoso.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Mesotelioma pleural maligno
ALIMTA en combinación con cisplatino, está indicado para el tratamiento de pacientes con mesotelioma pleural maligno no resecable que no han recibido quimioterapia previamente.
Cáncer de pulmón no microcítico
ALIMTA en combinación con cisplatino, está indicado para el tratamiento en primera línea de pacientes con cáncer de pulmón no microcítico localmente avanzado o metastásico, salvo aquellos que tengan una histología predominantemente de célula escamosa (ver sección 5.1).
ALIMTA en monoterapia está indicado como tratamiento de mantenimiento de pacientes con cáncer de pulmón no microcítico localmente avanzado o metastásico, salvo aquéllos que tengan histología predominantemente de célula escamosa, cuya enfermedad no ha progresado inmediatamente después de un régimen quimioterápico basado en un platino (ver sección 5.1).
ALIMTA en monoterapia está indicado para el tratamiento en segunda línea de pacientes con cáncer de pulmón no microcítico localmente avanzado o metastásico, salvo aquellos que tengan histología predominantemente de célula escamosa (ver sección 5.1).
4.2 Posología y forma de administración
Posología:
ALIMTA debe ser administrado bajo la supervisión de un médico cualificado en el uso de quimioterapia antineoplásica.
ALIMTA en combinación con cisplatino
La dosis recomendada de ALIMTA es de 500 mg/m2 del área de superficie corporal (ASC) administrados por perfusión intravenosa durante 10 minutos el primer día de cada ciclo de 21 días. La dosis recomendada de cisplatino es de 75 mg/m2 ASC administrada en perfusión durante dos horas, aproximadamente 30 minutos después de completar la perfusión de pemetrexed durante el primer día de cada ciclo de 21 días. Los pacientes deben recibir un tratamiento antiemético adecuado e hidratación apropiada antes y/o después de recibir cisplatino (consultar también el Resumen de Características del Producto de cisplatino para recomendaciones específicas de dosificación).
ALIMTA en monoterapia
En pacientes con cáncer de pulmón no microcítico que han sido tratados previamente con quimioterapia, la dosis recomendada de ALIMTA es de 500 mg/m2 (ASC) administrados como una perfusión intravenosa durante 10 minutos el primer día de cada ciclo de 21 días.
Pauta de premedicación
Para reducir la incidencia y gravedad de las reacciones cutáneas, se debe administrar un corticosteroide el día anterior, el mismo día y el día después de la administración de pemetrexed. El corticosteroide debe ser equivalente a 4 mg de dexametasona administrados por vía oral dos veces al día (ver sección 4.4).
Para reducir la toxicidad, los pacientes tratados con pemetrexed deben recibir también un suplemento vitamínico (ver sección 4.4). Los pacientes deben tomar diariamente ácido fólico por vía oral o un complejo polivitamínico que contenga ácido fólico (350 a 1.000 microgramos). Deben tomarse por lo menos cinco dosis de ácido fólico durante los siete días previos a la primera dosis de pemetrexed, y la administración debe continuar durante todo el tratamiento y durante 21 días después de la última dosis de pemetrexed. Los pacientes deben recibir también una inyección intramuscular de vitamina B12 (1.000 microgramos) en la semana anterior a la de la primera dosis de pemetrexed y a partir de ahí una vez cada tres ciclos. Tras la primera inyección de vitamina B12, las inyecciones posteriores se pueden administrar el mismo día que la perfusión de pemetrexed.
Monitorización
Antes de cada dosis se debe vigilar a los pacientes que reciben pemetrexed y realizar un recuento sanguíneo completo que incluya un recuento diferencial de células blancas (WCC) y un recuento de plaquetas. Antes de cada administración de quimioterapia se deben realizar pruebas bioquímicas sanguíneas para evaluar la función renal y hepática. Antes del comienzo de cada ciclo de quimioterapia, es necesario que el paciente presente: recuento absoluto de neutrófilos (ANC) > 1.500 células/mm3 y recuento de plaquetas > 100.000 células/mm3.
El aclaramiento de creatinina debe ser > 45 ml/min.
La bilirrubina total debe ser < 1,5 veces el límite superior de la normalidad. La fosfatasa alcalina (FA), aspartato aminotransferasa (AST o SGOT) y alanina aminotransferasa (ALT o SGPT) deben ser < 3 veces el límite superior de la normalidad. Se aceptan valores de fosfatasa alcalina, AST y ALT < 5 veces el límite superior de la normalidad si existe afectación tumoral en el hígado.
Ajuste de la dosis
Los ajustes de la dosis al comienzo de un nuevo ciclo deben basarse en el nadir de los recuentos hematológicos o en la máxima toxicidad no hematológica del ciclo anterior. El tratamiento debe retrasarse hasta permitir un tiempo de recuperación suficiente. Después de la recuperación de la toxicidad los pacientes deben volver a tratarse empleando las pautas de ajuste de dosis que aparecen en las tablas 1, 2 y 3, que son aplicables para ALIMTA empleado como agente único o en combinación con cisplatino.
|
Tabla 1 - Tabla de modificación de la dosis de ALIMTA (como agente único o en combinación) y cisplatino - Toxicidades hematológicas | |
|
Nadir de recuento absoluto de neutrófilos (ANC) < 500 /mm3 y nadir de plaquetas > 50.000 /mm3 |
75 % de la dosis previa (de ALIMTA y de cisplatino) |
|
Nadir de plaquetas < 50.000 /mm3 independientemente del nadir del recuento absoluto de neutrófilos (ANC) |
75 % de la dosis previa (de ALIMTA y de cisplatino) |
|
Nadir de plaquetas < 50.000 /mm3 con hemorragia3, con independencia del nadir de recuento absoluto de neutrófilos (ANC) |
50 % de la dosis previa (de ALIMTA y de cisplatino) |
a Estos criterios satisfacen la definición de hemorragia > Grado 2 establecida por los Criterios Comunes de Toxicidad (CTC) del Instituto Nacional del Cáncer (CTC v2.0; NCI 1998)
Si los pacientes desarrollan toxicidades no hematológicas > Grado 3 (excluyendo neurotoxicidad), se debe retrasar la administración de ALIMTA hasta que la toxicidad se haya recuperado hasta un valor menor o igual al que el paciente presentaba antes del tratamiento. Los ajustes de dosis por toxicidad no hematológica se resumen en la tabla 2.
|
Tabla 2 - Tabla de modificación de la dosis de ALIMTA (como agente único o en combinación) y cisplatino - Toxicidades no hematológicas a’ b | ||
|
Dosis de ALIMTA (mg/m2) |
Dosis de cisplatino (mg/m2) | |
|
Cualquier toxicidad grado 3 ó 4 excepto mucositis |
75 % de la dosis previa |
75 % de la dosis previa |
|
Cualquier diarrea que requiera hospitalización (independientemente del grado) o diarrea grado 3 ó 4. |
75 % de la dosis previa |
75 % de la dosis previa |
|
Mucositis grado 3 ó 4 |
50 % de la dosis previa |
100 % de la dosis previa |
a
b
Criterios Comunes de Toxicidad del Instituto Nacional del Cáncer (CTC v2.0; NCI 1998) Se excluye neurotoxicidad
En el caso de que aparezca neurotoxicidad, el ajuste de dosis recomendado de ALIMTA y cisplatino aparece en la Tabla 3. Los pacientes deben interrumpir el tratamiento si se observa neurotoxicidad grado 3 ó 4.
|
Tabla 3 - Tabla de modificación de la dosis de ALIMTA (como agente único o en combinación) y cisplatino - Neurotoxicidad | ||
|
Grado CTCa |
Dosis de ALIMTA (mg/m2) |
Dosis de cisplatino (mg/m2) |
|
0 - 1 |
100 % de la dosis previa |
100 % de la dosis previa |
|
2 |
100 % de la dosis previa |
50 % de la dosis previa |
Criterios Comunes de Toxicidad del Instituto Nacional del Cáncer (CTC v2.0; NCI 1998)
El tratamiento con ALIMTA debe suspenderse si el paciente presenta cualquier toxicidad hematológica o no hematológica grado 3 ó 4 tras dos reducciones de dosis, o inmediatamente si se observa neurotoxicidad grado 3 ó 4.
Personas de edad avanzada: no se ha demostrado en ningún ensayo clínico que los pacientes de 65 años de edad o mayores posean un mayor riesgo de presentar efectos adversos que los pacientes menores de 65 años. No son necesarios otros ajustes de la dosis aparte de los recomendados para todos los pacientes.
Población pediátrica
No hay datos relevantes del uso de ALIMTA en población pediátrica con mesotelioma pleural maligno y cáncer de pulmón no microcítico.
Pacientes con disfunción renal (Fórmula estandarizada de Cockcroft y Gault o tasa de filtración glomerular medida por el método radioisotópico de aclaración sérica de Tc99m-DPTA): el pemetrexed se elimina inalterado principalmente por excreción renal. En estudios clínicos, los pacientes con un aclaramiento de creatinina > 45 ml/min no requirieron ajustes de dosis diferentes de los recomendados para todos los pacientes. No existen suficientes datos sobre el uso de pemetrexed en pacientes con aclaramiento de creatinina inferior a 45 ml/min, por lo tanto no se recomienda el uso de pemetrexed en estos pacientes (ver sección 4.4).
Pacientes con disfunción hepática: no se ha identificado ninguna relación entre la farmacocinética de pemetrexed y la AST (SGOT), la ALT (SGPT) o la bilirrubina total. Sin embargo, no se han estudiado específicamente pacientes con disfunción hepática tales como bilirrubina > 1,5 veces el límite superior de la normalidad y/o aminotransferasas > 3,0 veces el límite superior de la normalidad (en ausencia de metástasis hepáticas) o aminotransferasas > 5,0 veces el límite superior de la normalidad (en presencia de metástasis hepáticas).
Forma de administración
Para consultar las precauciones que deben tomarse antes de manipular o administrar ALIMTA, ver sección 6.6.
ALIMTA se debe administrar como perfusión intravenosa durante 10 minutos el primer día de cada ciclo de 21 días. Para consultar las instrucciones de reconstitución y dilución de ALIMTA antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Lactancia materna (ver sección 4.6).
Administración concomitante de la vacuna de la fiebre amarilla (ver sección 4.5).
4.4 Advertencias y precauciones especiales de empleo
Pemetrexed puede suprimir la función de la médula ósea lo que se manifiesta como neutropenia, trombocitopenia y anemia (o pancitopenia) (ver sección 4.8). La mielosupresión es, normalmente, la toxicidad limitante de la dosis. Durante el tratamiento con pemetrexed se debe vigilar la mielosupresión de los pacientes y no se debe administrar pemetrexed a los pacientes hasta que el recuento absoluto de neutrófilos (ANC) vuelva a ser > 1.500 células/mm3 y el recuento de plaquetas vuelva a ser
3
> 100.000 células/mm . Las reducciones de dosis para ciclos posteriores se basan en el nadir de ANC, el recuento de plaquetas y la toxicidad máxima no hematológica observada en ciclos anteriores (ver sección 4.2).
Se notificó una toxicidad global menor y una reducción de las toxicidades hematológicas y no hematológicas grado 3/4 tales como neutropenia, neutropenia febril e infección con neutropenia grado 3/4,
5
cuando se administraron como premedicación ácido fólico y vitamina Bi2. Por tanto, se debe advertir a todos los pacientes tratados con pemetrexed de la necesidad de que tomen ácido fólico y vitamina B12 como medida profiláctica para reducir la toxicidad relacionada con el tratamiento (ver sección 4.2).
Se han notificado reacciones cutáneas en pacientes que no han recibido un tratamiento previo con un corticosteroide. El tratamiento previo con dexametasona (o equivalente) puede reducir la incidencia y la gravedad de reacciones cutáneas (ver sección 4.2).
Se ha estudiado un número insuficiente de pacientes con aclaramiento de creatinina inferior a 45 ml/min. Por tanto, no se recomienda el uso de pemetrexed en pacientes con aclaramiento de creatinina < 45 ml/min (ver sección 4.2).
Los pacientes que presenten insuficiencia renal de leve a moderada (aclaramiento de creatinina de 45 a 79 ml/min) deben evitar tomar antiinflamatorios no esteroideos (AINEs) como ibuprofeno y ácido acetilsalicílico (> 1,3 g diarios) durante dos días antes, el mismo día y dos días después de la administración de pemetrexed (ver sección 4.5).
Los pacientes con insuficiencia renal de leve a moderada candidatos a ser tratados con pemetrexed, deberán interrumpir el tratamiento con AINEs de largas semividas de eliminación durante al menos cinco días antes, el mismo día y dos días después de la administración de pemetrexed (ver sección 4.5).
Se han notificado acontecimientos renales graves, incluyendo fallo renal agudo, relacionados con el uso de pemetrexed solo o en combinación con otros agentes quimioterápicos. Muchos de los pacientes a los que les ocurrió esto tenían factores de riesgo subyacentes para el desarrollo de acontecimientos renales, incluyendo deshidratación, hipertensión preexistente o diabetes.
El efecto de la presencia de líquido en el tercer espacio, tal como derrame pleural o ascitis, en el tratamiento con pemetrexed no está completamente definido. En un estudio en fase 2 de pemetrexed, con 31 pacientes con tumores sólidos y con líquido estable en el tercer espacio, no se observaron diferencias en las concentraciones normalizadas en plasma de pemetrexed o en su aclaramiento en comparación con el grupo de pacientes sin líquido en el tercer espacio. Por lo tanto, se debe considerar el drenaje del tercer espacio antes de la administración de pemetrexed, aunque puede que no sea necesario.
Se ha observado deshidratación severa a causa de la toxicidad gastrointestinal asociada al tratamiento con pemetrexed en combinación con cisplatino. Por tanto, los pacientes deben recibir tratamiento antiemético adecuado e hidratación apropiada antes y/o después de recibir el tratamiento.
Durante los ensayos clínicos con pemetrexed se han comunicado con poca frecuencia acontecimientos cardiovasculares graves, incluyendo infarto de miocardio, y acontecimientos cerebrovasculares, normalmente cuando se administraba en combinación con otro agente citotóxico. La mayoría de los pacientes en los que se han observado estos efectos tenían factores de riesgo cardiovascular previos (ver sección 4.8).
El estado de inmunodepresión es habitual en los pacientes oncológicos. Por tanto, no se recomienda el uso concomitante de vacunas con microorganismos vivos atenuados (ver secciones 4.3 y 4.5).
El pemetrexed puede ser genotóxico, por ello se advierte a los pacientes varones en edad fértil que no engendren hijos durante el tratamiento y hasta 6 meses después. Se recomienda el uso de medidas anticonceptivas adecuadas o abstinencia sexual durante este periodo. Debido a la posibilidad de que el tratamiento con pemetrexed produzca infertilidad irreversible, se aconseja que los pacientes varones soliciten asesoramiento sobre la posibilidad de acudir a un banco de esperma antes de comenzar el tratamiento.
Se recomienda que las mujeres fértiles empleen métodos anticonceptivos efectivos durante el tratamiento con pemetrexed (ver sección 4.6).
Se han notificado casos de neumonitis por irradiación en pacientes tratados con radioterapia previa, concomitante o posterior a su tratamiento con pemetrexed. Se debe prestar especial atención a estos pacientes, y tener precaución cuando se utilicen otros agentes radiosensibilizantes.
Se han notificado casos de toxicidad cutánea tardía en pacientes sometidos a radioterapia semanas o años antes.
4.5 Interacción con otros medicamentos y otras formas de interacción
El pemetrexed se elimina inalterado, por vía renal principalmente mediante secreción tubular y, en menor medida mediante filtración glomerular. La administración concomitante de fármacos nefrotóxicos (p. ej. aminoglucósidos, diuréticos del asa, derivados del platino, ciclosporinas) podrían, potencialmente, producir un retraso en el aclaramiento de pemetrexed. Esta combinación debe usarse con precaución. Si fuera necesario utilizar alguno de estos fármacos, el aclaramiento de creatinina debe vigilarse estrechamente.
La administración concomitante de sustancias que también se eliminan por secreción tubular (p. ej. probenecid, penicilina) potencialmente pueden resultar en un retraso en el aclaramiento de pemetrexed. Se debe tener precaución cuando se administren estos fármacos en combinación con pemetrexed. Si fuera necesario administrarlos, se debe vigilar estrechamente el aclaramiento de creatinina.
En pacientes con la función renal normal (aclaramiento de creatinina > 80 ml/min), la administración de altas dosis de fármacos antiinflamatorios no esteroideos (AINEs, como ibuprofeno > 1.600 mg/día) y ácido acetilsalicílico a dosis elevadas (> 1,3 g diarios) pueden disminuir la eliminación de pemetrexed y, en consecuencia aumentar la aparición de efectos adversos asociados a pemetrexed. Por tanto, debe tenerse precaución durante la administración concomitante de altas dosis de AINEs o ácido acetilsalicílico con pemetrexed en pacientes con la función renal normal (aclaramiento de creatinina > 80 ml/min).
En pacientes con insuficiencia renal leve a moderada (aclaramiento de creatinina de 45 a 79 ml/min), debe evitarse la administración concomitante de pemetrexed con AINEs (p. ej. ibuprofeno) o ácido acetilsalicílico a altas dosis durante 2 días antes, el mismo día y 2 días después de la administración de pemetrexed (ver sección 4.4).
En ausencia de datos relativos a la posible interacción con AINEs de semividas más largas tales como piroxicam o rofecoxib, en pacientes con insuficiencia renal leve o moderada, debe interrumpirse la administración concomitante con pemetrexed durante al menos los 5 días anteriores, el mismo día y 2 días después de la administración de pemetrexed (ver sección 4.4). Si es necesaria la administración concomitante de AINEs, los pacientes deben ser vigilados estrechamente por si hubiese toxicidad, especialmente mielosupresión y toxicidad gastrointestinal.
El pemetrexed sufre un metabolismo hepático limitado. Los resultados de los estudios in vitro con microsomas hepáticos humanos indicaron que no es previsible que pemetrexed produzca una inhibición clínicamente significativa del aclaramiento metabólico de los fármacos metabolizados a través de los citocromos CYP3A, CYP2D6, CYP2C9 y CYP1A2.
Interacciones comunes a todos los citotóxicos:
Debido al aumento del riesgo de padecer trombosis, en pacientes con cáncer, es frecuente el empleo de tratamiento anticoagulante. La elevada variabilidad intraindividual del estado de la coagulación durante las enfermedades y la posibilidad de interacción entre los anticoagulantes orales y la quimioterapia antineoplásica, requiere un aumento de la frecuencia de control del INR (Cociente Normalizado Internacional) si se decide tratar al paciente con anticoagulantes orales.
Uso concomitante contraindicado: vacuna de la fiebre amarilla: riesgo de padecer la enfermedad generalizada (ver sección 4.3).
Uso concomitante no recomendado: vacunas con microorganismos vivos atenuados (excepto la fiebre amarilla, cuyo uso concomitante está contraindicado): riesgo de padecer la enfermedad sistémica, posiblemente fatal. El riesgo aumenta en pacientes que ya están immunodeprimidos por la enfermedad subyacente. Si existe, se debe emplear una vacuna con microorganismos inactivados (poliomielitis) (ver sección 4.4).
4.6 Fertilidad, embarazo y lactancia
Anticoncepción en hombres y mujeres
Las mujeres fértiles deben usar métodos anticonceptivos eficaces durante el tratamiento con pemetrexed. El pemetrexed puede ser genotóxico. Se advierte a los pacientes varones en edad fértil que no engendren hijos durante el tratamiento y hasta 6 meses después, y se recomienda el uso de medidas anticonceptivas adecuadas o abstinencia sexual durante este periodo.
Embarazo
No se dispone de datos sobre el uso de pemetrexed en mujeres embarazadas pero se sospecha que pemetrexed, al igual que otros antimetabolitos, cuando se administra durante el embarazo, puede causar defectos congénitos graves. Los estudios en animales han demostrado toxicidad en la reproducción (ver sección 5.3). No debe administrarse pemetrexed durante el embarazo a no ser que sea claramente necesario, después de evaluar cuidadosamente la necesidad de tratamiento de la madre y el riesgo para el feto (ver sección 4.4).
Lactancia
No se sabe si el pemetrexed se excreta en la leche materna por lo que no se puede excluir la posibilidad de aparición de reacciones adversas en el lactante. La lactancia debe interrumpirse durante el tratamiento con pemetrexed (ver sección 4.3).
Fertilidad
Debido a la posibilidad de que el tratamiento con pemetrexed produzca infertilidad irreversible, se aconseja que los pacientes varones soliciten asesoramiento sobre la posibilidad de acudir a un banco de esperma antes de comenzar el tratamiento.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se ha comunicado que pemetrexed puede causar astenia. Por tanto, se debe informar a los pacientes de que tengan precaución a la hora de conducir y manejar maquinaria si ocurre este efecto.
4.8 Reacciones adversas Resumen del perfil de seguridad:
Las reacciones adversas notificadas con mayor frecuencia en relación al tratamiento con pemetrexed, tanto si se utiliza en monoterapia como en combinación, son la supresión de médula ósea que se manifiesta como anemia, neutropenia, leucopenia, trombocitopenia y toxicidad gastrointestinal que se manifiesta como anorexia, náuseas, vómitos, diarrea, estreñimiento, faringitis, mucositis y estomatitis. Otras reacciones adversas incluyen toxicidad renal, aumento de aminotransferasas, alopecia, fatiga, deshidratación, exantema, infección/sepsis y neuropatía. Rara vez se han visto efectos como el síndrome de Stevens-Johnson y necrolisis epidérmica tóxica.
Tabla de reacciones adversas
La tabla que aparece a continuación proporciona la frecuencia y gravedad de las reacciones adversas que se han notificado en > 5 % de los 168 pacientes con mesotelioma que aleatoriamente recibieron cisplatino y pemetrexed y de los 163 pacientes con mesotelioma que aleatoriamente recibieron cisplatino como agente único. En los dos brazos de tratamiento, estos pacientes que no habían recibido quimioterapia previamente, recibieron suplementos con ácido fólico y vitamina B12.
Reacciones adversas
Frecuencia estimada: Muy frecuentes (> 1/10), Frecuentes (> 1/100 a < 1/10), Poco frecuentes (> 1/1.000 a < 1/100), Raras (> 1/10.000 a < 1/1.000), Muy raras (< 1/10.000) y de frecuencia no conocida (no puede estimarse a partir de los datos disponibles-notificaciones espontáneas).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Sistema de clasificación de órganos |
Frecuencia |
Acontecimiento * |
Pemetrexed-cisplatino |
Cisplatino | ||
|
(N = 168) |
(N = 163) | |||||
|
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) |
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) | |||
|
Trastornos de la sangre y del sistema linfático |
Muy frecuentes |
Disminución de neutrófilos/ granulocitos |
56,0 |
23,2 |
13,5 |
3,1 |
|
Disminución de leucocitos |
53,0 |
14,9 |
16,6 |
0,6 | ||
|
Disminución de hemoglobina |
26,2 |
4,2 |
10,4 |
0,0 | ||
|
Disminución de plaquetas |
23,2 |
5,4 |
8,6 |
0,0 | ||
|
Trastornos del metabolismo y de la nutrición |
Frecuentes |
Deshidratación |
6,5 |
4,2 |
0,6 |
0,6 |
|
Trastornos del sistema nervioso |
Muy frecuentes |
Neuropatía sensorial |
10,1 |
0,0 |
9,8 |
0,6 |
|
Frecuentes |
Alteración del gusto |
7,7 |
0,0*** |
6,1 |
0,0*** | |
|
Trastornos oculares |
Frecuentes |
Conjuntivitis |
5,4 |
0,0 |
0,6 |
0,0 |
|
Trastornos gastrointestinales |
Muy frecuentes |
Diarrea |
16,7 |
3,6 |
8,0 |
0,0 |
|
Vómitos |
56,5 |
10,7 |
49,7 |
4,3 | ||
|
Estomatitis/ Faringitis |
23,2 |
3,0 |
6,1 |
0,0 | ||
|
Náuseas |
82,1 |
11,9 |
76,7 |
5,5 | ||
|
Anorexia |
20,2 |
1,2 |
14,1 |
0,6 | ||
|
Estreñimiento |
11,9 |
0,6 |
7,4 |
0,6 | ||
|
Frecuentes |
Dispepsia |
5,4 |
0,6 |
0,6 |
0,0 | |
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Exantema |
16,1 |
0,6 |
4,9 |
0,0 |
|
Alopecia |
11,3 |
0,0*** |
5,5 |
0,0*** | ||
|
Trastornos renales y urinarios |
Muy frecuentes |
Elevación de creatinina |
10,7 |
0,6 |
9,8 |
1,2 |
|
Descenso del aclaramiento de creatinina* * |
16,1 |
0,6 |
17,8 |
1,8 | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Astenia |
47,6 |
10,1 |
42,3 |
9,2 |
* Referido a los CTC del Instituto Nacional del Cáncer versión 2 para cada grado de toxicidad excepto el término “descenso del aclaramiento de creatinina”.
**deriva del término “otros renal/genitourinario”.
*** De acuerdo con los CTC del Instituto Nacional del Cáncer (v2.0; NCI 1998), la alteración del gusto y la alopecia sólo deben notificarse como de Grado 1 ó 2.
Para esta tabla se realizó un corte en el 5 % para incluir todos los acontecimientos en los que el informador consideró que existía una posible relación del efecto con pemetrexed y cisplatino.
Las toxicidades CTC clínicamente relevantes que se notificaron en > 1 % y < 5 % de los pacientes que fueron asignados aleatoriamente para recibir cisplatino y pemetrexed incluyen: fallo renal, infección, pirexia, neutropenia febril, aumento de AST, ALT y GGT, urticaria y dolor torácico. Las toxicidades CTC clínicamente relevantes que se notificaron en < 1 % de los pacientes que fueron asignados aleatoriamente al grupo que recibió cisplatino y pemetrexed incluyen arritmia y neuropatía motora.
La siguiente tabla proporciona la frecuencia y gravedad de efectos indeseables que se han notificado en > 5 % de los 265 pacientes asignados aleatoriamente al grupo que recibió pemetrexed como agente único con suplementos de ácido fólico y vitamina B12 y los 276 pacientes asignados aleatoriamente al grupo que recibió docetaxel como agente único. A todos los pacientes se les había diagnosticado cáncer de pulmón no microcítico localmente avanzado o metastásico y habían recibido quimioterapia previa.
|
Sistema de clasificación de órganos |
Frecuencia |
Acontecimiento* |
Pemetrexed N = 265 |
Docetaxel N = 276 | ||
|
Toxicidad todos los grados (%) |
Toxicidad grado 3 -4 (%) |
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) | |||
|
Trastornos de la sangre y del sistema linfático |
Muy frecuentes |
Disminución de neutrófilos/ granulocitos |
10,9 |
5,3 |
45,3 |
40,2 |
|
Disminución de leucocitos |
12,1 |
4,2 |
34,1 |
27,2 | ||
|
Disminución de hemoglobina |
19,2 |
4,2 |
22,1 |
4,3 | ||
|
Frecuentes |
Disminución de plaquetas |
8,3 |
1,9 |
1,1 |
0,4 | |
|
Trastornos gastrointestinal es |
Muy frecuentes |
Diarrea |
12,8 |
0,4 |
24,3 |
2,5 |
|
Vómitos |
16,2 |
1,5 |
12,0 |
1,1 | ||
|
Estomatitis/ Faringitis |
14,7 |
1,1 |
17,4 |
1,1 | ||
|
Náuseas |
30,9 |
2,6 |
16,7 |
1,8 | ||
|
Anorexia |
21,9 |
1,9 |
23,9 |
2,5 | ||
|
Frecuentes |
Estreñimiento |
5,7 |
0,0 |
4,0 |
0,0 | |
|
Trastornos hepatobiliares |
Frecuentes |
Aumento de ALT (SGPT) |
7,9 |
1,9 |
1,4 |
0,0 |
|
Aumento de AST (SGOT) |
6,8 |
1,1 |
0,7 |
0,0 | ||
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Exantema/ descamación |
14,0 |
0,0 |
6,2 |
0,0 |
|
Frecuentes |
Prurito |
6,8 |
0,4 |
1,8 |
0,0 | |
|
Alopecia |
6,4 |
0,4** |
37,7 |
2,2** | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Astenia |
34,0 |
5,3 |
35,9 |
5,4 |
|
Frecuentes |
Fiebre |
8,3 |
0,0 |
7,6 |
0,0 | |
* Referido a los CTC del Instituto Nacional del Cáncer versión 2 para cada grado de toxicidad ** De acuerdo con los CTC del Instituto Nacional del Cáncer (v2.0; NCI 1998), la alopecia sólo
debe notificarse como de grado 1 ó 2.
Para esta tabla se realizó un corte en el 5 % para incluir todos los acontecimientos en los que el informador consideró que existía una posible relación del efecto con pemetrexed.
Las toxicidades CTC clínicamente relevantes notificadas en > 1 % y < 5 % de los pacientes asignados aleatoriamente al grupo de pemetrexed incluyen: infección sin neutropenia, neutropenia febril, reacción alérgica/hipersensibilidad, aumento de creatinina, neuropatía motora, neuropatía sensorial, eritema multiforme y dolor abdominal.
Las toxicidades CTC clínicamente relevantes que se notificaron en < 1 % de los pacientes que fueron asignados aleatoriamente a tratamiento con pemetrexed incluyen arritmias supraventriculares.
Las toxicidades de laboratorio clínicamente relevantes grado 3 y grado 4 fueron similares entre los resultados de los ensayos fase II, reunidos a partir de tres estudios con pemetrexed como único agente (n = 164) y el ensayo fase III con pemetrexed como único agente descrito anteriormente, con la excepción
de la neutropenia (12,8 % frente a 5,3 % respectivamente) y el aumento de alanina aminotransferasa (15,2 % frente a 1,9 %, respectivamente). Estas diferencias se debieron probablemente a las diferencias en la población de pacientes entre ambos grupos, ya que los ensayos fase II incluyeron tanto pacientes sin quimioterapia previa como pacientes con cáncer de mama intensamente tratados previamente con metástasis preexistentes en hígado, función basal hepática anormal o ambos.
La tabla que se incluye a continuación proporciona los datos de frecuencia y gravedad de reacciones adversas consideradas como posiblemente relacionadas con el medicamento en estudio y que han sido notificadas en > 5 % de los 839 pacientes con CPNM que fueron aleatorizados a recibir cisplatino y pemetrexed, y de los 830 pacientes con CPNM que fueron aleatorizados a recibir cisplatino y gemcitabina. Todos los pacientes recibieron el régimen de tratamiento en estudio como tratamiento inicial para el CPNM localmente avanzado o metastásico, y en ambos grupos de tratamiento los pacientes recibieron suplementos de ácido fólico y vitamina B12.
|
Sistema de clasificación de órganos |
Frecuencia |
Acontecimiento** |
Pemetrexed/cisplatino (N = 839) |
Gemcitabina/cisplatino (N = 830) | ||
|
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) |
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) | |||
|
Trastornos de la sangre y del sistema linfático |
Muy frecuentes |
Disminución de hemoglobina |
33,0* |
5,6* |
45,7* |
9,9* |
|
Disminución de neutrófilos/granulo- citos |
29,0* |
15,1* |
38,4* |
26,7* | ||
|
Disminución de leucocitos |
17,8 |
4,8* |
20,6 |
7,6* | ||
|
Disminución de plaquetas |
10,1* |
4,1* |
26,6* |
12,7* | ||
|
Trastornos del sistema nervioso |
Frecuentes |
Neuropatía sensorial |
8,5* |
0,0* |
12,4* |
0,6* |
|
Alteración del gusto |
8,1 |
0,0*** |
8,9 |
0,0*** | ||
|
Trastornos gastrointestin ales |
Muy frecuentes |
Náuseas |
56,1 |
7,2* |
53,4 |
3,9* |
|
Vómitos |
39,7 |
6,1 |
35,5 |
6,1 | ||
|
Anorexia |
26,6 |
2,4* |
24,2 |
0,7* | ||
|
Estreñimiento |
21,0 |
0,8 |
19,5 |
0,4 | ||
|
Estomatitis/ Faringitis |
13,5 |
0,8 |
12,4 |
0,1 | ||
|
Diarrea sin colostomía |
12,4 |
1,3 |
12,8 |
1,6 | ||
|
Frecuentes |
Dispepsia/Ardor |
5,2 |
0,1 |
5,9 |
0,0 | |
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Alopecia |
11,9* |
0,0*** |
21,4* |
0,5*** |
|
Frecuentes |
Exantema/ descamación |
6,6 |
0,1 |
8,0 |
0,5 | |
|
Trastornos renales y urinarios |
Muy frecuentes |
Elevación de creatinina |
10,1* |
0,8 |
6,9* |
0,5 |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Astenia |
42,7 |
6,7 |
44,9 |
4,9 |
* valor de p< 0,05 cuando se comparó pemetrexed/cisplatino frente a gemcitabina/cisplatino utilizando el test exacto de Fisher.
** Referido a los CTC del Instituto Nacional del Cáncer (v2,0; NCI 1998) para cada grado de toxicidad.
*** De acuerdo con los CTC del Instituto Nacional del Cáncer (v2.0; NCI 1998), las alteraciones del gusto y la alopecia sólo deben notificarse como de grado 1 ó 2.
Para esta tabla se realizó un corte en el 5 % para incluir todos los acontecimientos en los que el informador consideró que existía una posible relación del efecto con pemetrexed y cisplatino.
Las toxicidades clínicamente relevantes notificadas en > 1 % y < 5 % de los pacientes asignados aleatoriamente al grupo de cisplatino y pemetrexed incluyen: aumento de AST, aumento de ALT,
13
infección, neutropenia febril, fallo renal, pirexia, deshidratación, conjuntivitis y disminución del aclaramiento de creatinina.
Las toxicidades clínicamente relevantes que se notificaron en < 1 % en los pacientes que fueron asignados aleatoriamente a recibir cisplatino y pemetrexed incluyen: aumento de GGT, dolor torácico, arritmia y neuropatía motora.
Las toxicidades clínicamente relevantes en función del sexo en pacientes que estaban recibiendo pemetrexed más cisplatino fueron similares a las de la población general.
La siguiente tabla proporciona la frecuencia y gravedad de efectos adversos considerados como posiblemente relacionados con el fármaco en estudio y que han sido notificados en > 5% de los 800 pacientes aleatoriamente asignados para recibir pemetrexed en monoterapia y de los 402 pacientes aleatoriamente asignados para recibir placebo, en los estudios de mantenimiento con pemetrexed en monoterapia (JMEN: N=663) y de mantenimiento con continuación de pemetrexed (PARAMOUNT: N=539). Todos los pacientes fueron diagnosticados con CPNM grado IIIB o IV, y todos habían recibido previamente un régimen quimioterápico basado en un platino. Los pacientes de ambas ramas del estudio recibieron suplementos de ácido fólico y vitamina B12.
|
Sistema de clasificación de órganos |
Frecuencia |
Acontecimiento* |
Pemetrexed*** (N = 800) |
Placebo*** (N = 402) | ||
|
Toxicidad todos los grados (%) |
Toxicidad grado 3 / 4 (%) |
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) | |||
|
Trastornos de la sangre y del sistema linfático |
Muy frecuentes |
Disminución de hemoglobina |
18,0 |
4,5 |
5,2 |
0,5 |
|
Frecuentes |
Disminución de leucocitos |
5,8 |
1,9 |
0,7 |
0,2 | |
|
Disminución de neutrófilos |
8,4 |
4,4 |
0,2 |
0,0 | ||
|
Trastornos del sistema nervioso |
Frecuentes |
Neuropatía sensorial |
7,4 |
0,6 |
5,0 |
0,2 |
|
Trastornos gastrointesti nales |
Muy frecuentes |
Náuseas |
17,3 |
0,8 |
4,0 |
0,2 |
|
Anorexia |
12,8 |
1,1 |
3,2 |
0,0 | ||
|
Frecuentes |
Vómitos |
8,4 |
0,3 |
1,5 |
0,0 | |
|
Mucositis/ estomatitis |
6,8 |
0,8 |
1,7 |
0,0 | ||
|
Trastornos hepatobiliares |
Frecuentes |
Elevación de ALT (SGPT) |
6,5 |
0,1 |
2,2 |
0,0 |
|
Elevación de AST(SGOT) |
5,9 |
0,0 |
1,7 |
0,0 | ||
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes |
Exantema/ descamación |
8,1 |
0,1 |
3,7 |
0,0 |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Astenia |
24,1 |
5,3 |
10,9 |
0,7 |
|
Frecuentes |
Dolor |
7,6 |
0,9 |
4,5 |
0,0 | |
|
Edema |
5,6 |
0,0 |
1,5 |
0,0 | ||
|
Trastornos Renales |
Frecuentes |
Trastornos Renales**** |
7,6 |
0,9 |
1,7 |
0,0 |
Abreviaturas: ALT = alanina aminotransferasa; AST = aspartato aminotransferasa; CTCAE = Criterios
terminológicos comunes para acontecimientos adversos; NCI = Instituto Nacional del Cáncer; SGOT = oxalacético glutámico aminotransferasa sérica; SGPT = piruvico glutámico aminotransferasa sérica.
* Definición de los términos de frecuencia: Muy frecuente - > 10 %; Frecuente - > 5 % y < 10 %. Para esta tabla se realizó un corte en el 5 % para incluir todos los acontecimientos en los que el informador consideró que existía una posible relación del efecto con pemetrexed.
** Referir a los Criterios CTCAE del NCI (Versión 3.0; NCI 2003) para cada grado de toxicidad. Los valores mostrados se corresponden con la versión 3.0 de CTCAE.
***La tabla integrada de reacciones adversas combina los resultados del estudio de mantenimiento con pemetrexed JMEN (N=663) con el estudio de mantenimiento con continuación de pemetrexed PARAMOUNT (N=539).
**** Este término incluye aumento de la creatinina sérica/en sangre, disminución de la tasa de filtración glomerular, fallo renal y otros trastornos renales/genitourinarios.
Las toxicidades CTC clínicamente relevantes de cualquier grado notificadas en > 1 % y < 5 % de los pacientes asignados aleatoriamente al grupo de pemetrexed incluyen: neutropenia febril, infección, disminución de plaquetas, diarrea, estreñimiento, alopecia, prurito/picor, fiebre (en ausencia de neutropenia), enfermedad de la superficie ocular (incluyendo conjuntivitis), aumento del lagrimeo, mareos y neuropatía motora.
Las toxicidades CTC clínicamente relevantes que se notificaron en < 1 % de los pacientes que fueron asignados aleatoriamente a recibir pemetrexed incluyen: reacción alérgica/hipersensibilidad, eritema multiforme, arritmia supraventicular y embolia pulmonar.
Se evaluó la seguridad en los pacientes aleatorizados para recibir pemetrexed (N=800). Se evaluó la incidencia de reacciones adversas en aquellos pacientes que recibieron < 6 ciclos de mantenimiento con pemetrexed (N=519), y se comparó con la que presentaron los pacientes que recibieron > 6 ciclos de pemetrexed (N=281). Se observó un incremento en las reacciones adversas (de todos los grados) a medida que aumentaba la exposición. Se observó un incremento significativo en la incidencia de neutropenia de Grado 3/4 posiblemente relacionada con la medicación de estudio a mayor exposición a pemetrexed (< 6 ciclos: 3,3%, > 6 ciclos: 6,4%: p=0,046). No se vieron diferencias estadísticamente significativas en ninguna otra reacción adversa de Grado 3/4/5 a mayor exposición.
Durante los estudios clínicos con pemetrexed se han notificado con poca frecuencia acontecimientos adversos cardiovasculares y cerebrovasculares graves incluyendo infarto de miocardio, angina de pecho, accidente cerebrovascular y accidente isquémico transitorio; habitualmente estos acontecimientos se han comunicado cuando se ha administrado pemetrexed en combinación con otro agente citotóxico. La mayoría de los pacientes en los que se ha observado estos acontecimientos tenían antecedentes de factores de riesgo cardiovascular.
Durante los ensayos clínicos con pemetrexed se han notificado, raramente, casos de hepatitis potencialmente graves.
En los ensayos clínicos con pemetrexed se han notificado, poco frecuentemente, casos de pancitopenia.
En pacientes tratados con pemetrexed en ensayos clínicos se han notificado, con poca frecuencia, casos de colitis (incluyendo sangrado intestinal y rectal en algunos casos mortales, perforación intestinal, necrosis intestinal y tifilitis).
En pacientes tratados con pemetrexed en ensayos clínicos, se han notificado de forma poco frecuente casos de neumonitis intersticial con insuficiencia respiratoria que, en algunos casos, fueron mortales.
En pacientes tratados con pemetrexed se han notificado casos de edema de forma poco frecuente.
Durante los ensayos clínicos con pemetrexed, se han notificado de forma poco frecuente casos de esofagitis/esofagitis por radiación.
En los ensayos clínicos con pemetrexed se ha notificado frecuentemente sepsis, que en algunos casos, fue mortal.
Durante la vigilancia postcomercialización, se han notificado las siguientes reacciones adversas en pacientes tratados con pemetrexed:
Con poca frecuencia se han notificado casos de fallo renal agudo con el uso de pemetrexed solo o en combinación con otros agentes quimioterápicos (ver sección 4.4).
Con poca frecuencia se han notificado casos de neumonitis por irradiación en pacientes tratados con radioterapia previa, concomitante o posterior a su tratamiento con pemetrexed (ver sección 4.4).
En raras ocasiones se han notificado casos de toxicidad cutánea tardía en pacientes que habían recibido radioterapia previamente (ver sección 4.4).
Con poca frecuencia se han notificado casos de isquemia periférica que, en ocasiones, han derivado en necrosis en las extremidades.
Rara vez se han notificado casos de alteraciones bullosas incluyendo el síndrome de Stevens-Johnson y la necrolisis epidérmica tóxica que en algunos casos fueron mortales.
Rara vez se ha notificado anemia hemolítica inmunoinducida en pacientes tratados con pemetrexed.
Rara vez se han notificado casos de shock anafiláctico.
4.9 Sobredosis
Los síntomas de sobredosis que se han notificado incluyen neutropenia, anemia, trombocitopenia, mucositis, polineuropatía sensorial y exantema. Las complicaciones previsibles de sobredosis incluyen la supresión de la médula ósea que se manifiesta por la aparición de neutropenia, trombocitopenia y anemia. Además, puede observarse infección con o sin fiebre, diarrea y/o mucositis. En el caso de sospecha de sobredosis, se debe vigilar a los pacientes realizando recuentos sanguíneos y deben recibir tratamiento de apoyo cuando sea necesario. Debe considerarse el uso de folinato de calcio / ácido folínico en el tratamiento de la sobredosis por pemetrexed.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: análogos del ácido fólico, código ATC: L01BA04.
ALIMTA (pemetrexed) es un agente antineoplásico antifolato multidiana, que ejerce su acción mediante la interrupción de los procesos metabólicos esenciales dependientes de folato necesarios para la replicación celular.
Los estudios in vitro han mostrado que pemetrexed se comporta como un antifolato multidiana inhibiendo la timidilato sintetasa (TS), la dihidrofolato reductasa (DHFR) y la glicinamida ribonucleótido formiltransferasa (GARFT), que son enzimas dependientes del folato, claves para la biosíntesis de novo de los nucleótidos de timidina y purina. Pemetrexed se transporta al interior de las células tanto mediante el transportador de folato reducido como mediante sistemas proteicos transportadores de membrana unidos a folato. Una vez en la célula, pemetrexed se convierte rápida y eficazmente en formas poliglutamato mediante la enzima folilpoliglutamato sintetasa. Las formas poliglutamato se retienen en las células y son inhibidores incluso más potentes de la TS y la GARFT. La poliglutamación es un proceso dependiente del tiempo y de la concentración que ocurre en las células tumorales y, en menor medida, en tejidos normales. Los metabolitos poliglutamados poseen una semivida intracelular más larga que se traduce en una acción del fármaco prolongada en las células malignas.
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con ALIMTA en los diferentes grupos de la población pediátrica en las indicaciones autorizadas (ver sección 4.2).
Eficacia clínica:
Mesotelioma:
El estudio fase III EMPHACIS, multicéntrico, aleatorizado, simple ciego con ALIMTA y cisplatino frente a cisplatino en pacientes con mesotelioma pleural maligno no tratados previamente con quimioterapia, ha demostrado que los pacientes tratados con ALIMTA y cisplatino poseen un aumento clínicamente significativo de la mediana de supervivencia de 2,8 meses sobre los pacientes que recibieron cisplatino en monoterapia.
Durante el estudio se introdujo la administración de un suplemento a dosis bajas de ácido fólico y vitamina B12 para reducir la toxicidad. El análisis primario de este estudio se realizó sobre la población que incluía a todos los pacientes asignados al azar al brazo de tratamiento que recibía el fármaco en estudio (aleatorizados y tratados). Se realizó un análisis de subgrupos con los pacientes que recibieron suplemento de ácido fólico y vitamina B12 durante todo el tratamiento (suplemento completo). Los resultados de estos análisis de eficacia se resumen en la siguiente tabla:
Eficacia de ALIMTA más cisplatino vs. cisplatino en pacientes con mesotelioma pleural maligno
|
Pacientes aleatorizados y tratados |
Pacientes con suplemento vitamínico completo | |||
|
Parámetro de eficacia |
ALIMTA/ cisplatino |
Cisplatino |
ALIMTA/ cisplatino |
Cisplatino |
|
(N = 226) |
(N = 222) |
(N = 168) |
(N = 163) | |
|
Mediana de supervivencia global (meses) |
12,1 |
9,3 |
13,3 |
10,0 |
|
(95 % IC) |
(10,0 - 14,4) |
(7,8 - 10,7) |
(11,4 - 14,9) |
(8,4 - 11,9) |
|
valor de p* (Log Rank) |
0,020 |
0,051 | ||
|
Mediana tiempo hasta progresión tumoral (meses) |
5,7 |
3,9 |
6,1 |
3,9 |
|
(95 % IC) |
(4,9 - 6,5) |
(2,8 - 4,4) |
(5,3 - 7,0) |
(2,8 - 4,5) |
|
valor de p* (Log Rank) |
0,001 |
0,008 | ||
|
Tiempo hasta fracaso del tratamiento (meses) |
4,5 |
2,7 |
4,7 |
2,7 |
|
(95 % IC) |
(3,9 - 4,9) |
(2,1 - 2,9) |
(4,3 - 5,6) |
(2,2 - 3,1) |
|
valor de p* (Log Rank) |
0,001 |
0,001 | ||
|
Tasa de respuesta global ** |
41,3 % |
16,7 % |
45,5 % |
19,6 % |
|
(95 % IC) |
(34,8 - 48,1) |
(12,0 - 22,2) |
(37,8 - 53,4) |
(13,8 - 26,6) |
|
Test exacto Fisher valor de p* |
< 0,001 |
< 0,001 | ||
Abreviaturas: IC = intervalo de confianza *valor de p se refiere a la comparación entre brazos
**En el brazo de ALIMTA/cisplatino, aleatorizados y tratados (n = 225) y con suplemento vitamínico completo (n = 167)
Usando la Escala de Síntomas del Cáncer de Pulmón se demostró una mejoría estadísticamente significativa de los síntomas clínicamente relevantes (dolor y disnea) asociados al mesotelioma pleural maligno en la rama de tratamiento con ALIMTA/Cisplatino (212 pacientes) frente a la rama de cisplatino en monoterapia (218 pacientes). También se observaron diferencias estadísticamente significativas en los tests de función pulmonar. La diferencia entre ambos brazos es debida a la mejoría de la función pulmonar en el brazo de ALIMTA/cisplatino combinado y al deterioro de la misma en el brazo control.
Los datos de los pacientes con mesotelioma pleural maligno tratados con ALIMTA como agente único son escasos. La dosis de ALIMTA de 500 mg/m2 en monoterapia fue estudiada en 64 pacientes diagnosticados de mesotelioma pleural maligno no tratados con quimioterapia previamente. La tasa de respuesta global fue 14,1 %.
CPNM, tratamiento en segunda línea:
Un estudio fase III, multicéntrico, aleatorizado, abierto que comparaba ALIMTA frente a docetaxel en pacientes diagnosticados de cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico tras tratamiento quimioterápico previo, demostró una mediana de supervivencia de 8,3 meses en los pacientes tratados con ALIMTA (Población por Intención de Tratar n = 283) y de 7,9 meses en los pacientes tratados con docetaxel (Población por Intención de Tratar n = 288). El tratamiento quimioterápico previo no incluía ALIMTA. Un análisis acerca de la influencia de la histología del CPNM sobre el efecto del tratamiento en la supervivencia global, fue favorable a ALIMTA frente a docetaxel salvo cuando la histología era predominantemente escamosa (n = 399; 9,3 frente a 8,0 meses, HR ajustado = 0,78; IC 95 % = 0,61 - 1,00, p = 0,047) y fue favorable a docetaxel para la histología del carcinoma celular escamoso (n = 172; 6,2 frente a 7,4 meses, HR ajustado = 1,56; IC 95 % = 1,08 -2,26, p = 0,018). No se observaron diferencias clínicamente relevantes en el perfil de seguridad de ALIMTA entre los subgrupos histológicos.
Los datos clínicos limitados procedentes de otro ensayo fase III controlado sugieren que los datos de eficacia (supervivencia global, supervivencia libre de progresión) obtenidos para pemetrexed son similares entre los pacientes que habían sido tratados previamente con docetaxel (n = 41) y aquellos pacientes que no habían recibido tratamiento previo con docetaxel (n = 540).
Eficacia de ALIMTA vs docetaxel en CPNM en la Población por Intención de Tratar (ITT)
|
ALIMTA |
Docetaxel | |
|
Tiempo Supervivencia (meses) ■ Mediana (m) ■ 95 % IC para la mediana ■ HR ■ 95 % IC HR ■ No-inferioridad de valor p (HR) |
(n = 283) <7,0-39,4) 0 (0,82 0, |
(n = 288) 7,9 (6,3 - 9,2) ,99 - 1,20) 226 |
|
Supervivencia libre progresión (meses) ■ Mediana ■ HR (95 % IC) |
(n = 283) (n = 288) 2,9 2,9 0,97 (0,82 - 1,16) | |
|
Tiempo hasta fracaso del tratamiento (meses) ■ Mediana ■ HR (95 % IC) |
(n = 283) (n = 288) 2,3 2,1 ’ 0,84 (0,71 - 0,997) ’ | |
|
Respuesta (n: cualificados para respuesta) ■ Tasa de respuesta (%) (95 % IC) ■ Enfermedad estable (%) |
(n = 264) 9,1 (5,9 - 13,2) 45,8 |
(n = 274) 8,8 (5,7 - 12,8) 46,4 |
Abreviaturas: IC: intervalo de confianza; HR: cociente de riesgo; ITT: por intención de tratar; n: tamaño población total
CPNM, tratamiento en primera línea:
En un ensayo fase III, multicéntrico, aleatorizado y abierto, en el que se comparaba ALIMTA más cisplatino frente a gemcitabina más cisplatino en pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico (fase IIIb o IV) no tratados previamente con quimioterapia, se observó que ALIMTA más cisplatino (Población por Intención de Tratar (ITT) n = 862) cumplía con la variable principal de eficacia y mostraba una eficacia clínica similar a gemcitabina más cisplatino (ITT n = 863) en términos de supervivencia global (cociente de riesgo ajustado 0,94; IC del 95 % = 0,84 - 1,05). Todos los pacientes incluidos en este ensayo presentaban un valor de 0 ó 1 en la escala ECOG.
El análisis principal de eficacia se realizó sobre la población ITT. Los análisis de sensibilidad de los parámetros principales de eficacia fueron también analizados en la población por protocolo (PP). Los resultados de los análisis de eficacia para la población PP son consistentes con los resultados obtenidos para la población ITT y avalan la no inferioridad de AC frente GC.
La supervivencia libre de progresión (SLP) y la tasa de respuesta global fueron similares entre los dos brazos de tratamiento; la mediana de SLP fue de 4,8 meses para ALIMTA más cisplatino frente a 5,1 meses para gemcitabina más cisplatino (cociente de riesgo ajustado 1,04; IC del 95 % = 0,94 - 1,15) y tasa de respuesta global del 30,6 % (IC del 95 %= 27,3 - 33,9) para ALIMTA más cisplatino frente al 28,2 % (IC del 95 % = 25,0 - 31,4) para gemcitabina más cisplatino. Los datos de SLP fueron parcialmente confirmados por una revisión independiente (400/1725 pacientes fueron selecccionados aleatoriamente para la revisión).
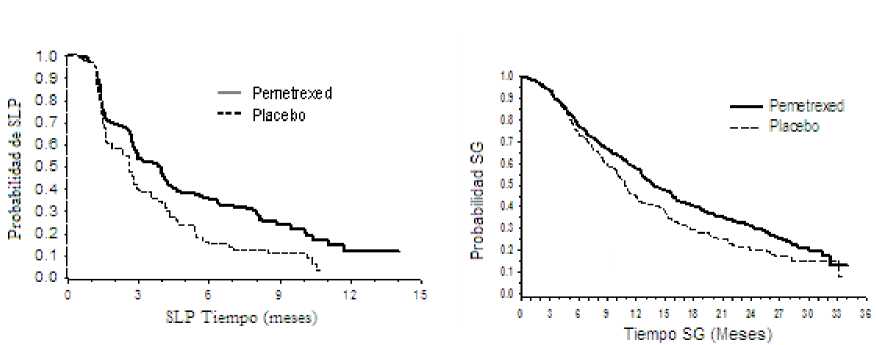
El análisis relativo a la influencia de la histología del CPNM sobre la supervivencia global demostró que existían diferencias clínicamente relevantes en supervivencia según la histología, ver la tabla incluida a continuación:
Eficacia de ALIMTA + cisplatino frente a gemcitabina + cisplatino en primera línea para cáncer de pulmón no microcítico - población ITT y subgrupos histológicos
|
Población ITT y subgrupos histológicos |
Mediana de supervivencia global en meses (IC 95 %) |
Cociente de riesgo ajustado (HR) (IC 95 %) |
Superioridad valor de p | |||
|
ALIMTA + cisplatino |
Gemcitabina + cisplatino | |||||
|
Población ITT (N = 1725) |
10,3 (9,8 - 11,2) |
N = 862 |
10,3 (9,6 - 10,9) |
N = 863 |
0,94a (0,84 - 1,05) |
0,259 |
|
Adenocarcinoma (N = 847) |
12,6 (10,7 - 13,6) |
N = 436 |
10,9 (10,2 - 11,9) |
N = 411 |
0,84 (0,71 - 0,99) |
0,033 |
|
Células grandes (N = 153) |
10,4 (8,6 - 14,1) |
N = 76 |
6,7 (5,5 - 9,0) |
N = 77 |
0,67 (0,48 - 0,96) |
0,027 |
|
Otros (N = 252) |
8,6 (6,8 - 10,2) |
N = 106 |
9,2 (8,1 - 10,6) |
N = 146 |
1,08 (0,81 - 1,45) |
0,586 |
|
Células escamosas (N = 473) |
9,4 (8,4 - 10,2) |
N = 244 |
10,8 (9,5 - 12,1) |
N = 229 |
1,23 (1,00 - 1,51) |
0,050 |
Abreviaturas: IC: intervalo de confianza; ITT: por intención de tratar; n: tamaño población total a Estadísticamente significativo para no inferioridad, con el intervalo de confianza completo para el HR bastante por debajo del margen de no inferioridad de 1,17645 (p< 0,001).
Gráficas de Kaplan Meier para supervivencia global por histología
Adeno cana nona
Caranoma decanías grandes
Tiempo de supervivencia (meses
Tiempo de superviven™ (meses
No se observaron diferencias clínicamente significativas en cuanto al perfil de seguridad de ALIMTA más cisplatino entre los subgrupos histológicos.
Los pacientes tratados con ALIMTA más cisplatino requirieron un menor número de transfusiones (16,4 % frente a 28,9 %, p< 0,001), tanto de hematíes (16,1 % frente a 27,3 %, p< 0,001) como de plaquetas (1,8 % frente a 4,5 %, p = 0,002). Asimismo, estos pacientes necesitaron una menor administración de eritropoyetina/darbopoyetina (10,4 % frente a 18,1 %, p< 0,001), de G-CSF/GM-CSF (3,1 % frente a 6,1 %, p = 0,004) y de preparados de hierro (4,3 % frente a 7,0 %, p = 0,021).
CPNM, tratamiento de mantenimiento:
JMEN
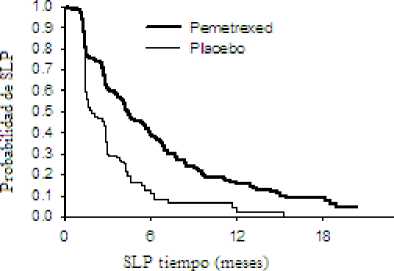
Un estudio fase III multicéntrico, aleatorizado, doble ciego, controlado con placebo (JMEN), comparó la eficacia y seguridad del tratamiento de mantenimiento con ALIMTA junto con los mejores cuidados de soporte (MCS) (n = 441) frente a placebo más MCS (n = 222), en pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado (estadio IIIB) o metastásico (fase IV), que no hubieran progresado tras cuatro ciclos de tratamiento en primera línea con un doblete conteniendo Cisplatino o Carboplatino en combinación con Gemcitabina, Paclitaxel o Docetaxel. No se incluyó como tratamiento de primera linea ningún doblete con ALIMTA. Todos los pacientes incluidos en el estudio tenían un valor de 0 ó 1 en la escala ECOG. Los pacientes recibieron tratamiento de mantenimiento hasta progresión de la enfermedad. Los parámetros de eficacia y seguridad se midieron desde el momento de la aleatorización después de haber completado el tratamiento en primera línea (inducción). Los pacientes recibieron una mediana de 5 ciclos de tratamiento de mantenimiento con ALIMTA, y 3,5 ciclos de placebo. Un total de 213 pacientes (48,3 %) completaron > 6 ciclos, y un total de 103 pacientes (23,4 %) completaron > 10 ciclos de tratamiento con ALIMTA.
El estudio cumplió el parámetro principal de eficacia y mostró una mejora estadísticamente significativa en SLP en la rama de tratamiento con ALIMTA comparada con la rama de placebo (n = 581, población revisada de forma independiente; mediana de 4,0 meses y 2,0 meses, respectivamente) (cociente de riesgo = 0,60, IC 95 % = 0,49-0,73, p < 0,00001). La revisión independiente de las tomografías (TAC) de pacientes confirmó los hallazagos de la evaluación realizada por los investigadores sobre SLP. La mediana de la supervivencia global para la población global (n = 663) fue de 13,4 meses para la rama de ALIMTA y de 10,6 meses para la rama de placebo, con un cociente de riesgo = 0,79 (IC del 95 % = 0,65 - 0,95; p = 0,01192).
Como ocurrió con otros estudios con ALIMTA, en el estudio JMEN se observó una diferencia en la eficacia de acuerdo con la histología del CPNM. Los pacientes con CPNM salvo aquellos que presentaban histología predominantemente de célula escamosa (n = 430, población revisada de forma independiente), presentaron una mediana de SLP de 4,4 meses para la rama de tratamiento con ALIMTA y 1,8 meses para la rama de placebo, cociente de riesgo = 0,47, (IC del 95 % = 0,37-0,60, p = 0,00001). La mediana de SG para los pacientes con CPNM salvo aquellos que presentaban histología predominantemente de célula escamosa (n = 481) fue de 15,5 meses para la rama de tratamiento con ALIMTA y 10,3 meses para la rama de placebo cociente de riesgo = 0,70, (IC 95 % = 0,56-0,88, p = 0,002). Incluyendo la fase de inducción, la mediana de SG para pacientes con CPNM salvo aquellos que presentaban histología predominantemente de célula escamosa fue de 18,6 meses para la rama de tratamiento con ALIMTA y de 13,6 meses para la rama de tratamiento con placebo cociente de riesgo = 0,71, (IC 95 % = 0,56-0,88, p = 0,002).
Los resultados de SLP y de SG en pacientes con histología de célula escamosa sugirieron que ALIMTA no ofrecía ninguna ventaja comparada con placebo.
No se observaron diferencias clínicamente relevantes en cuanto al perfil de seguridad de ALIMTA entre los distintos subgrupos histológicos.
JMEN: Gráficas de Kaplan Meier para supervivencia libre de progresión (SLP) y supervivencia global de ALIMTA frente a placebo en pacientes con CPNM salvo aquellos que presentaban histología predominantemente de célula escamosa:
Supervivencia libre de progresión
Supervivencia global
PARAMOUNT
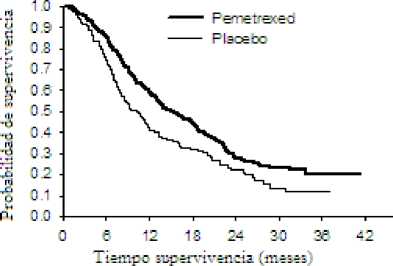
En un estudio en fase 3, multicéntrico, aleatorizado, doble-ciego, controlado con placebo (PARAMOUNT) se comparó la seguridad y eficacia de la continuación del tratamiento de mantenimiento con ALIMTA más cuidados de soporte BSC (n = 359) con placebo más cuidados de soporte BSC (n = 180) en pacientes con CPNM localmente avanzado (Estadío IIIB) o metastásico (Estadío IV), salvo aquellos que presentaban histología predominantemente de célula escamosa que no progresaron tras 4 ciclos de una primera línea de terapia de combinación de ALIMTA con cisplatino. De los 939 pacientes tratados con ALIMTA más cisplatino en inducción, 539 pacientes fueron aleatorizados a recibir tratamiento de mantenimiento con pemetrexed o placebo. De los pacientes aleatorizados, 44,9 % tuvieron una respuesta completa/parcial y el 51,9 % tuvieron una respuesta de estabilización de la enfermedad a la inducción con ALIMTA más cisplatino. A los pacientes aleatorizados al tratamiento de mantenimiento, se les exigió tener un valor de 0 ó 1 en la escala ECOG. La mediana de tiempo, desde el comienzo de la terapia de inducción con ALIMTA más cisplatino hasta el comienzo del tratamiento de mantenimiento fue de 2,96 meses, tanto en el brazo de pemetrexed como en el brazo de placebo. Los pacientes aleatorizados, recibieron el tratamiento de mantenimiento hasta la progresión de la enfermedad. La eficacia y seguridad fueron medidas desde la aleatorización tras haber completado la primera línea terapéutica (inducción). Los pacientes recibieron una mediana de 4 ciclos de tratamiento de mantenimiento con ALIMTA y 4 ciclos de placebo. Un total de 169 pacientes (47,1%) completaron > 6 ciclos de tratamiento de mantenimiento con ALIMTA, que representan al menos un total de 10 ciclos de ALIMTA.
El estudio alcanzó su variable primaria y demostró una mejora estadísticamente significativa de SLP en el brazo de ALIMTA, sobre el brazo de placebo (n =472, población revisada independientemente; mediana de 3,9 meses y 2,6 meses respectivamente) (cociente de riesgo = 0,64, 95% IC = 0,51-0,81, p = 0,0002). La revisión independiente de los escáneres de los pacientes, confirmó el hallazgo de la evaluación de los investigadores de SLP. Para los pacientes aleatorizados, medidos desde el comienzo del tratamiento de inducción de primera línea de ALIMTA más cisplatino, la mediana de SLP evaluada por los investigadores fue de 6,9 meses para el brazo de ALIMTA y de 5,6 meses para el brazo de placebo (cociente de riesgo = 0,59, 95% IC = 0,47-0,74). Tras la inducción de ALIMTA más cisplatino (4 ciclos), el tratamiento con ALIMTA fue estadísticamente superior a placebo para SG (mediana de 13,9 meses frente a 11,0 meses, cociente de riesgo = 0.78, IC 95% = 0,64-0,96, p= 0,0195). En el momento del análisis final de supervivencia, el 28,7% de los pacientes estaban vivos o se perdieron para el seguimiento en el brazo de ALIMTA frente al 21,7% en el brazo de placebo. El efecto relativo al tratamiento de ALIMTA fue internamente consistente entre los subgrupos (incluyendo estadío de la enfermedad, respuesta a la inducción, ECOG PS (Eastern Cooperative Oncology Group Performance status), hábito tabáquico, sexo, histología y edad) y fue similar a aquel observado en los análisis sin ajustar por SG y
SLP. Las tasas de supervivencia de 1 año y 2 años para pacientes tratados con ALIMTA fueron de un 58% y 32% respectivamente, comparado con el 45% y el 21% de los pacientes que recibieron placebo. Desde el inicio del tratamiento de inducción de primera línea de ALIMTA más cisplatino, la mediana de SG de los pacientes fue de 16,9 meses para el brazo de ALIMTA y de 14,0 meses para el brazo de placebo (cociente de riesgo =0,78, IC 95% =0,64-0,96). El porcentaje de pacientes que recibieron un tratamiento tras acabar el estudio fue del 64,3% para ALIMTA y 71,7% para placebo.
PARAMOUNT: Gráficas de Kaplan Meier para supervivencia libre de progresión (SLP) y supervivencia global (SG) para la continuación del tratamiento de mantenimiento con ALIMTA frente placebo en pacientes con CPNM salvo aquéllos que presentaban histología predominantemente de célula escamosa (medida desde la aleatorización)
Supervivencia libre de Progresión Supervivencia Global
Los perfiles de seguridad del tratamiento de mantenimiento con ALIMTA derivados de los dos estudios JMEN y PARAMOUNT fueron similares.
5.2 Propiedades farmacocinéticas
Las propiedades farmacocinéticas de pemetrexed tras su administración como agente único, han sido evaluadas en 426 pacientes con cáncer, con diferentes tipos de tumores sólidos, con un intervalo de dosis desde 0,2 hasta 838 mg/m2 durante un período de perfusión de 10 minutos. El pemetrexed tiene un volumen de distribución en estado de equilibrio de 9 l/m2. Estudios in vitro indican que pemetrexed se une a proteínas plasmáticas en aproximadamente un 81 %. La unión a proteínas plasmáticas no se ve afectada de manera notable por los diferentes grados de disfunción renal. El pemetrexed sufre un escaso metabolismo hepático. El pemetrexed es principalmente eliminado por vía urinaria, entre un 70 % y un 90 % de la dosis administrada se recupera inalterada en orina en las primeras 24 horas tras su administración. Estudios in vitro indican que pemetrexed se secreta de forma activa por el TAO3 (transportador de aniones orgánicos). El aclaramiento sistémico total de pemetrexed es de 91,8 ml/min y la vida media de eliminación del plasma es de 3,5 horas en pacientes con función renal normal (aclaramiento de creatinina de 90 ml/min). La variabilidad del aclaramiento entre pacientes es moderada (19,3 %). El área bajo la curva de pemetrexed (AUC) y la concentración máxima en plasma, aumentan proporcionalmente con la dosis. Las propiedades farmacocinéticas de pemetrexed permanecen durante múltiples ciclos de tratamiento.
Las propiedades farmacocinéticas de pemetrexed no se ven influenciadas por la administración concomitante de cisplatino. Los suplementos con ácido fólico oral y vitamina B12 intramuscular no afectan a la farmacocinética de pemetrexed.
5.3 Datos preclínicos sobre seguridad
La administración de pemetrexed a ratones preñados resultó en una disminución de la viabilidad fetal, disminución del peso fetal y osificación incompleta de algunas estructuras óseas incluyendo el paladar hendido.
La administración de pemetrexed en ratones macho resultó en toxicidad sobre la función reproductiva caracterizada por una tasa de fertilidad reducida y atrofia testicular. En un estudio llevado a cabo durante 9 meses en perros de raza beagle tratados con inyección intravenosa en bolus, se han observado alteraciones testiculares (degeneración/ necrosis del epitelio seminífero). Esto sugiere que el pemetrexed puede alterar la fertilidad masculina. No se ha investigado la fertilidad en mujeres.
El pemetrexed no ha demostrado ser mutagénico ni en el test in vitro de aberración cromosómica en células ováricas de hamster chino, ni en el test de Ames. El pemetrexed ha demostrado ser clastogénico en el test in vivo de micronúcleo en ratones.
No se han realizado estudios de valoración del potencial carcinogénico de pemetrexed.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Manitol
Ácido clorhídrico Hidróxido de sodio
6.2 Incompatibilidades
El pemetrexed es físicamente incompatible con diluyentes que contengan calcio, incluyendo el Ringer lactato para inyección y el Ringer para inyección. En ausencia de cualquier otro estudio de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
Viales sin abrir 3 años.
Solución reconstituida y solución para perfusión
Cuando la solución se prepara según las indicaciones dadas, las soluciones reconstituidas y para perfusión de ALIMTA no contienen conservantes antimicrobianos. Se ha demostrado que la estabilidad química y física en uso de las soluciones de pemetrexed, reconstituida y para perfusión, es de 24 horas en refrigeración. Desde un punto de vista microbiológico, el medicamento se debe usar inmediatamente tras su reconstitución. Si no se utiliza inmediatamente, el tiempo y las condiciones de conservación son responsabilidad del usuario y no deberían ser mayores de 24 horas a una temperatura de 2 °C a 8 °C.
6.4 Precauciones especiales de conservación
Viales sin abrir
Este medicamento no requiere ninguna condición especial de conservación.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de vidrio Tipo I con tapón de goma que contiene 100 mg de pemetrexed.
Envase con 1 vial.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
1. Usar técnicas asépticas durante la reconstitución y posterior dilución de pemetrexed para su administración mediante perfusión intravenosa.
2. Calcular la dosis y el número de viales de ALIMTA necesarios. Cada vial contiene un exceso de pemetrexed para facilitar la administración de la cantidad nominal necesaria.
3. Reconstituir los viales de 100 mg con 4,2 ml de solución de cloruro de sodio para inyección al 0,9 % (9 mg/ml), sin conservantes obteniendo una solución que contiene 25 mg/ml de pemetrexed. Agitar cuidadosamente el vial hasta que el polvo esté completamente disuelto. La solución resultante es transparente con un rango de color que puede variar desde incoloro a amarillo o amarillo-verdoso sin que esto afecte de forma negativa a la calidad del producto. El pH de la solución reconstituida está entre 6,6 y 7,8. Se requiere dilución posterior.
4. Se debe diluir el volumen apropiado de la solución reconstituida de pemetrexed hasta 100 ml con solución para inyección de cloruro de sodio al 0,9 % (9 mg/ml) sin conservantes y administrada como perfusión intravenosa durante 10 minutos.
5. La solución de pemetrexed para perfusión preparada según las indicaciones anteriormente descritas es compatible con los sistemas y bolsas de infusión de cloruro de polivinilo y poliolefina.
6. Los medicamentos para administración parenteral deben ser inspeccionados visualmente previamente a su administración, para descartar la aparición de partículas o alteración del color. Si se observan partículas no se debe administrar el medicamento.
7. Las soluciones de pemetrexed son para un solo uso. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Precauciones en la preparación y administración: Como cualquier otro agente antineoplásico potencialmente tóxico, se debe poner especial cuidado en el manejo y preparación de las soluciones de pemetrexed para perfusión. Se recomienda el uso de guantes para su manejo. Si las soluciones de pemetrexed entran en contacto con la piel, se debe lavar la piel inmediatamente y abundantemente con agua y jabón. Si las soluciones de pemetrexed entran en contacto con mucosas, lavar con agua abundante. Pemetrexed no es un fármaco vesicante. No existe un antídoto específico para la extravasación de pemetrexed. Se han comunicado algunos casos de extravasación de pemetrexed, los cuales no fueron valorados como graves por el investigador. La extravasación debe ser tratada según la práctica clínica habitual con otros fármacos no vesicantes.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht Países Bajos
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/290/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20 Septiembre 2004 Fecha de la última revalidación: 20 Septiembre 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA) http://www.ema.europa.eu/.
1. NOMBRE DEL MEDICAMENTO
ALIMTA 500 mg polvo para concentrado para solución para perfusión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene 500 mg de pemetrexed (como pemetrexed disódico).
Tras la reconstitución (ver sección 6.6), cada vial contiene 25 mg/ml de pemetrexed.
Excipientes con efecto conocido:
Cada vial contiene aproximadamente 54 mg de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para concentrado para solución para perfusión.
Polvo liofilizado de blanco a amarillo pálido o amarillo verdoso.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Mesotelioma pleural maligno:
ALIMTA en combinación con cisplatino, está indicado para el tratamiento de pacientes con mesotelioma pleural maligno no resecable que no han recibido quimioterapia previamente.
Cáncer de pulmón no microcítico:
ALIMTA en combinación con cisplatino, está indicado para el tratamiento en primera línea de pacientes con cáncer de pulmón no microcítico localmente avanzado o metastásico, salvo aquellos que tengan una histología predominantemente de célula escamosa (ver sección 5.1).
ALIMTA en monoterapia está indicado como tratamiento de mantenimiento de pacientes con cáncer de pulmón no microcítico localmente avanzado o metastásico, salvo aquéllos que tengan histología predominantemente de célula escamosa, cuya enfermedad no ha progresado inmediatamente después de un régimen quimioterápico basado en un platino (ver sección 5.1).
ALIMTA en monoterapia está indicado para el tratamiento en segunda línea de pacientes con cáncer de pulmón no microcítico localmente avanzado o metastásico, salvo aquellos que tengan histología predominantemente de célula escamosa (ver sección 5.1).
4.2 Posología y forma de administración
Posología:
ALIMTA debe ser administrado bajo la supervisión de un médico cualificado en el uso de quimioterapia antineoplásica.
ALIMTA en combinación con cisplatino
La dosis recomendada de ALIMTA es de 500 mg/m2 del área de superficie corporal (ASC) administrados por perfusión intravenosa durante 10 minutos el primer día de cada ciclo de 21 días. La dosis recomendada de cisplatino es de 75 mg/m2 ASC administrada en perfusión durante dos horas, aproximadamente 30 minutos después de completar la perfusión de pemetrexed durante el primer día de cada ciclo de 21 días. Los pacientes deben recibir un tratamiento antiemético adecuado e hidratación apropiada antes y/o después de recibir cisplatino(consultar también el Resumen de Características del Producto de cisplatino para recomendaciones específicas de dosificación).
ALIMTA en monoterapia:
En pacientes con cáncer de pulmón no microcítico que han sido tratados previamente con quimioterapia, la dosis recomendada de ALIMTA es de 500 mg/m2 (ASC) administrados como una perfusión intravenosa durante 10 minutos el primer día de cada ciclo de 21 días.
Pauta de premedicación:
Para reducir la incidencia y gravedad de las reacciones cutáneas, se debe administrar un corticosteroide el día anterior, el mismo día y el día después de la administración de pemetrexed. El corticosteroide debe ser equivalente a 4 mg de dexametasona administrados por vía oral dos veces al día (ver sección 4.4).
Para reducir la toxicidad, los pacientes tratados con pemetrexed deben recibir también un suplemento vitamínico (ver sección 4.4). Los pacientes deben tomar diariamente ácido fólico por vía oral o un complejo polivitamínico que contenga ácido fólico (350 a 1.000 microgramos). Deben tomarse por lo menos cinco dosis de ácido fólico durante los siete días previos a la primera dosis de pemetrexed, y la administración debe continuar durante todo el tratamiento y durante 21 días después de la última dosis de pemetrexed. Los pacientes deben recibir también una inyección intramuscular de vitamina B12 (1.000 microgramos) en la semana anterior a la de la primera dosis de pemetrexed y a partir de ahí una vez cada tres ciclos. Tras la primera inyección de vitamina B12, las inyecciones posteriores se pueden administrar el mismo día que la perfusión de pemetrexed.
Monitorización:
Antes de cada dosis se debe vigilar a los pacientes que reciben pemetrexed y realizar un recuento sanguíneo completo que incluya un recuento diferencial de células blancas (WCC) y un recuento de plaquetas. Antes de cada administración de quimioterapia se deben realizar pruebas bioquímicas sanguíneas para evaluar la función renal y hepática. Antes del comienzo de cada ciclo de quimioterapia, es necesario que el paciente presente: recuento absoluto de neutrófilos (ANC) > 1.500 células/mm3 y recuento de plaquetas > 100.000 células/mm3.
El aclaramiento de creatinina debe ser > 45 ml/min.
La bilirrubina total debe ser < 1,5 veces el límite superior de la normalidad. La fosfatasa alcalina (FA), aspartato aminotransferasa (AST o SGOT) y alanina aminotransferasa (ALT o SGPT) deben ser < 3 veces el límite superior de la normalidad. Se aceptan valores de fosfatasa alcalina, AST y ALT < 5 veces el límite superior de la normalidad si existe afectación tumoral en el hígado.
Ajuste de la dosis:
Los ajustes de la dosis al comienzo de un nuevo ciclo deben basarse en el nadir de los recuentos hematológicos o en la máxima toxicidad no hematológica del ciclo anterior. El tratamiento debe retrasarse hasta permitir un tiempo de recuperación suficiente. Después de la recuperación de la toxicidad los pacientes deben volver a tratarse empleando las pautas de ajuste de dosis que aparecen en las tablas 1, 2 y 3, que son aplicables para ALIMTA empleado como agente único o en combinación con cisplatino.
|
Tabla 1 - Tabla de modificación de la dosis de ALIMTA (como agente único o en combinación) y cisplatino - Toxicidades hematológicas | |
|
Nadir de recuento absoluto de neutrófilos (ANC) < 500 /mm3 y nadir de plaquetas > 50.000 /mm3 |
75 % de la dosis previa (de ALIMTA y de cisplatino) |
|
Nadir de plaquetas < 50.000 /mm3 independientemente del nadir del recuento absoluto de neutrófilos (ANC) |
75 % de la dosis previa (de ALIMTA y de cisplatino) |
|
Nadir de plaquetas < 50.000 /mm3 con hemorragia3, con independencia del nadir de recuento absoluto de neutrófilos (ANC) |
50 % de la dosis previa (de ALIMTA y de cisplatino) |
a Estos criterios satisfacen la definición de hemorragia > Grado 2 establecida por los Criterios Comunes de Toxicidad (CTC) del Instituto Nacional del Cáncer (CTC v2.0; NCI 1998)
Si los pacientes desarrollan toxicidades no hematológicas > Grado 3 (excluyendo neurotoxicidad), se debe retrasar la administración de ALIMTA hasta que la toxicidad se haya recuperado hasta un valor menor o igual al que el paciente presentaba antes del tratamiento. Los ajustes de dosis por toxicidad no hematológica se resumen en la tabla 2.
|
Tabla 2 - Tabla de modificación de la dosis de ALIMTA (como agente único o en combinación) y cisplatino - Toxicidades no hematológicas a’ b | ||
|
Dosis de ALIMTA (mg/m2) |
Dosis de cisplatino (mg/m2) | |
|
Cualquier toxicidad grado 3 ó 4 excepto mucositis |
75 % de la dosis previa |
75 % de la dosis previa |
|
Cualquier diarrea que requiera hospitalización (independientemente del grado) o diarrea grado 3 ó 4. |
75 % de la dosis previa |
75 % de la dosis previa |
|
Mucositis grado 3 ó 4 |
50 % de la dosis previa |
100 % de la dosis previa |
a
b
Criterios Comunes de Toxicidad del Instituto Nacional del Cáncer (CTC v2.0; NCI 1998) Se excluye neurotoxicidad
En el caso de que aparezca neurotoxicidad, el ajuste de dosis recomendado de ALIMTA y cisplatino aparece en la Tabla 3. Los pacientes deben interrumpir el tratamiento si se observa neurotoxicidad grado 3 ó 4.
|
Tabla 3 - Tabla de modificación de la dosis de ALIMTA (como agente único o en combinación) y cisplatino - Neurotoxicidad | ||
|
Grado CTCa |
Dosis de ALIMTA (mg/m2) |
Dosis de cisplatino (mg/m2) |
|
0 - 1 |
100 % de la dosis previa |
100 % de la dosis previa |
|
2 |
100 % de la dosis previa |
50 % de la dosis previa |
Criterios Comunes de Toxicidad del Instituto Nacional del Cáncer (CTC v2.0; NCI 1998)
El tratamiento con ALIMTA debe suspenderse si el paciente presenta cualquier toxicidad hematológica o no hematológica grado 3 ó 4 tras dos reducciones de dosis, o inmediatamente si se observa neurotoxicidad grado 3 ó 4.
Personas de edad avanzada: no se ha demostrado en ningún ensayo clínico que los pacientes de 65 años de edad o mayores posean un mayor riesgo de presentar efectos adversos que los pacientes menores de 65 años. No son necesarios otros ajustes de la dosis aparte de los recomendados para todos los pacientes.
Población pediátrica
No hay datos relevantes del uso de ALIMTA en población pediátrica con mesotelioma pleural maligno y cáncer de pulmón no microcítico.
Pacientes con disfunción renal (Fórmula estandarizada de Cockcroft y Gault o tasa de filtración glomerular medida por el método radioisotópico de aclaración sérica de Tc99m-DPTA): el pemetrexed se elimina inalterado principalmente por excreción renal. En estudios clínicos, los pacientes con un aclaramiento de creatinina > 45 ml/min no requirieron ajustes de dosis diferentes de los recomendados para todos los pacientes. No existen suficientes datos sobre el uso de pemetrexed en pacientes con aclaramiento de creatinina inferior a 45 ml/min, por lo tanto no se recomienda el uso de pemetrexed en estos pacientes (ver sección 4.4).
Pacientes con disfunción hepática: no se ha identificado ninguna relación entre la farmacocinética de pemetrexed y la AST (SGOT), la ALT (SGPT) o la bilirrubina total. Sin embargo, no se han estudiado específicamente pacientes con disfunción hepática tales como bilirrubina > 1,5 veces el límite superior de la normalidad y/o aminotransferasas > 3,0 veces el límite superior de la normalidad (en ausencia de metástasis hepáticas) o aminotransferasas > 5,0 veces el límite superior de la normalidad (en presencia de metástasis hepáticas).
Forma de administración
Para consultar las precauciones que deben tomarse antes de manipular o administrar ALIMTA, ver sección 6.6.
ALIMTA se debe administrar como perfusión intravenosa durante 10 minutos el primer día de cada ciclo de 21 días. Para consultar las instrucciones de reconstitución y dilución de ALIMTA antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Lactancia materna (ver sección 4.6).
Administración concomitante de la vacuna de la fiebre amarilla (ver sección 4.5).
4.4 Advertencias y precauciones especiales de empleo
Pemetrexed puede suprimir la función de la médula ósea lo que se manifiesta como neutropenia, trombocitopenia y anemia (o pancitopenia) (ver sección 4.8). La mielosupresión es, normalmente, la toxicidad limitante de la dosis. Durante el tratamiento con pemetrexed se debe vigilar la mielosupresión de los pacientes y no se debe administrar pemetrexed a los pacientes hasta que el recuento absoluto de neutrófilos (ANC) vuelva a ser > 1.500 células/mm3 y el recuento de plaquetas vuelva a ser
3
> 100.000 células/mm . Las reducciones de dosis para ciclos posteriores se basan en el nadir de ANC, el recuento de plaquetas y la toxicidad máxima no hematológica observada en ciclos anteriores (ver sección 4.2).
Se notificó una toxicidad global menor y una reducción de las toxicidades hematológicas y no hematológicas grado 3/4 tales como neutropenia, neutropenia febril e infección con neutropenia grado 3/4,
31
cuando se administraron como premedicación ácido fólico y vitamina Bi2. Por tanto, se debe advertir a todos los pacientes tratados con pemetrexed de la necesidad de que tomen ácido fólico y vitamina B12 como medida profiláctica para reducir la toxicidad relacionada con el tratamiento (ver sección 4.2).
Se han notificado reacciones cutáneas en pacientes que no han recibido un tratamiento previo con un corticosteroide. El tratamiento previo con dexametasona (o equivalente) puede reducir la incidencia y la gravedad de reacciones cutáneas (ver sección 4.2).
Se ha estudiado un número insuficiente de pacientes con aclaramiento de creatinina inferior a 45 ml/min. Por tanto, no se recomienda el uso de pemetrexed en pacientes con aclaramiento de creatinina < 45 ml/min (ver sección 4.2).
Los pacientes que presenten insuficiencia renal de leve a moderada (aclaramiento de creatinina de 45 a 79 ml/min) deben evitar tomar antiinflamatorios no esteroideos (AINEs) como ibuprofeno y ácido acetilsalicílico (> 1,3 g diarios) durante dos días antes, el mismo día y dos días después de la administración de pemetrexed (ver sección 4.5).
Los pacientes con insuficiencia renal de leve a moderada candidatos a ser tratados con pemetrexed, deberán interrumpir el tratamiento con AINEs de largas semividas de eliminación durante al menos cinco días antes, el mismo día y dos días después de la administración de pemetrexed (ver sección 4.5).
Se han notificado acontecimientos renales graves, incluyendo fallo renal agudo, relacionados con el uso de pemetrexed solo o en combinación con otros agentes quimioterápicos. Muchos de los pacientes a los que les ocurrió esto tenían factores de riesgo subyacentes para el desarrollo de acontecimientos renales, incluyendo deshidratación, hipertensión preexistente o diabetes.
El efecto de la presencia de líquido en el tercer espacio, tal como derrame pleural o ascitis, en el tratamiento con pemetrexed no está completamente definido. En un estudio en fase 2 de pemetrexed, con 31 pacientes con tumores sólidos y con líquido estable en el tercer espacio, no se observaron diferencias en las concentraciones normalizadas en plasma de pemetrexed o en su aclaramiento en comparación con el grupo de pacientes sin líquido en el tercer espacio. Por lo tanto, se debe considerar el drenaje del tercer espacio antes de la administración de pemetrexed, aunque puede que no sea necesario.
Se ha observado deshidratación severa a causa de la toxicidad gastrointestinal asociada al tratamiento con pemetrexed en combinación con cisplatino. Por tanto, los pacientes deben recibir tratamiento antiemético adecuado e hidratación apropiada antes y/o después de recibir el tratamiento.
Durante los ensayos clínicos con pemetrexed se han comunicado con poca frecuencia acontecimientos cardiovasculares graves, incluyendo infarto de miocardio, y acontecimientos cerebrovasculares, normalmente cuando se administraba en combinación con otro agente citotóxico. La mayoría de los pacientes en los que se han observado estos efectos tenían factores de riesgo cardiovascular previos (ver sección 4.8).
El estado de inmunodepresión es habitual en los pacientes oncológicos. Por tanto, no se recomienda el uso concomitante de vacunas con microorganismos vivos atenuados (ver secciones 4.3 y 4.5).
El pemetrexed puede ser genotóxico, por ello se advierte a los pacientes varones en edad fértil que no engendren hijos durante el tratamiento y hasta 6 meses después. Se recomienda el uso de medidas anticonceptivas adecuadas o abstinencia sexual durante este periodo. Debido a la posibilidad de que el tratamiento con pemetrexed produzca infertilidad irreversible, se aconseja que los pacientes varones soliciten asesoramiento sobre la posibilidad de acudir a un banco de esperma antes de comenzar el tratamiento.
Se recomienda que las mujeres fértiles empleen métodos anticonceptivos efectivos durante el tratamiento con pemetrexed (ver sección 4.6).
Se han notificado casos de neumonitis por irradiación en pacientes tratados con radioterapia previa, concomitante o posterior a su tratamiento con pemetrexed. Se debe prestar especial atención a estos pacientes, y tener precaución cuando se utilicen otros agentes radiosensibilizantes.
Se han notificado casos de toxicidad cutánea tardía en pacientes sometidos a radioterapia semanas o años antes.
Este medicamento contiene aproximadamente 54 mg de sodio por vial, lo que deberá tenerse en cuenta en el tratamiento de pacientes con dietas pobres en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
El pemetrexed se elimina inalterado, por vía renal principalmente mediante secreción tubular y, en menor medida mediante filtración glomerular. La administración concomitante de fármacos nefrotóxicos (p. ej. aminoglucósidos, diuréticos del asa, derivados del platino, ciclosporinas) podrían, potencialmente, producir un retraso en el aclaramiento de pemetrexed. Esta combinación debe usarse con precaución. Si fuera necesario utilizar alguno de estos fármacos, el aclaramiento de creatinina debe vigilarse estrechamente.
La administración concomitante de sustancias que también se eliminan por secreción tubular (p. ej. probenecid, penicilina) potencialmente pueden resultar en un retraso en el aclaramiento de pemetrexed. Se debe tener precaución cuando se administren estos fármacos en combinación con pemetrexed. Si fuera necesario administrarlos, se debe vigilar estrechamente el aclaramiento de creatinina.
En pacientes con la función renal normal (aclaramiento de creatinina > 80 ml/min), la administración de altas dosis de fármacos antiinflamatorios no esteroideos (AINEs, como ibuprofeno > 1.600 mg/día) y ácido acetilsalicílico a dosis elevadas (> 1,3 g diarios) pueden disminuir la eliminación de pemetrexed y, en consecuencia aumentar la aparición de efectos adversos asociados a pemetrexed. Por tanto, debe tenerse precaución durante la administración concomitante de altas dosis de AINEs o ácido acetilsalicílico con pemetrexed en pacientes con la función renal normal (aclaramiento de creatinina > 80 ml/min).
En pacientes con insuficiencia renal leve a moderada (aclaramiento de creatinina de 45 a 79 ml/min), debe evitarse la administración concomitante de pemetrexed con AINEs (p. ej. ibuprofeno) o ácido acetilsalicílico a altas dosis durante 2 días antes, el mismo día y 2 días después de la administración de pemetrexed (ver sección 4.4).
En ausencia de datos relativos a la posible interacción con AINEs de semividas más largas tales como piroxicam o rofecoxib, en pacientes con insuficiencia renal leve o moderada, debe interrumpirse la administración concomitante con pemetrexed durante al menos los 5 días anteriores, el mismo día y 2 días después de la administración de pemetrexed (ver sección 4.4). Si es necesaria la administración concomitante de AINEs, los pacientes deben ser vigilados estrechamente por si hubiese toxicidad, especialmente mielosupresión y toxicidad gastrointestinal.
El pemetrexed sufre un metabolismo hepático limitado. Los resultados de los estudios in vitro con microsomas hepáticos humanos indicaron que no es previsible que pemetrexed produzca una inhibición clínicamente significativa del aclaramiento metabólico de los fármacos metabolizados a través de los citocromos CYP3A, CYP2D6, CYP2C9 y CYP1A2.
Interacciones comunes a todos los citotóxicos:
Debido al aumento del riesgo de padecer trombosis, en pacientes con cáncer, es frecuente el empleo de tratamiento anticoagulante. La elevada variabilidad intraindividual del estado de la coagulación durante las enfermedades y la posibilidad de interacción entre los anticoagulantes orales y la quimioterapia antineoplásica, requiere un aumento de la frecuencia de control del INR (Cociente Normalizado Internacional) si se decide tratar al paciente con anticoagulantes orales.
Uso concomitante contraindicado: vacuna de la fiebre amarilla: riesgo de padecer la enfermedad generalizada (ver sección 4.3).
Uso concomitante no recomendado: vacunas con microorganismos vivos atenuados (excepto la fiebre amarilla, cuyo uso concomitante está contraindicado): riesgo de padecer la enfermedad sistémica, posiblemente fatal. El riesgo aumenta en pacientes que ya están immunodeprimidos por la enfermedad subyacente. Si existe, se debe emplear una vacuna con microorganismos inactivados (poliomielitis) (ver sección 4.4).
4.6 Fertilidad, embarazo y lactancia
Anticoncepción en hombres y mujeres
Las mujeres fértiles deben usar métodos anticonceptivos eficaces durante el tratamiento con pemetrexed. El pemetrexed puede ser genotóxico. Se advierte a los pacientes varones en edad fértil que no engendren hijos durante el tratamiento y hasta 6 meses después, y se recomienda el uso de medidas anticonceptivas adecuadas o abstinencia sexual durante este periodo.
Embarazo
No se dispone de datos sobre el uso de pemetrexed en mujeres embarazadas pero se sospecha que pemetrexed, al igual que otros antimetabolitos, cuando se administra durante el embarazo, puede causar defectos congénitos graves. Los estudios en animales han demostrado toxicidad en la reproducción (ver sección 5.3). No debe administrarse pemetrexed durante el embarazo a no ser que sea claramente necesario, después de evaluar cuidadosamente la necesidad de tratamiento de la madre y el riesgo para el feto (ver sección 4.4).
Lactancia
No se sabe si el pemetrexed se excreta en la leche materna por lo que no se puede excluir la posibilidad de aparición de reacciones adversas en el lactante. La lactancia debe interrumpirse durante el tratamiento con pemetrexed (ver sección 4.3).
Fertilidad
Debido a la posibilidad de que el tratamiento con pemetrexed produzca infertilidad irreversible, se aconseja que los pacientes varones soliciten asesoramiento sobre la posibilidad de acudir a un banco de esperma antes de comenzar el tratamiento.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se ha comunicado que pemetrexed puede causar astenia. Por tanto, se debe informar a los pacientes de que tengan precaución a la hora de conducir y manejar maquinaria si ocurre este efecto.
4.8 Reacciones adversas Resumen del perfil de seguridad:
Las reacciones adversas notificadas con mayor frecuencia en relación al tratamiento con pemetrexed, tanto si se utiliza en monoterapia como en combinación, son la supresión de médula ósea que se manifiesta como anemia, neutropenia, leucopenia, trombocitopenia y toxicidad gastrointestinal que se manifiesta como anorexia, náuseas, vómitos, diarrea, estreñimiento, faringitis, mucositis y estomatitis. Otras reacciones adversas incluyen toxicidad renal, aumento de aminotransferasas, alopecia, fatiga, deshidratación, exantema, infección/sepsis y neuropatía. Rara vez se han visto efectos como el síndrome de Stevens-Johnson y necrolisis epidérmica tóxica.
Tabla de reacciones adversas
La tabla que aparece a continuación proporciona la frecuencia y gravedad de las reacciones adversas que se han notificado en > 5 % de los 168 pacientes con mesotelioma que aleatoriamente recibieron cisplatino y pemetrexed y de los 163 pacientes con mesotelioma que aleatoriamente recibieron cisplatino como agente único. En los dos brazos de tratamiento, estos pacientes que no habían recibido quimioterapia previamente, recibieron suplementos con ácido fólico y vitamina B12.
Reacciones adversas
Frecuencia estimada: Muy frecuentes (> 1/10), Frecuentes (> 1/100 a < 1/10), Poco frecuentes (> 1/1.000 a < 1/100), Raras (> 1/10.000 a < 1/1.000), Muy raras (< 1/10.000) y de frecuencia no conocida (no puede estimarse a partir de los datos disponibles-notificaciones espontáneas).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Sistema de clasificación de órganos |
Frecuencia |
Acontecimiento * |
Pemetrexed-cisplatino |
Cisplatino | ||
|
(N = 168) |
(N = 163) | |||||
|
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) |
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) | |||
|
Trastornos de la sangre y del sistema linfático |
Muy frecuentes |
Disminución de neutrófilos/ granulocitos |
56,0 |
23,2 |
13,5 |
3,1 |
|
Disminución de leucocitos |
53,0 |
14,9 |
16,6 |
0,6 | ||
|
Disminución de hemoglobina |
26,2 |
4,2 |
10,4 |
0,0 | ||
|
Disminución de plaquetas |
23,2 |
5,4 |
8,6 |
0,0 | ||
|
Trastornos del metabolismo y de la nutrición |
Frecuentes |
Deshidratación |
6,5 |
4,2 |
0,6 |
0,6 |
|
Trastornos oculares |
Frecuentes |
Conjuntivitis |
5,4 |
0,0 |
0,6 |
0,0 |
|
Trastornos del sistema nervioso |
Muy frecuentes |
Neuropatía sensorial |
10,1 |
0,0 |
9,8 |
0,6 |
|
Frecuentes |
Alteración del gusto |
7,7 |
0,0*** |
6,1 |
0,0*** | |
|
Trastornos gastrointestinales |
Muy frecuentes |
Diarrea |
16,7 |
3,6 |
8,0 |
0,0 |
|
Vómitos |
56,5 |
10,7 |
49,7 |
4,3 | ||
|
Estomatitis/ Faringitis |
23,2 |
3,0 |
6,1 |
0,0 | ||
|
Náuseas |
82,1 |
11,9 |
76,7 |
5,5 | ||
|
Anorexia |
20,2 |
1,2 |
14,1 |
0,6 | ||
|
Estreñimiento |
11,9 |
0,6 |
7,4 |
0,6 | ||
|
Frecuentes |
Dispepsia |
5,4 |
0,6 |
0,6 |
0,0 | |
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Exantema |
16,1 |
0,6 |
4,9 |
0,0 |
|
Alopecia |
11,3 |
0,0*** |
5,5 |
0,0*** | ||
|
Trastornos renales y urinarios |
Muy frecuentes |
Elevación de creatinina |
10,7 |
0,6 |
9,8 |
1,2 |
|
Descenso del aclaramiento de creatinina* * |
16,1 |
0,6 |
17,8 |
1,8 | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Astenia |
47,6 |
10,1 |
42,3 |
9,2 |
|
* Referido a los CTC del Instituto Nacional de |
l Cáncer versión 2 para cad |
a grado de toxicidad | ||||
excepto el término “descenso del aclaramiento de creatinina”.
**deriva del término “otros renal/genitourinario”.
*** De acuerdo con los CTC del Instituto Nacional del Cáncer (v2.0; NCI 1998), la alteración del gusto y la alopecia sólo deben notificarse como de Grado 1 ó 2.
Para esta tabla se realizó un corte en el 5 % para incluir todos los acontecimientos en los que el informador consideró que existía una posible relación del efecto con pemetrexed y cisplatino.
Las toxicidades CTC clínicamente relevantes que se notificaron en > 1 % y < 5 % de los pacientes que fueron asignados aleatoriamente para recibir cisplatino y pemetrexed incluyen: fallo renal, infección, pirexia, neutropenia febril, aumento de AST, ALT y GGT, urticaria y dolor torácico. Las toxicidades CTC clínicamente relevantes que se notificaron en < 1 % de los pacientes que fueron asignados aleatoriamente al grupo que recibió cisplatino y pemetrexed incluyen arritmia y neuropatía motora.
La siguiente tabla proporciona la frecuencia y gravedad de efectos indeseables que se han notificado en > 5 % de los 265 pacientes asignados aleatoriamente al grupo que recibió pemetrexed como agente único con suplementos de ácido fólico y vitamina B12 y los 276 pacientes asignados aleatoriamente al grupo que recibió docetaxel como agente único. A todos los pacientes se les había diagnosticado cáncer de pulmón no microcítico localmente avanzado o metastásico y habían recibido quimioterapia previa.
|
Sistema de clasificación de órganos |
Frecuencia |
Acontecimiento * |
Pemetrexed N = 265 |
Docetaxel N = 276 | ||
|
Toxicidad todos los grados (%) |
Toxicidad grado 3 -4 (%) |
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) | |||
|
Trastornos de la sangre y del sistema linfático |
Muy frecuentes |
Disminución de neutrófilos/ granulocitos |
10,9 |
5,3 |
45,3 |
40,2 |
|
Disminución de leucocitos |
12,1 |
4,2 |
34,1 |
27,2 | ||
|
Disminución de hemoglobina |
19,2 |
4,2 |
22,1 |
4,3 | ||
|
Frecuentes |
Disminución de plaquetas |
8,3 |
1,9 |
1,1 |
0,4 | |
|
Trastornos gastrointestinal es |
Muy frecuentes |
Diarrea |
12,8 |
0,4 |
24,3 |
2,5 |
|
Vómitos |
16,2 |
1,5 |
12,0 |
1,1 | ||
|
Estomatitis/ Faringitis |
14,7 |
1,1 |
17,4 |
1,1 | ||
|
Náuseas |
30,9 |
2,6 |
16,7 |
1,8 | ||
|
Anorexia |
21,9 |
1,9 |
23,9 |
2,5 | ||
|
Frecuentes |
Estreñimiento |
5,7 |
0,0 |
4,0 |
0,0 | |
|
Trastornos hepatobiliares |
Frecuentes |
Aumento de ALT (SGPT) |
7,9 |
1,9 |
1,4 |
0,0 |
|
Aumento de AST (SGOT) |
6,8 |
1,1 |
0,7 |
0,0 | ||
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Exantema/ descamación |
14,0 |
0,0 |
6,2 |
0,0 |
|
Frecuentes |
Prurito |
6,8 |
0,4 |
1,8 |
0,0 | |
|
Alopecia |
6,4 |
0,4** |
37,7 |
2,2** | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Astenia |
34,0 |
5,3 |
35,9 |
5,4 |
|
Frecuentes |
Fiebre |
8,3 |
0,0 |
7,6 |
0,0 | |
* Referido a los CTC del Instituto Nacional del Cáncer versión 2 para cada grado de toxicidad ** De acuerdo con los CTC del Instituto Nacional del Cáncer (v2.0; NCI 1998), la alopecia sólo
debe notificarse como de grado 1 ó 2.
Para esta tabla se realizó un corte en el 5 % para incluir todos los acontecimientos en los que el informador consideró que existía una posible relación del efecto con pemetrexed.
Las toxicidades CTC clínicamente relevantes notificadas en > 1 % y < 5 % de los pacientes asignados aleatoriamente al grupo de pemetrexed incluyen: infección sin neutropenia, neutropenia febril, reacción alérgica/hipersensibilidad, aumento de creatinina, neuropatía motora, neuropatía sensorial, eritema multiforme y dolor abdominal.
Las toxicidades CTC clínicamente relevantes que se notificaron en < 1 % de los pacientes que fueron asignados aleatoriamente a tratamiento con pemetrexed incluyen arritmias supraventriculares.
Las toxicidades de laboratorio clínicamente relevantes grado 3 y grado 4 fueron similares entre los resultados de los ensayos fase II, reunidos a partir de tres estudios con pemetrexed como único agente (n = 164) y el ensayo fase III con pemetrexed como único agente descrito anteriormente, con la excepción de la neutropenia (12,8 % frente a 5,3 % respectivamente) y el aumento de alanina aminotransferasa
(15,2 % frente a 1,9 %, respectivamente). Estas diferencias se debieron probablemente a las diferencias en la población de pacientes entre ambos grupos, ya que los ensayos fase II incluyeron tanto pacientes sin quimioterapia previa como pacientes con cáncer de mama intensamente tratados previamente con metástasis preexistentes en hígado, función basal hepática anormal o ambos.
La tabla que se incluye a continuación proporciona los datos de frecuencia y gravedad de reacciones adversas consideradas como posiblemente relacionadas con el medicamento en estudio y que han sido notificadas en > 5 % de los 839 pacientes con CPNM que fueron aleatorizados a recibir cisplatino y pemetrexed, y de los 830 pacientes con CPNM que fueron aleatorizados a recibir cisplatino y gemcitabina. Todos los pacientes recibieron el régimen de tratamiento en estudio como tratamiento inicial para el CPNM localmente avanzado o metastásico, y en ambos grupos de tratamiento los pacientes recibieron suplementos de ácido fólico y vitamina B12.
|
Sistema de clasificación de órganos |
Frecuencia |
Acontecimiento** |
Pemetrexed/cisplatino (N = 839) |
Gemcitabina/cisplatino (N = 830) | ||
|
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) |
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) | |||
|
Trastornos de la sangre y del sistema linfático |
Muy frecuentes |
Disminución de hemoglobina |
33,0* |
5,6* |
45,7* |
9,9* |
|
Disminución de neutrófilos/ granulocitos |
29,0* |
15,1* |
38,4* |
26,7* | ||
|
Disminución de leucocitos |
17,8 |
4,8* |
20,6 |
7,6* | ||
|
Disminución de plaquetas |
10,1* |
4,1* |
26,6* |
12,7* | ||
|
Trastornos del sistema nervioso |
Frecuentes |
Neuropatía sensorial |
8,5* |
0,0* |
12,4* |
0,6* |
|
Alteración del gusto |
8,1 |
0,0*** |
8,9 |
0,0*** | ||
|
Trastornos gastrointesti nales |
Muy frecuentes |
Náuseas |
56,1 |
7,2* |
53,4 |
3,9* |
|
Vómitos |
39,7 |
6,1 |
35,5 |
6,1 | ||
|
Anorexia |
26,6 |
2,4* |
24,2 |
0,7* | ||
|
Estreñimiento |
21,0 |
0,8 |
19,5 |
0,4 | ||
|
Estomatitis/ Faringitis |
13,5 |
0,8 |
12,4 |
0,1 | ||
|
Diarrea sin colostomía |
12,4 |
1,3 |
12,8 |
1,6 | ||
|
Frecuentes |
Dispepsia/Ardor |
5,2 |
0,1 |
5,9 |
0,0 | |
|
Trastornos renales y urinarios |
Muy frecuentes |
Elevación de creatinina |
10,1* |
0,8 |
6,9* |
0,5 |
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Alopecia |
11,9* |
0,0*** |
21,4* |
0,5*** |
|
Frecuentes |
Exantema/ descamación |
6,6 |
0,1 |
8,0 |
0,5 | |
|
Trastornos |
Muy |
Astenia |
42,7 |
6,7 |
44,9 |
4,9 |
|
generales y alteraciones |
frecuentes | |||||
|
en el lugar de administración |
* valor de p< 0,05 cuando se comparó pemetrexed/cisplatino frente a gemcitabina/cisplatino utilizando el test exacto de Fisher.
** Referido a los CTC del Instituto Nacional del Cáncer (v2,0; NCI 1998) para cada grado de toxicidad.
*** De acuerdo con los CTC del Instituto Nacional del Cáncer (v2.0; NCI 1998), las alteraciones del gusto y la alopecia sólo deben notificarse como de grado 1 ó 2.
Para esta tabla se realizó un corte en el 5 % para incluir todos los acontecimientos en los que el informador consideró que existía una posible relación del efecto con pemetrexed y cisplatino.
Las toxicidades clínicamente relevantes notificadas en > 1 % y < 5 % de los pacientes asignados aleatoriamente al grupo de cisplatino y pemetrexed incluyen: aumento de AST, aumento de ALT, infección, neutropenia febril, fallo renal, pirexia, deshidratación, conjuntivitis y disminución del aclaramiento de creatinina.
Las toxicidades clínicamente relevantes que se notificaron en < 1 % en los pacientes que fueron asignados aleatoriamente a recibir cisplatino y pemetrexed incluyen: aumento de GGT, dolor torácico, arritmia y neuropatía motora.
Las toxicidades clínicamente relevantes en función del sexo en pacientes que estaban recibiendo pemetrexed más cisplatino fueron similares a las de la población general.
La siguiente tabla proporciona la frecuencia y gravedad de efectos adversos considerados como posiblemente relacionados con el fármaco en estudio y que han sido notificados en > 5% de los 800 pacientes aleatoriamente asignados para recibir pemetrexed en monoterapia y de los 402 pacientes aleatoriamente asignados para recibir placebo, en los estudios de mantenimiento con pemetrexed en monoterapia (JMEN: N=663) y de mantenimiento con continuación de pemetrexed (PARAMOUNT: N=539). Todos los pacientes fueron diagnosticados con CPNM grado IIIB o IV, y todos habían recibido previamente un régimen quimioterápico basado en un platino. Los pacientes de ambas ramas del estudio recibieron suplementos de ácido fólico y vitamina B12.
|
Sistema de clasificación de órganos |
Frecuencia |
Acontecimiento* |
Pemetrexed*** (N = 800) |
Placebo*** (N = 402) | ||
|
Toxicidad todos los grados (%) |
Toxicidad grado 3 / 4 (%) |
Toxicidad todos los grados (%) |
Toxicidad grado 3 - 4 (%) | |||
|
Trastornos de la sangre y del sistema linfático |
Muy frecuentes |
Disminución de hemoglobina |
18,0 |
4,5 |
5,2 |
0,5 |
|
Frecuentes |
Disminución de leucocitos |
5,8 |
1,9 |
0,7 |
0,2 | |
|
Disminución de neutrófilos |
8,4 |
4,4 |
0,2 |
0,0 | ||
|
Trastornos del sistema nervioso |
Frecuentes |
Neuropatía sensorial |
7,4 |
0,6 |
5,0 |
0,2 |
|
Trastornos gastrointesti nales |
Muy frecuentes |
Náuseas |
17,3 |
0,8 |
4,0 |
0,2 |
|
Anorexia |
12,8 |
1,1 |
3,2 |
0,0 | ||
|
Frecuentes |
Vómitos |
8,4 |
0,3 |
1,5 |
0,0 | |
|
Mucositis/ estomatitis |
6,8 |
0,8 |
1,7 |
0,0 | ||
|
Trastornos hepatobiliares |
Frecuentes |
Elevación de ALT (SGPT) |
6,5 |
0,1 |
2,2 |
0,0 |
|
Elevación de AST(SGOT) |
5,9 |
0,0 |
1,7 |
0,0 | ||
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes |
Exantema/ descamación |
8,1 |
0,1 |
3,7 |
0,0 |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Astenia |
24,1 |
5,3 |
10,9 |
0,7 |
|
Frecuentes |
Dolor |
7,6 |
0,9 |
4,5 |
0,0 | |
|
Edema |
5,6 |
0,0 |
1,5 |
0,0 | ||
|
Trastornos Renales |
Frecuentes |
Trastornos Renales**** |
7,6 |
0,9 |
1,7 |
0,0 |
Abreviaturas: ALT = alanina aminotransferasa; AST = aspartato aminotransferasa; CTCAE = Criterios terminológicos comunes para acontecimientos adversos; NCI = Instituto Nacional del Cáncer; SGOT = oxalacético glutámico aminotransferasa sérica; SGPT = piruvico glutámico aminotransferasa sérica.
* Definición de los términos de frecuencia: Muy frecuente - > 10 %; Frecuente - > 5 % y < 10 %. Para esta tabla se realizó un corte en el 5 % para incluir todos los acontecimientos en los que el informador consideró que existía una posible relación del efecto con pemetrexed.
** Referir a los Criterios CTcAe del NCI (Versión 3.0; NCI 2003) para cada grado de toxicidad. Los valores mostrados se corresponden con la versión 3.0 de CTCAE.
***La tabla integrada de reacciones adversas combina los resultados del estudio de mantenimiento con pemetrexed JMEN (N=663) con el estudio de mantenimiento con continuación de pemetrexed PARAMOUNT (N=539).
**** Este término incluye aumento de la creatinina sérica/en sangre, disminución de la tasa de filtración glomerular, fallo renal y otros trastornos renales/genitourinarios.
Las toxicidades CTC clínicamente relevantes de cualquier grado notificadas en > 1 % y < 5 % de los pacientes asignados aleatoriamente al grupo de pemetrexed incluyen: neutropenia febril, infección, disminución de plaquetas, diarrea, estreñimiento, alopecia, prurito/picor, fiebre (en ausencia de neutropenia), enfermedad de la superficie ocular (incluyendo conjuntivitis), aumento del lagrimeo, mareos y neuropatía motora.
Las toxicidades CTC clínicamente relevantes que se notificaron en < 1 % de los pacientes que fueron asignados aleatoriamente a recibir pemetrexed incluyen: reacción alérgica/hipersensibilidad, eritema multiforme, arritmia supraventicular y embolia pulmonar.
Se evaluó la seguridad en los pacientes aleatorizados para recibir pemetrexed (N=800). Se evaluó la incidencia de reacciones adversas en aquellos pacientes que recibieron < 6 ciclos de mantenimiento con pemetrexed (N=519), y se comparó con la que presentaron los pacientes que recibieron > 6 ciclos de pemetrexed (N=281). Se observó un incremento en las reacciones adversas (de todos los grados) a medida que aumentaba la exposición. Se observó un incremento significativo en la incidencia de neutropenia de Grado 3/4, posiblemente relacionada con la medicación de estudio a mayor exposición a pemetrexed (< 6 ciclos: 3,3%,> 6 ciclos: 6,4%: p=0,046). No se vieron diferencias estadísticamente significativas en ninguna otra reacción adversa de Grado 3/4/5 a mayor exposición.
Durante los estudios clínicos con pemetrexed se han notificado con poca frecuencia acontecimientos adversos cardiovasculares y cerebrovasculares graves incluyendo infarto de miocardio, angina de pecho, accidente cerebrovascular y accidente isquémico transitorio; habitualmente estos acontecimientos se han comunicado cuando se ha administrado pemetrexed en combinación con otro agente citotóxico. La mayoría de los pacientes en los que se ha observado estos acontecimientos tenían antecedentes de factores de riesgo cardiovascular.
Durante los ensayos clínicos con pemetrexed se han notificado, raramente, casos de hepatitis potencialmente graves.
En los ensayos clínicos con pemetrexed se han notificado, poco frecuentemente, casos de pancitopenia.
En pacientes tratados con pemetrexed en ensayos clínicos se han notificado, con poca frecuencia, casos de colitis (incluyendo sangrado intestinal y rectal en algunos casos mortales, perforación intestinal, necrosis intestinal y tifilitis).
En pacientes tratados con pemetrexed en ensayos clínicos, se han notificado de forma poco frecuente casos de neumonitis intersticial con insuficiencia respiratoria que, en algunos casos, fueron mortales.
En pacientes tratados con pemetrexed se han notificado casos de edema de forma poco frecuente.
Durante los ensayos clínicos con pemetrexed, se han notificado de forma poco frecuente casos de esofagitis/esofagitis por radiación.
En los ensayos clínicos con pemetrexed se ha notificado frecuentemente sepsis, que en algunos casos, fue mortal.
Durante la vigilancia postcomercialización, se han notificado las siguientes reacciones adversas en pacientes tratados con pemetrexed:
Con poca frecuencia se han notificado casos de fallo renal agudo con el uso de pemetrexed solo o en combinación con otros agentes quimioterápicos (ver sección 4.4).
Con poca frecuencia se han notificado casos de neumonitis por irradiación en pacientes tratados con radioterapia previa, concomitante o posterior a su tratamiento con pemetrexed (ver sección 4.4).
En raras ocasiones se han notificado casos de toxicidad cutánea tardía en pacientes que habían recibido radioterapia previamente (ver sección 4.4).
Con poca frecuencia se han notificado casos de isquemia periférica que, en ocasiones, han derivado en necrosis en las extremidades.
Rara vez se han notificado casos de alteraciones bullosas incluyendo el síndrome de Stevens-Johnson y la necrolisis epidérmica tóxica que en algunos casos fueron mortales.
Rara vez se ha notificado anemia hemolítica inmunoinducida en pacientes tratados con pemetrexed.
Rara vez se han notificado casos de shock anafiláctico.
4.9 Sobredosis
Los síntomas de sobredosis que se han notificado incluyen neutropenia, anemia, trombocitopenia, mucositis, polineuropatía sensorial y exantema. Las complicaciones previsibles de sobredosis incluyen la supresión de la médula ósea que se manifiesta por la aparición de neutropenia, trombocitopenia y anemia. Además, puede observarse infección con o sin fiebre, diarrea y/o mucositis. En el caso de sospecha de sobredosis, se debe vigilar a los pacientes realizando recuentos sanguíneos y deben recibir tratamiento de apoyo cuando sea necesario. Debe considerarse el uso de folinato de calcio / ácido folínico en el tratamiento de la sobredosis por pemetrexed.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: análogos del ácido fólico, código ATC: L01BA04.
ALIMTA (pemetrexed) es un agente antineoplásico antifolato multidiana, que ejerce su acción mediante la interrupción de los procesos metabólicos esenciales dependientes de folato necesarios para la replicación celular.
Los estudios in vitro han mostrado que pemetrexed se comporta como un antifolato multidiana inhibiendo la timidilato sintetasa (TS), la dihidrofolato reductasa (DHFR) y la glicinamida ribonucleótido formiltransferasa (GARFT), que son enzimas dependientes del folato, claves para la biosíntesis de novo de los nucleótidos de timidina y purina. Pemetrexed se transporta al interior de las células tanto mediante el transportador de folato reducido como mediante sistemas proteicos transportadores de membrana unidos a folato. Una vez en la célula, pemetrexed se convierte rápida y eficazmente en formas poliglutamato mediante la enzima folilpoliglutamato sintetasa. Las formas poliglutamato se retienen en las células y son inhibidores incluso más potentes de la TS y la GARFT. La poliglutamación es un proceso dependiente del tiempo y de la concentración que ocurre en las células tumorales y, en menor medida, en tejidos normales. Los metabolitos poliglutamados poseen una semivida intracelular más larga que se traduce en una acción del fármaco prolongada en las células malignas.
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con ALIMTA en los diferentes grupos de la población pediátrica en las indicaciones autorizadas (ver sección 4.2).
Eficacia clínica:
Mesotelioma:
El estudio fase III EMPHACIS, multicéntrico, aleatorizado, simple ciego con ALIMTA y cisplatino frente a cisplatino en pacientes con mesotelioma pleural maligno no tratados previamente con quimioterapia, ha demostrado que los pacientes tratados con ALIMTA y cisplatino poseen un aumento clínicamente significativo de la mediana de supervivencia de 2,8 meses sobre los pacientes que recibieron cisplatino en monoterapia.
Durante el estudio se introdujo la administración de un suplemento a dosis bajas de ácido fólico y vitamina B12 para reducir la toxicidad. El análisis primario de este estudio se realizó sobre la población que incluía a todos los pacientes asignados al azar al brazo de tratamiento que recibía el fármaco en estudio (aleatorizados y tratados). Se realizó un análisis de subgrupos con los pacientes que recibieron suplemento de ácido fólico y vitamina BJ2 durante todo el tratamiento (suplemento completo). Los resultados de estos análisis de eficacia se resumen en la siguiente tabla:
Eficacia de ALIMTA más cisplatino vs. cisplatino en pacientes con mesotelioma pleural maligno
|
Pacientes aleatorizados y tratados |
Pacientes con suplemento vitamínico completo | |||
|
Parámetro de eficacia |
ALIMTA/ cisplatino |
Cisplatino |
ALIMTA/ cisplatino |
Cisplatino |
|
(N = 226) |
(N = 222) |
(N = 168) |
(N = 163) | |
|
Mediana de supervivencia global (meses) |
12,1 |
9,3 |
13,3 |
10,0 |
|
(95 % IC) |
(10,0 - 14,4) |
(7,8 - 10,7) |
(11,4 - 14,9) |
(8,4 - 11,9) |
|
valor de p* (Log Rank) |
0,020 |
0,051 | ||
|
Mediana tiempo hasta progresión tumoral (meses) |
5,7 |
3,9 |
6,1 |
3,9 |
|
(95 % IC) |
(4,9 - 6,5) |
(2,8 - 4,4) |
(5,3 - 7,0) |
(2,8 - 4,5) |
|
valor de p* (Log Rank) |
0,001 |
0,008 | ||
|
Tiempo hasta fracaso del tratamiento (meses) |
4,5 |
2,7 |
4,7 |
2,7 |
|
(95 % IC) |
(3,9 - 4,9) |
(2,1 - 2,9) |
(4,3 - 5,6) |
(2,2 - 3,1) |
|
valor de p* (Log Rank) |
0,001 |
0,001 | ||
|
Tasa de respuesta global ** |
41,3 % |
16,7 % |
45,5 % |
19,6 % |
|
(95 % IC) |
(34,8 - 48,1) |
(12,0 - 22,2) |
(37,8 - 53,4) |
(13,8 - 26,6) |
|
Test exacto Fisher valor de p* |
< 0,001 |
< 0,001 | ||
Abreviaturas: IC = intervalo de confianza *valor de p se refiere a la comparación entre brazos
**En el brazo de ALIMTA/cisplatino, aleatorizados y tratados (n = 225) y con suplemento vitamínico completo (n = 167)
Usando la Escala de Síntomas del Cáncer de Pulmón se demostró una mejoría estadísticamente significativa de los síntomas clínicamente relevantes (dolor y disnea) asociados al mesotelioma pleural maligno en la rama de tratamiento con ALIMTA/Cisplatino (212 pacientes) frente a la rama de cisplatino en monoterapia (218 pacientes). También se observaron diferencias estadísticamente significativas en los tests de función pulmonar. La diferencia entre ambos brazos es debida a la mejoría de la función pulmonar en el brazo de ALIMTA/cisplatino combinado y al deterioro de la misma en el brazo control.
Los datos de los pacientes con mesotelioma pleural maligno tratados con ALIMTA como agente único son escasos. La dosis de ALIMTA de 500 mg/m2 en monoterapia fue estudiada en 64 pacientes diagnosticados de mesotelioma pleural maligno no tratados con quimioterapia previamente. La tasa de respuesta global fue 14,1 %.
CPNM, tratamiento en segunda línea:
Un estudio fase III, multicéntrico, aleatorizado, abierto que comparaba ALIMTA frente a docetaxel en pacientes diagnosticados de cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico tras tratamiento quimioterápico previo, demostró una mediana de supervivencia de 8,3 meses en los pacientes tratados con ALIMTA (Población por Intención de Tratar n = 283) y de 7,9 meses en los pacientes tratados con docetaxel (Población por Intención de Tratar n = 288). El tratamiento quimioterápico previo no incluía ALIMTA. Un análisis acerca de la influencia de la histología del CPNM sobre el efecto del tratamiento en la supervivencia global, fue favorable a ALIMTA frente a docetaxel salvo cuando la histología era predominantemente escamosa (n = 399; 9,3 frente a 8,0 meses, HR ajustado = 0,78; IC 95 % = 0,61 - 1,00, p = 0,047) y fue favorable a docetaxel para la histología del carcinoma celular escamoso (n = 172; 6,2 frente a 7,4 meses, HR ajustado = 1,56; IC del 95 % = 1,08 -2,26, p = 0,018). No se observaron diferencias clínicamente relevantes en el perfil de seguridad de ALIMTA entre los subgrupos histológicos.
Los datos clínicos limitados procedentes de otro ensayo fase III controlado sugieren que los datos de eficacia (supervivencia global, supervivencia libre de progresión) obtenidos para pemetrexed son similares entre los pacientes que habían sido tratados previamente con docetaxel (n = 41) y aquellos pacientes que no habían recibido tratamiento previo con docetaxel (n = 540).
Eficacia de ALIMTA vs docetaxel en CPNM en la Población por Intención de Tratar (ITT)
|
ALIMTA |
Docetaxel | |
|
Tiempo Supervivencia (meses) ■ Mediana (m) ■ 95 % IC para la mediana ■ HR ■ 95 % IC HR ■ No-inferioridad de valor p (HR) |
(n = 283) (7,0'-39,4) 0 (0,82 0, |
(n = 288) 7,9 (6,3 - 9,2) ,99 - 1,20) 226 |
|
Supervivencia libre progresión (meses) ■ Mediana ■ HR (95 % IC) |
(n = 283) (n = 288) 2,9 2,9 0,97 (0,82 - 1,16) | |
|
Tiempo hasta fracaso del tratamiento (meses) ■ Mediana ■ HR (95 % IC) |
(n = 283) (n = 288) 2,3 2,1 ’ 0,84 (0,71 - 0,997) ’ | |
|
Respuesta (n: cualificados para respuesta) ■ Tasa de respuesta (%) (95 % IC) ■ Enfermedad estable (%) |
(n = 264) 9,1 (5,9 - 13,2) 45,8 |
(n = 274) 8,8 (5,7 - 12,8) 46,4 |
Abreviaturas: IC: intervalo de confianza; HR: cociente de riesgo; ITT: por intención de tratar; n: tamaño población total
CPNM, tratamiento en primera línea:
En un ensayo fase III, multicéntrico, aleatorizado y abierto, en el que se comparaba ALIMTA más cisplatino frente a gemcitabina más cisplatino en pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico (fase IIIb o IV) no tratados previamente con quimioterapia, se observó que ALIMTA más cisplatino (Población por Intención de Tratar (ITT) n = 862) cumplía con la variable principal de eficacia y mostraba una eficacia clínica similar a gemcitabina más cisplatino (ITT n = 863) en términos de supervivencia global (cociente de riesgo ajustado 0,94; IC del 95 %: 0,84 - 1,05). Todos los pacientes incluidos en este ensayo presentaban un valor de 0 ó 1 en la escala ECOG.
El análisis principal de eficacia se realizó sobre la población ITT. Los análisis de sensibilidad de los parámetros principales de eficacia fueron también analizados en la población por protocolo (PP). Los resultados de los análisis de eficacia para la población PP son consistentes con los resultados obtenidos para la población ITT y avalan la no inferioridad de AC frente GC.
La supervivencia libre de progresión (SLP) y la tasa de respuesta global fueron similares entre los dos brazos de tratamiento; la mediana de SLP fue de 4,8 meses para ALIMTA más cisplatino frente a 5,1 meses para gemcitabina más cisplatino (cociente de riesgo ajustado 1,04; IC del 95 %: 0,94 - 1,15) y tasa de respuesta global del 30,6 % (IC del 95 %: 27,3 - 33,9) para ALIMTA más cisplatino frente al 28,2 % (IC del 95 % = 25,0 - 31,4) para gemcitabina más cisplatino. Los datos de SLP fueron parcialmente confirmados por una revisión independiente (400/1725 pacientes fueron selecccionados aleatoriamente para la revisión).
El análisis relativo a la influencia de la histología del CPNM sobre la supervivencia global demostró que existían diferencias clínicamente relevantes en supervivencia según la histología, ver la tabla incluida a continuación:
Eficacia de ALIMTA + cisplatino frente a gemcitabina + cisplatino en primera línea para cáncer de pulmón no microcítico - Población ITT y subgrupos histológicos
|
Población ITT y subgrupos histológicos |
Mediana de supervivencia global en meses (IC 95 %) |
Cociente de riesgo ajustado (HR) (IC 95 %) |
Superioridad valor de p | |||
|
ALIMTA + cisplatino |
Gemcitabina + cisplatino | |||||
|
Población ITT (N = 1725) |
10,3 (9,8 - 11,2) |
N = 862 |
10,3 (9,6 - 10,9) |
N = 863 |
0,94a (0,84 - 1,05) |
0,259 |
|
Adenocarcinoma (N = 847) |
12,6 (10,7 - 13,6) |
N = 436 |
10,9 (10,2 - 11,9) |
N = 411 |
0,84 (0,71 - 0,99) |
0,033 |
|
Células grandes (N = 153) |
10,4 (8,6 - 14,1) |
N = 76 |
6,7 (5,5 - 9,0) |
N = 77 |
0,67 (0,48 - 0,96) |
0,027 |
|
Otros (N = 252) |
8,6 (6,8 - 10,2) |
N = 106 |
9,2 (8,1 - 10,6) |
N = 146 |
1,08 (0,81 - 1,45) |
0,586 |
|
Células escamosas (N = 473) |
9,4 (8,4 - 10,2) |
N = 244 |
10,8 (9,5 - 12,1) |
N = 229 |
1,23 (1,00 - 1,51) |
0,050 |
Abreviaturas: IC: intervalo de confianza; ITT: por intención de tratar; n: tamaño población total a Estadísticamente significativo para no-inferioridad, con el intervalo de confianza completo para el HR bastante por debajo del margen de no inferioridad de 1,17645 (p< 0,001).
Gráficas de Kaplan Meier para supervivencia global por histología
«deno cano noma
Carcinoma de células grandes
Tiempo de supervivencia meses
Tiempo de supervivencia meses
No se observaron diferencias clínicamente significativas en cuanto al perfil de seguridad de ALIMTA más cisplatino entre los subgrupos histológicos.
Los pacientes tratados con ALIMTA más cisplatino requirieron un menor número de transfusiones (16,4 % frente a 28,9 %, p< 0,001), tanto de hematíes (16,1 % frente a 27,3 %, p< 0,001) como de plaquetas (1,8 % frente a 4,5 %, p = 0,002). Asimismo, estos pacientes necesitaron una menor administración de eritropoyetina/darbopoyetina (10,4 % frente a 18,1 %, p< 0,001), de G-CSF/GM-CSF (3,1 % frente a 6,1 %, p = 0,004) y de preparados de hierro (4,3 % frente a 7,0 %, p = 0,021).
CPNM, tratamiento de mantenimiento:
JMEN
Un estudio fase III multicéntrico, aleatorizado, doble ciego, controlado con placebo (JMEN), comparó la eficacia y seguridad del tratamiento de mantenimiento con ALIMTA junto con los mejores cuidados de soporte (MCS) (n = 441) frente a placebo más MCS (n = 222), en pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado (estadio IIIB) o metastásico (fase IV), que no hubieran progresado tras cuatro ciclos de tratamiento en primera línea con un doblete conteniendo Cisplatino o Carboplatino en combinación con Gemcitabina, Paclitaxel o Docetaxel. No se incluyó como tratamiento de primera linea ningún doblete con ALIMTA. Todos los pacientes incluidos en el estudio tenían un valor de 0 ó 1 en la escala ECOG. Los pacientes recibieron tratamiento de mantenimiento hasta progresión de la enfermedad. Los parámetros de eficacia y seguridad se midieron desde el momento de la aleatorización después de haber completado el tratamiento en primera línea (inducción). Los pacientes recibieron una mediana de 5 ciclos de tratamiento de mantenimiento con ALIMTA, y 3,5 ciclos de placebo. Un total de 213 pacientes (48,3 %) completaron > 6 ciclos, y un total de 103 pacientes (23,4 %) completaron > 10 ciclos de tratamiento con ALIMTA.
El estudio cumplió el parámetro principal de eficacia y mostró una mejora estadísticamente significativa en SLP en la rama de tratamiento con ALIMTA comparada con la rama de placebo (n = 581, población revisada de forma independiente; mediana de 4,0 meses y 2,0 meses, respectivamente) (cociente de riesgo = 0,60, IC 95 %= 0,49-0,73, p < 0,00001). La revisión independiente de las tomografías (TAC) de pacientes confirmó los hallazagos de la evaluación realizada por los investigadores sobre SLP. La mediana de la supervivencia global para la población global (n = 663) fue de 13,4 meses para la rama de ALIMTA y de 10,6 meses para la rama de placebo, con un cociente de riesgo = 0,79 (IC del 95 %=0,65-0,95, p = 0,01192).
Como ocurrió con otros estudios con ALIMTA, en el estudio JMEN se observó una diferencia en la eficacia de acuerdo con la histología del CPNM. Los pacientes con CPNM salvo aquellos que presentaban histología predominantemente de célula escamosa (n = 430, población revisada de forma independiente), presentaron una mediana de SLP de 4,4 meses para la rama de tratamiento con ALIMTA y 1,8 meses para la rama de placebo, cociente de riesgo = 0,47, IC (del 95 %: 0,37-0,60, p = 0,00001). La mediana de SG para los pacientes con CPNM salvo aquellos que presentaban histología predominantemente de célula escamosa (n = 481) fue de 15,5 meses para la rama de tratamiento con ALIMTA y 10,3 meses para la rama de placebo (cociente de riesgo = 0,70, IC 95 %= 0,56-0,88, p = 0,002). Incluyendo la fase de inducción, la mediana de SG para pacientes con CPNM salvo aquellos que presentaban histología predominantemente de célula escamosa fue de 18,6 meses para la rama de tratamiento con ALIMTA y de 13,6 meses para la rama de tratamiento con placebo cociente de riesgo = 0,71, (IC 95 %= 0,56-0,88,
p=0,002).
Los resultados de SLP y de SG en pacientes con histología de célula escamosa sugirieron que ALIMTA no ofrecía ninguna ventaja comparada con placebo.
No se observaron diferencias clínicamente relevantes en cuanto al perfil de seguridad de ALIMTA entre los distintos subgrupos histológicos.
JMEN: Gráficas de Kaplan Meier para supervivencia libre de progresión (SLP) y supervivencia global de ALIMTA frente a placebo en pacientes con CPNM salvo aquellos que presentaban histología predominantemente de célula escamosa:
Supervivencia libre de progresión
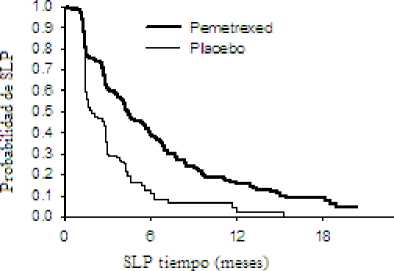
Supervivencia global
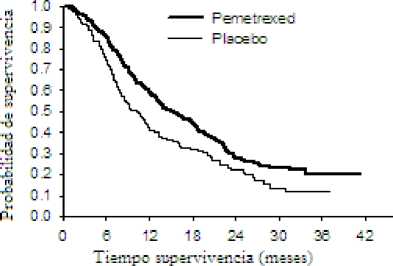
PARAMOUNT
En un estudio en fase 3, multicéntrico, aleatorizado, doble-ciego, controlado con placebo (PARAMOUNT) se comparó la seguridad y eficacia de la continuación del tratamiento de mantenimiento con ALIMTA más cuidados de soporte BSC (n = 359) con placebo más cuidados de soporte BSC (n = 180) en pacientes con CPNM localmente avanzado (Estadío IIIB) o metastásico (Estadío IV), salvo aquellos que presentaban histología predominantemente de célula escamosa que no progresaron tras 4 ciclos de una primera línea de terapia de combinación de ALIMTA con cisplatino. De los 939 pacientes tratados con ALIMTA más cisplatino en inducción, 539 pacientes fueron aleatorizados a recibir tratamiento de mantenimiento con pemetrexed o placebo. De los pacientes aleatorizados, 44,9 % tuvieron una respuesta completa/parcial y el 51,9 % tuvieron una respuesta de estabilización de la enfermedad a la inducción con ALIMTA más cisplatino. A los pacientes aleatorizados al tratamiento de mantenimiento, se les exigió tener un valor de 0 ó 1 en la escala ECOG. La mediana de tiempo, desde el comienzo de la terapia de inducción con ALIMTA más cisplatino hasta el comienzo del tratamiento de mantenimiento fue de 2,96 meses, tanto en el brazo de pemetrexed como en el brazo de placebo. Los pacientes aleatorizados, recibieron el tratamiento de mantenimiento hasta la progresión de la enfermedad. La eficacia y seguridad fueron medidas desde la aleatorización tras haber completado la primera línea terapéutica (inducción). Los pacientes recibieron una mediana de 4 ciclos de tratamiento de mantenimiento con ALIMTA y 4 ciclos de placebo. Un total de 169 pacientes (47,1 %) completaron > 6 ciclos de tratamiento de mantenimiento con ALIMTA, que representan al menos un total de 10 ciclos de ALIMTA.
El estudio alcanzó su variable primaria y demostró una mejora estadísticamente significativa de SLP en el brazo de ALIMTA, sobre el brazo de placebo (n =472, población revisada independientemente; mediana de 3,9 meses y 2,6 meses respectivamente) (cociente de riesgo = 0,64, IC 95% = 0,51-0,81, p = 0,0002). La revisión independiente de los escáneres de los pacientes, confirmó el hallazgo de la evaluación de los investigadores de SLP. Para los pacientes aleatorizados, medidos desde el comienzo del tratamiento de inducción de primera línea de ALIMTA más cisplatino, la mediana de SLP evaluada por los investigadores fue de 6,9 meses para el brazo de ALIMTA y de 5,6 meses para el brazo de placebo (cociente de riesgo = 0,59, 95% IC = 0,47-0,74). Tras la inducción de ALIMTA más cisplatino (4 ciclos), el tratamiento con ALIMTA fue estadísticamente superior a placebo para SG (mediana de 13,9 meses frente a 11,0 meses, cociente de riesgo = 0.78, IC 95% = 0,64-0,96, p= 0,0195). En el momento del análisis final de supervivencia, el 28,7% de los pacientes estaban vivos o se perdieron para el seguimiento en el brazo de ALIMTA frente al 21,7% en el brazo de placebo. El efecto relativo al tratamiento de ALIMTA fue internamente consistente entre los subgrupos (incluyendo estadío de la enfermedad, respuesta a la inducción, ECOG PS (Eastern Cooperative Oncology Group Performance status), hábito tabáquico, sexo, histología y edad) y fue similar a aquel observado en los análisis sin ajustar por SG y
SLP. Las tasas de supervivencia de 1 año y 2 años para pacientes tratados con ALIMTA fueron de un 58% y 32% respectivamente, comparado con el 45% y el 21% de los pacientes que recibieron placebo. Desde el inicio del tratamiento de inducción de primera línea de ALIMTA más cisplatino, la mediana de SG de los pacientes fue de 16,9 meses para el brazo de ALIMTA y de 14,0 meses para el brazo de placebo (cociente de riesgo =0,78, IC 95% =0,64-0,96). El porcentaje de pacientes que recibieron un tratamiento tras acabar el estudio fue del 64,3% para ALIMTA y 71,7% para placebo.
PARAMOUNT: Gráficas de Kaplan Meier para supervivencia libre de progresión (SLP) supervivencia global (SG) para la continuación del tratamiento de mantenimiento con ALIMTA frente placebo en pacientes con CPNM salvo aquéllos que presentaban histología predominantemente de célula escamosa (medida desde la aleatorización)
Supervivencia Global
Supervivencia libre de Progresión
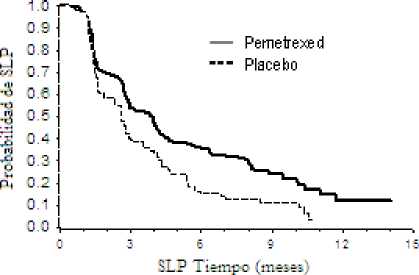
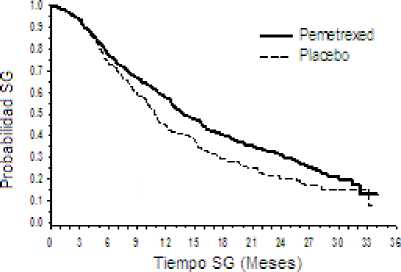
Los perfiles de seguridad del tratamiento de mantenimiento con ALIMTA derivados de los dos estudios JMEN y PARAMOUNT fueron similares.
5.2 Propiedades farmacocinéticas
Las propiedades farmacocinéticas de pemetrexed tras su administración como agente único, han sido evaluadas en 426 pacientes con cáncer, con diferentes tipos de tumores sólidos, con un intervalo de dosis desde 0,2 hasta 838 mg/m2 durante un período de perfusión de 10 minutos. El pemetrexed tiene un volumen de distribución en estado de equilibrio de 9 l/m2. Estudios in vitro indican que pemetrexed se une a proteínas plasmáticas en aproximadamente un 81 %. La unión a proteínas plasmáticas no se ve afectada de manera notable por los diferentes grados de disfunción renal. El pemetrexed sufre un escaso metabolismo hepático. El pemetrexed es principalmente eliminado por vía urinaria; entre un 70 % y un 90 % de la dosis administrada se recupera inalterada en orina en las primeras 24 horas tras su administración. Estudios in vitro indican que pemetrexed se secreta de forma activa por el TAO3 (transportador de aniones orgánicos). El aclaramiento sistémico total de pemetrexed es de 91,8 ml/min y la vida media de eliminación del plasma es de 3,5 horas en pacientes con función renal normal (aclaramiento de creatinina de 90 ml/min). La variabilidad del aclaramiento entre pacientes es moderada (19,3 %). El área bajo la curva de pemetrexed (AUC) y la concentración máxima en plasma, aumentan proporcionalmente con la dosis. Las propiedades farmacocinéticas de pemetrexed permanecen durante múltiples ciclos de tratamiento.
Las propiedades farmacocinéticas de pemetrexed no se ven influenciadas por la administración concomitante de cisplatino. Los suplementos con ácido fólico oral y vitamina B12 intramuscular no afectan a la farmacocinética de pemetrexed.
5.3 Datos preclínicos sobre seguridad
La administración de pemetrexed a ratones preñados resultó en una disminución de la viabilidad fetal, disminución del peso fetal y osificación incompleta de algunas estructuras óseas incluyendo el paladar hendido.
La administración de pemetrexed en ratones macho resultó en toxicidad sobre la función reproductiva caracterizada por una tasa de fertilidad reducida y atrofia testicular. En un estudio llevado a cabo durante 9 meses en perros de raza beagle tratados con inyección intravenosa en bolus, se han observado alteraciones testiculares (degeneración/ necrosis del epitelio seminífero). Esto sugiere que el pemetrexed puede alterar la fertilidad masculina. No se ha investigado la fertilidad en mujeres.
El pemetrexed no ha demostrado ser mutagénico ni en el test in vitro de aberración cromosómica en células ováricas de hamster chino, ni en el test de Ames. El pemetrexed ha demostrado ser clastogénico en el test in vivo de micronúcleo en ratones.
No se han realizado estudios de valoración del potencial carcinogénico de pemetrexed.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Manitol
Ácido clorhídrico Hidróxido de sodio
6.2 Incompatibilidades
El pemetrexed es físicamente incompatible con diluyentes que contengan calcio, incluyendo el Ringer lactato para inyección y el Ringer para inyección. En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
Viales sin abrir 3 años.
Solución reconstituida y solución para perfusión:
Cuando la solución se prepara según las indicaciones dadas, las soluciones reconstituidas y para perfusión de ALIMTA no contienen conservantes antimicrobianos. Se ha demostrado que la estabilidad química y física en uso de las soluciones de pemetrexed, reconstituida y para perfusión, es de 24 horas en refrigeración. Desde un punto de vista microbiológico, el medicamento se debe usar inmediatamente tras su reconstitución. Si no se utiliza inmediatamente, el tiempo y las condiciones de conservación son responsabilidad del usuario y no deberían ser mayores de 24 horas a una temperatura de 2 °C a 8 °C.
6.4 Precauciones especiales de conservación
Viales sin abrir:
Este medicamento no requiere ninguna condición especial de conservación.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de vidrio Tipo I con tapón de goma que contiene 500 mg de pemetrexed.
Envase con 1 vial.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
1. Usar técnicas asépticas durante la reconstitución y posterior dilución de pemetrexed para su administración mediante perfusión intravenosa.
2. Calcular la dosis y el número de viales de ALIMTA necesarios. Cada vial contiene un exceso de pemetrexed para facilitar la administración de la cantidad nominal necesaria.
3. Reconstituir los viales de 500 mg con 20 ml de solución de cloruro de sodio para inyección al 0,9 % (9 mg/ml), sin conservantes obteniendo una solución que contiene 25 mg/ml de pemetrexed. Agitar cuidadosamente el vial hasta que el polvo esté completamente disuelto. La solución resultante es transparente con un rango de color que puede variar desde incoloro a amarillo o amarillo-verdoso sin que esto afecte de forma negativa a la calidad del producto. El pH de la solución reconstituida está entre 6,6 y 7,8. Se requiere dilución posterior.
4. Se debe diluir el volumen apropiado de la solución reconstituida de pemetrexed hasta 100 ml con solución para inyección de cloruro de sodio al 0,9 % (9 mg/ml) sin conservantes y administrada como perfusión intravenosa durante 10 minutos.
5. La solución de pemetrexed para perfusión preparada según las indicaciones anteriormente descritas es compatible con los sistemas y bolsas de infusión de cloruro de polivinilo y poliolefina.
6. Los medicamentos para administración parenteral deben ser inspeccionados visualmente previamente a su administración, para descartar la aparición de partículas o alteración del color. Si se observan partículas no se debe administrar el medicamento.
7. Las soluciones de pemetrexed son para un solo uso. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Precauciones en la preparación y administración: Como cualquier otro agente antineoplásico potencialmente tóxico, se debe poner especial cuidado en el manejo y preparación de las soluciones de pemetrexed para perfusión. Se recomienda el uso de guantes para su manejo. Si las soluciones de pemetrexed entran en contacto con la piel, se debe lavar la piel inmediatamente y abundantemente con agua y jabón. Si las soluciones de pemetrexed entran en contacto con mucosas, lavar con agua abundante. Pemetrexed no es un fármaco vesicante. No existe un antídoto específico para la extravasación de pemetrexed. Se han comunicado algunos casos de extravasación de pemetrexed, los cuales no fueron valorados como graves por el investigador. La extravasación debe ser tratada según la práctica clínica habitual con otros fármacos no vesicantes.
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Países Bajos
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/290/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20 Septiembre 2004 Fecha de la última revalidación: 20 Septiembre 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA) http://www.ema.europa.eu/.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Nombre y dirección del fabricante responsable de la liberación de los lotes
Lilly France S.A.S.
2 rue du Colonel Lilly 67640 Fegersheim Francia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sistema de Farmacovigilancia
El Titular de la Autorización de Comercialización (TAC) debe asegurar que el Sistema de Farmacovigilancia, presentado en el Módulo 1.8.1 de la Autorización de Comercialización, esté instaurado y en funcionamiento antes de que el medicamento se comercialice y durante el tiempo que permanezca en el mercado.
Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades de farmacovigilancia detalladas en el Plan de Farmacovigilancia, de acuerdo con la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y cualquier actualización posterior del PGR acordada por el Comité de Medicamentos de Uso Humano (CHMP).
De acuerdo con la directriz del CHMP sobre Sistemas de Gestión de Riesgos para medicamentos de uso humano, el PGR actualizado se debe presentar junto con el siguiente Informe Periódico de Seguridad (IPS).
Además, se debe presentar un PGR actualizado:
• Cuando se reciba nueva información que pueda afectar a las especificaciones de seguridad vigentes, al Plan de Farmacovigilancia o las actividades de minimización de riesgos
• Dentro de los 60 días posteriores a la consecución de un hito importante (farmacovigilancia o minimización de riesgos)
• A petición de la Agencia Europea de Medicamentos.
IPSs
El ciclo de IPS para el medicamento debe seguir un ciclo anual, hasta que el CHMP acuerde algo distinto.
• CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
No procede.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
ALIMTA 100 mg polvo para concentrado para solución para perfusión pemetrexed
2. PRINCIPIO(S) ACTIVO(S)_
Cada vial contiene 100 mg de pemetrexed (como pemetrexed disódico).
Después de la reconstitución (ver prospecto), cada vial contiene 25 mg/ml de pemetrexed.
3. LISTA DE EXCIPIENTES
Manitol, ácido clorhídrico, hidróxido de sodio (para mayor información consultar el prospecto).
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo para concentrado para solución para perfusión. 1 vial
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Para usar sólo una vez.
Para vía intravenosa después de reconstitución y dilución. Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Leer el prospecto para el período de validez del producto reconstituido.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Desechar apropiadamente el contenido que no se haya usado.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/290/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ETIQUETA DEL VIAL
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
ALIMTA 100 mg polvo para concentrado para solución para perfusión
pemetrexed
Vía intravenosa.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
Leer el prospecto para el período de validez del producto reconstituido.
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
100 mg
6. OTROS
1. NOMBRE DEL MEDICAMENTO
ALIMTA 500 mg polvo para concentrado para solución para perfusión pemetrexed
2. PRINCIPIO(S) ACTIVO(S)_
Cada vial contiene 500 mg de pemetrexed (como pemetrexed disódico).
Después de la reconstitución (ver prospecto), cada vial contiene 25 mg/ml de pemetrexed.
3. LISTA DE EXCIPIENTES
Manitol, ácido clorhídrico, hidróxido de sodio (para mayor información consultar el prospecto).
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo para concentrado para solución para perfusión. 1 vial
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Para usar sólo una vez.
Para vía intravenosa después de reconstitución y dilución. Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Leer el prospecto para el período de validez del producto reconstituido.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Desechar apropiadamente el contenido que no se haya usado.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/290/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ETIQUETA DEL VIAL
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
ALIMTA 500 mg polvo para concentrado para solución para perfusión
pemetrexed
Vía intravenosa.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
Leer el prospecto para el período de validez del producto reconstituido.
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
500 mg
6. OTROS
ALIMTA 100 mg polvo para concentrado para solución para perfusión ALIMTA 500 mg polvo para concentrado para solución para perfusión
pemetrexed
Lea todo el prospecto detenidamente antes de empezar a recibir este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en éste prospecto.
Contenido del prospecto
1. Qué es ALIMTA y para qué se utiliza
2. Qué necesita saber antes de usar ALIMTA
3. Cómo usar ALIMTA
4. Posibles efectos adversos
5. Conservación de ALIMTA
6. Contenido del envase e información adicional
1. QUÉ ES ALIMTA Y PARA QUÉ SE UTILIZA
ALIMTA es un medicamento usado para el tratamiento del cáncer.
ALIMTA se puede administrar junto con cisplatino, otro medicamento anticanceroso, como tratamiento para el mesotelioma pleural maligno, una forma de cáncer que afecta a la mucosa del pulmón, a pacientes que no han recibido quimioterapia previa.
ALIMTA también se puede administrar, junto con cisplatino, para el tratamiento inicial de pacientes en estadíos avanzados de cáncer de pulmón.
Alimta se le puede prescribir si tiene cáncer de pulmón en un estadío avanzado, si su enfermedad ha respondido al tratamiento o si permanece inalterada tras la quimioterapia inicial.
ALIMTA también se puede administrar para el tratamiento de aquellos pacientes en estadíos avanzados de cáncer de pulmón cuya enfermedad ha progresado, que ya han recibido otro tratamiento inicial de quimioterapia.
2. QUÉ NECESITA SABER ANTES DE USAR ALIMTA No use ALIMTA:
- si es alérgico (hipersensible) a pemetrexed o a cualquiera de los demás componentes de ALIMTA (incluidos en la sección 6).
- si está dando el pecho, debe interrumpir la lactancia durante el tratamiento con ALIMTA.
- si le han administrado recientemente la vacuna contra la fiebre amarilla o se la van a administrar.
Advertencias y precauciones
Consulte a su médico o farmacéutico de hospital antes de que le administren ALIMTA.
Si ha tenido o tiene problemas de riñón dígaselo a su médico o al farmacéutico del hospital ya que cabe la posibilidad de que no pueda recibir ALIMTA.
Antes de cada perfusión tendrá que dar muestras de su sangre para evaluar si la función renal y hepática es suficiente y para evaluar si tiene suficientes células sanguíneas para recibir ALIMTA. Su médico puede decidir cambiar su dosis o retrasar el tratamiento dependiendo de su estado general y de si el recuento de sus células sanguíneas es demasiado bajo. Si está usted recibiendo además cisplatino, su médico se asegurará de que está correctamente hidratado y recibirá el tratamiento apropiado antes y después de recibir cisplatino para prevenir el vómito.
Si ha recibido o va a recibir radioterapia, por favor consulte con su médico, ya que se puede producir una reacción precoz o tardía entre la radiación y ALIMTA.
Si usted se ha vacunado recientemente, por favor consulte con su médico, dado que es posible que esta pueda causar algún efecto negativo con ALIMTA.
Si tiene una enfermedad del corazón o historia previa de enfermedad de corazón, por favor consulte con su médico.
Si tiene líquido acumulado alrededor del pulmón, su médico puede decidir extraer el fluido antes de administrarle ALIMTA.
Niños y adolescentes
No se dispone de datos relevantes del uso de ALIMTA en la población pediátrica.
Uso de ALIMTA con otros medicamentos
Informe a su médico si está utilizando medicamentos para el dolor o la inflamación (hinchazón), tales como los medicamentos denominados “medicamentos antiinflamatorios no esteroideos” (AINEs), incluyendo los adquiridos sin receta (como ibuprofeno). Hay muchas clases de AINEs con duración de acción diferente. Basándose en la fecha en la que le corresponde su perfusión de ALIMTA y/o el estado de su función renal, su médico le aconsejará qué medicamentos puede utilizar y cuándo puede hacerlo. Si no está seguro, consulte con su médico o farmacéutico por si algún medicamento que esté tomando es un AINE.
Informe a su médico o al farmacéutico del hospital si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta.
Embarazo, lactancia y fertilidad Embarazo
Si usted está embarazada, piensa quedarse embarazada o cree que pudiera estarlo, informe a su médico. Durante el embarazo debe evitarse el uso de ALIMTA. Su médico le informará de los posibles riesgos de tomar ALIMTA durante el embarazo. Las mujeres deben emplear métodos anticonceptivos eficaces durante el tratamiento con ALIMTA.
Lactancia
Si usted está dando el pecho, informe a su médico.
Durante el tratamiento con ALIMTA se debe interrumpir la lactancia.
Fertilidad
Se advierte a los pacientes varones, que no engendren un hijo durante y hasta 6 meses después del tratamiento con ALIMTA, y por tanto, deben utilizar métodos anticonceptivos efectivos durante y hasta 6 meses después del tratamiento con ALIMTA. Si desea tener un hijo durante el tratamiento o en los 6
meses siguientes tras haber recibido el tratamiento, pida consejo a su médico o farmacéutico. Es posible que desee solicitar información sobre conservación de esperma antes de comenzar su tratamiento.
Conducción y uso de máquinas
Puede que ALIMTA haga que se sienta cansado. Tenga cuidado cuando conduzca un vehículo o use máquinas.
ALIMTA contiene sodio
ALIMTA 500 mg contiene aproximadamente 54 mg de sodio por vial. Esto ha de tenerse en cuenta en pacientes con dietas pobres en sodio.
ALIMTA 100 mg contiene aproximadamente 11 mg de sodio por vial.
3. CÓMO USAR ALIMTA
La dosis de ALIMTA es de 500 miligramos por cada metro cuadrado de la superficie de su cuerpo. Le medirán la altura y el peso para calcular cuál es su superficie corporal. Su médico usará esta superficie para calcular la dosis correcta para usted. Esta dosis puede ajustarse o el tratamiento puede retrasarse dependiendo de su recuento de células sanguíneas y de su estado general. El farmacéutico del hospital, la enfermera o el médico habrá mezclado el polvo de ALIMTA con una solución de cloruro de sodio para inyección de 9 mg/ml (0,9 %), antes de que se le administre.
Usted siempre recibirá ALIMTA mediante una perfusión (gotero) en una de sus venas. La perfusión durará al menos 10 minutos.
Cuando use ALIMTA en combinación con cisplatino:
El médico o el farmacéutico del hospital calcularán cual es la dosis que usted necesita basándose en su altura y en su peso. El cisplatino también se administra mediante perfusión en una de sus venas y se da aproximadamente 30 minutos después de que haya terminado la perfusión de ALIMTA. La perfusión de cisplatino dura aproximadamente dos horas.
Normalmente debe recibir su perfusión una vez cada tres semanas.
Medicación adicional:
Corticosteroides: su médico le prescribirá unos comprimidos de esteroides (equivalentes a 4 miligramos de dexametasona dos veces al día) que tendrá que tomar el día anterior, el mismo día y el día siguiente al tratamiento con ALIMTA. Su médico le da este medicamento para reducir la frecuencia y la gravedad de las reacciones cutáneas que puede experimentar durante su tratamiento para el cáncer.
Suplemento vitamínico: su médico le prescribirá ácido fólico oral (vitamina) o un complejo multivitamínico que contenga ácido fólico (350 a 1.000 microgramos) y que debe tomar una vez al día mientras está tomando ALIMTA. Debe tomar por lo menos cinco dosis durante los siete días anteriores a la primera dosis de ALIMTA. Debe continuar tomando ácido fólico durante 21 días después de la última dosis de ALIMTA. Además recibirá una inyección de vitamina B12 (1.000 microgramos) en la semana anterior a la administración de ALIMTA y después aproximadamente cada 9 semanas (correspondientes a 3 ciclos del tratamiento con ALIMTA). La vitamina B12 y el ácido fólico se le dan para reducir los posibles efectos tóxicos del tratamiento para el cáncer.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
4. POSIBLES EFECTOS ADVERSOS
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Debe informar a su médico inmediatamente si usted nota algunos de los siguientes síntomas:
■ Fiebre o infección (frecuentes): si usted tiene una temperatura de 38 °C o superior, sudoración u otros signos de infección (ya que usted podría tener menos células blancas de lo normal, lo cual es muy frecuente). Las infecciones (sepsis) pueden ser graves y causar la muerte.
■ Si comienza a sentir dolor en el pecho (frecuente) o el ritmo del corazón es más rápido (poco frecuente).
■ Si tiene dolor, enrojecimiento, hinchazón o llagas en la boca (muy frecuentes).
■ Reacción alérgica: si desarrolla sarpullido (muy frecuente), sensación de quemazón o picor (frecuentes), o fiebre (frecuente). En raras ocasiones las reacciones de la piel pueden ser graves y pueden causar la muerte. Contacte con su médico si usted presenta erupción grave, picor o aparición de ampollas (síndrome de Stevens-Johnson o necrolisis epidérmica tóxica).
■ Si se siente cansado o mareado, si le falta la respiración o está pálido (debido a que usted tiene menos hemoglobina de lo normal, lo cual es muy frecuente).
■ Si experimenta sangrado de las encías, nariz o boca o cualquier sangrado que no cesa, orina roja o rosa o hematomas inesperados (debido a que usted tiene menos plaquetas de lo normal, lo cual es muy frecuente).
■ Si experimenta dificultad para respirar de forma repentina, dolor intenso en el pecho o tos con sangre en el esputo (poco frecuentes) (puede indicar que haya un coágulo de sangre en las venas de los pulmones).
La frecuencia de posibles efectos adversos que aparecen listados a continuación se definen de la siguiente forma:
Muy frecuentes (pueden afectar a más de 1 de cada 10 pacientes)
Frecuentes (pueden afectar entre 1 y 10 de cada 100 pacientes)
Poco frecuentes (pueden afectar entre 1 y 10 de cada 1.000 pacientes)
Raros (pueden afectar entre 1 y 10 de cada 10.000 pacientes)
Muy raros (pueden afectar a menos de 1 de cada 10.000 pacientes)
Los efectos adversos con ALIMTA pueden incluir:
Muy frecuentes
Recuento bajo de células blancas de la sangre Niveles bajos de hemoglobina (anemia)
Recuento bajo de plaquetas
Diarrea
Vómitos
Dolor, enrojecimiento, hinchazón o llagas en la boca Náuseas
Pérdida de apetito Astenia (cansancio)
Erupción en la piel
Pérdida de cabello
Estreñimiento
Pérdida de sensibilidad
Riñón: alteraciones en los análisis de sangre
Frecuentes
Reacción alérgica: sarpullido / sensación de quemazón o picor
Infección incluyendo sepsis
Fiebre
Deshidratación Fallo renal
Irritación de la piel y picores Dolor en el pecho Debilidad muscular Conjuntivitis (inflamación ocular)
Estómago revuelto Dolor en el abdomen Alteraciones en el sentido del gusto Hígado: alteraciones en los análisis de sangre Ojos llorosos
Poco frecuentes
Fallo renal agudo
Aceleración del ritmo del corazón
Inflamación de la mucosa del esófago (garganta) tras la combinación de ALIMTA y radioterapia Colitis (inflamación de la mucosa del intestino grueso, que puede estar acompañada de sangrado intestinal o rectal)
Neumonitis intersticial (endurecimiento de las paredes de los alveolos pulmonares)
Edema (exceso de líquido en los tejidos corporales que provoca hinchazón)
Algunos pacientes han experimentado un infarto, una embolia o “pequeña embolia” mientras recibían ALIMTA, normalmente en combinación con otro tratamiento anticancerígeno Pancitopenia: combinación de un bajo recuento de glóbulos blancos, glóbulos rojos y plaquetas Neumonitis por radiación (cicatrización de los sacos de aire del pulmón asociado a la radioterapia) puede ocurrir en pacientes que están siendo tratados con radiación bien antes, durante o tras su tratamiento con ALIMTA
Se ha notificado dolor en las extremidades, baja temperatura y cambios en la coloración de la piel Coágulos de sangre en las venas de los pulmones (embolia pulmonar)
Raras
Toxicidad cutánea tardía (erupción cutánea parecida a una quemadura solar grave) que puede aparecer en la piel que ha sido previamente expuesta a radiaciones, desde días a años después de dicha radiación Trastornos bullosos (enfermedades con formación de ampollas en la piel) incluyendo el Síndrome de Stevens-Johnson y Necrólisis epidérmica tóxica
Anemia hemolítica inmunoinducida (destrucción de los glóbulos rojos por anticuerpos)
Hepatitis (inflamación del hígado)
Shock anafiláctico (reacción alérgica grave)
Puede padecer alguno de estos síntomas y/o situaciones. Debe avisar a su médico tan pronto como comience a experimentar cualquiera de estos efectos adversos.
Si está preocupado por algún efecto adverso, consulte con su médico.
Si experimenta cualquier efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.
5. CONSERVACIÓN DE ALIMTA
Mantener fuera del alcance y de la vista de los niños.
No usar después de la fecha de caducidad que aparece en el envase.
Este medicamento no requiere ninguna condición especial de conservación.
Solución reconstituida y de perfusión: el medicamento debe usarse inmediatamente. Cuando se prepara como se ha indicado, la estabilidad química y física en uso de la solución reconstituida y de la de perfusión es de 24 horas en refrigeración.
Este medicamento es para un solo uso. La solución no usada debe desecharse de acuerdo con los requerimientos locales.
6. CONTENIDO DEL ENVASE E INFORMACIÓN ADICIONAL Composición de ALIMTA
El principio activo es pemetrexed.
ALIMTA 100 mg: Cada vial contiene 100 mg de pemetrexed (como pemetrexed disódico)
ALIMTA 500 mg: Cada vial contiene 500 mg de pemetrexed (como pemetrexed disódico)
Después de la reconstitución, la solución contiene 25 mg/ml de pemetrexed. Antes de la administración se requiere que el profesional sanitario realice otra dilución.
Los demás componentes son manitol, ácido clorhídrico e hidróxido de sodio.
Aspecto del producto y contenido del envase
ALIMTA es un polvo para concentrado para solución para perfusión en un vial. Es un polvo liofilizado de color blanco a amarillo pálido o amarillo verdoso. Cada envase de ALIMTA contiene un vial.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht Países Bajos
Responsable de la fabricación:
Lilly France S.A.S. rue du Colonel Lilly F-67640, Fegersheim Francia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84 Etarapun
Tn "Enu Runu HegepnaHg" E.B. - Etarapua Tea. + 359 2 491 41 40 Ceská republika ELI LILLY CR, s.r.o.
Tel: + 420 234 664 111 Danmark
Eli Lilly Danmark A/S
Tlf: +45 45 26 60 00
Deutschland
Lilly Deutschland GmbH
Tel. + 49-(0) 6172 273 2222
Eesti
Eli Lilly Holdings Limited Eesti filiaal
Tel: +372 6 817 280
EkXáda
OAPMAIEPB-AIAAY A.E.B.E.
Tp^: +30 210 629 4600
España
Lilly S.A.
Tel: + 34-91-663 50 00 France
Lilly France SAS
Tél: +33-(0) 1 55 49 34 34
Hrvatska
Eli Lilly Hrvatska d.o.o.
Tel: +385 1 2350 999 Ireland
Eli Lilly and Company (Ireland) Limited
Tel: + 353-(0) 1 661 4377
Ísland
Icepharma hf.
Sími + 354 540 8000 Italia
Eli Lilly Italia S.p.A.
Tel: + 39- 055 42571 Kúnpoq Phadisco Ltd TpT.: +357 22 715000 Latvija
Eli Lilly Holdings Limited parstavmeciba Latvija Tel: +371 6 7364000
Lietuva
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600 Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100 Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500 Nederland
Eli Lilly Nederland B.V.
Tel: + 31-(0) 30 60 25 800 Norge
Eli Lilly Norge A.S.
Tlf: + 47 22 88 18 00
Osterreich
Eli Lilly Ges.m.b.H.
Tel: + 43-(0) 1 711 780 Polska
Eli Lilly Polska Sp. z o.o.
Tel.: +48 (0) 22 440 33 00 Portugal
Lilly Portugal Produtos Farmacéuticos, Lda
Tel: + 351-21-4126600
Romania
Eli Lilly Romania S.R.L.
Tel: + 40 21 4023000 Slovenija
Eli Lilly farmacevtska druzba, d.o.o.
Tel: +386 (0)1 580 00 10 Slovenská republika
Eli Lilly Slovakia, s.r.o.
Tel: + 421 220 663 111 Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 Sverige
Eli Lilly Sweden AB
Tel: + 46-(0) 8 7378800
United Kingdom
Eli Lilly and Company Limited
Tel: + 44-(0) 1256 315000
Este prospecto ha sido aprobado en
Esta información está destinada únicamente a médicos o profesionales del sector sanitario: Instrucciones de uso y manipulación y eliminación
1. Use técnicas asépticas durante la reconstitución y posterior dilución de pemetrexed para su administración mediante perfusión intravenosa.
2. Calcule la dosis y el número de viales de ALIMTA necesarios. Cada vial contiene un exceso de pemetrexed para facilitar la administración de la cantidad nominal necesaria.
3. ALIMTA 100 mg:
Reconstituya cada vial de 100 mg con 4,2 ml de una solución para inyección de cloruro de sodio al 0,9 % (9 mg/ml), sin conservantes para obtener una solución que contenga 25 mg/ml de pemetrexed. ALIMTA 500 mg:
Reconstituya cada vial de 500 mg con 20 ml de una solución para inyección de cloruro de sodio al 0,9 % (9 mg/ml), sin conservantes para obtener una solución que contenga 25 mg/ml de pemetrexed.
Agitar cuidadosamente el vial hasta que el polvo este completamente disuelto. La solución resultante es transparente con un rango de color que puede variar desde incoloro a amarillo o amarillo-verdoso sin que esto afecte de forma negativa a la calidad del producto. El pH de la solución reconstituida está entre 6,6 y 7,8. Se requiere dilución posterior.
4. Se debe diluir el volumen apropiado de la solución reconstituida de pemetrexed hasta 100 ml con una solución para inyección de cloruro de sodio al 0,9 % (9 mg/ml) sin conservantes y debe administrarse como perfusión intravenosa durante 10 minutos.
5. La solución de pemetrexed para perfusión preparada según las indicaciones anteriormente descritas es compatible con los sistemas y las bolsas de infusión de cloruro de polivinilo y poliolefina. Pemetrexed es incompatible con diluyentes que contengan calcio, incluyendo el Ringer lactato para inyección y el Ringer para inyección.
6. Los medicamentos para administración parenteral deben ser inspeccionados visualmente previamente a su administración, para descartar la aparición de partículas o alteración del color. Si se observan partículas no se debe administrar el medicamento.
7. Las soluciones de pemetrexed son para un solo uso. Se debe desechar el medicamento y el material no utilizado según los requisitos locales.
Precauciones en la preparación y administración: Como cualquier otro agente antineoplásico potencialmente tóxico, se debe poner especial cuidado en el manejo y preparación de las soluciones de pemetrexed para perfusión. Se recomienda el uso de guantes para su manejo. Si las soluciones de pemetrexed entran en contacto con la piel, se debe lavar la piel inmediatamente y abundantemente con agua y jabón. Si las soluciones de pemetrexed entran en contacto con mucosas, lavar con agua abundante. Pemetrexed no es un fármaco vesicante. No existe un antídoto específico para la extravasación de pemetrexed. Se han comunicado algunos casos de extravasación de pemetrexed, los cuales no fueron valorados como serios por el investigador. La extravasación debe ser tratada según la práctica clínica habitual con otros fármacos no vesicantes.
70