Afinitor 10 Mg Comprimidos
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Afinitor 2,5 mg comprimidos Afinitor 5 mg comprimidos Afinitor 10 mg comprimidos
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Afinitor 2,5 mg comprimidos
Cada comprimido contiene 2,5 mg de everolimus.
Excipiente con efecto conocido:
Cada comprimido contiene 74 mg de lactosa.
Afinitor 5 mg comprimidos
Cada comprimido contiene 5 mg de everolimus.
Excipiente con efecto conocido:
Cada comprimido contiene 149 mg de lactosa.
Afinitor 10 mg comprimidos
Cada comprimido contiene 10 mg de everolimus.
Excipiente con efecto conocido:
Cada comprimido contiene 297 mg de lactosa.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido.
Afinitor 2,5 mg comprimidos
Comprimidos alargados, blancos a ligeramente amarillos, con un borde biselado y sin ranura, con la inscripción «LCL» en una cara y «NVR» en la otra.
Afinitor 5 mg comprimidos
Comprimidos alargados, blancos a ligeramente amarillos, con un borde biselado y sin ranura, con la inscripción «5» en una cara y «NVR» en la otra.
Afinitor 10 mg comprimidos
Comprimidos alargados, blancos a ligeramente amarillos, con un borde biselado y sin ranura, con la inscripción «UHE» en una cara y «NVR» en la otra.
DATOS CLÍNICOS
4.
4.1 Indicaciones terapéuticas
Cáncer de mama avanzado con receptor hormonal positivo
Afinitor está indicado para el tratamiento del cáncer de mama avanzado, con receptor hormonal positivo, HER2/neu negativo, en combinación con exemestano, en mujeres postmenopáusicas que no tengan una enfermedad visceral sintomática, después de recurrencia o progresión a un inhibidor de la aromatasa no esteroideo.
Tumores neuroendocrinos de origen pancreático
Afinitor está indicado para el tratamiento de tumores neuroendocrinos de origen pancreático no resecables o metastásicos bien o moderadamente diferenciados en pacientes adultos con enfermedad en progresión.
Tumores neuroendocrinos de origen gastrointestinal o pulmonar
Afinitor está indicado para el tratamiento de tumores neuroendocrinos de origen gastrointestinal o pulmonar no funcionantes, no resecables o metastásicos, bien diferenciados (Grado 1 o Grado 2), en pacientes adultos con enfermedad en progresión (ver las secciones 4.4 y 5.1).
Carcinoma de células renales
Afinitor está indicado para el tratamiento de pacientes con carcinoma de células renales avanzado, en los que la enfermedad ha progresado durante o después del tratamiento con una terapia dirigida al factor de crecimiento del endotelio vascular (VEGF).
4.2 Posología y forma de administración
El tratamiento con Afinitor deberá iniciarlo y supervisarlo un médico con experiencia en el uso de tratamientos contra el cáncer.
Posología
Para las diferentes pautas posológicas Afinitor está disponible como comprimidos de 2,5 mg, 5 mg y 10 mg.
La dosis recomendada es de 10 mg de everolimus una vez al día. Deberá continuarse el tratamiento mientras se observe beneficio clínico o hasta que se presente una toxicidad inaceptable.
Si el paciente olvida tomar una dosis, no debe tomar una dosis adicional, sino tomar la siguiente dosis prescrita según la pauta habitual.
Ajuste de dosis debida a reacciones adversas
El tratamiento de las reacciones adversas sospechadas graves y/o no tolerables puede precisar una reducción de la dosis y/o una interrupción temporal del tratamiento con Afinitor. Normalmente, no es preciso un ajuste de dosis para reacciones adversas de Grado 1. Si se necesita una reducción de la dosis, la dosis recomendada es de 5 mg al día y no debe reducirse por debajo de 5 mg diarios.
Tabla 1 Recomendaciones para el ajuste de la dosis
|
Reacción adversa |
Gravedad1 |
Ajuste de dosis de Afinitor |
|
Neumonitis no infecciosa |
Grado 2 |
Considerar la interrupción del tratamiento hasta que mejoren los síntomas a Grado < 1. Reiniciar el tratamiento a la dosis de 5 mg al día. Interrumpir el tratamiento si no se consigue una recuperación en 4 semanas. |
|
Grado 3 |
Interrumpir el tratamiento hasta que los síntomas pasen a Grado <1. Considerar el reinicio del tratamiento a la dosis de 5 mg al día. Si la toxicidad recurre a Grado 3, se debe considerar la interrupción del tratamiento. | |
|
Grado 4 |
Interrumpir el tratamiento. | |
|
Estomatitis |
Grado 2 |
Interrupción temporal de la dosis hasta la recuperación a Grado <1. Reiniciar el tratamiento a la misma dosis. Si la estomatitis recurre a Grado 2, interrumpir la dosis hasta la recuperación a Grado <1. Reiniciar el tratamiento a la dosis de 5 mg al día. |
|
Grado 3 |
Interrupción temporal de la dosis hasta la recuperación a Grado <1. Reiniciar el tratamiento a la dosis de 5 mg al día. | |
|
Grado 4 |
Interrumpir el tratamiento. | |
|
Otras toxicidades no hematológicas (excluyendo eventos metabólicos) |
Grado 2 |
Si la toxicidad es tolerable, no se requiere ajuste de dosis. Si la toxicidad se vuelve intolerable, interrumpir temporalmente la dosis hasta la recuperación a Grado <1. Reiniciar el tratamiento a la misma dosis. Si la toxicidad recurre a Grado 2, interrumpir el tratamiento hasta la recuperación a Grado <1. Reiniciar el tratamiento a la dosis de 5 mg al día. |
|
Grado 3 |
Interrupción temporal de la dosis hasta la recuperación a Grado <1. Considerar reiniciar el tratamiento a la dosis de 5 mg al día. Si la toxicidad recurre a Grado 3, considerar la interrupción. | |
|
Grado 4 |
Interrumpir el tratamiento. | |
|
Eventos metabólicos (pej.: hiperglucemia, dislipidemia) |
Grado 2 |
No se requiere ajuste de dosis. |
|
Grado 3 |
Interrupción temporal de la dosis. Reiniciar el tratamiento a la dosis de 5 mg al día. | |
|
Grado 4 |
Interrumpir el tratamiento. | |
|
Trombocitopenia |
Grado 2 (<75, >50x109/l) |
Interrupción temporal de la dosis hasta la recuperación a Grado <1 (>75x109/l). Reiniciar el tratamiento a la misma dosis. |
|
Grado 3 & 4 (<50x109/l) |
Interrupción temporal de la dosis hasta la recuperación a Grado <1 (>75x109/l). Reiniciar el tratamiento a la dosis de 5 mg al día. |
|
Neutropenia |
Grado 2 (>1x109/l) |
No se requiere ajuste de la dosis. |
|
Grado 3 (<1, >0,5x109/l) |
Interrupción temporal de la dosis hasta la recuperación a Grado <2 (>1x109/l). Reiniciar el tratamiento a la misma dosis. | |
|
Grado 4 (<0,5x109/l) |
Interrupción temporal de la dosis hasta la recuperación a Grado <2 (>1x109/l). Reiniciar el tratamiento a la dosis de 5 mg al día. | |
|
Neutropenia febril |
Grado 3 |
Interrupción temporal de la dosis hasta la recuperación a Grado <2 (>1,25x109/l) y sin fiebre. Reiniciar el tratamiento a la dosis de 5 mg al día. |
|
Grado 4 |
Interrumpir el tratamiento. |
El grado se basa en los criterios de nomenclatura común para acontecimiento adversos (CTCAE) v3.0 del Instituto Nacional del Cáncer (NCI)
Poblaciones especiales
Pacientes de edad avanzada (>65 años)
No es necesario ajustar la dosis (ver sección 5.2).
Insuficiencia renal
No es necesario ajustar la dosis (ver sección 5.2).
Insuficiencia hepática
- Insuficiencia hepática leve (Child-Pugh A) - la dosis recomendada es de 7,5 mg diarios.
- Insuficiencia hepática moderada (Child-Pugh B) - la dosis recomendada es de 5 mg diarios.
- Insuficiencia hepática grave (Child-Pugh C) - Afinitor sólo está recomendado si el beneficio esperado supera el riesgo. En este caso, no debe superarse una dosis de 2,5 mg diarios.
Se deben realizar ajustes de dosis si el estado hepático del paciente (Child-Pugh) cambia durante el tratamiento (ver también secciones 4.4 y 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de Afinitor en niños de 0 a 18 años. No se dispone de datos.
Forma de administración
Afinitor debe administrarse por vía oral una vez al día, a la misma hora cada día, sistemáticamente con comida o bien sin comida (ver sección 5.2). Los comprimidos de Afinitor deben tragarse enteros, con un vaso de agua. Los comprimidos no deben masticarse ni triturarse.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a otros derivados de rapamicina o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Neumonitis no infecciosa
La neumonitis no infecciosa es un efecto de clase de los derivados de rapamicina, incluido everolimus. En pacientes tratados con Afinitor se ha notificado neumonitis no infecciosa (incluyendo enfermedad pulmonar intersticial) de forma frecuente (ver sección 4.8). Algunos casos fueron graves y, en raras ocasiones, con desenlace mortal. Debe considerarse un diagnóstico de neumonitis no infecciosa en pacientes que presenten signos y síntomas respiratorios inespecíficos como hipoxia, derrame pleural, tos o disnea, y en aquellos en que se han descartado causas infecciosas, neoplásicas y otras causas no médicas mediante las pruebas adecuadas. Se debe descartar la presencia de infecciones oportunistas como neumonía por pneumocystis jirovecii (carinii) (NPJ, NPC) en el
Los pacientes que presenten cambios radiológicos indicativos de neumonitis no infecciosa y que tengan pocos o ningún síntoma pueden continuar el tratamiento con Afinitor sin ajustar la dosis. Si los síntomas son moderados (Grado 2) o graves (Grado 3), puede estar indicado el uso de corticosteroides hasta que los síntomas clínicos desaparezcan.
Para pacientes que requieren el uso de corticoesteroides para el tratamiento de neumonitis no infecciosa, se puede considerar la profilaxis para neumonía por pneumocystis jirovecii (carinii) (NPJ, NPC).
Infecciones
Everolimus tiene propiedades inmunosupresoras y puede predisponer los pacientes a infecciones bacterianas, fúngicas, víricas o por protozoos, incluyendo infecciones causadas por patógenos oportunistas (ver sección 4.8). En pacientes tratados con Afinitor se han descrito infecciones localizadas y sistémicas, incluyendo neumonía, otras infecciones bacterianas, infecciones fúngicas invasivas, tales como aspergilosis, candidiasis o neumonía por pneumocystis jirovecii (carinii) (NPJ, NPC) e infecciones víricas incluyendo reactivación del virus de la hepatitis B. Algunas de estas infecciones han sido graves (p.ej. provocando sepsis, insuficiencia respiratoria o hepática) y ocasionalmente con desenlace mortal.
Los médicos y los pacientes deberán ser conscientes del aumento de riesgo de infección con Afinitor. Las infecciones previas deberán tratarse adecuadamente y haberse curado completamente antes de iniciar el tratamiento con Afinitor. Durante el tratamiento con Afinitor, deberán estar alerta para detectar los signos y síntomas de infección: si se diagnostica una infección, establecer el tratamiento adecuado rápidamente y considerar la interrupción del tratamiento con Afinitor.
Si se diagnostica una infección fúngica sistémica invasiva, el tratamiento con Afinitor deberá interrumpirse de inmediato y permanentemente y el paciente deberá recibir el tratamiento antifúngico adecuado.
Se han notificado casos de neumonía por pneumocystis jirovecii (carinii) (NPJ, NPC), algunos con desenlace mortal, en pacientes que recibieron everolimus. La NPJ/NPC se puede asociar con el uso concomitante de corticosteroides u otros agentes inmunosupresores. Se debe considerar el uso de profilaxis para NPJ/NPC cuando se requiera el uso concomitante de corticosteroides u otros agentes inmunosupresores.
Reacciones de hipersensibilidad
Se han observado reacciones de hipersensibilidad con el tratamiento con everolimus (ver sección 4.3), que se manifiestan por síntomas que incluyen, aunque no exclusivamente, anafilaxis, disnea, sofocos, dolor en el pecho o angioedema (p.ej. hichazón en las vías respiratorias o la lengua, con o sin insuficiencia respiratoria).
Uso concomitante de inhibidores de la enzima convertidora de angiotensina (ECA)
Los pacientes que toman de forma concomitante un inhibidor de la ECA (p.ej. ramipril) pueden tener un mayor riesgo de sufrir angioedema (p.ej. hinchazón de las vías respiratorias o de la lengua, con o sin insuficiencia respiratoria) (ver sección 4.5).
Úlceras bucales
En pacientes tratados con Afinitor se han observado úlceras en la boca, estomatitis y mucositis bucal (ver sección 4.8). En estos casos se recomiendan tratamientos tópicos, pero deberán evitarse enjuagues bucales que contengan alcohol, peróxido, yodo y derivados del tomillo ya que pueden exacerbar la condición. No deberán utilizarse agentes antifúngicos a menos que se haya diagnosticado una infección fungica (ver sección 4.5).
Insuficiencia renal
En pacientes tratados con Afinitor se han observado casos de insuficiencia renal (incluyendo insuficiencia renal aguda), algunos con desenlace fatal (ver sección 4.8). La función renal se debe controlar especialmente en los pacientes que tienen factores de riesgo adicionales que pueden alterar más la función renal.
Pruebas de laboratorio y controles
Función renal
Se han notificado casos de elevaciones de creatinina sérica, normalmente leves, y proteinuria (ver sección 4.8). Se recomienda controlar la función renal, incluyendo la determinación de nitrógeno ureico en sangre (BUN), proteínas en orina o de creatinina sérica antes de empezar el tratamiento con Afinitor y periódicamente después.
Glucosa en sangre
Se ha notificado hiperglucemia (ver sección 4.8). Se recomienda el control de la glucosa sérica en ayunas antes de empezar el tratamiento con Afinitor y periódicamente después. Se recomienda un control más frecuente cuando Afinitor se administra de forma conjunta con otros medicamentos que pueden inducir hiperglucemia. Si es posible, deberá conseguirse un control glucémico óptimo del paciente antes de empezar el tratamiento con Afinitor.
Lípidos en sangre
Se ha notificado dislipemia (incluyendo hipercolesterolemia e hipertrigliceridemia). Se recomienda el control del colesterol y los triglicéridos en la sangre antes de empezar el tratamiento con Afinitor y periódicamente después, así como el manejo con el tratamiento médico adecuado.
Parámetros hematológicos
Se ha notificado disminución de hemoglobina, linfocitos, neutrófilos y plaquetas (ver sección 4.8). Se recomienda el control del hemograma completo antes de empezar el tratamiento con Afinitor y periódicamente después.
Tumores carcinoides funcionantes
En un ensayo aleatorizado, doble ciego, multicéntrico en pacientes con tumores carcinoides funcionantes, se comparó Afinitor más octreotida depot con placebo más octreotida depot. El estudio no alcanzó la variable principal de eficacia (supervivencia libre de progresión [SLP]) y el análisis intermedio de supervivencia global (SG) favoreció numéricamente el brazo de placebo más octreotida depot. Por lo tanto, no se ha establecido la seguridad y eficacia de Afinitor en pacientes con tumores carcinoides funcionantes.
Factores pronósticos en tumores neuroendocrinos de origen gastrointestinal o pulmonar En pacientes con tumores neuroendocrinos gastrointestionales o pulmonares no funcionantes y con factores pronóstico basales buenos, p.ej. tumor primario con origen en el ileón y valores de cromogranina A normales o sin afectación ósea, se debe realizar una valoración individual del beneficio-riesgo antes de iniciar el tratamiento con Afinitor. Se ha notificado una evidencia limitada de SLP en el subgrupo de pacientes con tumor primario con origen en el ileón (ver sección 5.1).
Interacciones
Deberá evitarse la administración conjunta con inhibidores e inductores de CYP3A4 y/o de la bomba de flujo de varios fármacos, la glicoproteina P (PgP). Si no puede evitarse la administración conjunta de un inhibidor o un inductor moderado de CYP3A4 y/o de PgP, pueden considerarse ajustes de dosis de Afinitor, en base a la AUC prevista (ver sección 4.5).
El tratamiento concomitante con inhibidores potentes de CYP3A4 supone un fuerte aumento de las concentraciones plasmáticas de everolimus (ver sección 4.5). En la actualidad no se dispone de datos suficientes para recomendar una dosis en esta situación. Por lo tanto, no se recomienda el tratamiento concomitante de Afinitor y de inhibidores potentes.
Se debe tener precaución cuando se administre Afinitor en combinación con sustratos de CYP3A4 administrados por vía oral con un estrecho margen terapéutico, debido a la posibilidad de interacciones entre los fármacos. Si se administra Afinitor con sustratos de CP3A4 administrados por vía oral con un estrecho margen terapéutico (p.ej. pimozida, terfenadina, astemizol, cisaprida, quinidina o derivados de alcaloides del cornezuelo del centeno) se debe controlar al paciente por la aparición de reacciones adversas descritas en la información de producto del sustrato de CYP3A4 administrado por vía oral (ver sección 4.5).
Insuficiencia hepática
En pacientes con insuficiencia hepática leve (Child-Pugh A), moderada (Child-Pugh B) y grave (Child-Pugh C) se observó un aumento de la exposición a everolimus (ver sección 5.2).
Sólo se recomienda el uso de Afinitor en pacientes con insuficiencia hepática grave (Child-Pugh C) si el beneficio potencial supera el riesgo (ver secciones 4.2 y 5.2).
No se dispone en la actualidad de datos clínicos de eficacia y seguridad que permitan sustentar recomendaciones de ajuste de dosis para el manejo de reacciones adversas en pacientes con insuficiencia hepática.
Vacunas
Durante el tratamiento con Afinitor deberá evitarse el uso de vacunas vivas (ver sección 4.5).
Lactosa
Los pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
Complicaciones en la cicatrización de heridas
La alteración en la cicatrización de heridas en un efecto de clase de los derivados de rapamicina, incluyendo everolimus. Por lo tanto, deberá tenerse precaución con el uso de Afinitor en el periodo peri-quirúrgico.
4.5 Interacción con otros medicamentos y otras formas de interacción
Everolimus es un sustrato de CYP3A4, y también es un sustrato y un inhibidor moderado de la PgP. Por lo tanto, la absorción y la consiguiente eliminación de everolimus puede verse influenciada por productos que afectan a CYP3A4 y/o a PgP. In vitro, everolimus es un inhibidor competitivo de CYP3A4 y un inhibidor mixto de CYP2D6.
En la Tabla 2 que se adjunta a continuación se detallan las interacciones conocidas y teóricas con inhibidores e inductores seleccionados de CYP3A4 y de PgP.
Inhibidores de CYP3A4 y de PgP que aumentan las concentraciones de everolimus Las sustancias que son inhibidores de CYP3A4 o de PgP pueden aumentar las concentraciones de everolimus en la sangre disminuyendo el metabolismo o el flujo de everolimus desde las células intestinales.
Inductores de CYP3A4 y de PgP que disminuyen las concentraciones de everolimus Las sustancias que son inductores de CYP3A4 o de PgP pueden disminuir las concentraciones de everolimus en la sangre aumentando el metabolismo o el flujo de everolimus desde las células intestinales.
Tabla 2 Efectos de otros principios activos sobre everolimus
|
Principio activo por interacción |
Interacción - Cambio en la AUC/ Cmax de Everolimus Proporción de media geométrica (intervalo observado) |
Recomendaciones sobre la administración conjunta |
|
Inhibidores potentes de CYP3A4/PgP | ||
|
Ketoconazol |
AUC Í15,3 veces (intervalo 11,2-22,5) Cmax Í4,1 veces (intervalo 2,6-7,0) |
No se recomienda el tratamiento concomitante de Afinitor y de inhibidores potentes. |
|
Itraconazol, posaconazol, voriconazol |
No estudiados. Se espera un aumento importante en la concentración de everolimus. | |
|
Telitromicina, claritromicina | ||
|
Nefazodona | ||
|
Ritonavir, atazanavir, saquinavir, darunavir, indinavir, nelfinavir | ||
|
Inhibidores moderados de CYP3A4/PgP | ||
|
Eritromicina |
AUC Í4,4 veces (intervalo 2,0-12,6) Cmax Í2,0 veces (intervalo 0,9-3,5) |
Deberá tenerse precaución cuando no pueda evitarse la administración concomitante de inhibidores moderados de CYP3A4 o de PgP. Si los pacientes necesitan la administración conjunta de un inhibidor moderado de CYP3A4 o de PgP, puede considerarse la reducción de dosis a 5 mg diarios o 2,5 mg diarios. Sin embargo no hay datos clínicos con este ajuste de dosis. Debido a la variabilidad entre sujetos los ajustes de dosis recomendados pueden no ser óptimos en todos los individuos, por tanto se recomienda un estrecho control de las reacciones adversas. Si se interrumpe el tratamiento con un inhibidor moderado, se debe considerar un periodo de lavado de al menos 2 a 3 días (tiempo medio de eliminación para los inhibidores moderados más utilizados) antes de que la dosis de Afinitor vuelva a la dosis utilizada antes de iniciar la administración concomitante. |
|
Imatinib |
AUC í 3,7 veces Cmax í 2,2 veces | |
|
Verapamilo |
AUC Í3,5 veces (intervalo 2,2-6,3) Cmax Í2,3 veces (intervalo 1,3-3,8) | |
|
Ciclosporina oral |
AUC Í2,7 veces (intervalo 1,5-4,7) Cmax Í1,8 veces (intervalo 1,3-2,6) | |
|
Fluconazol |
No estudiados. Se espera un aumento en la exposición. | |
|
Diltiazem | ||
|
Dronedarona |
No estudiado. Se espera un aumento en la exposición. | |
|
Amprenavir, fosamprenavir |
No estudiados. Se espera un aumento en la exposición. | |
|
Zumo de pomelo u otros alimentos que afecten a CYP3A4/PgP |
No estudiados. Se espera un aumento en la exposición (el efecto varía ampliamente) |
Deberá evitarse la combinación. |
|
Inductores potentes y moderados de CYP3A4/PgP | ||
|
Rifampicina |
AUC 163% (intervalo 0-80%) Cmax 458% (intervalo 10-70%) |
Evitar el uso conjunto de inductores potentes de CYP3A4. Si los pacientes necesitan la administración conjunta de un inductor potente de CYP3A4, debe considerarse un aumento de la dosis de Afinitor de 10 mg al día a 20 mg al día utilizando aumentos de dosis de 5 mg o menos aplicados en el Día 4 y 8 tras el inicio del inductor. Esta dosis de Afinitor se predice para ajustar el AUC al intervalo observado sin inductores. Sin embargo, no hay datos clínicos con este ajuste de dosis. Si se interrumpe el tratamiento con un inductor, se debe considerar un periodo de lavado de al menos 3 a 5 días (tiempo razonable para la desaparición de la inducción enzimática) antes que la dosis de Afinitor vuelva a la dosis utilizada antes de iniciar la administración conjunta. |
|
Dexametasona |
No estudiados. Se espera una disminución en la exposición. | |
|
Carbamazepina, fenobarbital, fenitoina |
No estudiados. Se espera una disminución en la exposición. | |
|
Efavirenz, nevirapina |
No estudiados. Se espera una disminución en la exposición. | |
|
Hierba de San Juan (Hypericum Perforatum) |
No estudiado. Se espera una disminución importante en la exposición. |
No se deben utilizar los preparados que contienen Hierba de San Juan durante el tratamiento con everolimus |
Agentes a los que everolimus puede alterar su concentración plasmática
En base a los resultados in vitro, las concentraciones sistémicas obtenidas después de dosis orales de 10 mg hacen poco probable la inhibición de PgP, CYP3A4 y CYP2D6. Sin embargo, no puede descartarse la inhibición de CYP3A4 y de PgP en el intestino. Un estudio de interacción en individuos sanos demostró que la administración conjunta de una dosis oral de midazolam, un sustrato sensible de CYP3A, con everolimus supuso un aumento del 25% en la Cmax de midazolam y un aumento del 30% en la AUC(0-inf) de midazolam. Es probable que el efecto sea debido a la inhibición del CYP3A4 intestinal por parte de everolimus. Por tanto, everolimus puede afectar la biodisponibilidad de los sustratos de CYP3A4 administrados conjuntamente por vía oral. Sin embargo, no se espera un efecto clínicamente relevante sobre la exposición de los sustratos de CYP3A4 administrados sistémicamente (ver sección 4.4).
La administración concomitante de everolimus y octreotida depot aumentó la Cmin de octreotida con una proporción media geométrica (everolimus/placebo) de 1,47. No se ha podido establecer un efecto clínicamente significativo sobre la respuesta de eficacia a everolimus en pacientes con tumores neuroendocrinos avanzados.
La administración conjunta de everolimus y exemestano aumentó la Cmin y la C2h de exemestano en un 45% y un 64% respectivamente. Sin embargo, los correspondientes niveles de estradiol en el estado estacionario (4 semanas) no fueron diferentes entre los dos brazos de tratamiento. No se observó un aumento en las reacciones adversas relacionadas con exemestano en los pacientes con cáncer de mama avanzado con receptor hormonal positivo que recibieron la combinación. El aumento en los niveles de exemestano es poco probable que tenga un impacto sobre la eficacia o la seguridad.
Uso concomitante de inhibidores de la enzima convertidora de angiotensina (ECA)
Los pacientes que toman de forma concomitante un inhibidor de la ECA (p.ej. ramipril) pueden tener un mayor riesgo de sufrir angioedema (ver sección 4.4).
Vacunas
La respuesta inmunológica a la vacunación puede verse afectada durante el tratamiento con Afinitor y por lo tanto, la vacuna puede ser menos efectiva. Deberá evitarse el uso de vacunas vivas durante el tratamiento con Afinitor (ver sección 4.4). Algunos ejemplos de vacunas vivas son: influenza intranasal, sarampión, parotiditis, rubeola, polio oral, BCG (Bacillus Calmette-Guérin), fiebre amarilla, varicela y la vacuna antitifoidea TY21a.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil/Anticoncepción en hombres y mujeres
Las mujeres en edad fértil deben utilizar un método de anticoncepción altamente efectivo (p.ej. métodos de control de la natalidad hormonales sin estrógeno orales, inyectados, o implantes, anticonceptivos basados en progesterona, histerectomía, ligadura de trompas, abstinencia completa, métodos de barrera, dispositivos intrauterinos [DIU], y/o esterilización femenina/masculina) mientras reciben tratamiento con everolimus, y hasta 8 semanas después de finalizar el tratamiento. No se debe prohibir a los pacientes varones si desean intentar tener hijos.
Embarazo
No existen datos adecuados sobre el uso de everolimus en mujeres embarazadas. Los estudios en animales han mostrado efectos de toxicidad reproductiva incluyendo embriotoxicidad y fetotoxicidad (ver sección 5.3). Se desconoce el riesgo potencial para las personas.
No se recomienda el uso de everolimus durante el embarazo y en mujeres en edad fértil que no utilicen métodos anticonceptivos.
Lactancia
Se desconoce si everolimus se excreta en la leche materna. Sin embargo, en ratas, everolimus y/o sus metabolitos se excretan rápidamente a la leche (ver sección 5.3). Por tanto, las mujeres que toman everolimus no deberán dar lactancia materna.
Fertilidad
Se desconoce el potencial de everolimus para causar infertilidad en pacientes hombres y mujeres, sin embargo en pacientes mujeres se ha observado amenorrea (amenorrea secundaria y otras irregularidades menstruales) y un desequilibrio asociado de hormona luteinizante (LH)/hormona estimulante del folículo (FSH). En base a los hallazgos preclínicos, la fertilidad masculina y femenina puede verse comprometida por el tratamiento con everolimus (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Afinitor sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada. Debe advertirse a los pacientes que tengan precaución al conducir o utilizar máquinas si experimentan fatiga durante el tratamiento con Afinitor.
Resumen del perfil de seguridad
El perfil de seguridad está basado en datos agrupados de 2.672 pacientes tratados con Afinitor en diez ensayos clínicos, que consisten en cinco ensayos fase III aleatorizados, doble ciego, controlados con placebo y cinco ensayos abiertos fase I y fase II, relacionado con las indicaciones autorizadas.
Las reacciones adversas más frecuentes (incidencia >1/10) a partir de los datos de seguridad agrupados fueron (en orden decreciente): estomatitis, erupción, fatiga, diarrea, infecciones, náusea, disminución del apetito, anemia, disgeusia, neumonitis, edema periférico, hiperglucemia, astenia, prurito, disminución de peso, hipercolesterolemia, epistaxis, tos y cefalea.
Las reacciones adversas de Grado 3-4 más frecuentes (incidencia >1/100 a <1/10) fueron estomatitis, anemia, hiperglucemia, infecciones, fatiga, diarrea, neumonitis, astenia, trombocitopenia, neutropenia, disnea, proteinuria, linfopenia, hemorragia, hipofosfatemia, erupción, hipertensión, neumonía, aumento de alanino aminotransferasa (ALT), aumento de aspartato aminotransferasa (AST) y diabetes mellitus. Los grados siguen la clasificación CTCAE, versión 3.0 y 4.03.
Tabla de reacciones adversas
La Tabla 3 presenta la categoría de frecuencia de las reacciones adversas notificadas en el análisis agrupado que se consideró para la agrupación de datos de seguridad. Las reacciones adversas se enumeran según el sistema de clasificación por órganos y sistemas MedDRA y por la categoría de frecuencia. Las categorías de frecuencia se definen utilizando los siguientes criterios: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 3 Reacciones adversas notificadas en los ensayos clínicos
|
Infecciones e infestaciones | |
|
Muy frecuentes |
Infecciones a * |
|
Trastornos de la sangre y del sistema linfático | |
|
Muy frecuentes |
Anemia |
|
Frecuentes |
Trombocitopenia, neutropenia, leucopenia, linfopenia |
|
Poco frecuentes |
Pancitopenia |
|
Raras |
Aplasia pura de glóbulos rojos |
|
Trastornos del sistema inmunológico | |
|
Poco frecuentes |
Hipersensibilidad |
|
Trastornos del metabolismo y de la nutrición | |
|
Muy frecuentes |
Disminución del apetito, hiperglucemia, hipercolesterolemia |
|
Frecuentes |
Hipertrigliceridemia, hipofosfatemia, diabetes mellitus, hiperlipemia, hipopotasemia, deshidratación, hipocalcemia |
|
Trastornos psiquiátricos | |
|
Frecuentes |
Insomnio |
|
Trastornos del sistema nervioso | |
|
Muy frecuentes |
Disgeusia, cefalea |
|
Poco frecuentes |
Ageusia |
|
Trastornos ocu |
ares |
|
Frecuentes |
Edema palpebral |
|
Poco frecuentes |
Conjuntivitis |
|
Trastornos cardiacos | |
|
Poco frecuentes |
Insuficiencia cardiaca congestiva |
|
Trastornos vasculares | |
|
Frecuentes |
Hemorragiab, hipertensión |
|
Poco frecuentes |
Sofocos, trombosis venosa profunda |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Muy frecuentes |
Neumonitis c, epistaxis, tos |
|
Frecuentes |
Disnea |
|
Poco frecuentes |
Hemoptisis, embolismo pulmonar |
|
Raras |
Síndrome de distress respiratorio agudo |
|
Trastornos gastrointestinales | |
|
Muy frecuentes |
Estomatitis d, diarrea, náusea |
|
Frecuentes |
Vómitos, sequedad en la boca, dolor abdominal, inflamación de las mucosas, dolor bucal, dispepsia, disfagia |
|
Trastornos hepatobiliares | |
|
Frecuentes |
Aumento de aspartato aminotransferasa, aumento de alanina aminotransferasa |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy frecuentes |
Erupción, prurito |
|
Frecuentes |
Sequedad de la piel, alteración de las uñas, alopecia leve, acné, eritema, onicoclasis, síndrome de eritrodisestesia palmo-plantar, exfoliación de la piel, lesión cutánea |
|
Raras |
Angioedema |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
Frecuentes |
Artralgia |
|
Trastornos renales y urinarios | |
|
Frecuentes |
Proteinuria*, aumento de creatinina en sangre, insuficiencia renal* |
|
Poco frecuentes |
Aumento de la orina durante el día, insuficiencia renal aguda* |
|
Trastornos del aparato reproductor y de la mama | |
|
Frecuentes |
Menstruación irregular e |
|
Poco frecuentes |
Amenorrea e |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes |
Fatiga, astenia, edema periférico |
|
Frecuentes |
Pirexia |
|
Poco frecuentes |
Dolor en el pecho no cardíaco, alteración en la cicatrización de heridas |
Muy
frecuentes
Disminución del peso
=<
a
b
c
d
e
Ver también subsección “Descripción de reacciones adversas seleccionadas”
Incluye todas las reacciones dentro de la clasificación de sistemas órganos «infecciones e infestaciones» incluyendo (frecuentes) neumonía, infección del tracto urinario; (poco frecuentes) bronquitis, herpes zóster, sepsis, abscesos, y casos aislados de infecciones oportunistas [p.ej. aspergilosis, candidiasis, neumonía por pneumocystis jirovecii (carinii) (NPJ, NPC) y hepatitis B (ver también sección 4.4)] y (raras) miocarditis vírica Incluye diferentes acontecimientos de sangrado de diversas localizaciones no enumerados individualmente
Incluye (frecuentes) neumonitis, enfermedad pulmonar intersticial, infiltración pulmonar y (raras) hemorragia alveolar pulmonar, toxicidad pulmonar y alveolitis
Incluye (muy frecuentes) estomatitis (frecuentes) estomatitis aftosa, úlceras en la boca y en la lengua y (poco frecuentes) glosodinia, glositis
Frecuencia basada en el número de mujeres de 10 a 55 años de edad en los datos agrupados
Descripción de reacciones adversas seleccionadas
En ensayos clínicos y notificaciones espontáneas postautorización, everolimus se ha asociado con casos graves de reactivación de hepatitis B, incluyendo casos con desenlace fatal. La reactivación de infección es un efecto esperado durante periodos de inmunosupresión.
En ensayos clínicos y en notificaciones espontáneas postautorización, se ha asociado everolimus con acontecimientos de insuficiencia renal (incluyendo casos con desenlace fatal) y proteinuria. Se recomienda controlar la función renal (ver sección 4.4).
En los ensayos clínicos y en notificaciones espontáneas postcomercialización, everolimus se ha asociado con casos de amenorrea (amenorrea secundaria y otras irregularidades menstruales).
En los ensayos clínicos y en notificaciones espontáneas post autorización, everolimus se ha asociado con casos de neumonía por pneumocystis jirovecii (carinii) (NPJ, NPC), algunos con desenlace mortal (ver sección 4.4).
En los ensayos clínicos y en notificaciones espontáneas post autorización se ha notificado casos de angioedema con y sin uso concomitante de inhibidores de ECA (ver sección 4.4).
Pacientes de edad avanzada
En la agrupación de datos de seguridad, el 37% de los pacientes tratados con Afinitor tenían >65 años de edad. El número de pacientes con una reacción adversa que supuso la interrupción del tratamiento con el medicamento fue superior en pacientes con >65 años de edad (20% frente 13%). Las reacciones adversas más frecuentes que supusieron la interrupción del tratamiento fueron neumonitis (incluyendo enfermedad pulmonar intersticial), estomatitis, fatiga y disnea.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
La experiencia con sobredosis notificada en humanos es muy limitada. Se han administrado dosis únicas de hasta 70 mg con una tolerabilidad aguda aceptable. En todos los casos de sobredosis deberán iniciarse medidas de soporte generales.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos, otros agentes antineoplásicos, inhibidores de la proteínquinasa, código ATC: L01XE10
Mecanismo de acción
Everolimus es un inhibidor selectivo de mTOR (diana de la rapamicina en los mamíferos). mTOR es una serina-treonina-quinasa clave, cuya actividad se sabe que está desregulada en diferentes cánceres humanos. Everolimus se une a la proteína intracelular FKBP-12, formando un complejo que inhibe la actividad del complejo mTOR 1 (mTORC1). La inhibición de la vía de señales mTORC1 interfiere con la traducción y síntesis de proteínas reduciendo la actividad de la proteina quinasa ribosomal S6 (S6K1) y la proteína de unión 4E del factor de elongación eucariótico (4EBP-1) que regula las proteínas implicadas en el ciclo celular, la angiogénesis y la glucolisis. Se cree que S6K1 fosforila el dominio de activación 1 del receptor estrogénico, que es responsable de la activación del receptor independiente del ligando. Everolimus reduce los niveles del factor de crecimiento endotelial vascular (VEGF), que potencia los procesos angiogénicos del tumor. Everolimus es un inhibidor potente del crecimiento y proliferación de las células del tumor, las células endoteliales, los fibroblastos y las células del músculo liso asociadas con vasos sanguíneos y ha mostrado que reduce la glicolisis en tumores sólidos in vitro e in vivo.
Eficacia clínica y seguridad
Cáncer de mama avanzado con receptor hormonal positivo
El estudio BOLERO-2 (estudio CRAD001Y2301), un estudio de fase III, aleatorizado, doble ciego, multicéntrico de Afinitor + exemestano frente a placebo + exemestano, se llevó a cabo en mujeres postmenopáusicas con cáncer de mama avanzado con receptor estrogénico positivo, HER2/neu negativo con recurrencia o progresión tras un tratamiento previo con letrozol o anastrozol. La aleatorización se estratificó por sensibilidad documentada a un tratamiento hormonal previo y por la presencia de metástasis viscerales. La sensibilidad a un tratamiento hormonal previo se definió como
(1) beneficio clínico documentado (respuesta completa [RC], respuesta parcial [RP], enfermedad estable >24 semanas) tras al menos un tratamiento hormonal previo en la enfermedad avanzada o
(2) al menos 24 meses de terapia hormonal adyuvante antes de la recurrencia.
La variable principal del estudio fue la supervivencia libre de progresión (SLP) evaluada por RECIST (Response Evaluation Criteria in Solid Tumors), basada en la valoración del investigador (radiología local). Los análisis de SLP de apoyo se basaron en una revisión radiológica central independiente.
Las variables secundarias incluyeron supervivencia global (SG), tasa de respuesta objetiva, tasa de beneficio clínico, seguridad, cambio en la calidad de vida (CdV) y tiempo hasta el deterioro de ECOG PS (Eastern Cooperative Oncology Group performance status).
Se aleatorizaron un total de 724 pacientes en una proporción 2:1 a la combinación de everolimus (10 mg diarios) + exemestano (25 mg diarios) (n=485) o al brazo de placebo + exemestano (25 mg diarios) (n=239). En el momento del análisis final de SG la mediana de duración del tratamiento con everolimus fue de 24,0 semanas (intervalo 1,0-199,1 semanas). La mediana de duración del tratamiento con exemestano fue más larga para el grupo de everolimus + exemestano a 29,5 semanas (1,0-199,1) que para el grupo de placebo + exemestano a 14,1 semanas (1,0-156,0).
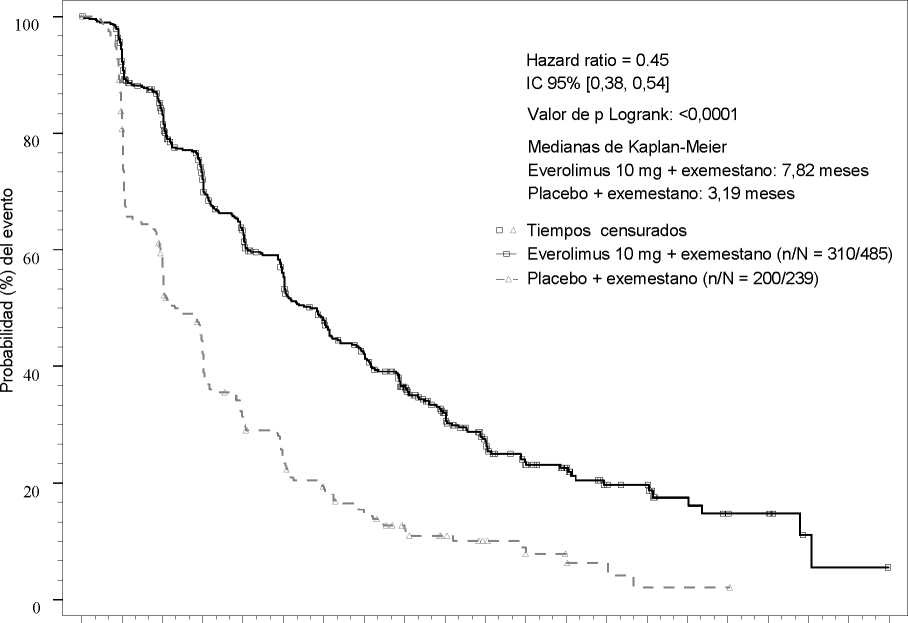
Los resultados de eficacia para la variable principal se obtuvieron a partir del análisis de SLP (ver Tabla 4 y Figura 1). Los pacientes en el brazo de placebo + exemestano no cruzaron a everolimus en el momento de la progresión.
Tabla 4 Resultados de eficacia del BOLERO-2
|
Análisis |
Afinitora n=485 |
Placebo3 n=239 |
Hazard ratio |
valor de p |
|
Mediana de supervivencia libre de progresión (meses) (IC 95%) | ||||
|
Revisión radiológica del investigador |
7 8 (6,9 a 8,5) |
3,2 (2,8 a 4,1) |
0,45 (0,38 a 0,54) |
<0,0001 |
|
Revisión radiológica independiente |
11,0 (9,7 a 15,0) |
4,1 (2,9 a 5,6) |
0,38 (0,31 a 0,48) |
<0,0001 |
|
Mediana de supervivencia global (meses) (IC 95%) | ||||
|
Mediana de supervivencia global |
31,0 (28,0 - 34,6) |
26,6 (22,6 - 33,1) |
0,89 (0,73 - 1,10) |
0,1426 |
|
Mejor respuesta global (%) (IC 95%) | ||||
|
Tasa de respuesta objectivab |
12,6% (9,8 a 15,9) |
1,7% (0,5 a 4,2) |
n/ad |
<0,0001e |
|
Tasa de beneficio clínicoc |
51,3% (46,8 a 55,9) |
26,4% (20,9 a 32,4) |
n/ad |
<0,0001e |
|
a Más exemestano b Tasa de respuesta objetiva = proporción de pacientes con respuesta completa o parcial c Tasa de beneficio clínico = proporción de pacientes con respuesta completa o parcial o enfermedad estable >24 semanas d No aplica e valor de p obtenido del ensayo exacto de Cochran-Mantel-Haenszel utilizando una versión estratificada del test de permutación de Cochran-Armitage. | ||||
0 6 12 18 24 30 36 42 48 54 60 66 72 78 84 90 96 102 108 114 120
Tiempo (semanas)
Numero de Pacientes todavía a riesgo
|
Tiempo(semana s0 |
6 |
12 |
18 |
24 |
30 |
36 |
42 |
48 |
54 |
60 |
66 |
72 |
78 |
84 |
90 |
96 |
102 |
108 |
114 |
120 |
|
Everolimus 485 |
436 |
366 |
304 |
257 |
221 |
185 |
158 |
124 |
91 |
66 |
50 |
35 |
24 |
22 |
13 |
10 |
8 |
2 |
1 |
0 |
|
Placebo 239 |
190 |
132 |
96 |
67 |
50 |
39 |
30 |
21 |
15 |
10 |
8 |
5 |
3 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
El efecto estimado del tratamiento sobre la SLP se vio apoyado por los análisis planificados de SLP por subgrupos según la evaluación del investigador. Para todos los subgrupos analizados (edad, sensibilidad al tratamiento hormonal previo, número de órganos afectados, estado de las lesiones sólo óseas en el inicio y presencia de metástasis viscerales, y entre los subgrupos demográficos y pronósticos más importantes), se observó un efecto positivo con el tratamiento con everolimus + exemestano con un hazard ratio estimado frente a placebo + exemestano de entre 0,25 a 0,60.
No se observaron diferencias entre los dos brazos respecto al tiempo hasta >5% de deterioro en la puntuación de los dominios funcionales y globales del QLQ-C30.
Tumores neuroendocrinos avanzados de origen pancreático (pNET)
El estudio RADIANT-3 (estudio CRAD001C2324), un estudio de fase III, multicéntrico, aleatorizado, doble ciego de Afinitor más la mejor terapia de soporte (MTS) frente a placebo más MTS en pacientes con pNET avanzado, demostró un beneficio clínico estadísticamente significativo de Afinitor sobre placebo de prolongación de la supervivencia libre de progresión (SLP) en unas 2,4 veces (11,04 meses frente a 4,6 meses) (HR 0,35; IC 95%: 0,27, 0,45; p<0,001) (ver Tabla 5 y Figura 2).
El estudio RADIANT-3 incluyó a pacientes con pNET avanzado bien y moderadamente diferenciado cuya enfermedad había progresado en los 12 meses anteriores. Como parte de la MTS se permitió el tratamiento con análogos de somatostatina.
La variable principal del estudio fue la SLP evaluada por RECIST (Response Evaluation Criteria in Solid Tumours). Tras la progresión radiológica documentada, se abrió el código de aleatorización de los pacientes por parte del investigador. Se permitió a los pacientes que estaban aleatorizados en el grupo placebo recibir Afinitor en tratamiento abierto.
Las variables secundarias incluyeron la seguridad, la tasa de respuesta objetiva, la duración de la respuesta y la supervivencia global (SG).
En total, 410 pacientes fueron aleatorizados 1:1 para recibir Afinitor 10 mg/día (n=207) o placebo (n=203). Las características demográficas estaban bien equilibradas (mediana de edad 58 años, 55% hombres, 78,5% caucásicos). El cincuenta y ocho por ciento de los pacientes en ambos brazos recibieron tratamiento sistémico previo. La mediana de duración del tratamiento ciego del estudio fue de 37,8 semanas (intervalo 1,1-129,9 semanas) para pacientes que recibieron everolimus y
16.1 semanas (intervalo 0,4-147,0 semanas) para los que recibieron placebo.
Tras la progresión de la enfermedad o después de abrir el código de aleatorización del estudio, 172 de los 203 pacientes (84,7%) inicialmente aleatorizados a placebo pasaron al grupo abierto de Afinitor. La mediana de duración del tratamiento abierto fue de 47,7 semanas entre todos los pacientes;
67.1 semanas en los 53 pacientes aleatorizados a everolimus que pasaron a everolimus abierto y
44.1 semanas en los 172 pacientes aleatorizados a placebo que pasaron a everolimus abierto.
Tabla 5 RADIANT-3 - Resultados de eficacia
|
Población |
Afinitor n=207 |
Placebo n=203 |
Hazard ratio (IC 95%) |
Valor de _p_ |
|
Supervivencia libre de progresión mediana (meses) (IC 95%) | ||||
|
Revisión radiológica del investigador |
11,04 (8,41, 13,86) |
4,60 (3,06, 5,39) |
0,35 (0,27, 0,45) |
<0,0001 |
|
Revisión radiológica independiente |
13,67 (11,17, 18,79) |
5,68 (5,39, 8,31) |
0,38 (0,28, 0,51) |
<0,0001 |
|
Mediana de supervivencia global (meses) (I |
IC 95%) | |||
|
Mediana de supervivencia global |
44,02 (35,61, 51,75) |
37,68 (29,14, 45,77) |
0,94 (0,73, 1,20) |
0,300 |
100
90
80
70
60
ro
;o
5 50 ro
-Q
o
40
30
20
10
4
6
8
Hazard ratio = 0,35 IC 95% [0,27, 0,45]
Valor de p logrank = <0,001 Medianas de Kaplan-Meier Afinitor : 11,04 meses Placebo : 4,60 meses
■ a Tiempos censurados
—■-Afinitor (n=207)
. . Placebo (n=203)
N°.de pacientes aún en riesgo Afinitor 207 189 153 126
Placebo 203 117 98 59
114
52
22 24 26 28 30
6 2 0 0 0 11110
Tumores neuroendocrinos avanzados de origen gastrointestinal o pulmonar Se llevó a cabo el estudio RADIANT-4 (estudio CRAD001T2302), un estudio fase III, multicéntrico, doble ciego, aleatorizado de Afinitor más el mejor tratamiento de soporte (MTS) frente a placebo más MTS en pacientes con tumores neuroendocrinos de origen gastrointestinal o pulmonar no funcionantes, bien diferenciados (Grado 1 o Grado 2), avanzados, sin antecedentes ni síntomas activos relacionados con el síndrome carcinoide.
La variable principal del estudio fue la supervivencia libre de progresión (SLP) evaluada según revisión radiológica central independiente de acuerdo con criterios RECIST (Response Evaluation Criteria in Solid Tumors). El análisis de apoyo de la SLP se basó en la revisión local del investigador. Las variables secundarias incluyeron la supervivencia global (SG), la tasa de respuesta global, la tasa de control de la enfermedad, seguridad, cambio en la calidad de vida (FACT-G) y tiempo hasta el deterioro en el estado general según la Organización Mundial de la Salud (OMS PS).
Un total de 302 pacientes fueron aleatorizados en una proporción de 2:1 para recibir tratamiento con everolimus (10 mg diarios) (n=205) o placebo (n=97). Las características demográficas y de la enfermedad estaban en general equilibradas (mediana de edad 63 años [intervalo 22 a 86], 76% caucásicos, antecedentes de uso previo de análogos de somatostatina [ASS]. La mediana de duración del tratamiento ciego fue de 40,4 semanas para los pacientes que recibieron Afinitor y de 19,6 semanas para los que recibieron placebo. Los pacientes en el brazo de placebo no cruzaron al grupo de everolimus en el momento de la progresión.
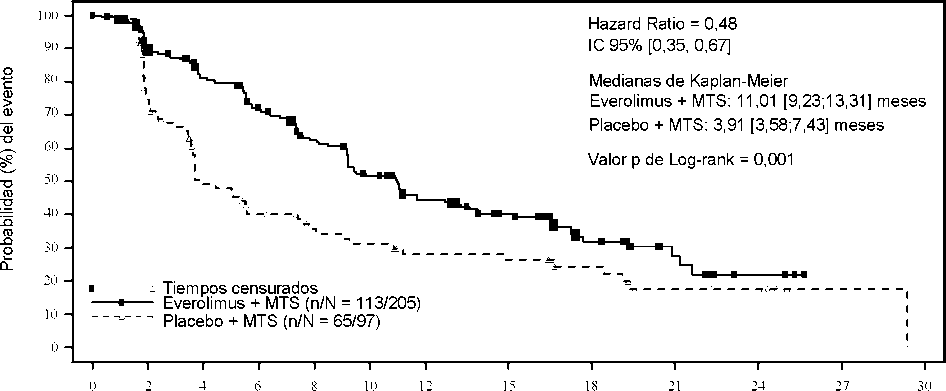
Tabla 6 RADIANT-4 - Resultados de la supervivencia libre de progresión
|
Población |
Afinitor n=205 |
Placebo n=97 |
Hazard ratio (95% CI) |
Valor de pa |
|
Mediana de supervivencia libre de progresión (meses) (IC 95%) | ||||
|
Revisión radiológica independiente |
11,01 (9,2, 13,3) |
3,91 (3,6, 7,4) |
0,48 (0,35, 0,67) |
<0,0001 |
|
Revisión radiológica del investigador |
13,96 (11,2, 17,7) |
5,45 (3,7, 7,4) |
0,39 (0,28, 0,54) |
<0,0001 |
|
a Valor de p unilateral de un test de log-rank estratificado | ||||
Figura 3 RADIANT-4 - Curvas de supervivencia libre de progresión Kaplan-Meier (revisión radiológica independiente)
Tiempo (meses)
Número de pacientes aún en riesgo
|
Tiempo(meses) |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
15 |
18 |
21 |
24 |
27 |
30 |
|
Everolimus |
205 |
168 |
145 |
124 |
101 |
81 |
65 |
52 |
26 |
10 |
3 |
0 |
0 |
|
Placebo |
97 |
65 |
39 |
30 |
24 |
21 |
17 |
15 |
11 |
6 |
5 |
1 |
0 |
En análisis de apoyo, se observó efecto positivo del tratamiento en todos los subgrupos con la excepción del subgrupo de pacientes con localización del tumor primario de ileón (Ileón: HR=1,22 [IC 95%: 0,56 a 2,65]; No ileón: HR=0,34 [IC 95%: 0,22 a 0,54]; Pulmón: HR=0,43 [IC 95%: 0,24 a 0,79] (ver Figura 4).
RADIANT-4 - Resultados de supervivencia libre de progresión por subgrupo de paciente pre-especificado (revisión radiológica independiente)
Figura 4
Edad OMS PS
ASS previo
Quimioterapia previa
Origen del tumorj primario
Grado del tumor-
Carga de tumor en el hígado
CgA basal NSE basal
Todos (N=302) <65 años (N=159) >65 años (N=143)
0 (N=216)
1 (N=86)
Si (N=157)
No (N=145)
Si (N=77)
No (N=225) Pulmón (N=90) Ileón (N=71)
No ileón* (N=141) Grado 1 (N=194) Grado 2 (N=107) <10% (N=228) >10% (N=72) >2xLSN (N=139) <2xLSN (N=138) >LSN (N=87) <LSN (N=188)
-o
—□-
-O-
HZh
-o
-o
0.1
Everolimus + BSC
A favor de
Placebo + MTS
*No ileón: estómago, colon, recto, apéndice, ciego, duodeno, yeyuno, carcinoma de origen primario
desconocido y otros orígenes gastrointestinales
LSN: Límite superior de la normalidad
CgA: Cromogranina A
NSE: Enolasa neuronal específica
Hazard ratio (95% CI) del modelo Cox estratificado.
El análisis intermedio de la SG pre planificado después de 101 muertes (de las 191 requeridas para el análisis final) y 33 meses de seguimiento favorecieron el brazo de everolimus; sin embargo, no se observó diferencia estadísticamente significativa en la SG [IC 95%: 0,48 a 1,11; p=0,071]).
No se observaron diferencias entre los dos brazos respecto al tiempo hasta el deterioro definitivo del estado general según la OMS (> 1 punto) y en el tiempo al deterioro definitivo de la puntuación total en la calidad de vida (puntuación total de FACT-G >7 puntos).
Carcinoma de células renales avanzado
Se llevó a cabo el estudio RECORD-1 (estudio CRAD001C2240), un estudio fase III, doble ciego, internacional, multicéntrico, aleatorizado, comparando 10 mg/día de everolimus con placebo, ambos junto al mejor cuidado de apoyo, en pacientes con carcinoma de células renales metastático, con progresión durante o después del tratamiento previo con terapia VEGFR-TKI (inhibidor de la tirosina cinasa y del receptor del factor de crecimiento endotelial vascular) (sunitinib, sorafenib, o ambos sunitinib y sorafenib). También se permitió el tratamiento previo con bevacizumab e interferón-a. Los pacientes se estratificaron según la clasificación del pronóstico del Memorial Sloan-Kettering Cancer Center (MSKCC) (grupos de riesgo favorable-intermedio-bajo) y el tratamiento anticanceroso previo (1 ó 2 tratamientos previos con VEGFR-TKI).
La variable principal del estudio fue la supervivencia libre de progresión, documentada en base a los criterios de RECIST (Response Evaluation Criteria in Solid Tumours) y valorado mediante una revisión central, independiente y ciega. Las variables secundarias incluyeron la seguridad, la tasa de respuesta objetiva del tumor, la supervivencia global, los síntomas relacionados con la enfermedad, y la calidad de vida. Después de la progresión, documentada radiológicamente, el investigador pudo abrir el código de aleatorización: los pacientes en el grupo de placebo pudieron recibir tratamiento abierto con 10 mg/día de everolimus. El Comité de Monitorización de Datos Independiente (Independent Data Monitoring Committee) recomendó la finalización de este ensayo en el momento del segundo análisis intermedio, pues se había alcanzado el objetivo primario.
En total, se aleatorizaron 416 pacientes con la relación 2:1 para ser tratados con Afinitor (n=277) ó placebo (n=139). Las características demográficas estuvieron bien equilibradas (edad mediana agrupada [61 años; intervalo 27-85], 78% hombres, 88% caucásicos, número de tratamientos previos con VEGFR-TKI [1-74%, 2-26%]). La mediana de duración del tratamiento ciego del estudio fue de 141 días (intervalo 19-451 días) para pacientes que recibieron everolimus y 60 días (intervalo 21-295 días) para los que recibieron placebo.
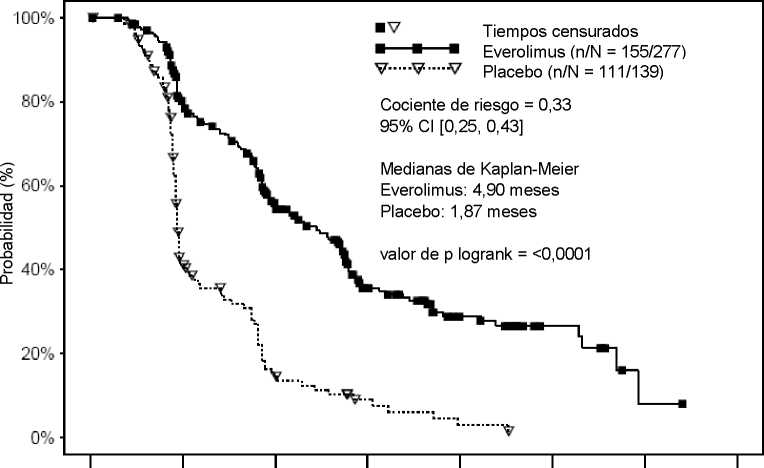
Afinitor fue superior a placebo en la variable principal de supervivencia libre de progresión, con una reducción estadísticamente significativa del 67% en el riesgo de progresión o muerte (ver Tabla 7 y Figura 5).
Tabla 7 RECORD-1 - Resultados de supervivencia libre de progresión
|
Población |
n |
Afinitor n=277 |
Placebo n=139 |
Hazard ratio (IC 95%) |
Valor de p |
|
Supervivencia libre de progresión mediana (meses) (IC 95%) | |||||
|
Análisis primario | |||||
|
Total (revisión central independiente ciega) |
416 |
4,9 (4,0-5,5) |
1,9 (1,8-1,9) |
0,33 (0,25-0,43) |
<0,0001a |
|
Análisis de apoyo/sensibi |
idad | ||||
|
Total (revisión local por investigador) |
416 |
5,5 (4,6-5,8) |
1,9 (1,8-2,2) |
0,32 (0,25-0,41) |
<0,0001a |
|
Puntuación MSKCC sobre el pronósticofrevisión centralizada independiente y ciega) | |||||
|
Riesgo favorable |
120 |
5,8 (4,0-7,4) |
1,9 (1,9-2,8) |
0,31 (0,19-0,50) |
<0,0001 |
|
Riesgo intermedio |
235 |
4,5 (3,8-5,5) |
1,8 (1,8-1,9) |
0,32 (0,22-0,44) |
<0,0001 |
|
Riesgo bajo |
61 |
3,6 (1,9-4,6) |
1,8 (1,8-3,6) |
0,44 (0,22-0,85) |
0,007 |
|
a Ensayo log-rank estratificado | |||||
D
N°pacientes todavía con riesgo Tiempo (meses) Z Afinitor Placebo
|
2 |
4 |
6 |
8 |
10 |
12 |
14 |
|
Tiempo (meses) | ||||||
|
2 |
4 |
6 |
8 |
10 |
12 |
14 |
|
192 |
115 |
51 |
26 |
10 |
1 |
0 |
|
47 |
15 |
6 |
2 |
0 |
0 |
0 |
Las tasas de SLP a los seis meses fueron del 36% para el tratamiento con Afinitor comparado con el 9% para placebo.
Se observaron respuestas objetivas del tumor confirmadas en 5 pacientes (2%) que recibían Afinitor, mientras que no se observó ninguna en pacientes que recibieron placebo. Por lo tanto, la ventaja en la supervivencia libre de progresión refleja principalmente la población con estabilización de la enfermedad (correspondiente al 67% del grupo de tratamiento con Afinitor).
Respecto a la supervivencia global no se observó una diferencia estadísticamente significativa relacionada con el tratamiento (Hazard ratio 0,87; intervalo de confianza: 0,65-1,17; p=0,177). El cruce de pacientes desde el grupo placebo al tratamiento abierto con Afinitor tras la progresión de la enfermedad confundió en la detección de cualquier diferencia en la supervivencia global relacionada con el tratamiento.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Afinitor en todos los grupos de la población pediátrica en tumores neuroendocrinos de origen pancreático, tumores neuroendocrinos torácicos y en carcinoma de células renales (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
En pacientes con tumores sólidos avanzados se alcanzan las concentraciones máximas de everolimus (Cmax) en una mediana de tiempo de 1 hora después de la administración diaria de 5 y 10 mg de everolimus en condiciones de ayuno o con una comida ligera libre de grasas. La Cmax es proporcional a la dosis entre 5 y 10 mg. Everolimus es un sustrato y un inhibidor moderado de PgP.
Efecto de la comida
En individuos sanos, las comidas con un alto contenido en grasa redujeron la exposición sistémica a everolimus 10 mg (medido como AUC) en un 22% y la concentración plasmática máxima Cmax en un 54%. Las comidas ligeras en grasa redujeron el AUC en un 32% y la Cmax en un 42%. Sin embargo, la comida no tuvo un efecto evidente sobre el perfil concentración-tiempo de la fase posterior a la absorción.
Distribución
La relación sangre-plasma de everolimus, que es dependiente de la concentración en el intervalo de 5 a 5.000 ng/ml es de 17% a 73%. En pacientes con cáncer tratados con 10 mg/día de everolimus, aproximadamente el 20% de la concentración de everolimus en sangre total está retenida en el plasma. La unión a proteínas plasmáticas es aproximadamente del 74% tanto en individuos sanos como en pacientes con insuficiencia hepática moderada. En pacientes con tumores sólidos avanzados, el volumen de distribución aparente (Vd) fue de 191 l para el compartimento central y de 517 l para el compartimento periférico.
Biotransformación
Everolimus es un sustrato de CYP3A4 y de PgP. Después de la administración oral, everolimus es el principal componente circulante en la sangre humana. Se han detectado en el plasma humano seis metabolitos principales de everolimus, incluyendo tres metabolitos monohidroxilados, dos productos de anillo abierto hidrolíticos, y un conjugado fosfatidilcolina de everolimus. También se identificaron estos metabolitos en especies animales utilizadas en los estudios de toxicidad, y mostraron aproximadamente 100 veces menos actividad que el propio everolimus. Por tanto, everolimus se considera que es la que contribuye de forma mayoritaria a la actividad farmacológica general.
Eliminación
La media del valor de aclaramiento oral (CL/F) de everolimus después de la administración de 10 mg diarios en pacientes con tumores sólidos avanzados fue de 24,5 l/h. La vida media de eliminación de everolimus es de aproximadamente 30 horas.
No se han llevado a cabo estudios específicos de excreción en pacientes con cáncer; sin embargo, se dispone de datos de los estudios realizados en pacientes trasplantados. Después de la administración de una dosis única de everolimus marcado radiactivamente junto con ciclosporina, el 80% de la radiactividad se recuperó en las heces, mientras el 5% se excretó en la orina. La sustancia original no se detectó en la orina ni en las heces.
Farmacocinética en el estado estacionario
Después de la administración de everolimus en pacientes con tumores sólidos avanzados, el AUC0-T en el estado estacionario fue proporcional a la dosis en el intervalo de dosis de 5 a 10 mg diarios. Se alcanzó el estado estacionario a las dos semanas. La Cmax es proporcional a la dosis entre 5 y 10 mg.
La tmax se alcanza 1-2 horas después de la dosis. Se observó una correlación significativa entre la AUC0-t y la concentración valle pre-dosis en el estado estacionario.
Poblaciones especiales
Insuficiencia hepática
La seguridad, tolerabilidad y farmacocinética de everolimus fue evaluada en dos estudios de dosis única oral de Afinitor comprimidos en 8 y 34 individuos con función hepática alterada respecto a individuos con función hepática normal.
En el primer estudio, el AUC media de everolimus en 8 individuos con insuficiencia hepática moderada (Child-Pugh B) fue el doble de la determinada en 8 individuos con función hepática normal.
En el segundo estudio de 34 individuos con diferente función hepática alterada en comparación con los individuos normales, se observó un aumento de 1,6 veces; 3,3 veces y 3,6 veces en la exposición (es decir AUC0-inf) para individuos con insuficiencia hepática leve (Child-Pugh A), moderada (Child-Pugh B) y grave (Child-Pugh C), respectivamente.
Las simulaciones farmacocinéticas de dosis múltiples apoyan las recomendaciones de dosis en individuos con insuficiencia hepática en función de su estado de Child-Pugh.
En base a los resultados de los dos estudios, se recomienda realizar ajuste de la dosis en pacientes con insuficiencia hepática (ver secciones 4.2 y 4.4).
Insuficiencia renal
En un análisis farmacocinético en una población de 170 pacientes con tumores sólidos avanzados, no se detectó una influencia significativa del aclaramiento de creatinina (25-178 ml/min) sobre el cociente CL/F de everolimus. La insuficiencia renal post-transplante (intervalo de aclaramiento de creatinina: 11-107 ml/min) no afectó la farmacocinética de everolimus en pacientes trasplantados.
Pacientes de edad avanzada
En una evaluación farmacocinética en una población de pacientes con cáncer, no se detectó una influencia significativa de la edad (27-85 años) sobre el aclaramiento oral de everolimus.
Características étnicas
El aclaramiento oral (CL/F) es similar en pacientes con cáncer japoneses y caucásicos con funciones hepáticas similares. En base a un análisis farmacocinético de la población, el valor de CL/F es una media del 20% superior en pacientes trasplantados negros.
5.3 Datos preclínicos sobre seguridad
El perfil de seguridad preclínica de everolimus se estudió en ratones, ratas, cerdos minipigs, monos y conejos. Los principales órganos diana fueron los sistemas reproductores femenino y masculino de diversas especies (degeneración tubular testicular, reducción del contenido de esperma en los epidídimos y atrofia uterina) en varias especies; los pulmones (aumento de macrófagos alveolares) en ratas y ratones; páncreas (degranulación y vacuolación de células exocrinas en monos y minicerdos, respectivamente, y degeneración de las células de los islotes en monos), y los ojos (opacidades lenticulares en la línea de sutura anterior) sólo en ratas. En ratas se observaron cambios menores en los riñones (exacerbación de de la lipofuscina relacionada con la edad en el epitelio tubular, aumentos en hidronefrosis) y en ratones (exacerbación de lesiones de base). No se observaron indicaciones de toxicidad en los riñones en monos o minipigs.
Everolimus pareció exacerbar espontáneamente las enfermedades subyacentes (miocarditis crónica en ratas, infección en el plasma y el corazón por el virus de Coxsackie en monos, infección del tracto gastrointestinal por coccidios en minipigs, lesiones de la piel en ratones y monos). Estos efectos se observaron generalmente a unos niveles de exposición sistémica dentro del intervalo de la exposición terapéutica o superior, con la excepción de los efectos en ratas, que aparecieron por debajo de la exposición terapéutica debido a una elevada distribución a tejidos.
En un estudio de fertilidad en ratas machos, se vio afectada la morfología testicular con dosis de 0,5 mg/kg y superiores, así como la motilidad espermática, el recuento de cabezas de espermatozoides y los niveles de testosterona plasmática disminuyeron a 5 mg/kg que causó una reducción de la fertilidad masculina. Se observó evidencia de reversibilidad.
En estudios de reproducción en animales no se vio afectada la fertilidad femenina. Sin embargo, dosis de everolimus por vía oral en ratas hembras de >0,1 mg/kg (aproximadamente 4% de la AUC0-24h en pacientes que reciben una dosis de 10 mg diarios) provocaron aumentos en las pérdidas pre-implementación.
Everolimus cruzó la placenta y causó toxicidad al feto. En ratas, everolimus causó embrio/fototoxicidad a la exposición sistémica por debajo del nivel terapéutico. Esto se manifestó como mortalidad y reducción en el peso fetal. La incidencia de variaciones y malformaciones esqueléticas (p.ej. fisura esternal) aumentó a 0,3 y 0,9 mg/kg. En conejos, fue evidente la embriotoxicidad en un aumento de resorciones tardías.
Los estudios de genotoxicidad que cubrieron los objetivos genotóxicos relevantes no mostraron evidencia de actividad clastogénica o mutagénica. La administración de everolimus durante un periodo de hasta 2 años no indicó ningún potencial oncogénico en ratones y ratas hasta las dosis más altas, correspondientes respectivamente a 3,9 y 0,2 veces la exposición clínica estimada.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Hidroxitolueno butilado (E321)
Estearato de magnesio Lactosa monohidrato Hipromelosa Crospovidona tipo A Lactosa anhidra
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C.
Conservar en el embalaje original para protegerlo de la luz y de la humedad.
6.5 Naturaleza y contenido del envase
Blister de Aluminio/poliamida/aluminio/PVC que contiene 10 comprimidos.
Afinitor 2,5 mg comprimidos
Envases que contienen 30 ó 90 comprimidos.
Afinitor 5 mg comprimidos
Envases que contienen 10, 30 ó 90 comprimidos
Afinitor 10 mg comprimidos
Envases que contienen 10, 30 ó 90 comprimidos
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Afinitor 2,5 mg comprimidos
EU/1/09/538/009
EU/1/09/538/010
Afinitor 5 mg comprimidos EU/1/09/538/001 EU/1/09/538/003 EU/1/09/538/007
Afinitor 10 mg comprimidos EU/1/09/538/004 EU/1/09/538/006 EU/1/09/538/008
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 03 de Agosto de 2009 Fecha de la última renovación: 03 de Agosto de 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Novartis Pharma GmbH Roonstrasse 25 D-90429 Nürnberg Alemania
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en
cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Obligación de llevar a cabo medidas posautorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Un ensayo aleatorizado de tres brazos para investigar la combinación de everolimus con exemestano frente a everolimus solo frente a capecitabina en pacientes con cáncer de mama metastásico con receptor estrogénico positivo tras recurrencia o progresión con letrozol o anastrozol, basado en un protocolo autorizado por el CHMP. |
CSR final: 3Q 2017 |
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Afinitor 2,5 mg comprimidos Everolimus
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 2,5 mg de everolimus.
3. LISTA DE EXCIPIENTES
Contiene lactosa. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos 90 comprimidos
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/538/009 30 comprimidos
EU/1/09/538/010 90 comprimidos
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Afinitor 2,5 mg
BLISTER
1. NOMBRE DEL MEDICAMENTO
Afinitor 2,5 mg comprimidos Everolimus
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Afinitor 5 mg comprimidos Everolimus
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 5 mg de everolimus.
3. LISTA DE EXCIPIENTES
Contiene lactosa. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
10 comprimidos 30 comprimidos 90 comprimidos
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/538/007 10 comprimidos
EU/1/09/538/001 30 comprimidos
EU/1/09/538/003 90 comprimidos
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Afinitor 5 mg
BLISTER
1. NOMBRE DEL MEDICAMENTO
Afinitor 5 mg comprimidos Everolimus
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Afinitor 10 mg comprimidos Everolimus
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 10 mg de everolimus.
3. LISTA DE EXCIPIENTES
Contiene lactosa. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
10 comprimidos 30 comprimidos 90 comprimidos
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/538/008 10 comprimidos
EU/1/09/538/004 30 comprimidos
EU/1/09/538/006 90 comprimidos
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Afinitor 10 mg
BLISTER
1. NOMBRE DEL MEDICAMENTO
Afinitor 10 mg comprimidos Everolimus
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
B. PROSPECTO
Prospecto: información para el paciente
Afinitor 2,5 mg comprimidos Afinitor 5 mg comprimidos Afinitor 10 mg comprimidos
Everolimus
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Afinitor y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Afinitor
3. Cómo tomar Afinitor
4. Posibles efectos adversos
5. Conservación de Afinitor
6. Contenido del envase e información adicional
1. Qué es Afinitor y para qué se utiliza
Afinitor es un medicamento para el cáncer que contiene el principio activo everolimus. Everolimus
reduce el aporte de sangre al tumor y retrasa el crecimiento y la diseminación de las células del
cáncer.
Afinitor se utiliza para tratar a pacientes adultos con:
- cáncer de mama avanzado con receptor hormonal positivo en mujeres postmenopáusicas, en las que otros tratamientos (denominados «inhibidores de la aromatasa no esteroideos») no pueden continuar manteniendo la enfermedad bajo control. Se administra junto con un tipo de medicamento denominado exemestano, un inhibidor de la aromatasa esteroideo, que se utiliza para el tratamiento hormonal del cáncer.
- tumores avanzados denominados tumores neuroendocrinos que se originan en el estómago, intestino, pulmón o páncreas. Se administra si los tumores no son operables y no producen un exceso de hormonas específicas o bien otras sustancias naturales relacionadas.
- cáncer de riñón avanzado (carcinoma de células renales avanzado), cuando otros tratamientos (denominados tratamiento anti-VEGF) no han ayudado a detener su enfermedad.
2. Qué necesita saber antes de empezar a tomar Afinitor
Afinitor únicamente le será recetado por un médico con experiencia en el tratamiento del cáncer. Siga cuidadosamente todas las instrucciones del médico. Pueden ser diferentes de la información general contenida en este prospecto. Si tiene dudas sobre Afinitor o sobre el motivo por el que le han recetado este medicamento, consulte a su médico.
No tome Afinitor
- si es alérgico a everolimus, a sustancias relacionadas como sirolimus o temserolimus, o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Si cree que puede ser alérgico, consulte a su médico.
Advertencias y precauciones
Consulte a su médico antes de empezar a tomar Afinitor:
- si tiene problemas en el hígado o si ha tenido alguna enfermedad que puede haber afectado su hígado. En este caso, su médico puede prescribirle una dosis diferente de Afinitor.
- si tiene diabetes (alto nivel de azúcar en la sangre). Afinitor puede aumentar los niveles de azúcar en la sangre y empeorar la diabetes mellitus. Esto puede hacer que necesite tratamiento con insulina y/o con medicamentos antidiabéticos orales. Informe a su médico si nota que tiene una sed excesiva o si necesita orinar con mayor frecuencia.
- si necesita que le administren una vacuna mientras está tomando Afinitor.
- si tiene un nivel alto de colesterol. Afinitor puede aumentar el colesterol y/o otras grasas de la sangre.
- si ha sufrido recientemente una operación quirúrgica importante, o si tiene todavía una herida no cicatrizada después de una operación quirúrgica. Afinitor puede aumentar el riesgo de problemas con la cicatrización de heridas.
- si tiene una infección. Puede ser necesario que le traten su infección antes de iniciar el tratamiento con Afinitor.
- si ha sufrido anteriormente hepatitis B, porque esta puede reactivarse durante el tratamiento con Afinitor (ver sección 4 «Posibles efectos adversos»).
Afinitor también puede:
- debilitar su sistema inmunitario. Por lo tanto, puede tener riesgo de tener una infección mientras está tomando Afinitor,
- afectar a la función del riñón. Por lo tanto, su médico controlará su función del riñón mientras está tomando Afinitor.
- causar dificultad para respirar, tos y fiebre.
Informe a su médico si sufre estos síntomas.
Durante el tratamiento se le van a realizar análisis de sangre periódicamente. Estos análisis determinarán la cantidad de células en la sangre (glóbulos blancos, glóbulos rojos y plaquetas) para comprobar si Afinitor está ejerciendo un efecto no deseado sobre estas células. También se le realizarán análisis de sangre para controlar la función del riñón (nivel de creatinina), la función del hígado (nivel de transaminasas) y los niveles del azúcar y de colesterol en la sangre. Estas pruebas se hacen debido a que éstos pueden verse afectados por el tratamiento con Afinitor.
Niños y adolescentes
No se debe administrar Afinitor a niños o adolescentes (menores de 18 años).
Uso de Afinitor con otros medicamentos
Afinitor puede afectar la forma cómo actúan otros medicamentos. Si está tomando otros medicamentos al mismo tiempo que Afinitor, su médico puede cambiar la dosis de Afinitor o de los otros medicamentos.
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Los siguientes pueden aumentar el riesgo de efectos adversos con Afinitor:
- ketoconazol, itraconazol, voriconazol, o fluconazol y otros medicamentos antifúngicos utilizados para tratar las infecciones por hongos.
- claritromicina, telitromicina o eritromicina, antibióticos utilizados para tratar las infecciones bacterianas.
- Ritonavir y otros medicamentos utilizados para tratar la infección por VIH/SIDA.
- verapamil o diltiazem, utilizados para tratar problemas del corazón o presión arterial alta.
- dronedarona, un medicamento utilizado para ayudar a regular el latido de su corazón.
- ciclosporina, un medicamento utilizado para prevenir que el cuerpo rechace los órganos trasplantados.
- imatinib, utilizado para inhibir el crecimiento de células anormales.
- inhibidores de la enzima convertidora de la angiotensina (ECA) (como ramipril) utilizados para tratar la presión arterial elevada u otros problemas cardiovasculares.
Los siguientes pueden reducir la eficacia de Afinitor:
- rifampicina, utilizada para tratar la tuberculosis (TB).
- efavirenz o nevirapina, utilizados para tratar la infección por VIH/SIDA
- Hierba de San Juan (Hypericum perforatum), un producto a base de plantas utilizado para tratar la depresión y otras afecciones.
- dexametasona, un corticosteroide utilizado para tratar una amplia variedad de situaciones incluyendo problemas inflamatorios o inmunes.
- fenitoína, carbamacepina o fenobarbital y otros antiepilépticos utilizados para controlar las convulsiones.
Deberá evitarse el uso de estos medicamentos durante el tratamiento con Afinitor. Si está tomando alguno de ellos, su médico puede prescribirle un medicamento diferente, o puede cambiar su dosis de Afinitor.
Toma de Afinitor con alimentos y bebidas
Debe tomar Afinitor a la misma hora cada día, siempre con las comidas o bien siempre fuera de las comidas. No tome pomelo ni zumo de pomelo mientras esté tomando Afinitor.
Embarazo, lactancia y fertilidad
Embarazo
Afinitor puede causar daño al feto y no se recomienda el tratamiento con Afinitor durante el embarazo. Informe a su médico si está embarazada o piensa que puede estarlo. Su médico comentará con usted si debe tomar este medicamento durante el embarazo.
Las mujeres que pueden quedarse embarazadas deben utilizar un método anticonceptivo altamente efectivo durante el tratamiento. Si, a pesar de estas medidas, cree que puede estar embarazada, consulte con su médico antes de tomar más Afinitor.
Lactancia
Afinitor puede causar daño al bebé lactante. No debe dar el pecho durante el tratamiento. Informe a su médico si está dando el pecho.
Afinitor puede tener un impacto sobre la fertilidad femenina. Informe a su médico si quiere tener niños.
Fertilidad masculina
Afinitor puede afectar la fertilidad del hombre. Consulte con su médico si quiere ser padre. Conducción y uso de máquinas
Si se siente anormalmente cansado (la fatiga es un efecto adverso muy frecuente), tenga especial cuidado cuando conduzca o utilice máquinas.
Afinitor contiene lactosa
Afinitor contiene lactosa (azúcar de la leche). Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo tomar Afinitor
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es de 10 mg, una vez al día. Su médico le informará sobre cuántos comprimidos de Afinitor debe tomar.
Si tiene problemas en el hígado, su médico puede empezar el tratamiento con una dosis más baja de Afinitor (2,5; 5; ó 7,5 mg al día).
Si presenta algunos efectos adversos mientras está tomando Afinitor (ver sección 4), su médico puede disminuir la dosis que toma o interrumpir el tratamiento durante un breve periodo de tiempo o bien definitivamente.
Tome Afinitor una vez al día, más o menos a la misma hora, siempre con comida o siempre sin comida.
Trague el(los) comprimido(s) enteros con un vaso de agua. Los comprimidos no deben masticarse ni triturarse.
Si toma más Afinitor del que debe
- Si ha tomado demasiado Afinitor, o si alguien tomó sus comprimidos de forma accidental, consulte a su médico o acuda inmediatamente al hospital inmediatamente. Puede ser necesario tratamiento urgente.
- Coja el envase y este prospecto para que el médico conozca qué es lo que ha tomado.
Si olvidó tomar Afinitor
Si se ha olvidado una dosis, tome la próxima dosis a la hora que le tocaba. No tome una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Afinitor
No interrumpa el tratamiento con Afinitor a menos que se lo diga su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
INTERRUMPA el tratamiento con Afinitor y busque ayuda médica inmediatamente si usted o su hijo
experimentan alguno de los siguientes signos de una reacción alérgica:
• dificultad para respirar o tragar
• hinchazón de la cara, labios, lengua o garganta
• picor intenso de la piel, con erupción de color rojo o bultos en la piel
Los efectos adversos graves de Afinitor incluyen:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
• Aumento de la temperatura, escalofríos (signos de infección)
• Fiebre, tos, dificultad para respirar, estertores (signos de inflamación del pulmón, también conocida como neumonitis)
Frecuentes (pueden afectar hasta 1 de cada 10 personas)
• Sed excesiva, elevada eliminación de orina, aumento del apetito con pérdida de peso, cansancio (signos de diabetes)
• Sangrado (hemorragia), por ejemplo en la pared intestinal
• Disminución importante de la eliminación de orina (singo de insuficiencia renal)
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
• Fiebre, erupción en la piel, dolor e inflamación en las articulaciones, así como cansancio, pérdida de apetito, náusea, ictericia (color amarillento de la piel), dolor en la parte superior derecha del abdomen, heces claras, orina oscura (pueden ser signos de una reactivación de la hepatitis B)
• Sensación de falta de aire al respirar, dificultad para respirar al tumbarse, hinchazón de los pies o piernas (signos de insuficiencia cardiaca)
• Hinchazón y/o dolor en una de las piernas, normalmente en la pantorrilla, enrojecimiento o calor en la piel en el área afectada (signos de bloqueo de un vaso sanguíneo (vena) en las piernas causado por un coágulo en la sangre)
• Inicio repentino de problemas para respirar, dolor en el pecho o tos con sangre (signos potenciales de embolismo pulmonar, una situación que aparece cuando se bloquean una o más arterias en los pulmones)
• Disminución importante en la eliminación de orina, hinchazón en las piernas, sensación de confusión, dolor en la espalda (signos de insuficiencia renal repentina)
• Erupción, picor, granos, dificultad para respirar o tragar, mareo (signos de una reacción alérgica grave, también conocida como hipersensibilidad)
Raras (pueden afectar hasta 1 de cada 1.000 personas)
• Dificultad para respirar o respiración rápida (signos de síndrome de distress respiratorio)
Si experimenta alguno de estos efectos adversos, informe a su médico inmediatamente puesto
que podrían tener consecuencias mortales.
Otros posibles efectos adversos de Afinitor incluyen:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
• Nivel alto de azúcar en la sangre (hiperglucemia)
• Pérdida de apetito
• Alteración del gusto (disgeusia)
• Dolor de cabeza
• Sangrado nasal (epistaxis)
• Tos
• Úlceras en la boca
• Molestias en el estómago incluyendo sensación de mareo (náusea) o diarrea
• Erupción en la piel
• Picor (prurito)
• Sensación de debilidad o cansancio
• Cansancio, dificultad para respirar, mareo, palidez de la piel, signos de un nivel bajo de glóbulos rojos (anemia)
• Hinchazón de los brazos, manos, pies, tobillos u otras partes del cuerpo (signos de edema)
• Pérdida de peso
• Nivel alto de lípidos (grasas) en la sangre (hipercolesterolemia)
Frecuentes (pueden afectar hasta 1 de cada 10 personas)
• Sangrado espontáneo o hematomas (signos de un nivel bajo de plaquetas, también conocido como trombocitopenia)
• Dificultad para respirar (disnea)
• Sed, baja eliminación de orina, orina oscura, piel seca enrojecida, irritabilidad (signos de deshidratación)
• Problemas para dormir (insomnio)
• Dolor de cabeza, mareo (signo de presión arterial alta, también conocido como hipertensión)
• Fiebre, dolor de garganta, úlceras en la boca debidas a infecciones (signos de un nivel bajo de glóbulos blancos, leucopenia, linfopenia y/o neutropenia)
• Fiebre
• Inflamación de la mucosa interna de la boca, estómago, intestino
• Sequedad de la boca
• Ardor de estómago (dispepsia)
• Vómitos
• Dificultad para tragar (disfagia)
• Dolor abdominal
• Acné
• Erupción y dolor en las palmas de las manos o las plantas de los pies (síndrome palmo-plantar)
• Enrojecimiento de la piel (eritema)
• Dolor articular
• Dolor en la boca
• Alteraciones en la menstruación como periodos irregulares
• Nivel alto de lípidos (grasas) en la sangre (hiperlipidemia, aumento de triglicéridos)
• Nivel bajo de potasio en la sangre (hipopotasemia)
• Nivel bajo de fosfato en la sangre (hipofosfatemia)
• Nivel bajo de calcio en la sangre (hipocalcemia)
• Sequedad de la piel, exfoliación de la piel, lesiones en la piel
• Alteraciones en las uñas, ruptura de las uñas
• Pérdida de pelo leve
• Análisis alterados de la función del hígado (aumento de alanina y aspartato aminotransferasa)
• Análisis alterados de la función del riñón (aumento de creatinina)
• Lagrimeo con picor, enrojecimiento e hinchazón
• Proteínas en la orina
Poco frecuentes (puede afectar hasta 1 de cada 100 personas)
• Debilidad, sangrado espontáneo o hematomas e infecciones frecuentes con signos como fiebre, escalofríos, dolor de garganta o úlceras en la boca (signos de nivel bajo de células en la sangre, también conocido como pancitopenia)
• Pérdida del sentido del gusto (ageusia)
• Tos con sangre (hemoptisis)
• Alteraciones en la menstruación como ausencia de periodos (amenorrea)
• Eliminación de orina de forma más frecuente durante el día
• Dolor en el pecho
• Cicatrización anormal de las heridas
• Sofocos
• Ojo rosado o rojo (conjuntivitis)
Raras (puede afectar hasta 1 de cada 1.000 personas)
• Cansancio, dificultad para respirar, mareo, palidez en la piel (signos de un nivel bajo de glóbulos rojos, posiblemente debido a un tipo de anemia denominada aplasia pura de glóbulos rojos)
• Hinchazón de la cara, alrededor de los ojos, boca y la mucosa interior de la boca y/o garganta, así como la lengua y dificultad para respirar o tragar (también conocido como angioedema), pueden ser signos de una reacción alérgica
Si estas reacciones adversas empeoran, informe a su médico y/o farmacéutico. La mayoría de efectos adversos son de leves a moderados y generalmente desaparecen si se interrumpe el tratamiento durante unos pocos días.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Afinitor
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en el envase y en el blister. La fecha de caducidad es el último día del mes que se indica.
- No conservar a temperatura superior a 25°C.
- Conservar en el embalaje original para protegerlo de la luz y de la humedad.
- Abrir el blíster justo antes de tomar los comprimidos.
- No utilice este medicamento si observa que el envase está dañado o muestra signos de manipulación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de Afinitor
- El principio activo es everolimus.
- Cada comprimido de Afinitor 2,5 mg contiene 2,5 mg de everolimus.
- Cada comprimido de Afinitor 5 mg contiene 5 mg de everolimus.
- Cada comprimidos de Afinitor 10 mg contiene 10 mg de everolimus.
- Los demás componentes son hidroxitolueno butilado (E321), estearato de magnesio, lactosa monohidrato, hipromelosa, crospovidona tipo A y lactosa anhidra.
Aspecto del producto y contenido del envase
Los comprimidos de Afinitor 2,5 mg son alargados, de color blanco a ligeramente amarillento. Tiene la inscripción «LCL» en una cara y «NVR» en la otra.
Los comprimidos de Afinitor 5 mg son alargados, de color blanco a ligeramente amarillento. Tienen la inscripción «5» en una cara y «NVR» en la otra.
Los comprimidos de Afinitor 10 mg son alargados, de color blanco a ligeramente amarillento. Tienen la inscripción «UHE» en una cara y «NVR» en la otra.
Afinitor 2,5 mg está disponbile en envases que contienen 30 ó 90 comprimidos.
Afinitor 5 mg y Afinitor 10 mg están disponibles en envases que contienen 10, 30 ó 90 comprimidos. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
Responsable de la fabricación
Novartis Pharma GmbH Roonstrasse 25 D-90429 Nürnberg Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Etarapna
Novartis Pharma Services Inc. Tea.: +359 2 489 98 28
Ceská republika
Novartis s.r.o.
Tel: +420 225 775 111
Danmark
Novartis Healthcare A/S Tlf: +45 39 16 84 00
Lietuva
Novartis Pharma Services Inc. Tel: +370 5 269 16 50
Luxembourg/Luxemburg
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Magyarország
Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00
Malta
Novartis Pharma Services Inc. Tel: +356 2122 2872
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EXXáóa Novartis (Hellas) A.E.B.E. Tr(k: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
España Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmacéuticos, S.A Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Romania Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
|
Italia Novartis Farma S.p.A. Tel: +39 02 96 54 1 |
Suomi/Finland Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200 |
|
Kúrcpog Novartis Pharma Services Inc. Tr(k: +357 22 690 690 |
Sverige Novartis Sverige AB Tel: +46 8 732 32 00 |
|
Latvija Novartis Pharma Services Inc. Tel: +371 67 887 070 |
United Kingdom Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370 |
|
Fecha de la última revisión de este prospecto: |
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
51