Abstral 800 Microgramos Comprimidos Sublinguales
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Abstral 100 microgramos comprimidos sublinguales Abstral 200 microgramos comprimidos sublinguales Abstral 300 microgramos comprimidos sublinguales Abstral 400 microgramos comprimidos sublinguales Abstral 600 microgramos comprimidos sublinguales Abstral 800 microgramos comprimidos sublinguales
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un comprimido sublingual contiene:
100 microgramos de fentanilo (como citrato)
200 microgramos de fentanilo (como citrato)
300 microgramos de fentanilo (como citrato)
400 microgramos de fentanilo (como citrato)
600 microgramos de fentanilo (como citrato)
800 microgramos de fentanilo (como citrato)
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido sublingual
de 100 microgramos es un comprimido blanco redondo.
de 200 microgramos es un comprimido blanco con forma oval
de 300 microgramos es un comprimido blanco con forma triangular.
de 400 microgramos es un comprimido blanco con forma de diamante.
de 600 microgramos es un comprimido blanco con forma de “D”
de 800 microgramos sublingual es un comprimido blanco con forma de cápsula.
El comprimido sublingual El comprimido sublingual El comprimido sublingual El comprimido sublingual El comprimido sublingual El comprimido sublingual
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de dolor irruptivo en pacientes adultos que ya reciben tratamiento con opiáceos para dolor crónico en cáncer. El dolor irruptivo es una exacerbación transitoria de dolor que se produce sobre una base de dolor persistente controlado por otros medios.
4.2 Posología y forma de administración
Abstral se debe administrar únicamente a aquellos pacientes que toleren su tratamiento con opiáceos para el dolor persistente del cáncer. Se puede considerar que los pacientes toleran los opiáceos si toman al menos 60 mg de morfina oral al día, al menos 25 microgramos de fentanilo transdérmico por hora, al menos 30 mg de oxicodona al día, al menos 8 mg de hidromorfona oral al día o una dosis equianalgésica de otro opioide durante una semana o más.
4.2.2 Forma de administración
Abstral comprimidos sublinguales se debe administrar directamente bajo la lengua en la parte más profunda. Abstral comprimidos sublinguales no se debe tragar sino dejar que se disuelva completamente en la cavidad sublingual sin masticar ni chupar. Se debe advertir a los pacientes de que no coman ni beban nada hasta que el comprimido sublingual esté completamente disuelto.
En pacientes con sequedad de boca, se puede utilizar agua para humedecer la mucosa oral antes de tomar Abstral.
Ajuste de la dosis:
El objetivo del ajuste de dosis es identificar una dosis óptima de mantenimiento para el tratamiento actual de los episodios de dolor irruptivo. Esta dosis óptima debe ofrecer la analgesia adecuada, con un nivel aceptable de efectos secundarios.
La dosis óptima de Abstral se determinará de forma individual mediante un ajuste ascendente. Están disponibles varias dosis para usar durante la fase de ajuste de dosis. La dosis inicial de Abstral utilizada debe ser de 100 microgramos, con aumento de la dosis según sea necesario utilizando las distintas dosis disponibles.
Se debe controlar estrechamente a los pacientes hasta que se alcance la dosis óptima.
No se debe cambiar a Abstral desde otros medicamentos que contengan fentanilo en una proporción de 1:1 debido a los diferentes perfiles de absorción. Si los pacientes cambian de otro medicamento que contenga fentanilo, será necesario un nuevo ajuste de dosis con Abstral.
Se recomienda el siguiente régimen de dosificación para el ajuste, aunque en todos los casos, el médico debe tener en cuenta la necesidad clínica del paciente, la edad y las enfermedades concomitantes.
Todos los pacientes deben iniciar el tratamiento con una dosis única de un comprimido sublingual de 100 microgramos. Si no se obtiene una analgesia adecuada dentro de los 15-30 minutos posteriores a la administración de un comprimido sublingual, se puede administrar un segundo comprimido sublingual complementario de 100 microgramos. Si no se obtiene una analgesia adecuada dentro de los 15-30 minutos posteriores a la primera dosis, se debe considerar el aumento de la dosis hasta la siguiente dosificación más alta disponible, para el siguiente episodio de dolor irruptivo (ver la figura de más abajo).
El aumento de la dosis se debe seguir paso a paso hasta que se consiga una analgesia adecuada con reacciones adversas tolerables. La dosis del segundo comprimido sublingual complementario se debe aumentar de 100 a 200 microgramos para las dosis de 400 microgramos y superiores. Esto se representa en la tabla más abajo. No se deben administrar más de dos (2) dosis para un solo episodio de dolor irruptivo durante esta fase de ajuste.

PROCESO DE AJUSTE DE ABSTRAL
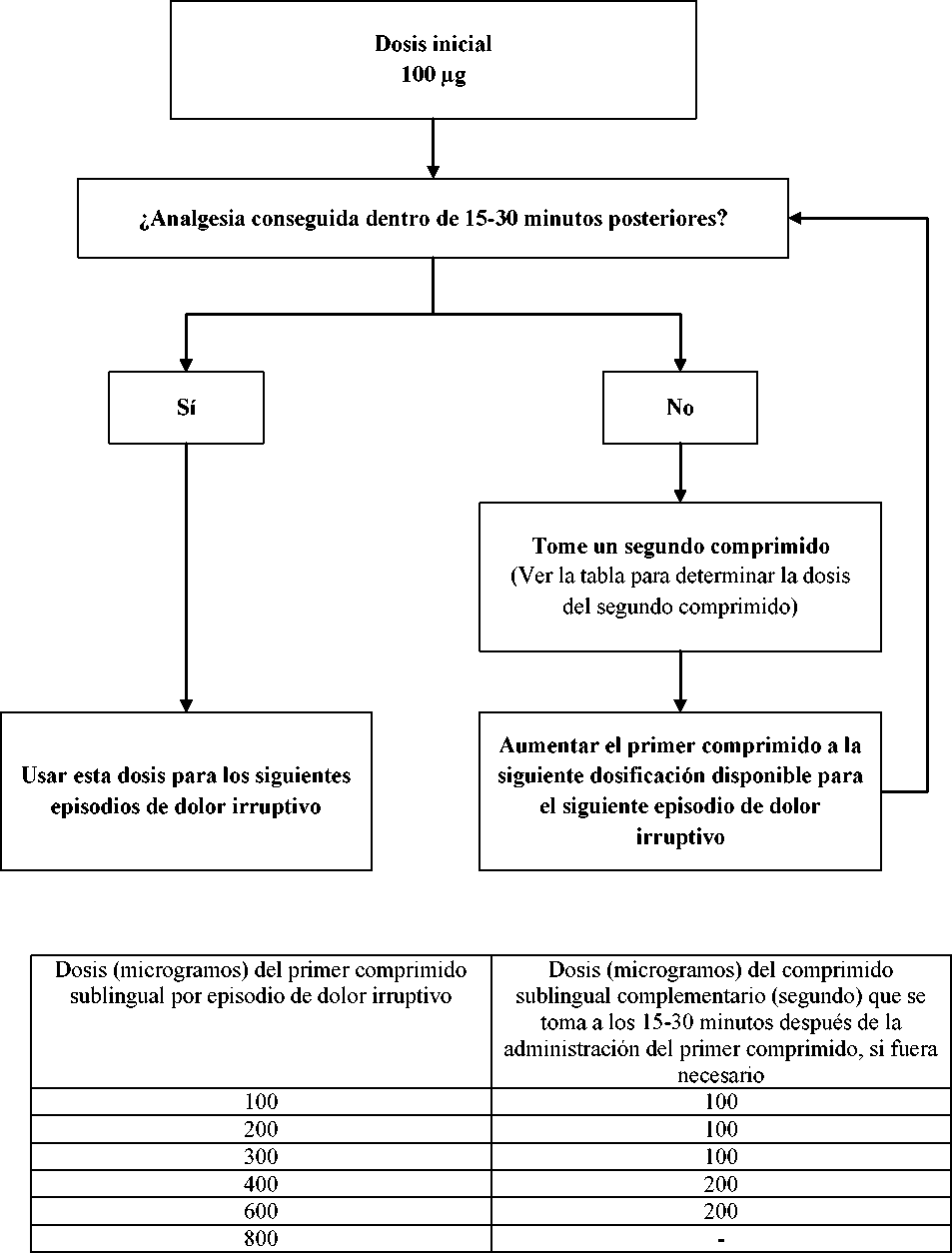
Si se obtiene una analgesia adecuada a altas dosis, pero los efectos adversos no son aceptables, se puede administrar una dosis intermedia (utilizando el comprimido sublingual 100 microgramos, cuando sea apropiado).
SAN IDAD, POLITICA LIUCA
SOCIAL E IGUALDAD IALDAD Agencia espanoia de cisoe
productos san-tanos [teños
Durante el periodo de ajuste de la dosis, se puede indicar a los pacientes que usen múltiplos de comprimidos de 100 microgramos y/o comprimidos de 200 microgramos para cualquier dosis individual. No deben tomarse más de cuatro (4) comprimidos de una sola vez.
La eficacia y seguridad de dosis superiores a 800 microgramos no han sido evaluadas en pacientes de estudios clínicos.
Para minimizar el riesgo de aparición de reacciones adversas relacionadas con opioides y para identificar la dosis adecuada, es imprescindible que los profesionales sanitarios lleven un estrecho control de los pacientes durante el proceso de ajuste.
Durante el periodo de ajuste de la dosis, los pacientes deben esperar como mínimo 2 horas antes de tratar otro episodio de dolor irruptivo con Abstral.
Tratamiento de mantenimiento:
Una vez determinada la dosis adecuada, que puede exceder de un comprimido, los pacientes deben mantener dicha dosis y limitar el consumo a un máximo de cuatro dosis de Abstral al día.
Durante el periodo de mantenimiento, los pacientes deben esperar como mínimo 2 horas antes de tratar otro episodio de dolor irruptivo con Abstral.
Reajuste de la dosis:
Si cambia de manera importante la respuesta (analgesia o reacciones adversas) a la dosis ajustada de Abstral, podría ser necesario un reajuste de la dosis para asegurar que se mantiene una dosis óptima.
Si se manifiestan más de cuatro episodios de dolor irruptivo al día durante un período de más de cuatro días consecutivos, se debe volver a calcular la dosis del opiáceo de acción prolongada utilizado para el dolor persistente. Si se cambia el opiáceo de acción prolongada o la dosis del opiáceo de acción prolongada, se debe revisar y, si es necesario, reajustar la dosis de Abstral para asegurar que el paciente esté tomando la dosis óptima.
Cualquier reajuste de dosis de cualquier analgésico debe ser supervisado obligatoriamente por un profesional sanitario.
Suspensión del tratamiento:
La administración de Abstral debe interrumpirse inmediatamente si el paciente ya no sufre episodios de dolor irruptivo. El tratamiento para el dolor irruptivo persistente debe mantenerse conforme a la prescripción.
Si se interrumpen todos los tratamientos con opioides, el médico deberá vigilar estrechamente al paciente para tratar los posibles efectos de abstinencia por una retirada repentina.
Uso en niños y adolescentes:
Abstral no debe ser utilizado en niños menores de 18 años debido a la ausencia de datos sobre seguridad y eficacia.
Uso en pacientes de edad avanzada
El ajuste de dosis debe realizarse con especial precaución y debe vigilarse estrechamente a los pacientes por si aparecieran signos de toxicidad por fentanilo (ver sección 4.4).
Uso en pacientes con insuficiencia renal y hepática
Debe tenerse especial cuidado durante el proceso de ajuste de dosis en pacientes con disfunción renal o hepática por si se detectaran signos de toxicidad por fentanilo (ver sección 4.4).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Pacientes que no estén en tratamiento de mantenimiento con opioides, por el mayor riesgo de depresión respiratoria.
Depresión respiratoria grave o enfermedades pulmonares obstructivas graves.
Tratamiento del dolor agudo distinto al dolor irruptivo.
4.4 Advertencias y precauciones especiales de empleo
Los pacientes y sus cuidadores deben estar informados de que Abstral contiene un principio activo en una cantidad que puede ser mortal para un niño, por lo que todos los comprimidos se deben mantener fuera del alcance y de la vista de los niños.
Debido a la posibilidad de efectos adversos potencialmente graves, que pueden aparecer durante el tratamiento con opioides como Abstral, deberá advertirse a los pacientes y a sus cuidadores de la importancia de tomar Abstral correctamente y de las acciones a tomar en el caso de que aparezcan síntomas de sobredosis.
Antes de comenzar el tratamiento con Abstral, es importante que se encuentre estabilizado el tratamiento opioide de larga duración que el paciente utilice para controlar su dolor persistente.
La administración repetida de opioides como fentanilo, puede producir tolerancia y dependencia física y/o fisiológica. Es rara la aparición de adicción yatrogénica tras el uso terapéutico de opioides.
Al igual que todos los opioides, existe un riesgo de depresión respiratoria clínicamente significativo, asociado al uso de Abstral. Deberán adoptarse precauciones especiales durante el ajuste de la dosis de Abstral, en pacientes con enfermedad pulmonar obstructiva crónica u otras patologías que puedan predisponer a la depresión respiratoria (como miastenia gravis) debido al riesgo de una depresión respiratoria adicional, que pueda producir insuficiencia respiratoria.
Abstral debe administrarse con extrema precaución en pacientes que puedan ser especialmente sensibles a los efectos intracraneales de la hipercapnia, como los que muestren evidencia de presión intracraneal elevada, reducción de la conciencia, coma o tumores cerebrales. En pacientes con lesiones craneales, el curso clínico puede enmascararse por el uso de opioides. En estos casos, los opioides deberán utilizarse sólo si es estrictamente necesario.
Enfermedad cardiaca
El fentanilo puede provocar bradicardia y debe administrarse con precaución en pacientes con bradiarritmias previas o ya existentes.
Los datos de estudios intravenosos con fentanilo, sugieren que los pacientes de edad avanzada pueden mostrar un menor aclaramiento, prolongando su semivida y que por tanto, pueden ser más sensibles al principio activo que los pacientes más jóvenes. Los pacientes de edad avanzada, caquéxicos o debilitados
deben ser vigilados atentamente para detectar signos de toxicidad por fentanilo, y reducir la dosis, si fuera necesario.
Abstral debe ser administrado con precaución en pacientes con disfunción hepática o renal, especialmente durante la fase de ajuste de dosis. El uso de Abstral en pacientes con insuficiencia hepática o renal, puede aumentar la biodisponibilidad de fentanilo y disminuir su aclaramiento sistémico, lo que puede dar lugar a su acumulación, aumentando y prolongando los efectos opioides.
Deben adoptarse precauciones en el tratamiento de pacientes con hipovolemia e hipotensión.
No se han realizado estudios de Abstral en pacientes con úlceras bucales o mucositis. En estos pacientes puede existir el riesgo de una mayor exposición sistémica y por tanto, se recomiendan precauciones especiales durante la fase de ajuste de dosis.
No deberían observarse efectos notables al cesar el tratamiento con Abstral, si bien los síntomas posibles de la retirada son: ansiedad, temblor, sudoración, palidez, náusea y vómitos.
Síndrome serotoninérgico
Se recomienda precaución cuando Abstral se administre de forma concomitante con fármacos que afecten a los sistemas de neurotransmisores serotoninérgicos.
El desarrollo de un síndrome serotoninérgico potencialmente mortal puede aparecer con el uso concomitante de fármacos serotoninérgicos, como los inhibidores selectivos de la recaptación de serotonina (ISRS) y los inhibidores de la recaptación de serotonina y noradrenalina (IRSN), y con los fármacos que afectan al metabolismo de la serotonina (incluidos los inhibidores de la monoamino oxidasa [IMAO]). Esto puede ocurrir con la dosis recomendada.
El síndrome serotoninérgico puede incluir cambios en el estado mental (p. ej., agitación, alucinaciones, coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, hipertermia), anomalías neuromusculares (p. ej., hiperreflexia, descoordinación, rigidez) y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea).
Si se sospecha de un síndrome serotoninérgico, debe suspenderse el tratamiento con Abstral.
4.5 Interacción con otros medicamentos y otras formas de interacción
Fentanilo se metaboliza por el CYP3A4. Los fármacos que inhiben la actividad del CYP3A4 como los antibióticos macrólidos (como eritromicina), agentes antifungicos azólicos (como ketoconazol o itraconazol) o ciertos inhibidores de la proteasa (como ritonavir) pueden aumentar la biodisponibilidad de fentanilo, disminuyendo su aclaramiento sistémico y potenciando o prolongando los efectos opioides. También se sabe que el zumo de pomelo inhibe el CYP3A4. Por tanto, fentanilo debe administrarse con precaución si se utiliza de forma concomitante con inhibidores de CYP3A4.
El uso concomitante de otros agentes depresores del Sistema Nervioso Central (SNC), como otros derivados de la morfina (analgésicos y antitusígenos), anestésicos generales, relajantes del músculo esquelético, antidepresivos sedantes, antihistamínicos H1 sedantes, barbitúricos, ansiolíticos (como benzodiazepinas), hipnóticos, antipsicóticos, clonidina y sustancias relacionadas, puede aumentar los
efectos depresores sobre el SNC. También pueden aparecer depresión respiratoria, hipotensión y sedación profunda.
El alcohol potencia los efectos sedantes de los analgésicos de tipo morfina, por lo que no se recomienda la administración concomitante de Abstral con bebidas alcohólicas o con medicamentos que contengan alcohol.
No está recomendada la administración de Abstral en pacientes que hayan recibido Inhibidores de la MonoAmino Oxidasa (IMAOs) durante las dos semanas anteriores, ya que se ha comunicado una potenciación grave e impredecible, de los IMAOs, con analgésicos opiáceos.
No está recomendado el uso concomitante de agonistas/antagonistas parciales de los opioides (p.ej. buprenorfina, nalbufina, pentazocina), ya que tienen una elevada afinidad por los receptores opioides con una actividad intrínseca relativamente baja y por lo tanto contrarrestan parcialmente el efecto analgésico del fentanilo y pueden inducir síntomas de abstinencia en pacientes dependientes de los opioides.
Fármacos serotoninérgicos
La administración concomitante de fentanilo con un fármaco serotoninérgico, como un inhibidor selectivo de la recaptación de serotonina (ISRS), un inhibidor de la recaptación de serotonina y noradrenalina (IRSN) o un inhibidor de la monoamino oxidasa (IMAO), puede aumentar el riesgo de síndrome serotoninérgico, un trastorno potencialmente mortal.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
No se ha establecido la seguridad del fentanilo en el embarazo. Los estudios en animales han demostrado toxicidad reproductiva, con deterioro de la fertilidad en ratas (ver sección 5.3). Se desconoce el riesgo en humanos. Fentanilo no debe utilizarse durante el embarazo excepto si fuese claramente necesario.
El tratamiento prolongado durante el embarazo puede producir síntomas de abstinencia en el recién nacido.
Fentanilo no debe utilizarse durante el parto o alumbramiento (incluyendo cesárea) ya que fentanilo atraviesa la placenta y puede producir depresión respiratoria en el feto o en el recién nacido.
4.6.2 Lactancia
El fentanilo pasa a la leche materna y puede provocar sedación y depresión respiratoria en el lactante. Las mujeres en periodo de lactancia no deben utilizar fentanilo y no debe reanudarse la lactancia hasta que hayan transcurrido al menos 5 días desde la última administración de fentanilo.
4.6.3 Fertilidad
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios con Abstral de los efectos sobre la capacidad para conducir y utilizar máquinas.
Sin embargo, se sabe que los analgésicos opioides pueden disminuir la capacidad mental o física para realizar tareas potencialmente peligrosas como conducir o manejar máquinas. Debe advertirse a los
pacientes que no conduzcan o utilicen máquinas si se sienten mareados, somnolientos o si tienen visión borrosa o doble mientras estén tomando Abstral.
4.8 Reacciones adversas
Cabe esperar que con Abstral se produzcan los efectos adversos típicos de los opioides; si bien tienden a disminuir en su intensidad con el uso continuado. Los efectos adversos potencialmente más graves, asociados al uso de opioides son la depresión respiratoria (que puede producir parada respiratoria), hipotensión y shock.
Los ensayos clínicos con Abstral se diseñaron para valorar la seguridad y la eficacia en el tratamiento de pacientes con dolor oncológico irruptivo; todos los pacientes tomaban opioides en forma concomitante, como morfina de liberación prolongada, oxicodona de liberación prolongada o fentanilo transdérmico, para su dolor persistente. En consecuencia, no es posible distinguir con exactitud los efectos de Abstral solo.
Las reacciones adversas observadas más frecuentemente con Abstral incluyen las reacciones adversas típicas de los opioides, tales como náuseas, estreñimiento, somnolencia y cefalea.
Resumen tabulado de las reacciones adversas con Abstral y/u otros compuestos que contienen fentanilo:
Se han notificado las siguientes reacciones adversas con Abstral y/u otros compuestos que contienen fentanilo provenientes de ensayos clínicos y de la experiencia post-comercialización. Estas reacciones adversas se clasifican por órgano/sistema y frecuencia (muy frecuentes > 1/10; frecuentes > 1/100 a < 1/10; poco frecuentes >1/1000 a <1/100; frecuencia no conocida (no puede estimarse a partir de los datos disponibles)). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Clasificación por órganos y sistemas |
Reacción adversa por frecuencia | |||
|
Muy frecuentes >1/10 |
Frecuentes > 1/100 a < 1/10) |
Poco frecuentes >1/1000 a < 1/100) |
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles) | |
|
Trastornos del sistema inmunológico |
Hipersensibilidad | |||
|
Trastornos del metabolismo y de la nutrición |
Anorexia Disminución del apetito | |||
|
Trastornos psiquiátricos |
Depresión Paranoia Estado de confusión Desorientación Cambios del estado mental Ansiedad Euforia |
Alucinaciones | ||

|
Clasificación por órganos y sistemas |
Reacción adversa por frecuencia | |||
|
Muy frecuentes >1/10 |
Frecuentes > 1/100 a < 1/10) |
Poco frecuentes >1/1000 a < 1/100) |
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles) | |
|
Disforia Labilidad emocional Alteraciones de la atención Insomnio | ||||
|
Trastornos del sistema nervioso |
Mareos Cefalea Somnolencia |
Amnesia Parosmia Disgeusia Temblor Letargia Hipoestesia Trastornos del sueño |
Convulsión | |
|
Trastornos oculares |
Visión borrosa | |||
|
Trastornos cardíacos |
Taquicardia Bradicardia | |||
|
Trastornos vasculares |
Hipotensión | |||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea |
Dolor faríngolaringeo Opresión en la garganta |
Depresión respiratoria | |
|
Trastornos gastrointestinales |
Náuseas |
Estomatitis Vómitos Estreñimiento Sequedad de boca |
Ulceración de la boca Ulceración gingival Ulceración en los labios Retraso del vaciado gástrico Dolor abdominal Dispepsia Molestia de estómago Trastornos en la lengua Estomatitis aftosa |
Inflamación de la lengua Diarrea |
5AN IDAD, POLITICA LITIGA
SOCIAL E IGUALDAD IALDAD
Agencia esparto» de cSacse-
medicamentos y ¡y
Cfoouctos san-tancs taws
|
Clasificación por órganos y sistemas |
Reacción adversa por frecuencia | |||
|
Muy frecuentes >1/10 |
Frecuentes > 1/100 a < 1/10) |
Poco frecuentes >1/1000 a < 1/100) |
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles) | |
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis |
Lesión cutánea Erupción cutánea Pruritis alérgica Prurito Sudores nocturnos Aumento de la tendencia a formar hematomas | ||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Artralgia Rigidez musculoesquelética Rigidez articular | |||
|
Trastornos del aparato reproductor y de la mama |
Disfunción eréctil | |||
|
Trastornos generales y alteraciones en el lugar de administración |
Fatiga |
*Síndrome de abstinencia Astenia Malestar |
Enrojecimiento y sofocos Edema periférico Pirexia | |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Sobredosis accidental |
Caídas | ||
* se han observado síntomas de abstinencia como náuseas, vómitos, diarrea, ansiedad, escalofríos, temblores y sudoración, con el fentanilo transmucoso.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
LITTCA ALDAD ota efe
4.9 Sobredosis
Los síntomas de sobredosis de fentanilo son una extensión de sus acciones farmacológicas, siendo el efecto más grave la depresión respiratoria, que puede producir parada respiratoria.
El tratamiento inmediato de la sobredosificación de opioides incluye la eliminación de cualquier comprimido sublingual de Abstral que quede en la boca, estimulación física y verbal del paciente y valoración del nivel de conciencia. Debe establecerse y mantenerse una vía aérea. Si fuera necesario se puede abrir una vía orofaríngea o insertar un tubo endotraqueal, administrar oxígeno o comenzar con ventilación mecánica, según proceda. Debe mantenerse una temperatura corporal adecuada y administración parenteral de líquidos.
Para el tratamiento de la sobredosis accidental en pacientes que no hayan recibido opioides anteriormente, deberá utilizarse naloxona u otro antagonista opioide según esté indicado clínicamente y de acuerdo con su Resumen de las Características del Producto. Puede ser necesaria la administración repetida de antagonistas opioides si se prolonga la depresión respiratoria.
Debe tenerse cuidado al utilizar naloxona u otros antagonistas opioides para tratar la sobredosis en pacientes tratados de manera continuada con opioides, debido al riesgo de provocar un síndrome de abstinencia agudo.
Si apareciese hipotensión grave o persistente, se debe considerar la posibilidad de hipovolemia y deberá manejarse la situación con una adecuada terapia parenteral de líquidos.
Tanto con el uso de fentanilo como de otros opioides, se ha descrito rigidez muscular que interfiere con la respiración. En esta situación puede ser necesaria la intubación endotraqueal, ventilación asistida y administración de antagonistas opioides, así como de relajantes musculares.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo fármacoterapéutico: Analgésicos; Opioides; Derivados de fenilpiperidina. Código ATC: N02AB03
Fentanilo es un analgésico p-opioide potente que produce una aparición rápida de analgesia y de corta duración de acción. Fentanilo es aproximadamente 100 veces más potente que la morfina como analgésico. Los efectos secundarios de fentanilo sobre el sistema nervioso central (SNC) la función respiratoria y gastrointestinal son típicos de los analgésicos opioides y se consideran efectos de clase.
Estos pueden incluir depresión respiratoria, bradicardia, hipotermia, estreñimiento, miosis, dependencia física y euforia.
Los efectos analgésicos de fentanilo están relacionados con el nivel en sangre de la sustancia activa: en pacientes que no hayan recibido tratamiento previo con opioides, las concentraciones séricas analgésicas eficaces mínimas de fentanilo oscilan entre 0,3-1,2 ng/ml, mientras que niveles sanguíneos de 10-20 ng/ml producen anestesia quirúrgica y depresión respiratoria profunda.
En pacientes con dolor oncológico crónico con dosis de opioides de mantenimiento estables, se ha observado una mejora estadísticamente significativa en la diferencia de la intensidad del dolor con Abstral frente a placebo, a partir de los 10 minutos de la administración (ver figura 1 debajo), con una necesidad significativamente inferior del uso de terapia analgésica de rescate.
Figura 1 Diferencia Promedio de la Intensidad del Dolor desde la línea base (± SE) para Abstral comparada con Placebo (medida con la escala de tipo Likert del 0 al 10)
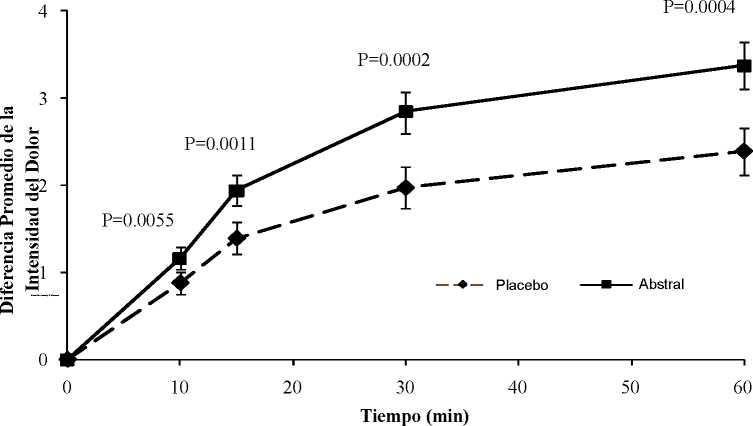
La seguridad y eficacia de Abstral se ha evaluado en pacientes que toman el fármaco al principio del episodio de dolor irruptivo. El uso preventivo de Abstral para los episodios de dolor previsible no se ha investigado en los ensayos clínicos.
Fentanilo, al igual que todos los agonistas de los receptores opioides p, produce depresión respiratoria dosis-dependiente. Este riesgo es más elevado en pacientes que no hayan recibido tratamiento previo con opioides que en pacientes que tienen dolor grave o que reciban tratamiento crónico con opioides. Los tratamientos prolongados con opioides suelen conducir al desarrollo de tolerancia a los efectos secundarios.
Mientras que los opioides aumentan, por lo general, el tono del músculo liso del tracto urinario, el efecto neto tiende a ser variable, produciendo en algunos casos urgencia urinaria y en otros, dificultades en la micción.
Los opioides aumentan el tono y disminuyen las contracciones de propulsión del músculo liso del tracto gastrointestinal, produciendo una prolongación del tiempo de tránsito intestinal, que puede ser responsable del estreñimiento causado por el fentanilo.
5.2 Propiedades farmacocinéticas
Fentanilo es un fármaco muy lipofílico que se absorbe muy rápidamente a través de la mucosa oral y más lentamente, a través del tracto gastrointestinal. El fentanilo administrado por vía oral sufre efectos de primer paso hepático e intestinal.
Abstral es una formulación de comprimido sublingual de disolución rápida. La absorción rápida de fentanilo tiene lugar a los 30 minutos tras la administración de Abstral. Se ha calculado que la biodisponibilidad absoluta de Abstral es, del 54%. Las concentraciones plasmáticas medias máximas de fentanilo oscilan entre 0,2 y 1,3 ng/ml (tras la administración de 100 a 800 pg de Abstral) y se alcanzan entre 22,5 a 240 minutos.
Aproximadamente el 80-85% del fentanilo se une a proteínas plasmáticas, principalmente a a1-glicoproteína y en menor grado, a albúmina y lipoproteína. El volumen de distribución de fentanilo en fase estacionaria es de aproximadamente 3-6 l/kg.
Fentanilo se metaboliza principalmente mediante el CYP3A4 produciendo metabolitos farmacológicamente inactivos, incluyendo norfentanilo. En las 72 horas siguientes a la administración intravenosa de fentanilo, alrededor del 75% de la dosis se excreta por orina, en su mayoría en forma de metabolitos, con menos de un 10% de fármaco en forma inalterada. Alrededor del 9% de la dosis se recupera en las heces, principalmente en forma de metabolitos. El aclaramiento plasmático total de fentanilo es de aproximadamente 0,5 l/h/kg.
Tras la administración de Abstral, la semivida de eliminación principal de fentanilo es de aproximadamente 7 horas (intervalo 3-12,5 horas) y la semivida terminal es de aproximadamente 20 horas (intervalo 11,5-25 horas).
La farmacocinética de Abstral ha demostrado ser proporcional a la dosis en el intervalo de 100 a 800 pg. Los estudios farmacocinéticos han demostrado que los comprimidos múltiples son bioequivalentes a los comprimidos individuales de una dosis equivalente.
Insuficiencia renal/hepática
La insuficiencia hepática o renal puede producir un aumento de las concentraciones séricas. Los pacientes de edad avanzada, caquéxicos o con insuficiencia en general pueden mostrar un menor aclaramiento de fentanilo, que puede resultar en una semivida terminal más prolongada (ver secciones 4.2 y 4.4).
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad y toxicidad a dosis repetidas, que no estén ya cubiertos en las otras secciones de esta ficha técnica. Los estudios en animales han demostrado reducción de la fertilidad y aumento de la mortalidad en los fetos de ratas. Sin embargo, no se han demostrado efectos teratogénicos.
Las pruebas de mutagenicidad en bacterias y roedores han mostrado resultados negativos. Al igual que otros opioides, fentanilo ha mostrado efectos mutagénicos in vitro en células de mamíferos. Sin embargo es poco probable el riesgo mutagénico con el uso terapéutico, ya que los efectos se indujeron únicamente a concentraciones muy elevadas.
Los estudios de carcinogenicidad (bioensayo dérmico alternativo de 26 semanas en ratones transgénicos Tg.AC; estudio de carcinogenicidad subcutánea de 2 años en ratas) con fentanilo no pusieron de manifiesto ningún hallazgo indicativo de potencial oncogénico. La evaluación de los cortes laminares de cerebro del estudio de carcinogenicidad en ratas mostró lesiones cerebrales en los animales tratados con dosis altas de citrato de fentanilo. Se desconoce la relevancia de estos hallazgos para los seres humanos.
6 . DATOS FARMACÉUTICOS 6.1 Lista de excipientes
Manitol (E421)
3E
Celulosa microcristalina silicificada Croscarmelosa de sodio Estearato de magnesio
6.2 Incompatibilidades
No aplicable
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C.
Conservar en el embalaje original para protegerlo de la humedad.
6.5 Naturaleza y contenido del envase
Abstral comprimidos sublinguales se acondiciona en blisters a prueba de niños, con alveolos de OPA/aluminio/PVC con cubierta de papel/poliéster/aluminio, contenidos en el interior de un envase externo de cartón. El envase lleva un código de color para cada dosis de Abstral comprimidos sublinguales.
Tamaño del envase: Envases con 10 ó 30 comprimidos sublinguales. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
El material no utilizado debe ser eliminado de forma segura.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo a la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
ProStrakan Ltd,
Galabank Business Park,
Galashiels, TD1 1QH Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
N° Registro: 70.501 N° Registro: 70.502 N° Registro: 70.504 N° Registro: 70.507 N° Registro: 70.508 N° Registro: 70.511
Abstral 100 microgramos comprimidos sublinguales Abstral 200 microgramos comprimidos sublinguales Abstral 300 microgramos comprimidos sublinguales Abstral 400 microgramos comprimidos sublinguales Abstral 600 microgramos comprimidos sublinguales Abstral 800 microgramos comprimidos sublinguales
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 12-02-2009