Abilify Maintena 300 Mg Polvo Y Disolvente Para Suspension De Liberacion Prolongada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable Cada vial contiene 300 mg de aripiprazol.
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable Cada vial contiene 400 mg de aripiprazol.
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Cada jeringa precargada contiene 300 mg de aripiprazol.
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Cada jeringa precargada contiene 400 mg de aripiprazol.
Después de reconstituir, cada ml de suspensión contiene 200 mg de aripiprazol.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable Polvo y disolvente para suspensión de liberación prolongada inyectable
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Polvo: blanco a blanquecino Disolvente: solución transparente
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Abilify Maintena está indicado para el tratamiento de mantenimiento de la esquizofrenia en pacientes adultos estabilizados con aripiprazol oral.
4.2 Posología y forma de administración
Posología
En pacientes que nunca han tomado aripiprazol, se debe comprobar la tolerabilidad con aripiprazol oral antes de iniciar el tratamiento con Abilify Maintena.
La dosis inicial y de mantenimiento recomendada de Abilify Maintena es de 400 mg.
No es necesario el ajuste de la dosis de este medicamento. Abilify Maintena se debe administrar una vez al mes como inyección única (no antes de 26 días después de la inyección previa).
Después de la primera inyección, se debe continuar el tratamiento con 10 a 20 mg de aripiprazol oral durante 14 días consecutivos para mantener las concentraciones terapéuticas de aripiprazol durante el inicio del tratamiento.
Si se presentan reacciones adversas con la dosis de 400 mg una vez al mes, se debe considerar una reducción de dosis a 300 mg.
Dosis omitidas
|
Dosis omitidas | |
|
Si la 2 a o 3 a dosis es omitida y el período desde la última inyección es: |
Acción |
|
> 4 semanas y < 5 semanas |
Se debe administrar la inyección lo antes posible y luego retomar el programa mensual de inyecciones. |
|
> 5 semanas |
Se debe recomenzar aripiprazol oral concomitante durante 14 días con la siguiente inyección administrada y luego reiniciar el programa de inyecciones mensuales. |
|
Si la 4 a dosis o las siguientes son omitidas (ej. después de lograr un estado estacionario) y el período desde de la última inyección es: |
Acción |
|
> 4 semanas y < 6 semanas |
La inyección debe administrarse lo antes posible y luego reiniciar el programa de inyecciones mensuales. |
|
> 6 semanas |
Se debe reiniciar el aripiprazol oral concomitantemente durante 14 días, con la siguiente inyección y, posteriormente, reanudar el tratamiento de inyecciones mensuales. |
Poblaciones especiales
Pacientes de edad avanzada
No se ha establecido la seguridad y eficacia de Abilify Maintena para el tratamiento de la esquizofrenia en pacientes de 65 años de edad o mayores de 65 años (ver sección 4.4).
Insuficiencia Renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal (ver la sección 5.2).
Insuficiencia hepática
No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. En pacientes que presentan insuficiencia hepática grave, los datos disponibles son insuficientes para establecer recomendaciones. En estos pacientes, que precisan una dosificación cuidadosa, es preferible utilizar la formulación oral (ver sección 5.2).
Metabolizadores lentos de la CYP2D6 conocidos
En pacientes que se sabe que son metabolizadores lentos de la CYP2D6, la dosis de inicio y mantenimiento debe ser de 300 mg. Cuando se emplea concomitantemente con inhibidores potentes de la CYP3A4, debe reducirse la dosis a 200 mg (ver sección 4.5).
Ajuste de la dosis por interacciones
Los ajustes de dosis deben hacerse en pacientes que estén tomando concomitantemente inhibidores potentes de la CYP3A4 o inhibidores potentes de la CYP2D6 durante más de 14 días. Si el inhibidor de la CYP3A4 o la CYP2D6 se suspende, es posible que la dosis deba ser aumentada a la dosis anterior (ver sección 4.5). Si se producen reacciones adversas a pesar del ajuste de la dosis de Abilify Maintena, se debe reconsiderar la necesidad de utilizar inhibidores de la CYP2D6 o la CYP3A4.
Se debe evitar el empleo de inductores de la CYP3A4 al mismo tiempo que Abilify Maintena durante más de 14 días, porque los niveles sanguíneos de aripiprazol están disminuidos y pueden estar por debajo del nivel en que son efectivos (ver sección 4.5).
Ajuste de la dosis de Abilify Maintena en pacientes en tratamiento concomitante con inhibidores potentes de la CYP2D6, inhibidores potentes de la CYP3A4 y/o inductores de la CYP3A4 durante más de 14 días
|
Dosis ajustada | |
|
Pacientes en tratamiento con 400 mg de Abilify Maintena | |
|
Inhibidores potentes de la CYP2D6 o de la CYP3A4 |
300 mg |
|
Inhibidores potentes de la CYP2D6 y de la CYP3A4 |
200 mg* |
|
Inductores de la CYP3A4 |
Evite su empleo |
|
Pacientes en tratamiento con 300 mg de Abilify Maintena | |
|
Inhibidores potentes de la CYP2D6 o de la CYP3A4 |
200 mg* |
|
Inhibidores potentes de la CYP2D6 y de la CYP3A4 |
160 mg* |
|
Inductores de la CYP3A4 |
Evite su empleo |
Las dosis de 200 mg y 160 mg solo se consiguen ajustando el volumen de inyección con Abilify Maintena polvo y disolvente para suspensión de liberación prolongada inyectable.
Población pediátrica
No se ha establecido la seguridad y la eficacia de Abilify Maintena en niños y adolescentes entre 0-17 años de edad. No se dispone de datos.
Forma de administración
Abilify Maintena está destinado para ser administrado únicamente por vía intramuscular, no por vía intravenosa ni subcutánea. Debe ser administrado por un profesional sanitario.
Abilify Maintena polvo y disolvente para suspensión de liberación prolongada inyectable La suspensión se debe inyectar inmediatamente después de ser reconstituida, pero puede conservarse en el vial a una temperatura inferior a 25 °C durante 4 horas.
Abilify Maintena polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
La suspensión se debe inyectar inmediatamente después de ser reconstituida, pero puede conservarse en la jeringa a una temperatura inferior a 25 °C durante 2 horas.
La suspensión se debe inyectar lentamente en el glúteo o el deltoides, en una única administración (la dosis no se debe dividir). Se debe tener cuidado y evitar inyectarla por error en un vaso sanguíneo.
Administración en el glúteo
La aguja recomendada para la administración en el glúteo es de 38 mm, aguja hipodérmica de seguridad de calibre 22; para pacientes obesos (índice de masa corporal > 28 kg/m2) se debe emplear una aguja hipodérmica de seguridad de 50 mm de calibre 21. Las inyecciones en el glúteo se deben alternar entre ambos glúteos.
Administración en el músculo deltoides
La aguja recomendada para la administración en el deltoides es una aguja hipodérmica de seguridad de 25 mm calibre 23; para pacientes obesos se debe emplear una aguja hipodérmica de seguridad de 38 mm calibre 22. Las inyecciones en el deltoides se deben alternar entre ambos músculos deltoides.
Los viales con el polvo y disolvente así como la jeringa pre cargada son de un solo uso.
En el prospecto incluido en la caja se encuentran todas las instrucciones para la utilización y manipulación de Abilify Maintena (la información está destinada a profesionales sanitarios).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
La mejoría clínica del paciente durante el tratamiento antipsicótico puede tardar desde varios días a algunas semanas. Los pacientes deben estar estrechamente controlados durante este periodo.
Uso en pacientes que se encuentran en un estado sumamente agitado o psicótico grave
Abilify Maintena no se debe utilizar para el tratamiento de estados agitados agudos o psicóticos graves cuando esté justificado el control inmediato de los síntomas.
Tendencias suicidas
La aparición de comportamiento suicida es inherente a las enfermedades psicóticas y en algunos casos se han notificado al poco tiempo del inicio o el cambio de tratamiento antipsicótico, incluyendo el tratamiento con aripiprazol (ver sección 4.8). El tratamiento con antipsicóticos en pacientes de alto riesgo debe ir acompañado de una estrecha supervisión.
Trastornos cardiovasculares
Aripiprazol debe ser empleado con precaución en pacientes que presentan enfermedad cardiovascular conocida (antecedentes de infarto de miocardio o enfermedad isquémica cardiaca, fallo cardíaco, o anomalías de la conducción), enfermedad cerebrovascular, enfermedades que pueden predisponer a la hipotensión (deshidratación, hipovolemia, y tratamiento con medicamentos antihipertensivos) o a la hipertensión, incluyendo hipertensión acelerada o maligna. Se han notificado casos de tromboembolismo venoso (TEV) con medicamentos antipsicóticos. Dado que los pacientes tratados con antipsicóticos presentan a menudo factores de riesgo adquiridos para el TEV, se deben identificar todos los posibles factores de riesgo de TEV antes y durante el tratamiento con aripiprazol, así como tomar las correspondientes medidas preventivas (ver sección 4.8).
Prolongación del intervalo QT
En estudios clínicos de tratamiento con aripiprazol oral, la incidencia de prolongación del intervalo QT fue comparable a placebo. Aripiprazol debe ser empleado con precaución en pacientes con antecedentes familiares de prolongación del intervalo QT (ver sección 4.8).
Discinesia tardía
En ensayos clínicos de hasta un año de duración, se han notificado casos poco frecuentes de discinesia durante el tratamiento con aripiprazol. Si aparecen signos y síntomas de discinesia tardía en un paciente tratado con aripiprazol, se debe considerar una reducción de dosis o la interrupción del tratamiento (ver sección 4.8). Estos síntomas pueden empeorar temporalmente o incluso pueden manifestarse después de la interrupción del tratamiento.
Síndrome Neuroléptico Maligno (SNM)
El SNM es un complejo de síntomas potencialmente mortal asociado al tratamiento con fármacos antipsicóticos. En ensayos clínicos se han notificado casos raros de SNM durante el tratamiento con aripiprazol. Las manifestaciones clínicas del SNM son hipertermia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autónoma (pulso o presión sanguínea irregular, taquicardia, diaforesis y disritmia cardíaca). Los signos adicionales pueden incluir una elevación de creatina fosfoquinasa, mioglobinuria (rabdomiólisis), e insuficiencia renal aguda. También se han notificado elevaciones de la creatina fosfoquinasa y rabdomiólisis no necesariamente asociadas con el SNM. Si un paciente desarrolla signos y síntomas indicativos de SNM, o presenta fiebre alta inexplicable sin manifestaciones clínicas adicionales de SNM, todos los medicamentos antipsicóticos, incluyendo aripiprazol, deben ser interrumpidos (ver sección 4.8).
Convulsiones
En ensayos clínicos se han notificado casos poco frecuentes de convulsiones durante el tratamiento con aripiprazol. Por lo tanto, se debe emplear aripiprazol con precaución en pacientes epilépticos o con historia de convulsiones (ver sección 4.8).
Pacientes de edad avanzada con psicosis relacionada con demencia
Aumento de mortalidad
En tres estudios controlados con placebo, con aripiprazol oral, en pacientes de edad avanzada con psicosis asociada a la enfermedad de Alzheimer (n = 938; media de edad: 82,4 años; rango:
56-99 años), los pacientes tratados con aripiprazol tuvieron un mayor riesgo de muerte en comparación con placebo. La tasa de muerte en pacientes tratados con aripiprazol oral fue del 3,5 % en comparación con el 1,7 % en el grupo placebo. Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecieron ser de origen cardiovascular (ej. insuficiencia cardiaca, muerte súbita) o infecciosa (ej. neumonía) (ver sección 4.8).
Reacciones adversas cerebrovasculares
En los mismos estudios con aripiprazol oral, se notificaron reacciones adversas cerebrovasculares (ej. ictus, crisis isquémica transitoria), incluyendo fallecimiento (media de edad: 84 años; rango:
78-88 años). En total en estos estudios, en un 1,3 % de los pacientes tratados con aripiprazol oral se notificaron reacciones cerebrovasculares adversas en comparación con el 0,6 % de los pacientes tratados con placebo. Esta diferencia no fue estadísticamente significativa. Sin embargo, en uno de estos ensayos, un estudio a dosis fijas, hubo una relación dosis respuesta significativa para las reacciones adversas cerebrovasculares, en pacientes tratados con aripiprazol (ver sección 4.8).
Aripiprazol no está indicado para el tratamiento de pacientes con psicosis relacionada con demencia.
Hiperglucemia y diabetes mellitus
En algunos casos se ha notificado hiperglucemia extrema y asociada con cetoacidosis o coma hiperosmolar o muerte en pacientes tratados con medicamentos antipsicóticos atípicos, incluyendo aripiprazol. Entre los factores de riesgo que pueden predisponer a los pacientes a padecer complicaciones graves se incluye la obesidad y los antecedentes familiares de diabetes. En los ensayos clínicos con aripiprazol, no hubo diferencias significativas en la tasa de incidencia de reacciones adversas hiperglucémicas (incluyendo diabetes) o en los valores de glucemia alterados, en comparación con placebo. No se dispone de datos precisos del riesgo de reacciones adversas relacionadas con la hiperglucemia en pacientes tratados con aripiprazol y con otros medicamentos antipsicóticos atípicos, que permitan establecer comparaciones directas. Los pacientes tratados con medicamentos antipsicóticos, incluyendo aripiprazol, deben ser observados para detectar posibles signos y síntomas de hiperglucemia (como polidipsia, poliuria, polifagia y debilidad), y los pacientes con diabetes mellitus o con factores de riesgo de diabetes mellitus deben ser controlados de forma regular, para detectar un posible empeoramiento del control de la glucosa (ver sección 4.8).
Hipersensibilidad
Se pueden producir reacciones de hipersensibilidad con aripiprazol, caracterizadas por síntomas alérgicos.
Aumento de peso
El aumento de peso se suele dar en pacientes esquizofrénicos en tratamiento con antipsicóticos que se sabe causan aumento de peso, comorbilidades, estilo de vida poco saludable, y puede conducir a complicaciones graves. El aumento de peso ha sido notificado después de la comercialización, en pacientes a los que se les ha prescrito aripiprazol oral. Cuando ha ocurrido, ha sido habitualmente en aquellos pacientes con factores de riesgo significativos como antecedentes de diabetes, alteraciones tiroideas o adenoma pituitario. En estudios clínicos no se ha observado que aripiprazol haya inducido un aumento de peso clínicamente significativo (ver sección 4.8).
Disfagia
La dismotilidad esofágica y la aspiración se han asociado al uso de medicamentos antipsicóticos, incluyendo aripiprazol. El aripiprazol debe utilizarse con precaución en pacientes con riesgo de neumonía por aspiración.
Adicción patológica al juego
Se han notificado informes postcomercialización de adicción patológica al juego en pacientes tratados con aripiprazol oral, independientemente de si estos pacientes tenían antecedentes previos de adicción al juego o no. El riesgo puede ser mayor en pacientes con antecedentes de adicción al juego y por este motivo deben ser controlados cuidadosamente (ver sección 4.8).
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones con Abilify Maintena. La siguiente información fue obtenida a partir de estudios con aripiprazol oral.
Dado su antagonismo al receptor al adrenérgico, aripiprazol tiene la capacidad de aumentar el efecto de ciertos medicamentos antihipertensivos. Dados los efectos primarios del aripiprazol sobre el SNC, se debe tener precaución al administrar aripiprazol en combinación con alcohol u otros medicamentos del SNC con efectos adversos que se solapan, como la sedación (ver sección 4.8). Se debe tener precaución cuando se administre de forma concomitante aripiprazol con otros medicamentos que produzcan prolongación del intervalo QT o trastornos electrolíticos.
Interacción de otros medicamentos con aripiprazol
Aripiprazol se metaboliza por múltiples vías, involucrando las enzimas CYP2D6 y CYP3A4 pero no la enzima CYP1A. Por lo tanto, no es necesario un ajuste de dosis en fumadores.
Quinidina y otros inhibidores potentes de la CYP2D6
En un estudio clínico de aripiprazol oral en sujetos sanos, un inhibidor potente de la CYP2D6 (quinidina) aumentó el AUC en un 107 %, mientras que no produjo cambios en la Cmax. El AUC y la Cmax del deshidroaripiprazol, el metabolito activo, disminuyeron en un 32 % y 47 %, respectivamente. Es esperable que otros inhibidores potentes de la CYP2D6, como la fluoxetina y la paroxetina, tengan efectos similares y por lo tanto se debe aplicar una reducción de dosis considerando dichas disminuciones (ver sección 4.2).
Ketoconazol y otros inhibidores potentes de la CYP3A4
En un estudio clínico de aripiprazol oral en sujetos sanos, un inhibidor potente de la CYP3A4 (ketoconazol) elevó el AUC del aripiprazol y la Cmax en un 63 % y 37 %, respectivamente; y aumentó el AUC y la Cmax del deshidroaripiprazol en un 77 % y 43 %, respectivamente. En metabolizadores lentos de la CYP2D6, el empleo concomitante de inhibidores potentes de la CYP3A4 puede dar lugar a concentraciones plasmáticas más altas de aripiprazol, en comparación con los metabolizadores rápidos de la CYP2D6 (ver sección 4.2). Cuando se considere la administración concomitante de ketoconazol u otros inhibidores potentes de la CYP3A4 con aripiprazol, los posibles beneficios deberán ser mayores que los posibles riesgos para el paciente. Cabe esperar que otros inhibidores potentes de la CYP3A4, como itraconazol y los inhibidores de la proteasa VIH, tengan efectos similares y, por lo tanto, se debe aplicar una reducción de dosis acorde con los datos anteriores (ver sección 4.2). Cuando se interrumpe el inhibidor de la CYP2D6 o la CYP3A4, se debe aumentar la dosis de aripiprazol a la dosis previa al inicio del tratamiento concomitante. Cuando se emplean inhibidores débiles de la CYP3A4 (ej. diltiazem) o de la CYP2D6 (ej. escitalopram) de forma concomitante con este medicamento, es esperable que se produzcan pequeños aumentos de la concentración plasmática de aripiprazol.
Carbamezapina y otros inductores de la CYP3A4
Después de la administración concomitante de carbamezapina, un inductor potente de la CYP3A4, y aripiprazol oral, a pacientes con esquizofrenia o trastorno esquizoafectivo, las medias geométricas de la Cmax y el AUC para aripiprazol fueron un 68 % y 73 % más bajos respectivamente, en comparación con la administración de aripiprazol oral (30 mg) en monoterapia. Asimismo, las medias geométricas de la Cmax y el AUC para el deshidroaripiprazol, después de la administración concomitante de carbamazepina, fueron un 69 % y 71 % más bajos respectivamente, que los obtenidos después del tratamiento con aripiprazol oral en monoterapia. Cabe esperar que la administración concomitante de Abilify Maintena y otros inductores de la CYP3A4 (como rifampicina, rifabutina, fenitoína, fenobarbital, primidona, efavirenz, nevirapina y la hierba de San Juan) tengan efectos similares. Se debe evitar el empleo concomitante de inductores de la CYP3A4 con Abilify Maintena, debido a que los niveles de aripiprazol en sangre disminuyen y pueden caer por debajo de los niveles efectivos.
Valproato y litio
La administración de valproato o litio de forma concomitante con aripiprazol, no produjo cambios clínicamente significativos en las concentraciones de aripiprazol, y por lo tanto no es necesario ajustar la dosis cuando se administra valproato o litio con Abilify Maintena.
Interacción de aripiprazol con otros medicamentos
En estudios clínicos, dosis orales de 10-30 mg/día de aripiprazol no tuvieron efectos significativos sobre el metabolismo de los sustratos de la CYP2D6 (índice dextrometorfano/3-metoximorfinan) CYP2C9 (warfarina), CYP2C19 (omeprazol) y CYP3A4 (dextrometorfano). Además, aripiprazol y deshidroaripiprazol no parecen modificar el metabolismo mediado por la CYP1A2, según estudios in vitro. Por lo tanto, es poco probable que Abilify Maintena cause interacciones medicamentosas clínicamente importantes mediadas por estas enzimas.
La administración de aripiprazol de forma concomitante con lamotrigina, dextrometorfano, warfarina, omeprazol, escitalopram o venlafaxina, no produjo cambios clínicamente significativos en la concentración de estos medicamentos. Por lo tanto, no es necesario ajustar la dosis de estos medicamentos cuando se administran concomitantemente con Abilify Maintena.
Síndrome serotoninérgico
Se han notificado casos de síndrome serotoninérgico en pacientes en tratamiento con aripiprazol, se pueden producir signos y síntomas de esta alteración especialmente con el empleo concomitante con otros medicamentos serotoninérgicos, como ISRS/ISRN o con medicamentos que se sabe que aumentan la concentración de aripiprazol (ver sección 4.8).
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay estudios bien controlados y adecuados con aripiprazol en mujeres embarazadas. Aunque se han notificado anomalías congénitas, no se ha podido establecer una relación causal con aripiprazol. Los estudios realizados en animales, no pudieron excluir el potencial de toxicidad en el desarrollo (ver sección 5.3). Se aconseja a las pacientes notificar a sus médicos si están embarazadas o tienen intención de quedarse embarazadas durante el tratamiento con Abilify Maintena. Debido a la insuficiente información de seguridad en humanos y los problemas identificados en estudios de reproducción animal, este medicamento no debe utilizarse en el embarazo, a menos que el beneficio esperado justifique claramente el riesgo potencial para el feto.
Los prescriptores deben ser conscientes de las propiedades de la acción prolongada de Abilify Maintena.
Los recién nacidos expuestos a antipsicóticos (incluyendo aripiprazol) durante el tercer trimestre del embarazo, corren el riesgo de sufrir reacciones adversas entre las que se incluyen síntomas extrapiramidales y/o síndrome de abstinencia, que pueden variar en gravedad y duración después del nacimiento. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o trastornos alimentarios. Por lo tanto, los recién nacidos deben estar cuidadosamente controlados (ver sección 4.8).
Lactancia
Aripiprazol se excreta en la leche materna. Se debe tomar la decisión de interrumpir la lactancia o de interrumpir/abstenerse del tratamiento con Abilify Maintena, teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio del tratamiento para la mujer.
Fertilidad
Aripiprazol no afectó a la fertilidad, según los datos de estudios de toxicidad reproductiva.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de aripiprazol sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada, debido a sus posibles efectos sobre el sistema nervioso o visual, como sedación, somnolencia, síncope, visión borrosa, diplopía (ver sección 4.8). Por lo tanto, se debe aconsejar a los pacientes no conducir o manejar máquinas hasta que se conozca la susceptibilidad individual a este medicamento.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas medicamentosas (RAM) observadas con mayor frecuencia, notificadas en > 5 % de los pacientes, en dos estudios clínicos doble ciego a largo plazo con Abilify Maintena fueron: aumento de peso (9,0 %), acatisia (7,9 %), insomnio (5,8 %) y dolor en el lugar de la inyección (5,1 %).
Tabla de reacciones adversas
La incidencia de reacciones adversas medicamentosas (RAM) asociadas con el tratamiento con aripiprazol aparecen en la tabla siguiente. Esta tabla está basada en acontecimientos adversos notificados durante los ensayos clínicos y/o la utilización postcomercialización.
Todas las RAM están incluidas según el sistema de clasificación de órganos, frecuencias: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000), muy raras (< 1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Dentro de cada grupo de frecuencias, las reacciones adversas se presentan en orden decreciente de gravedad.
La frecuencia de las reacciones adversas notificadas durante el uso después de la comercialización no puede ser determinada ya que se derivan de notificaciones espontáneas. Por lo tanto, la frecuencia de estos efectos adversos se califica como “no conocida”.
|
Frecuentes |
Poco frecuentes |
Frecuencia no conocida | |
|
Trastornos de la sangre y del sistema linfático |
Neutropenia Anemia Trombocitopenia Recuento disminuido de neutrófilos Recuento disminuido de glóbulos blancos |
Leucopenia | |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
Reacción alérgica (ej. reacción anafiláctica, angioedema, incluyendo inflamación de la lengua, edema de la lengua, edema del rostro, prurito o urticaria) | |
|
Trastornos endocrinos |
Disminución de la prolactina en sangre Hiperprolactinemia |
Coma diabético hiperosmolar Cetoacidosis diabética | |
|
Trastornos del metabolismo y de la nutrición |
Peso aumentado Diabetes mellitus Peso disminuido |
Hiperglucemia Hipercolesterolemia Hiperinsulinemia Hiperlipidemia Hipertrigliceridemia Trastorno del apetito |
Anorexia Hiponatremia |
|
Trastornos psiquiátricos |
Agitación Ansiedad Inquietud Insomnio |
Ideación suicida Trastorno psicótico Alucinación Trastorno delirante Hipersexualidad Reacción de pánico Depresión Labilidad afectiva Apatía Disforia Trastorno del sueño Bruxismo Libido disminuida Alteración del humor |
Suicidio consumado Intento de suicidio Juego patológico Nerviosismo Agresividad |
|
Trastornos del sistema nervioso |
Trastorno extrapiramidal Acatisia Temblor Discinesia Sedación Somnolencia Mareo Cefalea |
Distonia Discinesia tardía Parkinsonismo Trastorno del movimiento Hiperactividad psicomotora Síndrome de piernas inquietas Rigidez en rueda dentada Hipertonía Bradicinesia Babeo Disgeusia Parosmia |
Síndrome neuroléptico maligno Convulsión del gran mal Síndrome serotoninérgico Trastornos del habla |
|
Trastornos oculares |
Crisis oculogira Visión borrosa Dolor ocular Diplopía |
|
Frecuentes |
Poco frecuentes |
Frecuencia no conocida | |
|
Trastornos cardíacos |
Extrasístoles ventriculares Bradicardia Taquicardia Disminución de la amplitud de la onda T en el electrocardiograma Electrocardiograma anormal Inversión de la onda T del electrocardiograma |
Muerte súbita inexplicable Parada cardiaca Torsades de pointes Arritmia ventricular Prolongación del intervalo QT | |
|
Trastornos vasculares |
Hipertensión Hipotensión ortostática Presión arterial aumentada |
Síncope Tromboembolismo venoso (incluyendo embolismo pulmonar y trombosis venosa profunda) | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos Hipo |
Espasmo orofaríngeo Laringoespasmo Neumonía por aspiración | |
|
Trastornos gastrointestin ales |
Boca seca |
Enfermedad por reflujo gastroesofágico Dispepsia Vómitos Diarrea Náuseas Dolor abdominal superior Molestia abdominal Estreñimiento Movimientos intestinales frecuentes Hipersecreción salival |
Pancreatitis Disfagia |
|
Trastornos hepatobiliares |
Prueba anormal de función hepática Enzimas hepáticos aumentados Alanina aminotransferasa elevada Gamma glutamil transferasa elevada Bilirrubina elevada en sangre Aspartato aminotransferasa elevada |
Insuficiencia hepática Ictericia Hepatitis Fosfatasa alcalina elevada | |
|
Trastornos de la piel y del tejido subcutáneo |
Alopecia Acné Rosácea Eczema Induración de la piel |
Erupción Reacción de fotosensibilidad Hiperhidrosis | |
|
Trastornos musculoesque léticos y del tejido conjuntivo |
Rigidez musculoesquelét ica |
Rigidez muscular Espasmos musculares Sacudidas musculares Tirantez muscular Mialgia Dolor en una extremidad |
Rabdomiolisis |
|
Frecuentes |
Poco frecuentes |
Frecuencia no conocida | |
|
Artralgia Dolor de espalda Limitación de la movilidad de la articulación Rigidez de nuca Trismo | |||
|
Trastornos renales y urinarios |
Nefrolitiasis Glucosuria |
Retención urinaria Incontinencia urinaria | |
|
Embarazo, puerperio y enfermedades perinatales |
Síndrome de abstinencia de fármacos en neonatos (ver sección 4.6) | ||
|
Trastornos del aparato reproductor y de la mama |
Disfunción eréctil |
Galactorrea Ginecomastia Dolor mamario a la palpación Sequedad vulvovaginal |
Priapismo |
|
Trastornos generales y alteraciones en el lugar de administració n |
Dolor en la zona de inyección Induración de la zona de inyección Fatiga |
Pirexia Astenia Alteración de la marcha Malestar torácico Reacción en la zona de inyección Eritema en la zona de inyección Hinchazón en la zona de inyección Molestia en la zona de inyección Prurito en la zona de inyección Sed Lentitud de movimiento |
Alteración de la regulación de la temperatura (ej. hipotermia, pirexia) Dolor torácico Edema periférico |
|
Exploraciones complementa rias |
Creatinfosfoqui nasa en sangre elevada |
Glucosa elevada en sangre Glucosa disminuida en sangre Hemoglobina glicosilada aumentada Perímetro abdominal aumentado Colesterol disminuido en sangre Triglicéridos disminuidos en sangre |
Fluctuación de la glucosa en sangre |
Descripción de reacciones adversas seleccionadas
Reacciones en el lugar de la inyección
Durante las fases controladas de doble ciego de ambos estudios a largo plazo, se observaron reacciones en el lugar de la inyección; que en general fueron de gravedad leve a moderada y se resolvieron con el tiempo. El dolor en el lugar de la inyección (incidencia 5,1 %) tuvo una mediana de aparición en el día 2 después de la inyección y una mediana de duración de 4 días.
En un estudio abierto que comparaba la biodisponibilidad de Abilify Maintena inyectado en el glúteo o el deltoides, las reacciones relacionadas con el lugar de la inyección fueron ligeramente más frecuentes en el deltoides. La mayoría fueron leves y mejoraron en las inyecciones posteriores.
Cuando se compara con los estudios en los que Abilify Maintena se inyecta en el glúteo, la reaparición del dolor en el lugar de la inyección fue más frecuente en el deltoides.
Leucopenia
Se ha notificado neutropenia en los ensayos clínicos con Abilify Maintena que generalmente se inició alrededor del día 16 después de la primera inyección, y duró una mediana de 18 días.
Síntomas extrapiramidales (SEP)
En estudios en pacientes estables con esquizofrenia, Abilify Maintena se asoció con una frecuencia más alta de SEP (18,4 %) en comparación con el tratamiento oral con aripiprazol (11,7 %). La acatisia fue el síntoma observado con mayor frecuencia (8,2 %), generalmente se inició alrededor del día 10 después de la primera inyección, y duró una mediana de 56 días. Los sujetos con acatisia se suelen tratar con medicamentos anticolinérgicos, principalmente mesilato de benzatropina y trihexifenidilo; y, con menor frecuencia, con medicamentos como propranolol y benzodiacepinas (clonazepam y diazepam), para controlar la acatisia. El parkinsonismo fue el siguiente acontecimiento observado con mayor frecuencia (6,9 % en el grupo tratado con Abilify Maintena, 4,15 % en el grupo tratado con comprimidos orales de 10-30 mg de aripiprazol y 3,0 % en el grupo placebo, respectivamente).
Distonía
Efecto de clase: En individuos susceptibles y durante los primeros días del tratamiento pueden producirse síntomas de distonía, contracciones anormales prolongadas de los músculos. Entre los síntomas de distonía se incluyen: espasmo de los músculos del cuello, progresando a veces a contracción de la garganta, dificultad para la deglución, dificultad para respirar, y/o protrusión de la lengua. Aunque estos síntomas pueden ocurrir a dosis bajas, ocurren con mayor frecuencia y son más graves, en los tratamientos con medicamentos antipsicóticos de primera generación de alta potencia, y a dosis más altas. Se ha observado un riesgo elevado de distonía aguda en los varones y en grupos de menor edad.
Peso
Durante la fase doble ciego, con control activo del estudio a largo plazo de 38 semanas de duración, la incidencia de aumento de peso > 7 % desde el inicio hasta la última visita fue del 9,5 % en el grupo de Abilify Maintena y del 11,7 % en el grupo tratado con comprimidos orales de 10-30 mg de aripiprazol. La incidencia de pérdida de peso > 7 % desde el inicio hasta la última visita fue del 10,2 % en el grupo de Abilify Maintena y del 4,5 % en el grupo tratado con comprimidos orales de 10-30 mg de aripiprazol. Durante la fase doble ciego, controlada con placebo, del estudio a largo plazo de 52 semanas de duración, la incidencia de aumento de peso > 7 % desde el inicio hasta la última visita fue del 6,4 % en el grupo de Abilify Maintena y del 5,2 % en el grupo placebo. La incidencia de pérdida de peso > 7 % desde el inicio hasta la última visita fue del 6,4 % en el grupo de Abilify Maintena y del 6,7 % en el grupo placebo. Durante el tratamiento a doble ciego, el cambio medio en el peso corporal desde el inicio hasta la última visita fue de -0,2 kg en el grupo de Abilify Maintena y -0,4 kg en el grupo placebo (p = 0,812).
Prolactina
Durante los ensayos clínicos para las indicaciones aprobadas y la experiencia poscomercialización, se han observado aumentos y disminuciones en los niveles de prolactina sérica en comparación con los valores iniciales observados con aripiprazol (sección 5.1).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se notificaron casos de reacciones adversas asociadas con sobredosis en estudios clínicos con Abilify Maintena. Se debe tener cuidado de no inyectar este medicamento por error en un vaso sanguíneo. Después de cualquier administración intravenosa involuntaria/accidental de una sobredosis confirmada o sospechada, es necesario un control estrecho del paciente y, si surge cualquier signo o síntoma potencialmente grave, es necesario realizar una monitorización que incluirá la realización de un electrocardiograma de forma continuada. La supervisión médica y la monitorización deben continuarse hasta que el paciente se recupere.
Una simulación de descarga rápida demostró que la media esperada de la concentración de aripiprazol, alcanza un pico de 4500 ng/ml o aproximadamente 9 veces el rango terapéutico superior. En el caso de descarga rápida de la dosis, se espera que las concentraciones de aripiprazol disminuyan rápidamente al límite superior de la ventana terapéutica, después de alrededor de 3 días. El día 7, la mediana de las concentraciones de aripiprazol disminuye aún más hasta alcanzar concentraciones similares a las que se alcanzan después de la administración de una dosis IM sin descarga rápida. Mientras las sobredosis son menos probables con medicamentos parenterales que con medicamentos orales, a continuación se muestra información relativa a sobredosis con aripiprazol oral.
Signos y síntomas
En estudios clínicos y experiencias post comercialización, se identificaron sobredosis agudas accidentales o intencionadas con aripiprazol sólo, en pacientes adultos, y a dosis estimadas, según notificación, de hasta 1.260 mg (41 veces mayor que la dosis diaria más alta recomendada para aripiprazol) sin que se produjeran fallecimientos. Los signos y síntomas de potencial importancia clínica observados incluyeron: letargia, elevación de la presión sanguínea, somnolencia, taquicardia, náuseas, vómitos y diarrea. Además, se han recibido notificaciones de sobredosis accidental con aripiprazol sólo (hasta 195 mg) en niños, sin que se produjera ningún desenlace mortal. Los signos y síntomas médicos potencialmente graves notificados incluyeron: somnolencia, pérdida transitoria del conocimiento y síntomas extrapiramidales.
Manejo de la sobredosis
El tratamiento de la sobredosis debe concentrarse en una terapia de soporte, manteniendo una vía aérea adecuada, oxigenación y ventilación, y tratamiento sintomático. Se debe considerar la posibilidad de que haya múltiples medicamentos implicados. A continuación, se debe empezar de forma inmediata la monitorización cardiovascular y realizar una monitorización electrocardiografía continua para detectar posibles arritmias. Después de una sobredosis con aripiprazol, sospechada o confirmada, se debe seguir una estrecha monitorización y supervisión médica hasta la recuperación del paciente.
Hemodiálisis
Aunque no hay información sobre los efectos de la hemodiálisis para tratar una sobredosis de aripiprazol, es improbable que sea útil para dicho tratamiento, dado que aripiprazol presenta una amplia unión a proteínas plasmáticas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Psicolépticos, otros antipsicóticos, código ATC: N05AX12 Mecanismo de acción
Se ha propuesto que la eficacia del aripiprazol en esquizofrenia está mediada por una combinación de agonismo parcial a los receptores de la dopamina D2 y de la serotonina 5-HT¡a y de antagonismo a los receptores 5-HT2A. Aripiprazol mostró propiedades antagonistas en modelos animales de hiperactividad dopaminérgica y propiedades agonistas de hipoactividad dopaminérgica. Aripiprazol presenta una alta afinidad in vitro de unión a los receptores D2 y D3 de la dopamina, y a los receptores 5-HTia y 5-HT2A de la serotonina, y una afinidad moderada por los receptores D4 de la dopamina, 5-HT2C y 5-HT7 de la serotonina, alfa-1 adrenérgico y H1 de la histamina. Aripiprazol también presentó una moderada afinidad de unión por el sitio de recaptación de la serotonina y una afinidad no apreciable por los receptores colinérgicos muscarínicos. La interacción con otros receptores distintos de los subtipos de la dopamina y la serotonina puede explicar algunos de los otros efectos clínicos de aripiprazol.
La administración oral de dosis de aripiprazol de 0,5 a 30 mg, administradas una vez al día, a voluntarios sanos, durante 2 semanas, produjo una reducción dependiente de la dosis en la unión de 11C-racloprida, un ligando de los receptores D2/D3, en el núcleo caudado y el putamen, detectado por tomografía de emisión de positrones.
Eficacia clínica y seguridad
Tratamiento de mantenimiento de la esquizofrenia en adultos
La eficacia de Abilify Maintena en el tratamiento de mantenimiento de pacientes con esquizofrenia fue demostrada en dos estudios doble ciego aleatorizados a largo plazo.
El primer estudio pivotal fue de 38 semanas, aleatorizado, doble ciego, con control activo, diseñado para determinar la eficacia, seguridad y tolerabilidad de este medicamento administrado en inyecciones mensuales, en comparación con aripiprazol administrado en comprimidos orales de 10-30 mg una vez al día, como tratamiento de mantenimiento en pacientes adultos con esquizofrenia. Este estudio consistió en una fase de selección y tres fases de tratamiento: Fase de conversión, Fase de estabilización oral y Fase doble ciego de control activo.
Seiscientos sesenta y dos pacientes fueron seleccionados para la fase doble ciego, con control activo, de 38 semanas, y fueron asignados aleatoriamente, en una razón de 2:2:1, a uno de los 3 grupos de tratamiento: 1) Abilify Maintena, 2) la dosis de estabilización de aripiprazol oral 10-30 mg o 3) aripiprazol inyectable 50 mg/25 mg de acción prolongada. La dosis de aripiprazol inyectable 50 mg/25 mg de acción prolongada se incluyó como una dosis baja para probar la sensibilidad del ensayo para el diseño de no inferioridad.
En los resultados del análisis de la variable principal de eficacia, la proporción estimada de pacientes que experimentaron una recaída al final de la semana 26 de la fase doble ciego con control activo, mostraron que 400 mg/300 mg de Abilify Maintena no es inferior a los comprimidos orales de 10-30 mg de aripiprazol. La tasa estimada de recaídas al final de la semana 26 fue del 7,12 % con Abilify Maintena, y del 7,76 % con comprimidos orales de 10-30 mg de aripiprazol, una diferencia de -0,64 %.
El IC 95 % (-5,26, 3,99) por la diferencia en la proporción estimada de pacientes que experimentaron una recaída al final de la semana 26, excluyó el margen predefinido de no inferioridad, 11,5 %. Por lo tanto, Abilify Maintena no es inferior a los comprimidos orales de 10-30 mg de aripiprazol.
La proporción estimada de pacientes que experimentaron una recaída al final de la semana 26 en el grupo Abilify Maintena fue del 7,12 %, porcentaje estadísticamente significativo menor que en el grupo de aripiprazol inyectable 50 mg/25 mg de acción prolongada, que fue del 21,80 % (p = 0,0006). De este modo, se estableció la superioridad de Abilify Maintena sobre el aripiprazol inyectable 50 mg/25 mg de acción prolongada y se confirmó la validez del diseño del estudio.
En la Figura 1 se muestran las curvas Kaplan-Meier del tiempo desde la aleatorización hasta la recaída durante la fase de doble ciego, con control activo, de 38 semanas para Abilify Maintena, aripiprazol oral 10-30 mg y aripiprazol inyectable 50 mg/25 mg de acción prolongada.
Figura 1 Gráfico Kaplan-Meier o del estimador producto-límite para el Tiempo de Exacerbación de los Síntomas Psicóticos/Recaída
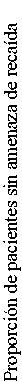
1,0
0,8
0,6
0,4
0,2
0,0
IMD 400/300 mg ARIP 10-30 mg IMD 50/25 mg
|
ARIP IMD 400/ 300 mg ARIP 10-30 mg ARIP IMD 50/25 mg | |

|
Prueba del orden logarítmico ARIP IMD 400/300 mg frente a ARIP 10-30 mg: valor de p de 0,9920 ARIP IMD 400/300 mg frente a ARIP IMD 50/25 mg: valor de p < 0,0001 |
Número de pacientes con riesgo
|
265 |
259 |
253 |
252 |
248 |
2 4 2 |
2 4 1 |
233 |
227 |
225 |
2 2 2 |
2 17 |
2 1 6 |
2 1 5 |
2 1 2 |
2 1 0 |
207 |
205 |
202 |
173 |
|
266 |
264 |
2 5 2 |
245 |
237 |
225 |
222 |
2 1 4 |
2 1 0 |
208 |
206 |
204 |
20 1 |
20 1 |
196 |
193 |
189 |
183 |
183 |
163 |
|
1 3 1 |
1 30 |
124 |
1 1 7 |
1 1 3 |
108 |
10 1 |
95 |
90 |
86 |
84 |
80 |
76 |
72 |
7 1 |
70 |
68 |
65 |
62 |
59 |
0 1 4 28 42 56 70 84 9 8 1 1 2 126 1 40 154 168 182 19 6 210 2 24 238 2 5 2 26 6
Días desde la aleatorización
NOTA: ARIP IMD = 400/300 mg = Abilify Maintena. ARIP 10-30 mg = aripiprazol oral. ARIP IMD 50/25 mg = acción prolongada
inyectable.
Además, la no inferioridad de Abilify Maintena comparada con aripiprazol oral 10-30 mg está respaldada por los resultados del análisis de la Escala del Síndrome Positivo Negativo (PANSS).
Tabla 1 PANSS puntuación total - Cambio desde el inicio a la semana 38-LOCF: Muestra de eficacia aleatorizada a b
|
PANSS puntuación total - Cambio desde el inicio hasta la semana 38- LOCF: Muestra de eficacia aleatorizada a b | |||
|
Abilify Maintena |
Aripiprazol oral |
Aripiprazol de acción prolongada inyectable | |
|
400 mg/300 mg |
10-30 mg/día |
50 mg/25 mg | |
|
(n = 263) |
(n = 266) |
(n = 131) | |
|
Media Basal (DS) |
57,9 (12,94) |
56,6 (12,65) |
56,1 (12,59) |
|
Variación Media (DS) |
-1,8 (10,49) |
0,7 (11,60) |
3,2 (14,45) |
|
Valor-P |
NA |
0,0272 |
0,0002 |
a: Cambio negativo en la puntuación indica mejoría.
b: Solo los pacientes que tengan inicio y al menos un post inicio fueron incluidos. Los valores-P se derivaron de la comparación del cambio
desde el inicio dentro del análisis del modelo de covarianza con el tratamiento como término y el inicio como covariable.
En el segundo estudio de 52 semanas de duración, de diseño doble ciego, aleatorizado, de retirada, participaron pacientes adultos estadounidenses con diagnóstico de esquizofrenia. Este estudio consistió en una fase de selección y cuatro fases de tratamiento a doble ciego y controlado con placebo: Conversión, Estabilización Oral, y Estabilización con Abilify Maintena. Los pacientes que cumplieron con los requisitos de la estabilización oral en la Fase de Estabilización Oral fueron asignados a recibir, de modo simple ciego, Abilify Maintena, y comenzaron una fase de estabilización con Abilify Maintena durante un mínimo de 12 semanas y un máximo de 36 semanas. Los pacientes aptos para la fase doble ciego, controlada con placebo, se asignaron aleatoriamente para recibir tratamiento con Abilify Maintena o placebo en una razón de 2:1, respectivamente.
En el análisis final de eficacia se incluyó a 403 pacientes aleatorizados y 80 eventos de exacerbación de síntomas psicóticos/recaída. El 39,6 % de los pacientes del grupo del placebo habían progresado a una recaída, mientras que en el grupo de Abilify Maintena este porcentaje fue del 10 %; por lo tanto, los pacientes del grupo placebo tuvieron un riesgo 5,03 veces mayor de experimentar una recaída en comparación con los pacientes del grupo de Abilify Maintena.
Prolactina
En la fase doble ciego, con control activo, del estudio de 38 semanas, desde el inicio hasta la última visita, hubo una disminución media en los niveles de prolactina en el grupo de Abilify Maintena (-0,33 ng/ml) comparada con una elevación media en el grupo tratado con comprimidos orales de 10-30 mg de aripiprazol (0,79 ng/ml;p < 0,01). La incidencia de pacientes tratados con Abilify Maintena, que presentaban niveles de prolactina > 1 vez el límite superior de la normalidad (LSN) en cualquier evaluación, fue del 5,4 %; en comparación con el 3,5 % de los pacientes tratados con comprimidos orales de 10-30 mg de aripiprazol. Los pacientes varones, en general, presentaron una incidencia más alta que las pacientes mujeres en cada grupo de tratamiento.
En la fase de doble ciego controlado con placebo del estudio de 52 semanas, desde el inicio hasta la última visita, hubo una disminución media en los niveles de prolactina en el grupo con Abilify Maintena (-0,38 ng/ml) en comparación con una elevación media en el grupo con placebo (1,67 ng/ml). La incidencia de los pacientes tratados con Abilify Maintena, con niveles de prolactina > 1 vez el límite superior de la normalidad (LSN), fue del 1,9 %; en comparación con el
7,1 % en los pacientes con placebo.
Tratamiento agudo de la esquizofrenia en adultos
La eficacia de Abilify Maintena en pacientes adultos con esquizofrenia recidiva aguda se estableció en un estudio clínico a corto plazo (12 semanas) aleatorizado, doble ciego, controlado con placebo (n = 339).
El criterio principal de valoración (cambio en el puntaje total de PANSS desde el inicio hasta la semana 10) demostró la superioridad de Abilify Maintena (n = 167) sobre el placebo (n = 172). Asimismo, los puntajes de la subescala positiva y negativa de PANSS, también mostraron una mejoría (reducción) en el tiempo a partir del inicio.
Tabla 2 PANSS puntuación total - Cambio desde el inicio a la semana 10: Muestra de eficacia aleatorizada
|
PANSS puntuación total - Cambio desde el inicio a la semana 10: Muestra de eficacia aleatorizada a | ||
|
Abilify Maintena 400 mg/300 mg |
Placebo | |
|
Media basal (DE) |
102,4 (11,4) |
103,4 (11,1) |
|
n = 162 |
n = 167 | |
|
Media de mínimos cuadrados (EE) |
-26,8 (1,6) |
-11,7 (1,6) |
|
n = 99 |
n = 81 | |
|
Valor p |
< 0,0001 | |
|
Diferencia del tratamientob (IC del 95 %) |
-15,1 (-19,4, -10,8) | |
a Los datos se analizaron utilizando el enfoque de un modelo mixto de mediciones repetidas (MMRM). El análisis solo incluyó sujetos que fueron asignados de forma aleatoria al tratamiento, que recibieron al menos una inyección y a los que se les había realizado una evaluación al inicio y al menos una evaluación de eficacia después del inicio. b Diferencia (Abilify Maintena menos el placebo) en la media de mínimos cuadrados a partir del inicio.
Abilify Maintena también demostró una mejoría estadísticamente significativa en los síntomas representada por el cambio del puntaje CGIS entre el inicio y la semana 10.
El funcionamiento personal y social se evaluó utilizando la escala de comportamiento PSP por sus siglas en inglés. La PSP es una escala validada, calificada por un médico, con la que se mide el funcionamiento personal y social en cuatro ámbitos: actividades socialmente útiles (p. ej., trabajo y estudio), relaciones personales y sociales, cuidado personal y comportamientos alterados y agresivos. Hubo una diferencia estadísticamente significativa en favor del tratamiento con Abilify Maintena 400 mg/300 mg comparado con el placebo en la semana 10 (+7,1; p < 0,0001; IC del 95 %: 4,1; 10,1 utilizando un modelo ANCOVA (LOCF)).
El perfil de seguridad fue consistente con el ya conocido para Abilify Maintena. Sin embargo, hubo diferencias con lo que se ha observado en el uso de mantenimiento en el tratamiento de la esquizofrenia. En un estudio a corto plazo (12 semanas), aleatorizado, doble ciego, controlado con placebo, en sujetos tratados con Abilify Maintena 400 mg/300 mg, los síntomas que presentaron al menos el doble de la incidencia que con el placebo, fueron: aumento de peso y acatisia. La incidencia de aumento de peso de > 7 % desde el inicio hasta la última visita (semana 12) fue de 21,5 % para Abilify Maintena comparado con el grupo placebo de 8,5 %. La acatisia fue el SEP observado con mayor frecuencia (Abilify Maintena 11,4 % y grupo placebo 3,5 %).
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Abilify Maintena en los subgrupos de población pediátrica con esquizofrenia (ver sección 4.2).
5.2 Propiedades farmacocinéticas
Absorción
Después de la administración de Abilify Maintena, la absorción de aripiprazol a la circulación sistémica es lenta y prolongada, lo que es debido a la baja solubilidad de las partículas de aripiprazol. La media de la semivida de absorción de Abilify Maintena es de 28 días. La absorción de aripiprazol en la formulación de liberación prolongada fue total en relación al estándar de liberación inmediata. Los valores de dosis ajustadas de Cmax para la formulación de liberación prolongada fueron aproximadamente del 5 % de la Cmax de la formulación estándar de liberación inmediata. Después de la administración de una dosis única de Abilify Maintena en el glúteo y el deltoides, el grado de absorción (AUC) fue similar en ambos lugares de inyección; sin embargo, la velocidad de absorción (C max ) fue superior tras la administración en el deltoides. Después de la administración de dosis múltiples intramusculares, las concentraciones plasmáticas de aripiprazol aumentan gradualmente hasta alcanzar una concentración plasmática máxima a una mediana de tmax de 7 días en el caso del glúteo y de 4 días en el caso del deltoides. Las concentraciones del estado estacionario para el sujeto típico se obtuvieron después de la cuarta dosis para ambos lugares de administración. Después de la administración de inyecciones mensuales de Abilify Maintena, de 300 mg a 400 mg, se observan aumentos en las concentraciones y en el AUC de aripiprazol y deshidroaripiprazol inferiores a los que proporcionalmente se producirían con el aumento de la dosis.
Distribución
En función de los resultados de los estudios de administración oral de aripiprazol, éste se distribuye ampliamente a través de todo el cuerpo, con un volumen de distribución aparente de 4,9 l/kg, lo que indica una distribución extravascular extensa. A concentraciones terapéuticas, la unión de aripiprazol y deshidroaripiprazol a las proteínas plasmáticas es superior al 99 %, siendo ésta principalmente con la albúmina.
Biotransformación
Aripiprazol sufre una extensa metabolización hepática, principalmente por tres vías de biotransformación: deshidrogenación, hidroxilación y N-dealquilación. Según estudios in vitro, las enzimas CYP3A4 y CYP2D6 son responsables de la deshidrogenación y la hidroxilación del aripiprazol, y la N-dealquilación es catalizada por la CYP3A4. Aripiprazol es la fracción predominante del medicamento en circulación sistémica. Después de administrar dosis múltiples de Abilify Maintena, deshidroaripiprazol, el metabolito activo, representa cerca del 29,1-32,5 % del AUC del aripiprazol en plasma.
Eliminación
Después de administrar dosis múltiples de 400 mg o 300 mg de Abilify Maintena, la vida media de eliminación media terminal del aripiprazol es de 46,5 y 29,0 días respectivamente, probablemente
debido a una velocidad de absorción limitada por la cinética. Tras una única dosis oral de aripiprazol marcado con 14C, aproximadamente el 27 % de la radioactividad administrada se recuperó en la orina y aproximadamente el 60 % en las heces. Menos del 1 % de aripiprazol inalterado se excretó en orina, y aproximadamente un 18 % se recuperó inalterado en las heces.
Farmacocinética en poblaciones especiales
Metabolizadores lentos de la CYP2D6
Basándose en la farmacocinética de Abilify Maintena en humanos, el aclaramiento corporal total de aripiprazol fue de 3,71 l/h en metabolizadores rápidos de la CYP2D6, y aproximadamente 1,88 l/h (aproximadamente 50 % más bajo) en metabolizadores lentos de la CYP2D6 (para recomendación de dosis ver la sección 4.2).
Pacientes de edad avanzada
No se han observado diferencias en la farmacocinética de aripiprazol entre sujetos adultos de edad avanzada y adultos jóvenes después de la administración oral de aripiprazol. Asimismo, no hubo efectos detectables de la edad sobre los análisis farmacocinéticos con Abilify Maintena en pacientes esquizofrénicos.
Sexo
No hay diferencias en la farmacocinética del aripiprazol entre sujetos hombres y mujeres sanos, tras la administración oral de aripiprazol. Asimismo, no hubo efectos clínicamente significativos del sexo en el análisis farmacocinético de Abilify Maintena, en estudios clínicos con pacientes con esquizofrenia.
Tabaquismo
El estudio de la farmacocinética de aripiprazol oral no ha revelado ninguna evidencia de efectos clínicamente significativos del consumo de tabaco sobre la farmacocinética de aripiprazol.
Etnia
El estudio de la farmacocinética en humanos mostró que no hay ninguna evidencia de diferencias en la farmacocinética de aripiprazol relacionadas con la raza.
Insuficiencia renal
En un estudio de dosis únicas de aripiprazol oral, las características farmacocinéticas del aripiprazol y deshidroaripiprazol fueron similares en pacientes con enfermedad renal grave en comparación con cualquier sujeto joven sano.
Insuficiencia hepática
Un estudio en dosis única de aripiprazol oral, en sujetos con diversos grados de cirrosis hepática (Child-Pugh Clases A, B, y C), no mostró efectos significativos de la insuficiencia hepática sobre la farmacocinética del aripiprazol y deshidroaripiprazol, sin embargo, el estudio incluyó solo a 3 pacientes con cirrosis hepática Clase C, lo que no es suficiente para sacar conclusiones sobre su capacidad metabólica.
5.3 Datos preclínicos sobre seguridad
El perfil toxicológico para aripiprazol administrado en animales de experimentación, mediante inyección intramuscular es, generalmente, similar al observado tras la administración oral a niveles plasmáticos comparables. Sin embargo, con la inyección intramuscular se observó una respuesta inflamatoria en el lugar de la inyección que consistió en una inflamación granulomatosa, focos (medicamento depositado), infiltrados celulares y edema (hinchazón) y, en monos, fibrosis. Estos efectos se resolvieron gradualmente con la suspensión de la dosis.
Los datos de los estudios no clínicos sobre la administración oral de aripiprazol no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción y el desarrollo.
Aripiprazol oral
Únicamente a dosis o exposición a aripiprazol oral por encima de la dosis o exposición máxima establecida en humanos, se observaron efectos toxicológicos significativos; lo que indica que estos efectos fueron limitados o no tuvieron relevancia en la práctica clínica. Estos efectos fueron: toxicidad adrenocortical dependiente de la dosis en ratas, después de 104 semanas de la administración oral de aproximadamente 3 a 10 veces el AUC media en estado de estacionario de la dosis máxima recomendada en humanos, y aumento de los carcinomas adrenocorticales y carcinomas/adenomas adrenocorticales combinados en ratas hembras a aproximadamente 10 veces el AUC media en estado de estacionario de la dosis máxima recomendada en humanos. La exposición máxima no tumorogénica en ratas hembras fue de aproximadamente 7 veces la exposición a la dosis recomendada en humanos.
Un hallazgo adicional fue la colelitiasis, como consecuencia de la precipitación de los conjugados de sulfato de hidroximetabolitos de aripiprazol en la bilis de monos, después de la administración de dosis orales repetidas a 25 a 125 mg/kg/día, o aproximadamente a dosis de 16 a 81 veces la dosis máxima recomendada en humanos, en mg/m2 .
Sin embargo, las concentraciones de los conjugados del sulfato de hidroxiaripiprazol en la bilis de humanos, a la dosis más alta propuesta, 30 mg al día, no fueron superiores al 6 % de la concentración biliar en monos, en la semana 39 del estudio, estos valores están muy por debajo (6 %) de sus límites de solubilidad in vitro.
En estudios de dosis repetidas en ratas y perros jóvenes, el perfil de toxicidad del aripiprazol fue comparable al observado en animales adultos, y no hubo evidencia de neurotoxicidad o acontecimientos adversos sobre el desarrollo.
En base a los resultados de una serie completa de ensayos estándar de genotoxicidad, aripiprazol se consideró no genotóxico. En estudios de toxicidad reproductiva aripiprazol no redujo la fertilidad.
En ratas, se ha observado toxicidad durante el desarrollo, incluyendo osificación fetal retardada dependiente de la dosis y posibles efectos teratogénicos, en exposiciones a dosis subterapéuticas (basadas en el AUC), y en conejos, en exposiciones a dosis de aproximadamente entre 3 y 11 veces el AUC media en estado estacionario a la máxima dosis clínica recomendada. Se produjo toxicidad materna a dosis similares a las encontradas para la toxicidad sobre el desarrollo.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo
Carmelosa sódica Manitol
Fosfato deshidrogenado de sodio monohidrato Hidróxido de sodio
Disolvente
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable Se ha demostrado estabilidad química y física durante 4 horas a 25 °C. Desde el punto de vista microbiológico, a menos que el método para abrir/reconstituir descarte el riesgo de contaminación microbiana, el producto debe emplearse de inmediato. Si no se utiliza de inmediato, el tiempo y las condiciones de conservación para utilizarlo son responsabilidad del usuario. Agitar el vial vigorosamente durante al menos 60 segundos para garantizar la resuspensión antes de la inyección. No conserve la suspensión reconstituida en la jeringa.
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Si no se administra la inyección inmediatamente después de la reconstitución, se puede conservar la jeringa a una temperatura inferior a 25 °C hasta 2 horas. Agite la jeringa vigorosamente durante al menos 20 segundos para garantizar la resuspensión antes de inyectarla si la jeringa no se ha utilizado durante más de 15 minutos.
6.4 Precauciones especiales de conservación
No congelar.
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase Vial
Vial de vidrio tipo I, con tapón de caucho laminado y sellado con una tapa de aluminio tipo “flip-off’. Disolvente
Vial de 2 ml de vidrio tipo I con tapón de caucho laminado y sellado con una tapa de aluminio tipo “flip-off\
Envase individual
Cada envase individual contiene un vial con polvo, un vial de 2 ml con disolvente, una jeringa de 3 ml con luer-lock con una aguja hipodérmica de seguridad ya colocada, de 38 mm, calibre 21, con un dispositivo de protección de la aguja, una jeringa desechable de 3 ml con punta luer-lock, un adaptador de vial, y tres agujas hipodérmicas de seguridad: una de 25 mm y calibre 23, una de 38 mm y calibre 22, y una de 50 mm y calibre 21.
Envase múltiple
Lote de 3 envases individuales.
Jeringa precargada
Jeringa precargada de vidrio tipo I que contiene polvo en la cámara delantera y disolvente en la cámara trasera.
Envase individual
Cada envase individual contiene una jeringa precargada y tres agujas hipodérmicas de seguridad: una de 25 mm y calibre 23, una de 38 mm y calibre 22, y una de 50 mm y calibre 21.
Envase múltiple
Lote de 3 envases individuales.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
En el prospecto incluido en la caja se encuentran todas las instrucciones para la utilización y manipulación de Abilify Maintena (la información está destinada a profesionales sanitarios).
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road,
Wexham, SL3 6PJ - Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable
EU/1/13/882/001
EU/1/13/882/003
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable
EU/1/13/882/002
EU/1/13/882/004
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en
jeringa precargada
EU/1/13/882/005
EU/1/13/882/007
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en
jeringa precargada
EU/1/13/882/006
EU/1/13/882/008
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 15/noviembre/2013
10. FECHA DE LA REVISIÓN DEL TEXTO
{MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
H. Lundbeck A/S Ottiliavej 9 DK-2500 Valby Dinamarca
Elaiapharm
2881 Route des Cretes Z.I Les Bouillides Sophia Antipolis
06550 Valbonne
Francia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en
cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable aripiprazol
Cada vial contiene 300 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Un vial con polvo
Un vial con 2 ml de disolvente
Dos jeringas estériles, una con aguja para la reconstitución Tres agujas hipodérmicas de seguridad Un adaptador del vial
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Agite el vial vigorosamente durante al menos 30 segundos hasta que la suspensión se vea uniforme. Si no se administra la inyección inmediatamente después de la reconstitución, agite vigorosamente durante al menos 60 segundos para resuspenderla antes de inyectarla.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Periodo de validez después de la reconstitución: 4 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Deseche de forma adecuada el vial, adaptador, jeringa, agujas, suspensión no empleada y agua para preparaciones inyectables.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable aripiprazol
Cada vial contiene 400 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Un vial con polvo
Un vial con 2 ml de disolvente
Dos jeringas estériles, una con aguja para la reconstitución Tres agujas hipodérmicas de seguridad Un adaptador del vial
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Agite el vial vigorosamente durante al menos 30 segundos hasta que la suspensión se vea uniforme. Si no se administra la inyección inmediatamente después de la reconstitución, agite vigorosamente durante al menos 60 segundos para resuspenderla antes de inyectarla.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Periodo de validez después de la reconstitución: 4 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Deseche de forma adecuada el vial, adaptador, jeringa, agujas, suspensión no empleada y agua para preparaciones inyectables.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable aripiprazol
Cada vial contiene 300 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Envase múltiple: Tres envases individuales, cada uno contiene:
Un vial con polvo
Un vial con 2 ml de disolvente
Dos jeringas estériles, una con aguja para la reconstitución Tres agujas hipodérmicas de seguridad Un adaptador del vial
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Agite el vial vigorosamente durante al menos 30 segundos hasta que la suspensión se vea uniforme. Si no se administra la inyección inmediatamente después de la reconstitución, agite vigorosamente durante al menos 60 segundos para resuspenderla antes de inyectarla.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Periodo de validez después de la reconstitución: 4 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche de forma adecuada el vial, adaptador, jeringa, agujas, suspensión no empleada y agua para preparaciones inyectables.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable aripiprazol
Cada vial contiene 300 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Envase individual que contiene:
Un vial con polvo
Un vial con 2 ml de disolvente
Dos jeringas estériles, una con aguja para la reconstitución Tres agujas hipodérmicas de seguridad Un adaptador del vial
Componente de un envase múltiple, no se puede vender por separado.
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Agite el vial vigorosamente durante al menos 30 segundos hasta que la suspensión se vea uniforme. Si no se administra la inyección inmediatamente después de la reconstitución, agite vigorosamente durante al menos 60 segundos para resuspenderla antes de inyectarla.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
8. FECHA DE CADUCIDAD
CAD
Periodo de validez después de la reconstitución: 4 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche de forma adecuada el vial, adaptador, jeringa, agujas, suspensión no empleada y agua para preparaciones inyectables.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable aripiprazol
Cada vial contiene 400 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Envase múltiple: Tres envases individuales, cada uno contiene:
Un vial con polvo
Un vial con 2 ml de disolvente
Dos jeringas estériles, una con aguja para la reconstitución Tres agujas hipodérmicas de seguridad Un adaptador del vial
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Agite el vial vigorosamente durante al menos 30 segundos hasta que la suspensión se vea uniforme. Si no se administra la inyección inmediatamente después de la reconstitución, agite vigorosamente durante al menos 60 segundos para resuspenderla antes de inyectarla.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Periodo de validez después de la reconstitución: 4 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche de forma adecuada el vial, adaptador, jeringa, agujas, suspensión no empleada y agua para preparaciones inyectables.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable aripiprazol
Cada vial contiene 400 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Envase individual que contiene:
Un vial con polvo
Un vial con 2 ml de disolvente
Dos jeringas estériles, una con aguja para la reconstitución Tres agujas hipodérmicas de seguridad Un adaptador del vial
Componente de un envase múltiple, no se puede vender por separado.
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Agite el vial vigorosamente durante al menos 30 segundos hasta que la suspensión se vea uniforme. Si no se administra la inyección inmediatamente después de la reconstitución, agite vigorosamente durante al menos 60 segundos para resuspenderla antes de inyectarla.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
8. FECHA DE CADUCIDAD
CAD
Periodo de validez después de la reconstitución: 4 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche de forma adecuada el vial, adaptador, jeringa, agujas, suspensión no empleada y agua para preparaciones inyectables.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
Vial de polvo 300 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Abilify Maintena 300 mg polvo para inyección de liberación prolongada aripiprazole
IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
300 mg
6. OTROS
Vial de polvo 400 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Abilify Maintena 400 mg polvo para inyección de liberación prolongada aripiprazole
IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
400 mg
6. OTROS
Vial de disolvente
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Disolvente para Abilify Maintena Agua para preparaciones inyectables
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
2 ml
6. OTROS
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en
jeringa precargada
aripiprazol
Cada jeringa precargada contiene 300 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Una jeringa precargada que contiene polvo en la cámara delantera y disolvente en la cámara trasera. Tres agujas hipodérmicas de seguridad
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Sujetando la jeringa en posición vertical, agítela vigorosamente durante 20 segundos hasta que el fármaco tenga un color blanco lechoso uniforme e inyéctelo inmediatamente. Si no se administra la inyección inmediatamente después de la reconstitución, se puede conservar la jeringa a una temperatura inferior a 25 °C hasta 2 horas. Agite la jeringa vigorosamente durante al menos 20 segundos para garantizar la resuspensión antes de inyectarla si la jeringa no se ha utilizado durante más de 15 minutos.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Periodo de validez después de la reconstitución: 2 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche la jeringa precargada y las agujas de forma adecuada.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/005
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en
jeringa precargada
aripiprazol
Cada jeringa precargada contiene 400 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Una jeringa precargada que contiene polvo en la cámara delantera y disolvente en la cámara trasera. Tres agujas hipodérmicas de seguridad
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Sujetando la jeringa en posición vertical, agítela vigorosamente durante 20 segundos hasta que el fármaco tenga un color blanco lechoso uniforme e inyéctelo inmediatamente. Si no se administra la inyección inmediatamente después de la reconstitución, se puede conservar la jeringa a una temperatura inferior a 25 °C hasta 2 horas. Agite la jeringa vigorosamente durante al menos 20 segundos para garantizar la resuspensión antes de inyectarla si la jeringa no se ha utilizado durante más de 15 minutos.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Periodo de validez después de la reconstitución: 2 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche la jeringa precargada y las agujas de forma adecuada.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/006
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en
jeringa precargada
aripiprazol
Cada jeringa precargada contiene 300 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Envase múltiple: Tres envases individuales, cada uno contiene:
Una jeringa precargada que contiene polvo en la cámara delantera y disolvente en la cámara trasera. Tres agujas hipodérmicas de seguridad
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Sujetando la jeringa en posición vertical, agítela vigorosamente durante 20 segundos hasta que el fármaco tenga un color blanco lechoso uniforme e inyéctelo inmediatamente. Si no se administra la inyección inmediatamente después de la reconstitución, se puede conservar la jeringa a una temperatura inferior a 25 °C hasta 2 horas. Agite la jeringa vigorosamente durante al menos 20 segundos para garantizar la resuspensión antes de inyectarla si la jeringa no se ha utilizado durante más de 15 minutos.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Periodo de validez después de la reconstitución: 2 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Deseche la jeringa precargada y las agujas de forma adecuada.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/007
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en
jeringa precargada
aripiprazol
Cada jeringa precargada contiene 300 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Envase individual que contiene:
Una jeringa precargada que contiene polvo en la cámara delantera y disolvente en la cámara trasera. Tres agujas hipodérmicas de seguridad
Componente de un envase múltiple, no se puede vender por separado.
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Sujetando la jeringa en posición vertical, agítela vigorosamente durante 20 segundos hasta que el fármaco tenga un color blanco lechoso uniforme e inyéctelo inmediatamente. Si no se administra la inyección inmediatamente después de la reconstitución, se puede conservar la jeringa a una temperatura inferior a 25 °C hasta 2 horas. Agite la jeringa vigorosamente durante al menos 20 segundos para garantizar la resuspensión antes de inyectarla si la jeringa no se ha utilizado durante más de 15 minutos.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
8. FECHA DE CADUCIDAD
CAD
Periodo de validez después de la reconstitución: 2 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Deseche la jeringa precargada y las agujas de forma adecuada.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/007
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en
jeringa precargada
aripiprazol
Cada jeringa precargada contiene 400 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Envase múltiple: Tres envases individuales, cada uno contiene:
Una jeringa precargada que contiene polvo en la cámara delantera y disolvente en la cámara trasera. Tres agujas hipodérmicas de seguridad
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Sujetando la jeringa en posición vertical, agítela vigorosamente durante 20 segundos hasta que el fármaco tenga un color blanco lechoso uniforme e inyéctelo inmediatamente. Si no se administra la inyección inmediatamente después de la reconstitución, se puede conservar la jeringa a una temperatura inferior a 25 °C hasta 2 horas. Agite la jeringa vigorosamente durante al menos 20 segundos para garantizar la resuspensión antes de inyectarla si la jeringa no se ha utilizado durante más de 15 minutos.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Periodo de validez después de la reconstitución: 2 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Deseche la jeringa precargada y las agujas de forma adecuada.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/008
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en
jeringa precargada
aripiprazol
Cada jeringa precargada contiene 400 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Envase individual que contiene:
Una jeringa precargada que contiene polvo en la cámara delantera y disolvente en la cámara trasera. Tres agujas hipodérmicas de seguridad
Componente de un envase múltiple, no se puede vender por separado.
Leer el prospecto antes de utilizar este medicamento.
Solo para vía intramuscular.
Sujetando la jeringa en posición vertical, agítela vigorosamente durante 20 segundos hasta que el fármaco tenga un color blanco lechoso uniforme e inyéctelo inmediatamente. Si no se administra la inyección inmediatamente después de la reconstitución, se puede conservar la jeringa a una temperatura inferior a 25 °C hasta 2 horas. Agite la jeringa vigorosamente durante al menos 20 segundos para garantizar la resuspensión antes de inyectarla si la jeringa no se ha utilizado durante más de 15 minutos.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
8. FECHA DE CADUCIDAD
CAD
Periodo de validez después de la reconstitución: 2 horas por debajo de 25 °C
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Deseche la jeringa precargada y las agujas de forma adecuada.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/882/008
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
Jeringa precargada - 300 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Abilify Maintena 300 mg inyección aripiprazole
IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
300 mg
6. OTROS
Jeringa precargada - 400 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Abilify Maintena 400 mg inyección aripiprazole
IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
400 mg
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable
aripiprazol
Lea todo el prospecto detenidamente antes de recibir este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Abilify Maintena y para qué se utiliza
2. Qué necesita saber antes de que se le administre Abilify Maintena
3. Como se administra Abilify Maintena
4. Posibles efectos adversos
5. Conservación de Abilify Maintena
6. Contenido del envase e información adicional
1. Qué es Abilify Maintena y para qué se utiliza
Abilify Maintena contiene el principio activo aripiprazol y pertenece a un grupo de medicamentos llamados antipsicóticos. Se utiliza para tratar la esquizofrenia - una enfermedad con síntomas como escuchar, ver o sentir cosas que no existen, desconfianza, creencias equivocadas, lenguaje incoherente y monotonía emocional y del comportamiento. Las personas con esta enfermedad también pueden sentirse deprimidas, culpables, inquietas o tensas.
Abilify Maintena está indicado para pacientes adultos con esquizofrenia que están suficientemente estabilizados durante el tratamiento con aripiprazol oral.
2. Qué necesita saber antes de que se le administre Abilify Maintena No use Abilify Maintena:
- si es alérgico al aripiprazol o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Hable con su médico o enfermero antes de que le administren Abilify Maintena.
Se han comunicado casos de pacientes que experimentan pensamientos y comportamientos suicidas durante el tratamiento con aripiprazol. Informe a su médico inmediatamente si tiene pensamientos o sentimientos de dañarse a sí mismo.
Antes del tratamiento con Abilify Maintena, dígale a su médico si sufre de
• niveles altos de azúcar en la sangre (caracterizado por síntomas como sed excesiva, aumento de la cantidad de orina, aumento del apetito y sensación de debilidad) o antecedentes familiares de diabetes.
• convulsiones, ya que su médico puede querer controlarlo más de cerca
• movimientos musculares involuntarios e irregulares, especialmente en la cara.
• enfermedades cardiovasculares (enfermedades del corazón y la circulación, antecedentes familiares de enfermedad cardiovascular), ictus o mini ictus, presión sanguínea anormal.
• coágulos sanguíneos o antecedentes familiares de coágulos sanguíneos ya que los antipsicóticos han sido asociados con la formación de coágulos sanguíneos.
• antecedentes de adicción al juego.
• problemas de hígado (hepáticos) graves.
Si nota que está ganando peso, desarrolla movimientos inusuales, siente somnolencia que interfiere en sus actividades diarias normales, cualquier dificultad para tragar o presenta síntomas de alergia, hable con su médico inmediatamente.
Niños y adolescentes
No utilice este medicamento en niños y adolescentes menores de 18 años. Se desconoce si es seguro y efectivo en estos pacientes.
Uso de Abilify Maintena con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o está pensando tomar cualquier otro medicamento, incluidos los medicamentos sin receta.
Medicamentos para bajar la presión sanguínea: Abilify Maintena puede aumentar el efecto de medicamentos utilizados para bajar la presión sanguínea. Asegúrese de informar a su médico si usted toma medicamentos para controlar la presión sanguínea.
Si está usando Abilify Maintena con algún otro medicamento, puede significar que su médico deba cambiar su dosis de Abilify Maintena o la de los otros medicamentos. Es especialmente importante que mencione a su médico si está tomando:
• medicamentos para corregir el ritmo cardíaco (como quinidina, amiodarona, flecainida)
• antidepresivos o medicamentos a base de plantas utilizados para el tratamiento de la depresión y la ansiedad (como fluoxetina, paroxetina, venlafaxina, Hierba de San Juan)
• medicamentos para tratar infecciones por hongos (antifungicos) (como ketoconazol, itraconazol)
• ciertos medicamentos para tratar la infección por VIH (como inhibidores de la proteasa p. ej. indinavir, ritonavir)
• anticonvulsivantes utilizados para tratar la epilepsia (como carbamazepina, fenitoína, fenobarbital)
• ciertos antibióticos utilizados para tratar la tuberculosis (rifabutina, rifampicina)
Estos medicamentos pueden aumentar el riesgo de la aparición de efectos adversos o reducir el efecto de Abilify Maintena; si usted observa cualquier síntoma poco común al tomar cualquiera de estos medicamentos al mismo tiempo que Abilify Maintena, debe comunicárselo a su médico.
Los medicamentos que aumentan los niveles de serotonina se emplean generalmente en enfermedades que incluyen depresión , trastorno de ansiedad generalizada , trastorno obsesivo compulsivo (TOC) y fobia social así como migraña y dolor :
• triptanes, tramadol y triptófano utilizados para enfermedades como la depresión, el trastorno de ansiedad generalizada, el trastorno obsesivo compulsivo (TOC) y la fobia social así como la migraña y el dolor
• ISRS (como paroxetina y fluoxetina) utilizados para la depresión, el TOC, el pánico y la ansiedad
• otros antidepresivos (como venlafaxina y triptófano) utilizados en la depresión grave
• antidepresivos tricíclicos (como clomipramina y amitriptilina) utilizados en enfermedades depresivas
• hierba de San Juan (Hypericum perforatum) utilizada en medicamentos a base de plantas para la depresión leve
• analgésicos (como tramadol y petidina) utilizados para aliviar el dolor
• triptanos (como sumatriptan y zolmitripitan) utilizados para tratar la migraña
Estos medicamentos pueden aumentar el riesgo de la aparición de efectos adversos; si usted observa cualquier síntoma poco común al tomar cualquiera de estos medicamentos al mismo tiempo que Abilify Maintena, debe comunicárselo a su médico.
Uso de Abilify Maintena con alcohol
Se debe evitar el consumo de alcohol.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
No debe usar Abilify Maintena si está embarazada a no ser que haya hablado esto con su médico. Asegúrese de informar a su médico inmediatamente si está embarazada, cree que puede estar embarazada o si está planeando quedarse embarazada.
Los siguientes síntomas pueden ocurrir en bebés recién nacidos, de madres que han usado Abilify Maintena en el último trimestre de embarazo (últimos tres meses del embarazo): temblor, rigidez y/o debilidad muscular, somnolencia, agitación, problemas respiratorios y dificultad en la alimentación.
Si su bebé desarrolla cualquiera de estos síntomas debe contactar con su médico.
Si está usando Abilify Maintena, su médico discutirá con usted sobre si debe dar el pecho a su bebé considerando el beneficio para usted de su tratamiento y el beneficio para su bebé de darle el pecho. Si está siendo tratada con Abilify Maintena no debe dar el pecho. Hable con su médico sobre el mejor modo de alimentar a su bebé si está usando Abilify Maintena.
Conducción y uso de máquinas
No conduzca o use herramientas o máquinas hasta que sepa cómo le afecta Abilify Maintena, ya que el mareo, la sedación, visión doble y somnolencia han sido comunicados como efectos adversos posibles de este medicamento.
3. Como se administra Abilify Maintena
Abilify Maintena se presenta en polvo, que su médico o enfermera preparan en una suspensión. Su médico se lo administrará como una inyección única en el glúteo o el deltoides (nalga u hombro) cada mes. Puede que sienta un poco de dolor durante la inyección. Su médico alternará las inyecciones entre el lado derecho y el izquierdo. Las inyecciones no se administrarán por vía intravenosa.
Su médico decidirá cuál es la dosis de Abilify Maintena más adecuada para usted. La dosis inicial recomendada es de 400 mg, a no ser que su médico decida administrarle una dosis inicial más baja o de seguimiento (300 mg, 200 mg o 160 mg). El tratamiento con aripiprazol oral se continúa durante 14 días después de la primera inyección. A continuación, se administra el tratamiento con inyecciones de Abilify Maintena, a no ser que su médico le indique lo contrario.
Si se le administra más Abilify Maintena del que se debe
Este medicamento se le administrará bajo supervisión médica, por lo tanto, es poco probable que se le administre demasiado. Si es visto por más de un médico, asegúrese de decirles que está usando Abilify Maintena.
Los pacientes a los que se les ha administrado demasiado aripiprazol han experimentado los siguientes síntomas:
• latidos rápidos del corazón, agitación/agresividad, problemas con el lenguaje.
• movimientos inusuales (especialmente de la cara o la lengua) y nivel de conciencia disminuido.
Otros síntomas pueden incluir:
• confusión aguda, convulsiones (epilepsia), coma, una combinación de fiebre, respiración acelerada, sudoración,
• rigidez muscular y somnolencia, respiración más lenta, ahogo, presión sanguínea alta o baja, ritmos anómalos del corazón.
Contacte con su médico u hospital más cercano inmediatamente si experimenta cualquiera de los síntomas anteriores.
Si no recibió su dosis de Abilify Maintena
Es importante no olvidarse de su dosis programada. Debe recibir una inyección cada mes pero no antes de que hayan pasado 26 días desde la última inyección. Si olvida una inyección, debe contactar con su médico para programar la siguiente inyección lo más pronto posible. Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o enfermero.
Si se suspende la administración de Abilify Maintena
No interrumpa su tratamiento sólo porque se sienta mejor. Es importante que siga recibiendo Abilify Maintena durante el tiempo que su médico le haya indicado.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Informe a su médico inmediatamente si presenta cualquiera de los siguientes efectos adversos graves:
• una combinación de cualquiera de estos síntomas: somnolencia excesiva, mareos, confusión, desorientación, dificultad para hablar, dificultad para caminar, rigidez muscular o temblor, fiebre, debilidad, irritabilidad, agresividad, ansiedad, elevación de la presión sanguínea o convulsiones que pueden conducir a pérdida del conocimiento.
• movimientos inusuales principalmente de la cara o la lengua, ya que su médico puede querer bajar la dosis.
• si tiene síntomas como hinchazón, dolor y enrojecimiento en la pierna puede ser que tenga un coágulo sanguíneo, que puede desplazarse por los vasos sanguíneos a los pulmones causando dolor en el pecho y dificultad para respirar. Si nota cualquiera de estos síntomas acuda inmediatamente a su médico.
• una combinación de fiebre, respiración más rápida, sudoración, rigidez muscular y somnolencia o letargo ya que esto puede ser un signo de una enfermedad llamada síndrome neuroléptico maligno (SNM)
• más sed de lo habitual, necesita orinar más de lo habitual, con mucho apetito, se siente débil o cansado, siente ganas de vomitar, se siente confundido o su aliento huele a frutas ya que esto puede ser un signo de diabetes.
Los efectos adversos incluidos a continuación también pueden ocurrir después de la administración de
Abilify Maintena.
Efectos adversos frecuentes (puede afectar hasta 1 de cada 10 personas):
• aumento de peso, pérdida de peso
• sentirse ansioso, problemas para dormir (insomnio)
• sentirse inquieto e incapaz de quedarse quieto, dificultad para mantenerse sentado, temblor, tics incontrolables, sacudidas o movimientos de retorcimiento, piernas inquietas
• cambios en el nivel de lucidez, somnolencia
• movimientos musculares que no puede controlar como muecas, chasquear los labios o movimientos de la lengua. Generalmente afectan la cara y la boca primero pero pueden afectar otras partes del cuerpo. Estos pueden ser signos de un trastorno llamado “discinesia tardía”.
• parkinsonismo; este es un término médico que incluye varios síntomas como rigidez muscular, espasmos al doblar las extremidades, movimientos del cuerpo lentos o descoordinados, cara inexpresiva, músculos tensos, arrastrar los pies, pasos rápidos y falta de movimiento normal de los brazos al caminar
• resistencia espasmódica a movimientos pasivos como tensar y relajar los músculos, tono muscular aumentado en forma anómala, rigidez muscular, movimientos lentos del cuerpo
• mareo, dolor de cabeza
• boca seca
• dolor en el sitio de la inyección, endurecimiento de la piel en el sitio de la inyección
• debilidad, pérdida de fuerza o cansancio extremo
• niveles elevados de la enzima creatininfosfoquinasa
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
• aumento o disminución del apetito, distorsión de los sentidos del gusto y del olfato
• niveles bajos de un cierto tipo de glóbulos blancos (neutropenia), hemoglobina baja o bajo recuento de glóbulos rojos, bajo recuento de plaquetas en la sangre
• reacción alérgica (hipersensibilidad)
• aumento o disminución de los niveles sanguíneos de la hormona prolactina
• aumento de azúcar en la sangre, disminución de azúcar en la sangre
• aumento de grasas sanguíneas como colesterol, triglicéridos elevados y también niveles bajos de colesterol y niveles bajos de triglicéridos
• aumento de los niveles de insulina, una hormona que regula los niveles del azúcar en la sangre
• pensamientos de suicidio
• trastorno mental caracterizado por percepción defectuosa o pérdida de la realidad, alucinaciones, delirio
• interés sexual alterado o aumentado
• reacción de pánico, depresión, inestabilidad emocional, estado de indiferencia con falta de emoción, sentimientos de malestar emocional y mental, estado de ánimo alterado
• trastorno del sueño
• rechinar los dientes o apretar la mandíbula
• hipo
• fijación del globo ocular en una posición, visión borrosa, dolor de ojos, visión doble
• latido anómalo del corazón, velocidad del latido rápida o lenta, conducción eléctrica del corazón anómala, electrocardiograma anómalo (ECG)
• mareo al ponerse de pie después de haber estado acostado o sentado debido a una bajada en la presión sanguínea, presión sanguínea alta
• tos
• molestia de estómago, indigestión, babeo, más saliva en la boca de lo normal, vómitos, náuseas,
diarrea, constipación, dolor de estómago o molestias intestinales, movimientos intestinales frecuentes
• valores hepáticos anómalos en la sangre
• caída anormal del cabello
• acné, enfermedad de la piel donde la nariz y las mejillas están inusualmente enrojecidas,
eczema, endurecimiento de la piel
• rigidez muscular, espasmos musculares, tics musculares, tensión muscular, dolor muscular (mialgia), dolor en las extremidades, alteración de la marcha, dolor de las articulaciones (artralgia), dolor de espalda, disminución de la movilidad de las articulaciones, cuello rígido, apertura de la boca limitada
• cálculos renales o azúcar (glucosa) en la orina
• aumento del tamaño de las mamas en los hombres, mamas dolorosas, sequedad vaginal
• pérdida de fuerza
• molestias en el pecho
• reacciones en el sitio de inyección como enrojecimiento, hinchazón, malestar y picor en el sitio de la inyección
• circunferencia de la cintura aumentada
Los siguientes efectos adversos han sido comunicados desde la comercialización de aripiprazol oral pero la frecuencia con la que ocurren no es conocida:
• niveles bajos de glóbulos blancos
• latido cardíaco inusual, muerte súbita inexplicada, ataque al corazón
• reacción alérgica (p. ej. hinchazón de la boca, lengua, rostro y garganta, picor, urticaria), sarpullido
• cetoacidosis (cetonas en la sangre y orina) o coma, bajo nivel de sodio en la sangre
• pérdida del apetito (anorexia), dificultad para tragar
• agresividad
• nerviosismo, adicción al juego, pensamientos de suicidio e intento de suicidio; trastorno del lenguaje, convulsión, síndrome serotoninérgico (una reacción que puede causar sensación de intensa felicidad, somnolencia, torpeza, inquietud, sensación de estar bebido, fiebre, sudoración, rigidez muscular), la combinación de fiebre, rigidez muscular, respiración acelerada, sudoración, disminución de la conciencia y cambios bruscos en la presión sanguínea y la frecuencia cardíaca (síndrome neuroléptico maligno)
• desmayo, espasmo de los músculos alrededor de la glotis, aspiración accidental de alimento con riesgo de neumonía (infección de los pulmones), inflamación del páncreas.
• insuficiencia hepática, inflamación del hígado, piel y parte blanca de los ojos amarillenta, sensibilidad a la luz, sudoración excesiva, rigidez, calambres, dolor muscular, debilidad
• pérdida involuntaria de orina (incontinencia), dificultad para orinar
• erección prolongada y/o dolorosa
• dificultad para controlar la temperatura corporal central o sobrecalentamiento, dolor en el pecho, hinchazón de las manos, tobillos o pies
Comunicación de efectos adversos
Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Abilify Maintena
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
No congelar.
La suspensión reconstituida debe utilizarse inmediatamente pero puede ser conservada en el vial durante 4 horas a una temperatura inferior a 25 °C. No conserve la suspensión reconstituida en la jeringa.
Los medicamentos no se deben tirar por los desagües. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de Abilify Maintena
- El principio activo es aripiprazol.,
Cada vial contiene 300 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Cada vial contiene 400 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
- Los demás componentes son Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Aspecto de Abilify Maintena y contenido del envase
Abilify Maintena es un polvo y disolvente para la preparación de una suspensión inyectable de liberación prolongada.
Abilify Maintena es un polvo blanco o blanquecino que se presenta en un vial de vidrio transparente. Su médico o enfermero/a preparará una suspensión de Abilify Maintena que se le administrará en una inyección. Para ello utilizará el vial de disolvente que viene en el estuche, solución transparente en un vial de vidrio transparente.
Envase individual
Cada envase individual contiene un vial con polvo, un vial de 2 ml con disolvente, una jeringa de 3 ml con luer-lock con una aguja hipodérmica de seguridad ya colocada, de 38 mm, calibre 21, con un dispositivo de protección de la aguja, una jeringa desechable de 3 ml con punta luer-lock, un adaptador de vial, y tres agujas hipodérmicas de seguridad: una de 25 mm y calibre 23, una de 38 mm y calibre 22, y una de 50 mm y calibre 21.
Envase múltiple
Lote de 3 envases individuales.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road,
Wexham, SL3 6PJ - Reino Unido
Responsable de la fabricación
H. Lundbeck A/S Ottiliavej 9, 2500 Valby Dinamarca
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Lundbeck S.A./N.V.
Tél/Tel: +32 2 535 79 79
Bt^rapnn
Lundbeck Export A/S Representative Office Tel: +359 2 962 4696 medicamento dirigiéndose al representante local del
Lietuva
H. Lundbeck A/S Tel: +45 36301311
Luxembourg/Luxemburg
Lundbeck S.A.
Tél: +32 2 535 79 79
|
Ceská republika Lundbeck Ceská republika s.r.o. Tel: +420 225 275 600 |
Magyarország Lundbeck Hungaria Kft. Tel: +36 1 4369980 |
|
Danmark Otsuka Pharma Scandinavia AB Tel: +46 8 54528660 |
Malta H. Lundbeck A/S Tel: +45 36301311 |
|
Deutschland Otsuka Pharma GmbH Tel: +49 69 1700860 |
Nederland Lundbeck B.V. Tel: +31 20 697 1901 |
|
Eesti H. Lundbeck A/S Tel: +45 36301311 |
Norge Otsuka Pharma Scandinavia AB Tel: +46 8 54528660 |
|
EkXáóa Lundbeck Hellas S.A. Tr(k: +30 210 610 5036 |
Osterreich Lundbeck Austria GmbH Tel: +43 1 266 91 08 |
|
España Otsuka Pharmaceutical S.A. Tel: +34 93 208 10 20 |
Polska Lundbeck Poland Sp. z o. o. Tel.: +48 22 626 93 00 |
|
France Otsuka Pharmaceutical France SAS Tél: +33 (0)1 47 08 00 00 |
Portugal Lundbeck Portugal Lda Tel: +351 21 00 45 900 |
|
Hrvatska Lundbeck Croatia d.o.o. Tel.: +385 1 644 82 63 |
Romania Lundbeck Export A/S Reprezentanta din Romania Tel: +40 21319 88 26 |
|
Ireland Lundbeck (Ireland) Limited Tel: +353 1 468 9800 |
Slovenija Lundbeck Pharma d.o.o. Tel.: +386 2 229 4500 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Lundbeck Slovensko s.r.o. Tel: +421 2 5341 42 18 |
|
Italia Otsuka Pharmaceutical Italy S.r.l Tel: +39 02 00 63 27 10 |
Suomi/Finland Otsuka Pharma Scandinavia AB Tel: +46 8 54528660 |
|
Kúrcpog Lundbeck Hellas A.E Tr(k.: +357 22490305 |
Sverige Otsuka Pharma Scandinavia AB Tel: +46 8 54528660 |
|
Latvija H. Lundbeck A/S Tel: +45 36301311 |
United Kingdom Otsuka Pharmaceuticals (UK) Ltd Tel: +44 203 747 5300 |
Fecha de la última revisión de este prospecto: {MM/AAAA} Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
INSTRUCCIONES PARA PROFESIONALES SANITARIOS
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable
Aripiprazol
Paso 1: Preparación antes de reconstituir el polvo
Saque todos los componentes del envase y confirme que están todos los que se indican en la siguiente lista:
- Prospecto de Abilify Maintena e instrucciones para profesionales sanitarios
- Vial con polvo.
- Vial con 2 ml de disolvente.
Importante: el vial con el disolvente contiene una cantidad adicional de disolvente.
- Una jeringa luer-lock de 3 ml con aguja hipodérmica de seguridad de 38 mm calibre 21, ya colocada, con un dispositivo de protección para la aguja.
- Una jeringa desechable con punta luer-lock de 3 ml.
- Un adaptador del vial.
de protección para la de protección para la de protección para la
- Una aguja hipodérmica de seguridad de 25 mm calibre 23 con dispositivo aguja.
- Una aguja hipodérmica de seguridad de 38 mm calibre 22 con dispositivo aguja.
- Una aguja hipodérmica de seguridad de 50 mm calibre 21 con dispositivo aguja.
- Instrucciones para la aguja y la jeringa Paso 2: Reconstitución del polvo
a) Quite la tapa del vial con polvo y la del vial con disolvente y limpie el tapón de ambos viales con un hisopo estéril impregnado en alcohol.
b) Utilizando la jeringa con la aguja ya colocada, extraiga el volumen de disolvente predeterminado del vial correspondiente, volcando el disolvente hacia la jeringa.
Vial de 300 mg:
Añada 1,5 ml de disolvente para reconstituir el polvo.
Vial de 400 mg:
Añada 1,9 ml de disolvente para reconstituir el polvo.
Quedará una pequeña cantidad de disolvente residual en el vial después de la extracción. Cualquier exceso debe ser eliminado.

Agua
c) Inyecte lentamente el disolvente en el vial que contiene el polvo.
d) Saque el aire para igualar la presión en el vial tirando del émbolo levemente hacia atrás.
e) Posteriormente, saque la jeringa del vial.
Proceda a encajar el dispositivo de seguridad de la aguja utilizando la técnica de una mano. Presione suavemente la funda contra una superficie plana hasta que la aguja quede encajada firmemente en la funda de protección de la aguja.
Compruebe visualmente que la aguja ha encajado perfectamente en la funda de protección de la aguja y deseche la jeringa.

Eliminar
f) Agite el vial vigorosamente durante 30 segundos hasta que la suspensión se vea uniforme.
g) Inspeccione visualmente la suspensión reconstituida por si hubiera partículas y decoloración antes de la administración. El medicamento reconstituido es una suspensión líquida de color blanco o blanquecino. No utilice la suspensión reconstituida si contiene partículas o presenta decoloración.
h) Si no se administra la inyección inmediatamente después de la reconstitución, puede mantener el vial hasta 4 horas a una temperatura inferior a 25 °C y agitarlo vigorosamente, durante al menos 60 segundos, para garantizar la resuspensión antes de inyectarla.
i) No conserve la suspensión reconstituida en la jeringa.
Paso 3: Preparación antes de la inyección
a) Retire la cubierta del envase protector del adaptador del vial, pero no extraiga el adaptador del vial del envase protector.
b) Sujete el envase protector del adaptador del vial, y fije la jeringa luer-lock insertándola en el adaptador del vial y girándola a continuación.
c) Emplee la jeringa luer-lock para extraer el adaptador del vial del envase protector y deseche el envase protector del adaptador del vial. No toque la punta del adaptador del vial en ningún momento.
~......~ f
a

uiuiy
M Jim en a
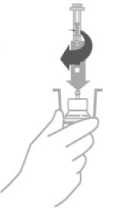
d) Determine el volumen recomendado para la inyección.
|
Abilify Maintena vial de 300 mg | |
|
Dosis |
Volumen a inyectar |
|
— |
— |
|
300 mg |
1,5 ml |
|
200 mg |
1,0 ml |
|
160 mg |
0,8 ml |
|
Abilify Maintena vial de 400 mg | |
|
Dosis |
Volumen a inyectar |
|
400 mg |
2,0 ml |
|
300 mg |
1,5 ml |
|
200 mg |
1,0 ml |
|
160 mg |
0,8 ml |
e) Limpie la tapa del vial con la suspensión reconstituida con un hisopo estéril impregnado en alcohol.
f) Coloque y sujete el vial con la suspensión reconstituida sobre una superficie dura. Encaje el adaptador del vial sujetando la parte externa del adaptador del vial y empujando la punta del adaptador del vial firmemente, a través del tapón de caucho, hasta que encaje en su lugar.
g) Extraiga lentamente el volumen recomendado del vial con la jeringa luer-lock para poder inyectarlo. En el vial quedará una pequeña cantidad, un exceso de la suspensión.

Paso 4: Procedimiento de inyección
a) Saque la jeringa luer-lock que contiene el volumen recomendado de la suspensión reconstituida de Abilify Maintena del vial.
b) Seleccione una de las agujas hipodérmicas de seguridad descritas a continuación, en función del lugar de inyección y del peso del paciente, y una la aguja hipodérmica a la jeringa luer-lock que contiene la suspensión para inyectar. Asegúrese de que la aguja hipodérmica está firmemente unida al dispositivo protector de la aguja, presionando y girando en el sentido de las agujas del reloj, luego retire la cubierta de la aguja inmediatamente.
|
Tipo morfológico |
Lugar de la inyección |
Tamaño de la aguja |
|
No obesos |
Deltoides Glúteo |
25 mm calibre 23 38 mm calibre 22 |
|
Obesos |
Deltoides Glúteo |
38 mm calibre 22 50 mm calibre 21 |
c) Inyecte lentamente el volumen recomendado mediante una inyección intramuscular de una única dosis en el glúteo o el deltoides. No masajee el sitio de la inyección. Se debe tener cuidado y evitar inyectarla por error en un vaso sanguíneo. No inyecte en zonas con signos de inflamación, piel dañada, hinchazón y/o hematomas.
Sólo para inyección intramuscular profunda en el glúteo o el deltoides.
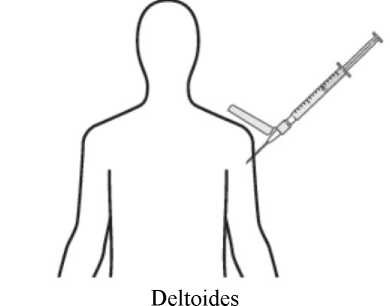
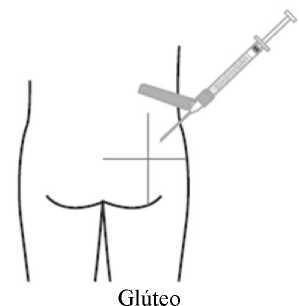
Recuerde rotar los sitios de inyección en ambos glúteos y deltoides. Busque signos o síntomas de administración intravenosa involuntaria.
Paso 5: Procedimientos después de la inyección
Encaje el dispositivo de seguridad de la aguja como se describe en el Paso 2 e). Deseche los viales, adaptador, agujas y jeringa, de forma adecuada, después de la inyección. Los viales con polvo y disolvente son para un solo uso.


Prospecto: información para el usuario
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable
en jeringa precargada
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable
en jeringa precargada
aripiprazol
Lea todo el prospecto detenidamente antes de recibir este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Abilify Maintena y para qué se utiliza
2. Qué necesita saber antes de que se le administre Abilify Maintena
3. Como se administra Abilify Maintena
4. Posibles efectos adversos
5. Conservación de Abilify Maintena
6. Contenido del envase e información adicional
1. Qué es Abilify Maintena y para qué se utiliza
Abilify Maintena contiene el principio activo aripiprazol y pertenece a un grupo de medicamentos llamados antipsicóticos. Se utiliza para tratar la esquizofrenia - una enfermedad con síntomas como escuchar, ver o sentir cosas que no existen, desconfianza, creencias equivocadas, lenguaje incoherente y monotonía emocional y del comportamiento. Las personas con esta enfermedad también pueden sentirse deprimidas, culpables, inquietas o tensas.
Abilify Maintena está indicado para pacientes adultos con esquizofrenia que están suficientemente estabilizados durante el tratamiento con aripiprazol oral.
2. Qué necesita saber antes de que se le administre Abilify Maintena No use Abilify Maintena:
- si es alérgico al aripiprazol o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Hable con su médico o enfermero antes de que le administren Abilify Maintena.
Se han comunicado casos de pacientes que experimentan pensamientos y comportamientos suicidas durante el tratamiento con aripiprazol. Informe a su médico inmediatamente si tiene pensamientos o sentimientos de dañarse a sí mismo.
Antes del tratamiento con Abilify Maintena, dígale a su médico si sufre de
• niveles altos de azúcar en la sangre (caracterizado por síntomas como sed excesiva, aumento de la cantidad de orina, aumento del apetito y sensación de debilidad) o antecedentes familiares de diabetes.
• convulsiones, ya que su médico puede querer controlarlo más de cerca
• movimientos musculares involuntarios e irregulares, especialmente en la cara.
• enfermedades cardiovasculares (enfermedades del corazón y la circulación, antecedentes familiares de enfermedad cardiovascular), ictus o mini ictus, presión sanguínea anormal.
• coágulos sanguíneos o antecedentes familiares de coágulos sanguíneos ya que los antipsicóticos han sido asociados con la formación de coágulos sanguíneos.
• antecedentes de adicción al juego.
• problemas de hígado (hepáticos) graves.
Si nota que está ganando peso, desarrolla movimientos inusuales, siente somnolencia que interfiere en sus actividades diarias normales, cualquier dificultad para tragar o presenta síntomas de alergia, hable con su médico inmediatamente.
Niños y adolescentes
No utilice este medicamento en niños y adolescentes menores de 18 años. Se desconoce si es seguro y efectivo en estos pacientes.
Uso de Abilify Maintena con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o está pensando tomar cualquier otro medicamento, incluidos los medicamentos sin receta.
Medicamentos para bajar la presión sanguínea: Abilify Maintena puede aumentar el efecto de medicamentos utilizados para bajar la presión sanguínea. Asegúrese de informar a su médico si usted toma medicamentos para controlar la presión sanguínea.
Si está usando Abilify Maintena con algún otro medicamento, puede significar que su médico deba cambiar su dosis de Abilify Maintena o la de los otros medicamentos. Es especialmente importante que mencione a su médico si está tomando:
• medicamentos para corregir el ritmo cardíaco (como quinidina, amiodarona, flecainida)
• antidepresivos o medicamentos a base de plantas utilizados para el tratamiento de la depresión y la ansiedad (como fluoxetina, paroxetina, venlafaxina, Hierba de San Juan)
• medicamentos para tratar infecciones por hongos (antifúngicos) (como ketoconazol, itraconazol)
• ciertos medicamentos para tratar la infección por VIH (como inhibidores de la proteasa p. ej. indinavir, ritonavir)
• anticonvulsivantes utilizados para tratar la epilepsia (como carbamazepina, fenitoína, fenobarbital)
• ciertos antibióticos utilizados para tratar la tuberculosis (rifabutina, rifampicina)
Estos medicamentos pueden aumentar el riesgo de la aparición de efectos adversos o reducir el efecto de Abilify Maintena; si usted observa cualquier síntoma poco común al tomar cualquiera de estos medicamentos al mismo tiempo que Abilify Maintena, debe comunicárselo a su médico.
Los medicamentos que aumentan los niveles de serotonina se emplean generalmente en enfermedades que incluyen depresión , trastorno de ansiedad generalizada , trastorno obsesivo compulsivo (TOC) y fobia social así como migraña y dolor :
• triptanes, tramadol y triptófano utilizados para enfermedades como la depresión, el trastorno de ansiedad generalizada, el trastorno obsesivo compulsivo (TOC) y la fobia social así como la migraña y el dolor
• ISRS (como paroxetina y fluoxetina) utilizados para la depresión, el TOC, el pánico y la ansiedad
• otros antidepresivos (como venlafaxina y triptófano) utilizados en la depresión grave
• antidepresivos tricíclicos (como clomipramina y amitriptilina) utilizados en enfermedades depresivas
• hierba de San Juan (Hypericum perforatum) utilizada en medicamentos a base de plantas para la depresión leve
• analgésicos (como tramadol y petidina) utilizados para aliviar el dolor
triptanos (como sumatriptan y zolmitripitan) utilizados para tratar la migraña
Estos medicamentos pueden aumentar el riesgo de la aparición de efectos adversos; si usted observa cualquier síntoma poco común al tomar cualquiera de estos medicamentos al mismo tiempo que Abilify Maintena, debe comunicárselo a su médico.
Uso de Abilify Maintena con alcohol
Se debe evitar el consumo de alcohol.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
No debe usar Abilify Maintena si está embarazada a no ser que haya hablado esto con su médico.
Asegúrese de informar a su médico inmediatamente si está embarazada, cree que puede estar embarazada o si está planeando quedarse embarazada.
Los siguientes síntomas pueden ocurrir en bebés recién nacidos, de madres que han usado Abilify Maintena en el último trimestre de embarazo (últimos tres meses del embarazo): temblor, rigidez y/o debilidad muscular, somnolencia, agitación, problemas respiratorios y dificultad en la alimentación.
Si su bebé desarrolla cualquiera de estos síntomas debe contactar con su médico.
Si está usando Abilify Maintena, su médico discutirá con usted sobre si debe dar el pecho a su bebé considerando el beneficio para usted de su tratamiento y el beneficio para su bebé de darle el pecho. Si está siendo tratada con Abilify Maintena no debe dar el pecho. Hable con su médico sobre el mejor modo de alimentar a su bebé si está usando Abilify Maintena.
Conducción y uso de máquinas
No conduzca o use herramientas o máquinas hasta que sepa cómo le afecta Abilify Maintena, ya que el mareo, la sedación, visión doble y somnolencia han sido comunicados como efectos adversos posibles de este medicamento.
3. Como se administra Abilify Maintena
Abilify Maintena se presenta como una jeringa precargada. Su médico se lo administrará como una inyección única en el glúteo o el deltoides (nalga u hombro) cada mes. Puede que sienta un poco de dolor durante la inyección. Su médico alternará las inyecciones entre el lado derecho y el izquierdo. Las inyecciones no se administrarán por vía intravenosa.
Su médico decidirá cuál es la dosis de Abilify Maintena más adecuada para usted. La dosis inicial recomendada es de 400 mg, a no ser que su médico decida administrarle una dosis inicial más baja o de seguimiento (300 mg, 200 mg o 160 mg). El tratamiento con aripiprazol oral se continúa durante 14 días después de la primera inyección. A continuación, se administra el tratamiento con inyecciones de Abilify Maintena, a no ser que su médico le indique lo contrario.
Si se le administra más Abilify Maintena del que se debe
Este medicamento se le administrará bajo supervisión médica, por lo tanto, es poco probable que se le administre demasiado. Si es visto por más de un médico, asegúrese de decirles que está usando Abilify Maintena.
Los pacientes a los que se les ha administrado demasiado aripiprazol han experimentado los siguientes síntomas:
• latidos rápidos del corazón, agitación/agresividad, problemas con el lenguaje.
• movimientos inusuales (especialmente de la cara o la lengua) y nivel de conciencia disminuido.
Otros síntomas pueden incluir:
• confusión aguda, convulsiones (epilepsia), coma, una combinación de fiebre, respiración acelerada, sudoración,
• rigidez muscular y somnolencia, respiración más lenta, ahogo, presión sanguínea alta o baja, ritmos anómalos del corazón.
Contacte con su médico u hospital más cercano inmediatamente si experimenta cualquiera de los síntomas anteriores.
Si no recibió su dosis de Abilify Maintena
Es importante no olvidarse de su dosis programada. Debe recibir una inyección cada mes pero no antes de que hayan pasado 26 días desde la última inyección. Si olvida una inyección, debe contactar con su médico para programar la siguiente inyección lo más pronto posible. Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o enfermero.
Si se suspende la administración de Abilify Maintena
No interrumpa su tratamiento sólo porque se sienta mejor. Es importante que siga recibiendo Abilify Maintena durante el tiempo que su médico le haya indicado.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Informe a su médico inmediatamente si presenta cualquiera de los siguientes efectos adversos graves:
• una combinación de cualquiera de estos síntomas: somnolencia excesiva, mareos, confusión, desorientación, dificultad para hablar, dificultad para caminar, rigidez muscular o temblor, fiebre, debilidad, irritabilidad, agresividad, ansiedad, elevación de la presión sanguínea o convulsiones que pueden conducir a pérdida del conocimiento.
• movimientos inusuales principalmente de la cara o la lengua, ya que su médico puede querer bajar la dosis.
• si tiene síntomas como hinchazón, dolor y enrojecimiento en la pierna puede ser que tenga un coágulo sanguíneo, que puede desplazarse por los vasos sanguíneos a los pulmones causando dolor en el pecho y dificultad para respirar. Si nota cualquiera de estos síntomas acuda inmediatamente a su médico.
• una combinación de fiebre, respiración más rápida, sudoración, rigidez muscular y somnolencia o letargo ya que esto puede ser un signo de una enfermedad llamada síndrome neuroléptico maligno (SNM)
• más sed de lo habitual, necesita orinar más de lo habitual, con mucho apetito, se siente débil o cansado, siente ganas de vomitar, se siente confundido o su aliento huele a frutas ya que esto puede ser un signo de diabetes.
Los efectos adversos incluidos a continuación también pueden ocurrir después de la administración de
Abilify Maintena.
Efectos adversos frecuentes (puede afectar hasta 1 de cada 10 personas):
• aumento de peso, pérdida de peso
• sentirse ansioso, problemas para dormir (insomnio)
• sentirse inquieto e incapaz de quedarse quieto, dificultad para mantenerse sentado, temblor, tics incontrolables, sacudidas o movimientos de retorcimiento, piernas inquietas
• cambios en el nivel de lucidez, somnolencia
• movimientos musculares que no puede controlar como muecas, chasquear los labios o movimientos de la lengua. Generalmente afectan la cara y la boca primero pero pueden afectar otras partes del cuerpo. Estos pueden ser signos de un trastorno llamado “discinesia tardía”.
• parkinsonismo; este es un término médico que incluye varios síntomas como rigidez muscular, espasmos al doblar las extremidades, movimientos del cuerpo lentos o descoordinados, cara inexpresiva, músculos tensos, arrastrar los pies, pasos rápidos y falta de movimiento normal de los brazos al caminar
• resistencia espasmódica a movimientos pasivos como tensar y relajar los músculos, tono muscular aumentado en forma anómala, rigidez muscular, movimientos lentos del cuerpo
• mareo, dolor de cabeza
• boca seca
• dolor en el sitio de la inyección, endurecimiento de la piel en el sitio de la inyección
• debilidad, pérdida de fuerza o cansancio extremo
• niveles elevados de la enzima creatininfosfoquinasa
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
• aumento o disminución del apetito, distorsión de los sentidos del gusto y del olfato
• niveles bajos de un cierto tipo de glóbulos blancos (neutropenia), hemoglobina baja o bajo recuento de glóbulos rojos, bajo recuento de plaquetas en la sangre
• reacción alérgica (hipersensibilidad)
• aumento o disminución de los niveles sanguíneos de la hormona prolactina
• aumento de azúcar en la sangre, disminución de azúcar en la sangre
• aumento de grasas sanguíneas como colesterol, triglicéridos elevados y también niveles bajos de colesterol y niveles bajos de triglicéridos
• aumento de los niveles de insulina, una hormona que regula los niveles del azúcar en la sangre
• pensamientos de suicidio
• trastorno mental caracterizado por percepción defectuosa o pérdida de la realidad, alucinaciones, delirio
• interés sexual alterado o aumentado
• reacción de pánico, depresión, inestabilidad emocional, estado de indiferencia con falta de emoción, sentimientos de malestar emocional y mental, estado de ánimo alterado
• trastorno del sueño
• rechinar los dientes o apretar la mandíbula
• hipo
• fijación del globo ocular en una posición, visión borrosa, dolor de ojos, visión doble
• latido anómalo del corazón, velocidad del latido rápida o lenta, conducción eléctrica del corazón anómala, electrocardiograma anómalo (ECG)
• mareo al ponerse de pie después de haber estado acostado o sentado debido a una bajada en la presión sanguínea, presión sanguínea alta
• tos
• molestia de estómago, indigestión, babeo, más saliva en la boca de lo normal, vómitos, náuseas, diarrea, constipación, dolor de estómago o molestias intestinales, movimientos intestinales frecuentes
• valores hepáticos anómalos en la sangre
• caída anormal del cabello
• acné, enfermedad de la piel donde la nariz y las mejillas están inusualmente enrojecidas,
eczema, endurecimiento de la piel
• rigidez muscular, espasmos musculares, tics musculares, tensión muscular, dolor muscular (mialgia), dolor en las extremidades, alteración de la marcha, dolor de las articulaciones (artralgia), dolor de espalda, disminución de la movilidad de las articulaciones, cuello rígido, apertura de la boca limitada
• cálculos renales o azúcar (glucosa) en la orina
• aumento del tamaño de las mamas en los hombres, mamas dolorosas, sequedad vaginal
• pérdida de fuerza
• molestias en el pecho
• reacciones en el sitio de inyección como enrojecimiento, hinchazón, malestar y picor en el sitio de la inyección
• circunferencia de la cintura aumentada
Los siguientes efectos adversos han sido comunicados desde la comercialización de aripiprazol oral pero la frecuencia con la que ocurren no es conocida:
• niveles bajos de glóbulos blancos
• latido cardíaco inusual, muerte súbita inexplicada, ataque al corazón
• reacción alérgica (p. ej. hinchazón de la boca, lengua, rostro y garganta, picor, urticaria), sarpullido
• cetoacidosis (cetonas en la sangre y orina) o coma, bajo nivel de sodio en la sangre
• pérdida del apetito (anorexia), dificultad para tragar
• agresividad
• nerviosismo, adicción al juego, pensamientos de suicidio e intento de suicidio; trastorno del lenguaje, convulsión, síndrome serotoninérgico (una reacción que puede causar sensación de intensa felicidad, somnolencia, torpeza, inquietud, sensación de estar bebido, fiebre, sudoración, rigidez muscular), la combinación de fiebre, rigidez muscular, respiración acelerada, sudoración, disminución de la conciencia y cambios bruscos en la presión sanguínea y la frecuencia cardíaca (síndrome neuroléptico maligno)
• desmayo, espasmo de los músculos alrededor de la glotis, aspiración accidental de alimento con riesgo de neumonía (infección de los pulmones), inflamación del páncreas.
• insuficiencia hepática, inflamación del hígado, piel y parte blanca de los ojos amarillenta, sensibilidad a la luz, sudoración excesiva, rigidez, calambres, dolor muscular, debilidad
• pérdida involuntaria de orina (incontinencia), dificultad para orinar
• erección prolongada y/o dolorosa
• dificultad para controlar la temperatura corporal central o sobrecalentamiento, dolor en el pecho, hinchazón de las manos, tobillos o pies
Comunicación de efectos adversos
Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Abilify Maintena
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
Si no se administra la inyección inmediatamente después de la reconstitución, puede conservarse la jeringa a una temperatura inferior a 25 °C durante 2 horas.
Los medicamentos no se deben tirar por los desagües. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de Abilify Maintena
- El principio activo es aripiprazol.,
Cada jeringa precargada contiene 300 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
Cada jeringa precargada contiene 400 mg de aripiprazol.
Después de la reconstitución, cada ml de suspensión contiene 200 mg de aripiprazol.
- Los demás componentes son Polvo
Carmelosa sódica, manitol, fosfato deshidrogenado de sodio monohidrato, hidróxido de sodio Disolvente
Agua para preparaciones inyectables
Aspecto de Abilify Maintena y contenido del envase
Abilify Maintena se presenta en una jeringa precargada que contiene un polvo blanco a blanquecino en la cámara delantera y un disolvente transparente en la cámara trasera. El médico preparará una suspensión que le administrará mediante una inyección.
Envase individual
Cada envase individual contiene una jeringa precargada y tres agujas hipodérmicas de seguridad: una de 25 mm y calibre 23, una de 38 mm y calibre 22, y una de 50 mm y calibre 21.
Envase múltiple
Lote de 3 envases individuales.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road,
Wexham, SL3 6PJ - Reino Unido
Responsable de la fabricación
H. Lundbeck A/S Ottiliavej 9, 2500 Valby Dinamarca
Elaiapharm
2881 Route des Cretes Z.I Les Bouillides Sophia Antipolis
06550 Valbonne
Francia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Lietuva
H. Lundbeck A/S Tel: +45 36301311
Luxembourg/Luxemburg
Lundbeck S.A.
Tél: +32 2 535 79 79
Belgie/Belgique/Belgien
Lundbeck S.A./N.V.
Tél/Tel: +32 2 535 79 79
Bt^rapnn
Lundbeck Export A/S Representative Office Tel: +359 2 962 4696
|
Ceská republika Lundbeck Ceská republika s.r.o. Tel: +420 225 275 600 |
Magyarország Lundbeck Hungaria Kft. Tel: +36 1 4369980 |
|
Danmark Otsuka Pharma Scandinavia AB Tel: +46 8 54528660 |
Malta H. Lundbeck A/S Tel: +45 36301311 |
|
Deutschland Otsuka Pharma GmbH Tel: +49 69 1700860 |
Nederland Lundbeck B.V. Tel: +31 20 697 1901 |
|
Eesti H. Lundbeck A/S Tel: +45 36301311 |
Norge Otsuka Pharma Scandinavia AB Tel: +46 8 54528660 |
|
EkXáóa Lundbeck Hellas S.A. Tr(k: +30 210 610 5036 |
Osterreich Lundbeck Austria GmbH Tel: +43 1 266 91 08 |
|
España Otsuka Pharmaceutical S.A. Tel: +34 93 208 10 20 |
Polska Lundbeck Poland Sp. z o. o. Tel.: +48 22 626 93 00 |
|
France Otsuka Pharmaceutical France SAS Tél: +33 (0)1 47 08 00 00 |
Portugal Lundbeck Portugal Lda Tel: +351 21 00 45 900 |
|
Hrvatska Lundbeck Croatia d.o.o. Tel.: +385 1 644 82 63 |
Romania Lundbeck Export A/S Reprezentanta din Romania Tel: +40 21319 88 26 |
|
Ireland Lundbeck (Ireland) Limited Tel: +353 1 468 9800 |
Slovenija Lundbeck Pharma d.o.o. Tel.: +386 2 229 4500 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Lundbeck Slovensko s.r.o. Tel: +421 2 5341 42 18 |
|
Italia Otsuka Pharmaceutical Italy S.r.l Tel: +39 02 00 63 27 10 |
Suomi/Finland Otsuka Pharma Scandinavia AB Tel: +46 8 54528660 |
|
Kúrcpog Lundbeck Hellas A.E Tr(k.: +357 22490305 |
Sverige Otsuka Pharma Scandinavia AB Tel: +46 8 54528660 |
|
Latvija H. Lundbeck A/S Tel: +45 36301311 |
United Kingdom Otsuka Pharmaceuticals (UK) Ltd Tel: +44 203 747 5300 |
Fecha de la última revisión de este prospecto: {MM/AAAA} Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
INSTRUCCIONES PARA PROFESIONALES SANITARIOS
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyectable en jeringa precargada
Aripiprazol
Paso 1: Preparación antes de reconstituir el polvo
Saque todos los componentes del envase y confirme que están todos los que se indican en la siguiente lista:
- Prospecto de Abilify Maintena e instrucciones para profesionales sanitarios.
- Una j eringa precargada de Abilify Maintena.
23 con dispositivo de protección para la 22 con dispositivo de protección para la 21 con dispositivo de protección para la
- Una aguja hipodérmica de seguridad de 25 mm calibre aguja.
- Una aguja hipodérmica de seguridad de 38 mm calibre aguja.
- Una aguja hipodérmica de seguridad de 50 mm calibre aguja.
- Instrucciones para la aguja y la jeringa.
Paso 2: Reconstitución del polvo
a) Empuje ligeramente el vástago del émbolo para acoplar las roscas. A continuación, gire el
vástago del émbolo hasta que ya no gire más para liberar el diluyente. Una vez que el vástago del émbolo se haya fijado por completo, la junta de estanqueidad central se localizará en la línea indicadora.
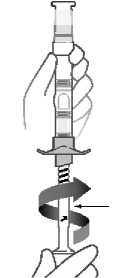
Línea indicadora Vástago del émbolo
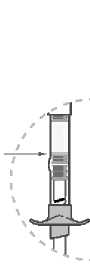
b) Sujetando la jeringa en posición vertical, agítela vigorosamente durante 20 segundos hasta que la suspensión reconstituida tenga un aspecto_uniforme. Inyecte la suspensión inmediatamente después de la reconstitución.
c) Inspeccione visualmente la jeringa por si hubiera partículas y decoloración antes de la administración. La suspensión del medicamento reconstituido debe parecer una suspensión homogénea, uniforme, opaca y de color blanco lechoso.
d) Si no se administra la inyección inmediatamente después de la reconstitución, puede conservarse la jeringa a una temperatura inferior a 25 °C durante 2 horas. Agite la jeringa vigorosamente durante al menos 20 segundos para garantizar la resuspensión antes de inyectarla si la jeringa no se ha utilizado durante más de 15 minutos.
Paso 3: Preparación antes de la inyección
a) Gire y extraiga el tapón y el protector.

Girar + extraer
Tapón
Protector
20 segundos
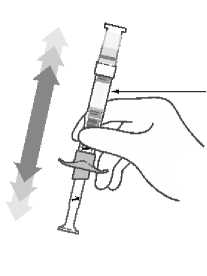
Blanco lechoso uniforme
t
—_ Girar + extraer

b) Seleccione una de las agujas hipodérmicas de seguridad descritas a continuación, en función del lugar de inyección y del peso del paciente:
|
Tipo morfológico |
Lugar de la inyección |
Tamaño de la aguja |
|
No obesos |
Deltoides Glúteo |
25 mm calibre 23 38 mm calibre 22 |
|
Obesos |
Deltoides Glúteo |
38 mm calibre 22 50 mm calibre 21 |
c) Mientras sujeta el capuchón de la aguja, presione la aguja para asegurarse de que está firmemente acoplada al dispositivo de seguridad. Gire hacia la derecha hasta que esté perfectamente ajustada.
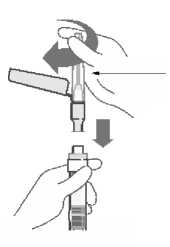
Capuchón de la aguja
d) A continuación tire de la aguja hacia arriba.
Capuchón de la aguja
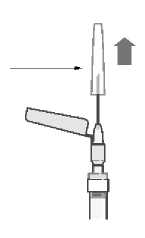
Tirar
e) Sujete la jeringa en posición vertical y presione lentamente el vástago del émbolo para
expulsar el aire. Si no es posible presionar el vástago del émbolo para expulsar el aire, compruebe que el vástago del émbolo está girado hasta su tope máximo. La resuspensión no es posible una vez que se ha expulsado el aire de la jeringa.
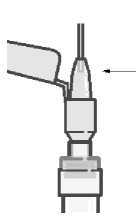
Expulse el aire hasta que la suspensión cubra la base de la aguja*
*Si nota algún problema o resistencia para expulsar el aire,
compruebe que el vástago del émbolo está girado hasta su tope máximo.
f) Inyecte lentamente en el glúteo o el deltoides. No masajee el sitio de la inyección. Se debe tener cuidado y evitar inyectarla por error en un vaso sanguíneo. No inyecte en zonas con signos de inflamación, piel dañada, hinchazón y/o hematomas.
Sólo para inyección intramuscular profunda en el glúteo o el deltoides.


Glúteo
Recuerde rotar los sitios de inyección en ambos glúteos y deltoides. Busque signos o síntomas
de administración intravenosa involuntaria.
Paso 4: Procedimientos después de la inyección
Encaje el dispositivo de seguridad de la aguja. Deseche la aguja y la jeringa precargada de forma adecuada después de la inyección.
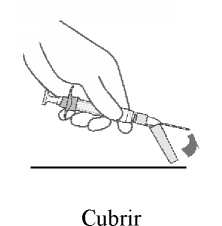

ANEXO IV
CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DE LAS CONDICIONES DE LAS AUTORIZACIONES DE COMERCIALIZACIÓN
Conclusiones científicas
Teniendo en cuenta lo dispuesto en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre los informes periódicos de seguridad (IPSs) para aripiprazol, las conclusiones científicas del Comité de Medicamentos de Uso Humano (CHMP) son las siguientes:
Según los datos recogidos en las bases de datos de seguridad, las bases de datos clínicas y la bibliografía médica, la mayoría de las notificaciones de hipo fueron no graves y se resolvieron de forma espontánea sin necesidad de ninguna intervención médica. Teniendo en cuenta el número de casos clínicos de hipo con aripiprazol (principalmente en su formulación oral), el tiempo hasta la aparición del hipo desde el inicio del tratamiento con aripiprazol, así como algunas notificaciones positivas de retirada y reexposición, parece que existe algún grado de asociación causal entre la exposición a aripiprazol y el hipo. Asimismo, las medidas de desproporcionalidad recogidas tanto en la base de datos del sistema de notificación de acontecimientos adversos (Adverse Event Reporting System, FAERS) de la Agencia de Alimentos y Medicamentos (FDA) de los EE UU como en la base de datos VigiBase sugieren una posible asociación entre el aripiprazol y el hipo. El PRAC consideró necesaria la actualización de la información del producto de aripiprazol para incluir el acontecimiento adverso “hipo” en la sección 4.8 de la ficha técnica, puesto que no podía descartarse el papel causal de aripiprazol en los casos notificados. El prospecto debe actualizarse en consecuencia.
Por tanto, a la vista de los datos presentados en los IPSs revisados, el PRAC consideró que los cambios en la información del producto de los medicamentos que contienen aripiprazol estaban justificados.
El CHMP está de acuerdo con las conclusiones científicas del PRAC.
Motivos para la modificación de las condiciones de las Autorizaciones de Comercialización
De acuerdo con las conclusiones científicas para el principio activo aripiprazol, el CHMP considera que el balance beneficio-riesgo de los medicamentos que contienen dicho principio activo es favorable sujeto a los cambios propuestos en la información del producto.
El CHMP recomienda que se modifiquen las condiciones de las Autorizaciones de Comercialización.
85